副溶血弧菌耐热直接溶血素4种亚基制备条件的研究
2017-07-18李红娜袁飞张辰暘马文良罗云敬
李红娜袁 飞张辰暘马文良罗云敬*张 峰**
(1.北京工业大学生命科学与生物工程学院 北京 100124;2.中国检验检疫科学研究院)
副溶血弧菌耐热直接溶血素4种亚基制备条件的研究
李红娜1,2袁 飞2张辰暘1马文良1罗云敬1*张 峰2**
(1.北京工业大学生命科学与生物工程学院 北京 100124;2.中国检验检疫科学研究院)
耐热直接溶血素是副溶血弧菌的主要毒素,耐热直接溶血素的制备对进一步建立副溶血弧菌毒素检测方法有很重要的意义。本项目研究了培养温度和培养时间对耐热直接溶血素1、2、3、4等亚基表达的影响。结果显示,培养温度为28℃时最适合耐热直接溶血素亚基的制备。温度低于28℃或高于28℃时,耐热直接溶血素亚基的表达量都较低。培养时间为8-12 h时,耐热直接溶血素亚基的制备量达到最大,增加培养时间后,制备量却有明显下降趋势。另外,还对影响酶切去重组耐热直接溶血素亚基标签效率的影响因素进行了研究,包括酶切温度、酶添加量等。结果显示,从15℃到40℃,随着酶切温度的升高,酶切效率逐渐增大;随着酶添加比例的增加,酶切效率逐渐增大,当酶添加比例为1∶20时,酶切效率达到最大。研究结果表明,培养温度和培养时间对于耐热直接溶血素亚基的制备具有较大的影响;酶切温度和酶添加比例对去标签效率也具有影响。
副溶血弧菌;耐热直接溶血素亚基;表达;培养温度;培养时间
1 前言
副溶血弧菌是海产品引起食物中毒的常见病原菌,适合生长的温度范围为15℃-44℃[1]。耐热直接溶血素(TDH)和耐热直接相关溶血素(TRH)是副溶血弧菌两个主要的毒力因子,这两种物质结构非常相似,都由二聚体构成,并有相似的溶血活性[2]。吴永宁等[3]对中国2003-2008年间由副溶血弧菌引发的食物中毒事件进行了总结,该致病菌可引起人急性肠胃炎,使人发生恶心、呕吐、腹痛、腹泻等症状[4]。副溶血弧菌引起人食物中毒常发生在4月到10月份,常见引起中毒食物为肉及肉制品、海产品等,通常表现为交叉污染。副溶血弧菌引起人类疾病的途径除了饮食外,还可以通过皮肤接触产生。如人类皮肤接触到被副溶血弧菌污染的水后会引起伤口感染、肠胃炎或者败血症等[5]。因此对于副溶血弧菌的监测除了市场上流通的海产品,还需对娱乐水域的水环境进行监测。Sadok Khouadja等[6]研究表明,非致病性的副溶血弧菌可能是毒力基因库,可水平转移产生新型致病副溶血弧菌。
本项目的目的是通过大肠杆菌表达TDH亚基,为后续副溶血弧菌检测做准备[7-9]。由于TDH是副溶血弧菌的主要毒力因子,因此外界环境对TDH亚基制备的影响,对副溶血弧菌毒素制备从而进一步建立副溶血弧菌毒素检测方法具有很重要的意义。本项目对影响TDH表达量的培养温度及培养时间进行了研究,并且还研究了影响酶切去标签的酶切温度、酶的比例及酶切时间。
2 材料与方法
2.1 材料
2.1.1 试剂
琼脂粉、异丙基硫代半乳糖苷(纯度99%)、NaCl(分析纯)、KH2PO4(分析纯)、NaH2PO4(分析纯)、KCl(分析纯)、NaOH(分析纯)、Tris(纯度≧99.9%)、十二烷基硫酸钠(纯度99.5%)、二硫苏糖醇(纯度 98%)、溴酚蓝(纯度 99%)、甘油(分析纯)、丙烯酰胺(分析纯)、过硫酸铵(分析纯)、四甲基乙二胺(纯度99%)、甘氨酸(纯度99%)、考马斯亮蓝(纯度99.9%)、乙醇(分析纯)、硫酸(分析纯)、包涵体溶解液、卡那霉素、镍琼脂糖、非干扰型蛋白浓度测定试剂盒、感受态大肠杆菌(BL21)和质粒pET28a等:全部购于生工(中国,上海);乙腈:购于赛默飞世儿(美国,马萨诸塞州);去离子水:由Milli-Q(德国,达姆施塔特)制备。
2.1.2 仪器
全温震荡培养箱(HZQ-F280):太仓华美(中国,苏州);图像扫描仪(Image scanne Ⅲ):通用(康涅狄格,美国);超声波细胞破碎仪(JY88-Ⅱ):新芝生物(中国,宁波);低速冷冻离心机(DL-5M):湘仪(中国,长沙);高速冷冻离心机(HC-3018R):中科中佳(中国,安徽);电热恒温培养箱(DHP-9162):太仓华利达(中国,苏州);可见分光光度计(V-1800):美谱达(中国,上海):恒温槽(SC-15):天恒(中国,宁波);超净工作台(YJ-1450):康旺(中国,苏州);立式压力蒸汽灭菌锅(YM50):三申(中国,上海);电热鼓风干燥箱(101A-3E):上海实验室仪器厂(中国,上海);迷你双立式电泳槽(DYCZ-24DN):六一(中国,北京)。
2.2 方法
2.2.1 溶液配制
(1)LB培养基:25.000 g LB琼脂粉加入到1.0 L蒸馏水中,混匀后高压蒸汽灭菌。
(2)异丙基硫代半乳糖苷(IPTG)工作液:称取24.000 g IPTG固体粉末溶于100mL蒸馏水中,充分混匀。
(3)磷酸盐缓冲溶液(10×PBS,pH7.4):称取 80.000g NaCl、2.000 g KH2PO4、21.700 g NaH2PO4和 2.000 g KCl,然后加入1.0 L双蒸水,充分混匀,用NaOH调节pH为7.4。
(4)蛋白上样缓冲液(5×):称取 37.920 g Tris、100.000 g十二烷基硫酸钠(SDS)、75.000 g二硫苏糖醇(DTT)和0.500 g溴酚蓝,量取500.00mL甘油,加双蒸水定容至1.0 L,充分混匀。
(5)5%浓缩胶:量取 1.44mL 双蒸水、416.7 μL 30%丙烯酰胺、623.0 μL 缓冲液、25.0 μL 10%SDS、12.5 μL过硫酸铵(APS)和 2.5 μL四甲基乙二胺(TEMED),充分混匀。
(6)12%分离胶:量取2.50mL双蒸水、3.00mL 30%丙烯酰胺、1.88mL 缓冲液、75.0 μL 10%SDS、30.0 μL10%APS 和 15.0 μL TEMED,充分混匀。
(7)10×Tris-Gly 缓冲溶液:称取 30.000 g Tris、144.000 g甘氨酸和10.000 g SDS,加双蒸水定容至1.0 L,充分混匀。
(8)考马斯亮蓝工作液(CBB):称取 0.200g CBB,量取100.00mL 95%乙醇和200.00mL 85%磷酸,加双蒸水定容至2.0 L,充分混匀后过滤。
(9)柱平衡液A和B、除杂液D及洗脱液C:柱平衡液A和B、除杂液D及洗脱液C的配制方法见表1。
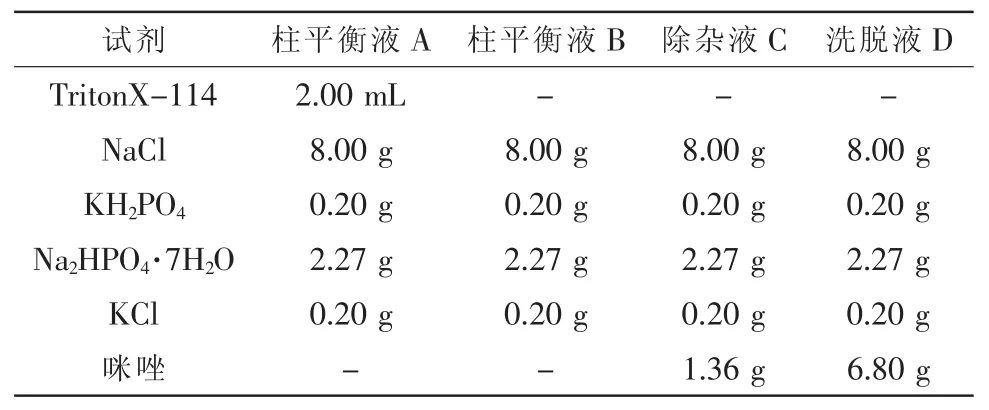
表1 溶液A、B、C和D的配制方法
2.2.2 重组质粒转化及重组细菌产毒培养
取1μL重组质粒 pET28a转化100 μL感受态大肠杆菌(BL21),42℃下热击 90 s,然后在冰上静置2min。取50 μL转化好的重组BL21于30%卡那霉素的LB培养基上,37℃培养过夜。转化成功的BL21可在30%卡那霉素的LB培养基上生长增殖,均匀分布。挑取转化成功的BL21菌株于30%卡那霉素的LB培养液中,37℃、220 rpm振荡培养过夜。取菌培养液于新的30%卡那霉素LB培养液中继续培养,菌液和培养基的比例为1∶100,37℃、220 rpm振荡培养3 h。当菌液浓度达到0.6 OD时,加入终浓度为0.5mmol/L的IPTG,220 rpm、28℃下诱导产毒培养12 h。
2.2.3 离心收集表达重组TDH亚基的菌体
取诱导产毒培养的菌液于离心管中,4000 rpm离心10min,去上清,收集沉淀,含表达重组TDH亚基的菌体用破碎缓冲液重悬,放置冰浴中超声(400W,20min)破碎菌体,释放重组TDH亚基。重组TDH亚基溶于上清液中,离心收集上清液,12 000 rpm离心20min。
2.2.4 重组TDH亚基纯化。
将重组TDH亚基提取液经过镍琼脂糖层析柱进行纯化,镍琼脂糖层析柱用5mL Ni-IDA填充。将适量的提取液加入到镍琼脂糖层析柱中,用200mL A液冲洗层析柱,然后用200mL B液冲洗层析柱,再用50mL D液冲洗层析柱,最后用200mL C液洗脱重组TDH亚基,并收集洗脱液。
2.2.5 去标签
重组TDH亚基所带标签为组氨酸标签(histidine-tag),histidine-tag 与 TDH 亚基之间通过肠激酶识别位点(DDDDK)相连,因此选用肠激酶(enterokinase,EK)切割 histidine-tag。纯化后的重组TDH亚基提取液和EK按照70∶1(m:m)的比例混合均匀后,置于40℃水浴中酶切6 h。
2.2.6 去标签TDH亚基纯化
酶切混合液通过镍琼脂糖层析柱进行纯化。没有去掉histidine-tag的重组TDH亚基和histidinetag会保留在镍琼脂糖层析柱中,去掉标签的目标蛋白TDH亚基则不能在镍琼脂糖层析柱中保留。将酶切混合液加入到镍琼脂糖层析柱中,加入100mLB液洗脱去标签TDH亚基,并收集洗脱液,去标签TDH亚基即为TDH亚基。将洗脱液脱盐后,-80℃保存,冻干。
酶切混合液通过镍琼脂糖层析柱进行纯化,没有去掉histidine-tag的重组TDH亚基和histidinetag会保留在镍琼脂糖层析柱中,去掉标签的目标蛋白TDH亚基则不能在镍琼脂糖层析柱中保留。将酶切混合液加入到镍琼脂糖层析柱中,加入100mL B液洗脱TDH亚基,并收集洗脱液,去标签TDH亚基即为TDH亚基。将洗脱液脱盐后,-80℃保存,冻干。
3 结果与讨论
3.1 温度对重组TDH亚基表达的影响
对温度作为影响重组TDH亚基表达的因素进行了研究,研究的温度范围为15℃、20℃、28℃和37℃。培养结束后,4 000 rpm离心10min收集菌体,然后用破碎缓冲液(PBS,pH7.4)重悬后,超声6min破碎菌体,12 000 rpm离心20min,收集上清液。分别将 15℃、20℃、28℃和 37℃得到的上清液进行SDS-PAGE电泳检测,结果见图1-图4。

图1 不同温度下TDH1亚基的表达

图2 不同温度下TDH2亚基的表达
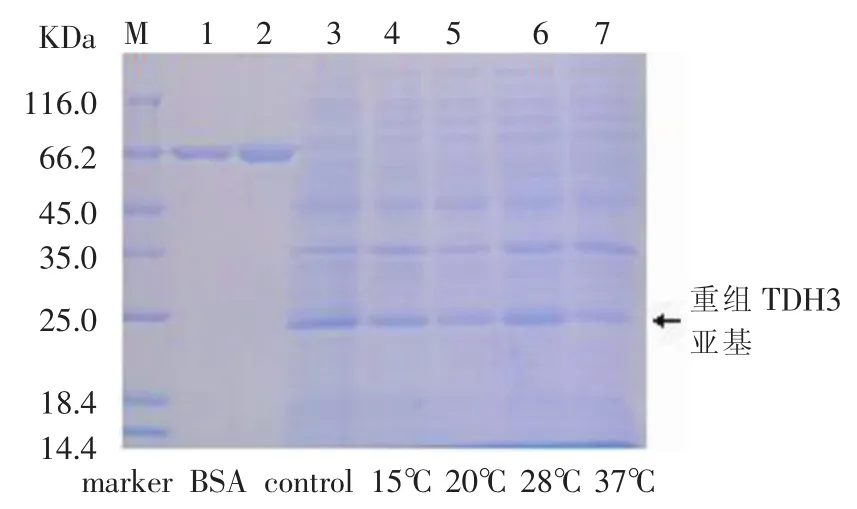
图3 不同温度下TDH3亚基的表达

图4 不同温度下TDH4亚基的表达
图1-图4显示,从15℃-28℃,随着培养温度的升高,重组TDH亚基电泳条带逐渐变宽,颜色逐渐加深,重组TDH亚基的表达量逐渐增加,28℃时,重组TDH亚基的表达量达到最大值;而从28℃-37℃,重组TDH亚基的电泳条带变窄,颜色变浅,重组TDH亚基的表达量下降。因此,温度对于重组TDH的表达有很大影响,这可能是在低于30℃的条件下时,适合于细菌表达次级代谢产物,但是温度过低则使细菌内的某些代谢酶活性降低。
3.2 培养时间对重组TDH亚基表达的影响
对培养时间作为影响重组TDH亚基表达的因素进行了研究。分别在 28℃下培养 2 h、4 h、8 h、12 h、24 h、48 h,然后 4 000 rpm 离心 10min,分别收集菌体,用PBS重悬后,超声破碎菌体,12 000 rpm离心20min,收集上清液,然后进行SDS-PAGE检测,结果见图5-图8。

图5 不同培养时间下TDH1亚基的表达

图6 不同培养时间下TDH2亚基的表达

图7 不同培养时间下TDH3亚基的表达
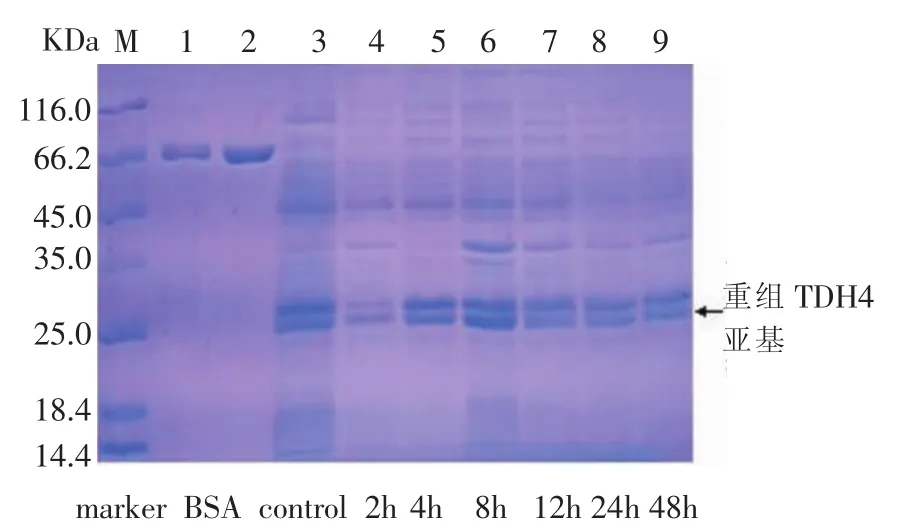
图8 不同培养时间下TDH4亚基的表达
图5-图8显示,从2-8 h,随着培养时间的增加,重组TDH亚基的电泳条带逐渐变宽,颜色加深,重组TDH亚基的表达量增加,在8-12 h间重组TDH亚基表达量达到最大;12 h后,随着培养时间的增加,重组TDH亚基的电泳条带变窄,颜色变浅,重组TDH亚基的表达量下降。因此,培养时间对于重组TDH亚基的表达量也有很大影响,12 h后重组TDH亚基表达量下降的原因可能为,在12 h后细菌出现衰亡现象,菌体内容物溢出,导致重组TDH亚基被降解。
3.3 酶切温度对去标签效果的影响
对酶切温度作为影响酶切效率的因素进行了考察。将酶切温度设为 15℃、20℃、25℃、30℃、35℃、40℃ 6个组,取1mL纯化提取液,加入 10 μL EK(0.6mg/mL),平行6组,分别在上述6个温度下进行酶切12 h,将酶切混合液进行SDS-PAGE检测,结果见图9-图12。
图9-图12显示,从 15℃到 30℃之间,随着酶切温度的升高,重组TDH亚基的电泳条带逐渐变窄,颜色变浅,而TDH亚基的电泳条带逐渐变宽,颜色逐渐变浅,酶切效率逐渐升高;酶切温度为35℃时,酶切效率达到最大;酶切温度从35℃到40℃时,酶切效率基本不变。酶切温度对于酶切效率的影响不可忽视。
3.4 酶与底物的比例对酶切效率的影响
对酶添加比例作为酶切效率的影响因素进行了考察。按照 0∶1,1∶10,1∶20,1∶50,1∶80,1∶100 的比例加入EK(0.6mg/mL),重组TDH亚基提取液的浓度为2mg/mL。将各组分置于35℃水浴中酶切12 h,然后将不同酶比例的酶切混合液进行SDS-PAGE检测,结果见图13-图16。
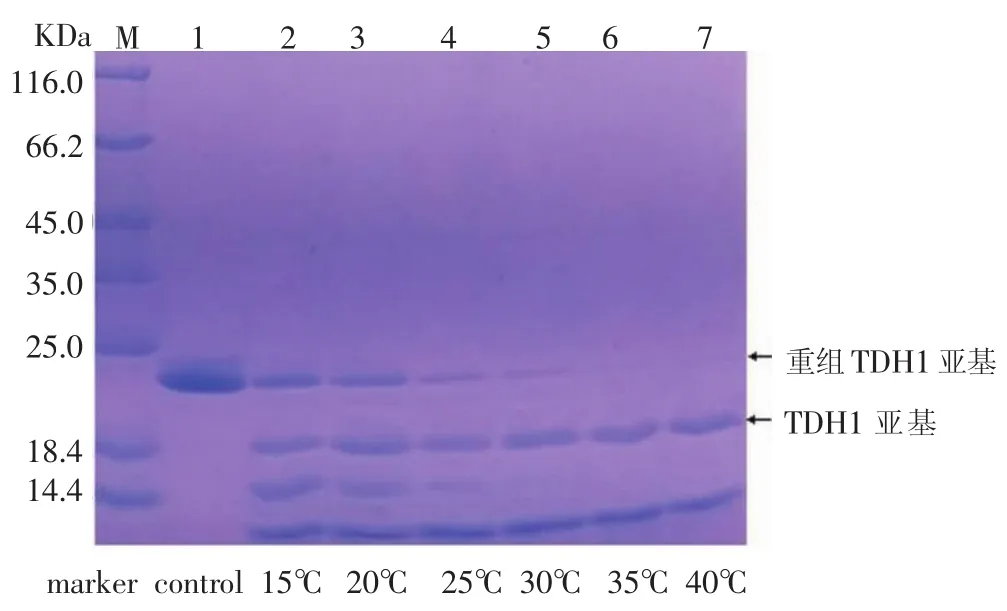
图9 不同酶切温度的酶切效果
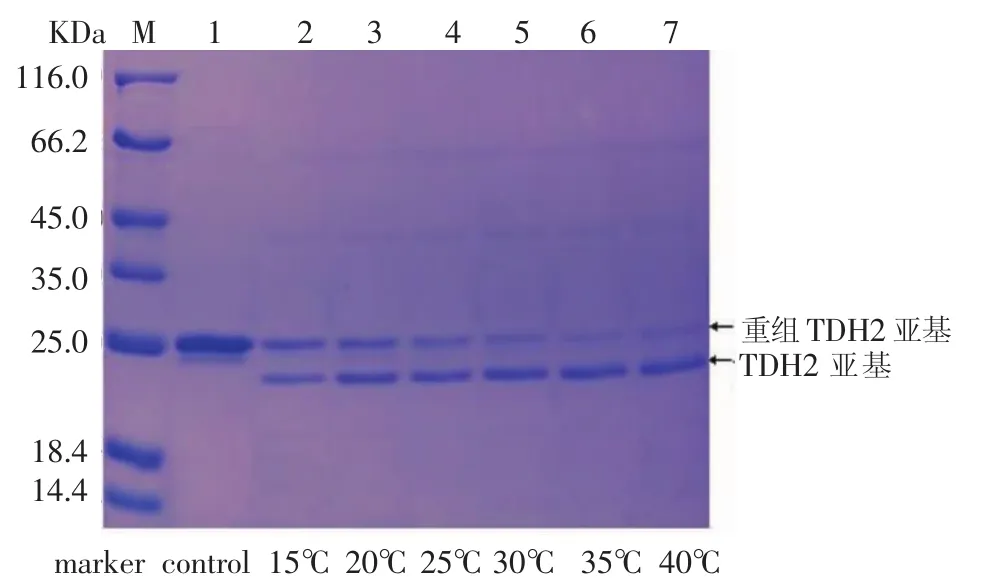
图10 不同酶切温度的酶切效果

图11 不同酶切温度的酶切效果
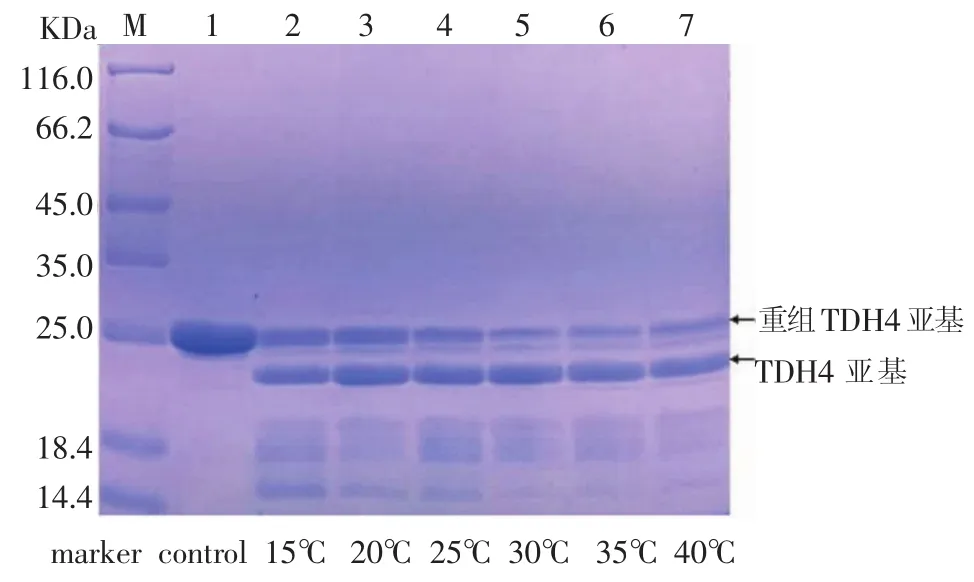
图12 不同酶切温度的酶切效果
图13-图16显示,从1∶100到1∶20之间,随着酶比例的增加,重组TDH亚基的电泳条带逐渐消失,酶切效率逐渐增加;酶添加比例为1∶20时,酶切效率基本达到100%。酶添加比例到一定程度达到饱和,为避免不必要的浪费,酶添加比例为1∶20即可。

图13 不同酶与底物比例的酶切效果

图14 不同酶与底物比例的酶切效果

图15 不同酶与底物比例的酶切效果

图16 不同酶与底物比例的酶切效果
3.5 酶切时间对重组TDH亚基去标签效果的影响
对酶切时间对酶切效率的影响进行了考察。分别按照体积比1∶20加入EK,然后在35℃的水浴中分别酶切 0h、2 h、6h、12 h、24h、36h、48h,然后将酶切混合液进行SDS-PAGE检测,结果见图17-图20。
图17-图20显示,从0-12 h,随着酶切时间的增加,重组TDH亚基的电泳条带逐渐消失,酶切12 h后,酶切效率基本达到100%。为了减少实验所需时间,酶切时间的考察十分必要。
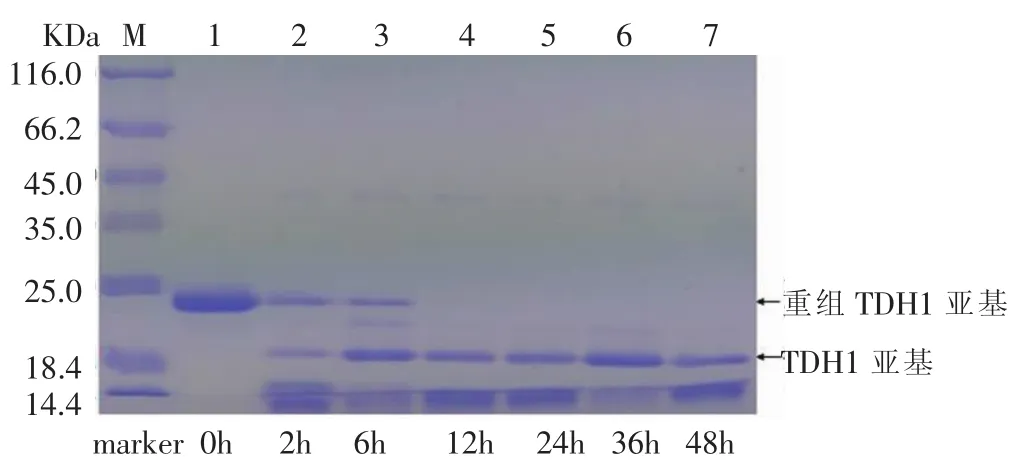
图17 不同酶切时间的酶切效果

图18 不同酶切时间的酶切效果
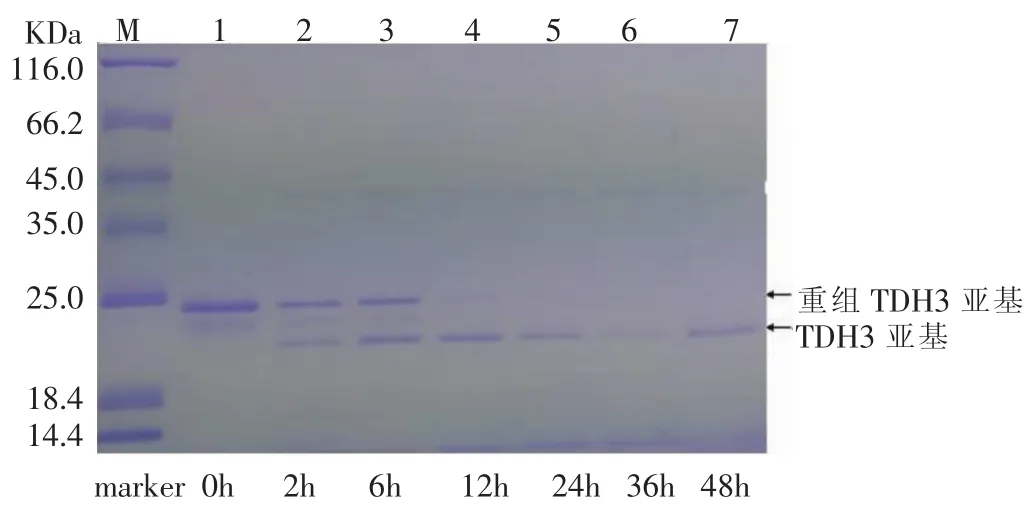
图19 不同酶切时间的酶切效果
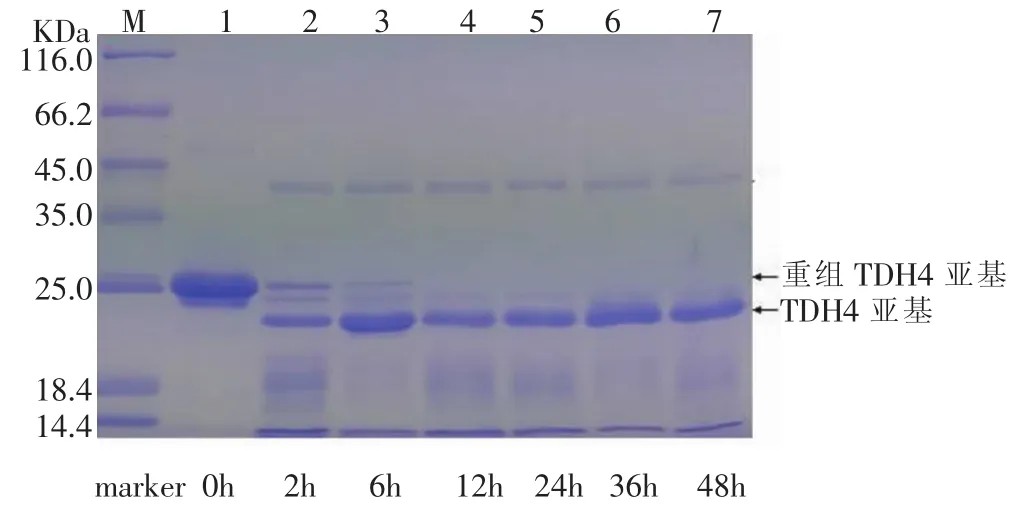
图20 不同酶切时间的酶切效果
4 结论
(1)通过对培养温度和培养时间对TDH亚基制备的影响研究发现,TDH最适表达的温度为28℃左右。这个结果提示气温为28℃左右时,可能为副溶血弧菌产毒的有利条件。因此,当气温接近28℃时,应该注意防范副溶血弧菌可能带来的食物中毒风险。当培养时间为8-12 h时,TDH亚基的表达量达到最大,但12 h之后TDH亚基的表达量明显下降。这个结果提示,当培养液中营养物质基本被消耗掉后,菌体繁殖能力降低,发生自溶现象,胞内各种酶类物质释放,导致TDH亚基被降解。研究表明,培养温度和培养时间均对TDH亚基的制备有较大影响,是不能被忽视的因素。
(2)对影响酶切效率的因素进行了研究,结果显示酶切温度和酶添加量对于酶切效率有很大影响。为了提高酶切效率,缩短实验所需时间,同时又避免不必要的浪费,酶切温度和酶添加量是必须要考察的因素。
(3)本研究为副溶血弧菌食物中毒的预防提供了依据。
[1]Arisara Boonyawantang,Warapa Mahakarnchanakul,Chitsiri Rachtanapun,et al.Behavior of pathogenic Vibrio parahaemolyticus in prawn in response to temperature in laboratory and factory[J].Food Control,2012,(26):479-485.
[2]Ohnishi Kiyouhisa,Nakahira Kumiko,Unzai Satoru,et al.Relationship between heat-induced fibrillogenicity and hemolytic activity of thermostable direct hemolysin and a related hemolysin of Vibrio parahaemolyticus[J].FEMS Microbiology Letters,2011,318(1):10-17.
[3]Yongning Wu,Jian Wen,Yi Ma,et al.Epidemiology of foodborne disease outbreaks caused by Vibrio parahaemolyticus,China,2003-2008[J].Food Control,2014,(46):197-202.
[4]林祥田.94起副溶血弧菌食物中毒流行病学特征分析[J].营养与食品卫生,2006,18(3):141-143.
[5]Kristi S Shaw,Amy R Sapkota,John M Jacobs,et al.Recreationalswimmers'exposuretoVibrio vulnificusand Vibrio parahaemolyticus in the Chesapeake Bay,Maryland,USA[J].Environment International,2015,(74):99-105.
[6]Sadok Khouadja,Elisabetta Suffredini,Besma Baccouche,et al.Occurrence ofvirulence genes among Vibrio cholerae and Vibrio parahaemolyticusstrains from treated wastewaters[J].Environ Monit Assess,2014,(186):6935-6945.
[7]陈心,马蓉,张千千,等.细菌感染后大黄鱼脾脏组织中PcQM基因表达及PcQM 在大肠杆菌中原核表达[J].基因组学与应用生物学,2014,33(5):946-952.
[8]刘桦,杨晓龙,唐丽,等.NGAL重组蛋白的表达与纯化及其促进结肠癌转移的研究 [J].成都医学院学报,2015,10(2):142-151.
[9]陈祥,宦海霞,万婷,等.猪源大肠杆菌F18菌毛的体外表达和抗原特性 [J].微生物学报,2014,54(2):236-242.
Environmental Factors on Preparation of Thermostable Direct Hemolysin Subunits
LI Hongna1,2, YUAN Fei2, ZHANG Chenyang1, MA Wenliang1, LUO Yunjing1*, ZHANG Feng2**
(1.College of Life Science and Bioengineering, Beijing University of Technology, Beijing, 100124;2.Chinese Academy of Inspection and Quarantine)
Thermostable direct hemolysins(TDHs)were the major virulence factros of vibrio parahaemolyticus.The expression of TDH was important to further study of vibrio parahaemolyticus detection.So environmental factors on expression of TDH subunits were studied in this paper,and the culture temperature and time were studied.The result showed that 28℃was most proper for expression of TDH subunits,and expression of TDH subunits was in low level when culture temperature below or above of 28℃.The expression of TDH subunits reached maximum within 8-12 h,however,the expression of TDH subunits was decreasing when culture time was over 12 h.In addition,influence factors on enzymatic digestion were investigated.The result showed that the enzymatic efficiency was increasing along with the enzymatic temperature ranged from 15℃ to 40℃ and enzyme ratio ranged from 1 ∶100 to 1∶20.The result suggested that culture temperature and time can affect the expression of TDH subunits,and enzymatic temperature and enzyme ratio can affect enzymatic efficiency.
Vibrio Parahaemolyticus;Thermostable Direct Hemolysins;Genetic Engineering Technology;Culture Temperature;Culture Time
Q789
E-mail:lihongna1@163.com;*通讯作者Email:luoyj@bjut.edu.cn;**通讯作者E-mail:fengzhang@126.com
公益性行业科研专项经费项目(201510038);国家质检总局科技计划项目(2014IK084)
2017-03-31
