瑞香狼毒根中总香豆素的提取工艺研究
2017-07-15张等宏陈娥肖春芳张远学叶兴枝杨
张等宏+陈娥+肖春芳+张远学+叶兴枝+杨国才+沈艳芬+高剑华

摘要:为研究瑞香狼毒(Stellera chamaejasme L.)根中总香豆素的提取工艺,以紫外可见分光光度法作为分析手段,以化合物瑞香苷为标准化合物,绘制了瑞香狼毒根中总香豆素的标准曲线,作为总香豆素得率的评价标准。采用乙醇为提取溶剂,对冷浸、热回流、超声波辅助提取法比较发现,超声提取效果最好。因此用单因素法对超声辅助提取条件进行了选择,考察了提取溶剂、提取温度、提取时间、料液比对总香豆素提取的影响,确定了最佳单因素条件。乙酸乙酯作为提取溶剂、温度55 ℃、提取时间40 min、料液比1∶15(g/mL)。选用的5种大孔吸附树脂中对AB-8型树脂纯化效果最好,50%乙醇洗脱液对香豆素的纯化效率可达90%以上。
关键词:瑞香苷;总香豆素;提取工艺;超声辅助提取;大孔吸附树脂
中图分类号:R284.2 文献标识码:A 文章编号:0439-8114(2017)12-2328-04
DOI:10.14088/j.cnki.issn0439-8114.2017.12.032
Extraction Technology of Total Coumarines in Root of Stellera chamaejasme L.
ZHANG Deng-hong,CHEN E,XIAO Chun-fang,ZHANG Yuan-xue,YE Xing-zhi,
YANG Guo-cai,SHEN Yan-fen,GAO Jian-hua
(Enshi Academy of Agricultural Science/Enshi South-China Potato Research Center, Enshi 445000, Hubei,China)
Abstract: To study the extraction technology of total coumarin from the root of Stellera chamaejasme L.,the content of total coumarin is determined by UV spectrophotometry. This study has been used daphin as control,the content of total coumarin in root of Stellera was determined by standard curve. The yield of total coumarin is as the detective marker. Ethyl alcohol was used as extracts solvents,compared and analysis cold impregnation, hot reflux and ultrasonic assisted extraction. The results showed that ultrasonic assisted extraction were the best mehod. The effects of solvent,extraction temperature,extraction time and ratio of solid to liquid in extraction procedure on the extraction rate of total coumarins in Stellera was researched by single factor experiment. The optimal extraction technology of total coumarins in Stellera was:ethyl acetate solvent,extraction temperature 55 ℃,extraction time 40 min,the material-liquid ration 1∶15. The AB-8 was the most suitable type for the purification of total coumarin from Stellera among the five kinds of macroporous resin,the extraction efficiency of 50% ethanol eluent was 90%,get the most of coumarin.
Key words: daphin;total coumarin;extraction technology;ultrasonic assisted extraction;Daphnetin, Macroporous adsorption resin
瑞香狼毒(Stellera chamaejasme L.)是多年生的草本植物,為瑞香科狼毒属,俗称打碗花、断肠草、馒头花等,盛花期7~9月,色泽鲜艳[1-5]。分布在海拔2 000~4 000 m的干燥向阳坡地[6,7],在中国的北部和西南等地有大面积分布,在西北干旱地区具有很强的生态竞争力[8-11],其根系可达地下1 m,生态适应能力强,在逆境中生命力顽强。其根部有剧毒,常引起牛羊误食中毒,严重影响放牧[11-16]。
前期研究发现,瑞香狼毒对截形叶螨(Tetranychus truncates Ehara)、二斑叶螨(Tetranychus urticae Koch)和豌豆蚜(Acyrthosiphon pisum)具有较强的触杀活性,其中石油醚部位和氯仿部位的活性最强,通过活性跟踪分离确定了6个活性化合物,其中5个是香豆素类化合物,5个香豆素化合物对截形叶螨、二斑叶螨、豌豆蚜均表现出一定的触杀活性,而化合物伞形花内酯和瑞香苷具有很强的触杀活性。为了实现瑞香狼毒杀虫剂的制剂化研究,进一步实现产业化,能够高效快捷的提取出瑞香狼毒中的主要成分,本研究以瑞香苷作为瑞香狼毒中总香豆素的提取标准,以紫外分光光度计为检测仪器,对提取方法及提取条件进行研究,选择最佳提取方法及最佳提取工艺,在此基础上对提取物进一步分离纯化,以期得到高含量的杀虫活性物质。
1 材料与方法
1.1 材料与仪器
瑞香狼毒:瑞香狼毒根部试验样品采自四川阿坝,阴干,切段,粉碎,备用。瑞香苷为分离得到。D101、D201、HPD400、HPD600、AB-8型大孔吸附树脂,所用试剂均为分析纯。
仪器:旋转蒸发仪SW-CJ-2G(瑞士Buchi公司);循环水式多用真空泵SHB-B95(郑州市亚荣仪器有限公司);AL104电子天平(梅特勒-托利多仪器上海有限公司);UV2550 型紫外可见分光光度计(日本Shimadzu公司);JY98-3D型超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.2 方法
1.2.1 吸收波长的确定 准确称取10 mg瑞香苷单体化合物,乙醇定容至50 mL,吸取2 mL至比色皿中,在波长245~600 nm之间扫描,得到最大吸收波长为310 nm。
1.2.2 总香豆素含量测定 以瑞香苷为标准品,参照丛建明等[17]试验方法,进行瑞香狼毒中总香豆素含量的测定。称取10 mg瑞香苷单体化合物,置于50 mL容量瓶中,加无水乙醇定容至刻度(0.20 g/L)得对照品溶液。分别吸取对照品溶液5.0、7.5、10.0、12.5、15.0、17.5 mL分置于50 mL容量瓶中,用乙醇稀释至刻度。以无水乙醇为空白对照,于310 nm处测定其吸光度,并根据测定结果绘制标准曲线。得到方程为A=36.151x+0.031 6,相关系数R2=0.998 3,线性关系良好。称取100 g样品用95%乙醇提取3次,提取液浓缩至一定体积后,转移至500 mL容量瓶中,定容,得到待测样品。称取待测样品比重,将待测样品于310 nm处测定吸光度,最后将结果代入所得曲线方程中,计算出x值,重复3次。通过上述方法计算总香豆素含量。
M=xV/m
式中,x为由标准曲线计算的质量浓度(mg/mL);V为样品定容体积(mL);m为瑞香狼毒粉的质量(g)。
1.2.3 比重测定 将定容后的样品称取其总质量,减去容量瓶质量即为样品定容至500 mL体积时的比重,重复3次。
1.2.4 提取物制备 用超声辅助提取法,以乙酸乙酯作为提取溶剂,温度55 ℃,提取40 min,料液比 1∶15(g/mL,下同),浓缩阴干后备用。
1.2.5 提取物纯化 将“1.2.4”制备的提取物用不同型号的大孔吸附树脂进行纯化,孔径2 cm的玻璃柱填料300 g,经碱洗(1% NaOH)酸洗(1% HCl)活化后,准确称取用“1.2.4”中方法制备好的1 g样品,去离子水充分悬浮后上样,分别用0、30%、50%、70%、90%的乙醇水溶液梯度洗脱2个柱体积,将得到的洗脱液分别减压浓缩,转移至500 mL容量瓶中,定容,得到待测样品。称取待测样品比重,将待测样品于310 nm处测定吸光度,重复3次,最后将结果代入“1.2.2”所得曲线方程中,计算出x值。
1.2.6 提取物的纯化效率计算 用选取的超声辅助方法提取得到的样品中总香豆素含量为0.434 2 mg/g,纯化后测定吸光度可以计算出洗脱液中香豆素含量,与加入的总香豆素比值得到香豆素的纯化效率。
2 结果与分析
2.1 提取工艺研究结果
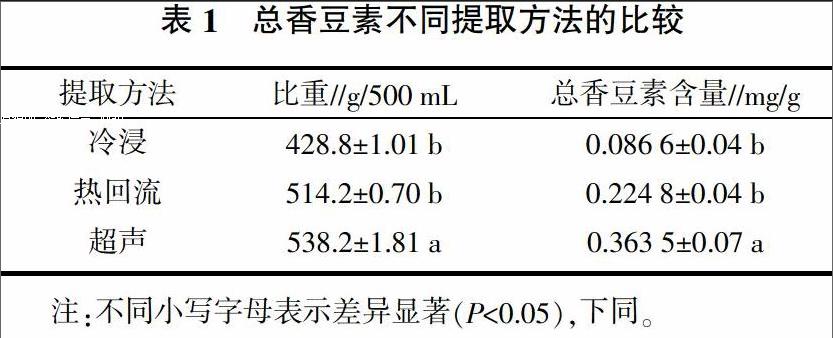
2.1.1 总香豆素提取方法的选择 狼毒根粉分别用冷浸、热回流、超声提取总香豆素,提取2 h,料液比1∶40(g/mL,下同),95%乙醇。热回流温度选择80 ℃,超声功率为300 W。由表1可知,冷浸提取出的香豆素含量最低,超声提取效果最好,与其他2种提取方法差异显著,因此选用超声提取法对瑞香狼毒根中总香豆素提取工艺进行优化。
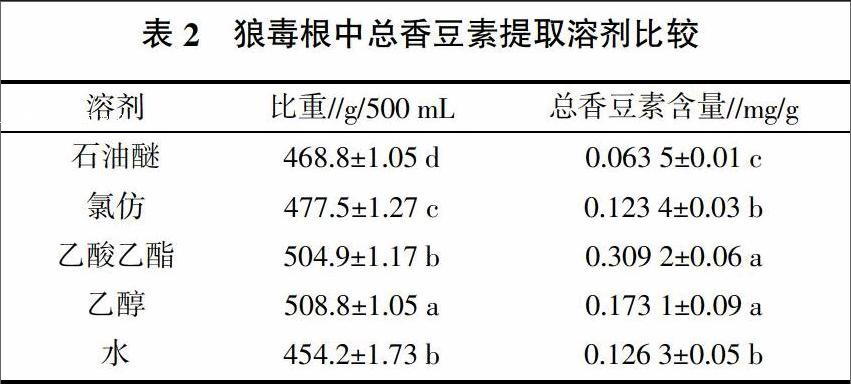
2.1.2 超声提取溶剂的选择 选用石油醚、氯仿、乙酸乙酯、乙醇、水作为提取溶剂进行提取溶剂的选择,提取时间设为30 min,料液比1∶10,提取功率为300 W,常温提取。由表2可知,乙醇提取物和乙酸乙酯提取物中总香豆素含量显著高于其他溶剂提取物,而乙醇提取物的比重显著高于其他溶剂提取物,乙醇的渗透性强,提取出的样品比重最大,可以将狼毒根中多数物质提取出来,而乙酸乙酯提取物的比重低于乙醇提取物的比重,因此选用乙酸乙酯作為提取溶剂有利于对香豆素的进一步纯化。
2.1.3 超声提取时间的选择 选用乙酸乙酯作为提取溶剂进行提取时间的选择,料液比1∶10,提取功率为300 W,常温提取。由表3可知,在40 min时总香豆素的含量达到最大值,随着时间的延长,总香豆素含量下降,长时间的超声振荡可能引起香豆素化合物的分解,比重随着时间的延长呈增加趋势,说明其他非香豆素化合物进入了提取液中,因此选用40 min作为最佳提取时间进行下一步试验。
2.1.4 超声提取温度的选择 选用乙酸乙酯作为提取溶剂,提取时间为40 min,料液比1∶10,提取功率为300 W,进行提取温度的选择。由表4可知,随着提取温度的增加比重呈增加趋势,总香豆素含量在55 ℃达到最大值,因此选用55 ℃作为最佳提取温度进行下一步试验。
2.1.5 超声提取料液比的选择 选用乙酸乙酯作为提取溶剂,提取温度为55 ℃,提取时间为40 min,提取功率为300 W,进行料液比的选择。由表5可知,随着溶剂的增加,比重和总香豆素含量均呈增加趋势,比重大于15后总香豆素含量增加不明显而比重增加相对较多,说明提取物中其他杂质增加明显,因此选用1∶15作为最佳料液比进行下一步试验。
2.2 纯化制备研究结果
2.2.1 D101型大孔吸附树脂的纯化效果 由表6可知,D101型大孔吸附树脂用水(0%)洗脱后,洗脱液中香豆素含量较少,纯化效率和损失率分别为9.43%、90.57%;30%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为22.46%、77.54%;50%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为39.02%、60.98%;70%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为31.63%、68.37%;90%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为3.89%、96.11%。说明D101吸附作用集中在30%~70%之间,占总香豆素含量的80%以上。
2.2.2 D201型大孔吸附树脂的纯化效果 由表7可知,D201型大孔吸附树脂用水(0%)洗脱后,洗脱液中香豆素含量较少,纯化效率和损失率分别为6.24%、93.76%;30%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为35.20%、64.80%;50%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为42.21%、57.79%;70%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为18.89%、81.11%;90%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为10.26%、89.74%。说明D201吸附作用集中在30%~50%之间,占总香豆素含量的70%以上。
2.2.3 HPD400型大孔吸附树脂的纯化效果 由表8可知,HPD400型大孔吸附树脂用水(0%)洗脱后,洗脱液中香豆素含量较少,纯化效率和损失率分别为6.50%、93.50%;30%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为3.41%、96.59%;50%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为23.13%、76.87%;70%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为40.93%、59.07%;90%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为6.88%、93.12%。说明HPD400吸附作用集中在50%~70%之间,占总香豆素含量的60%以上。
2.2.4 HPD600型大孔吸附树脂的纯化效果 由表9可知,HPD600型大孔吸附树脂用水(0%)洗脱后,洗脱液中香豆素含量较少,纯化效率和损失率分别为3.22%、96.78%;30%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为6.75%、93.25%;50%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为26.31%、73.69%;70%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为31.57%、68.43%;90%乙醇水溶液洗脱后对香豆素的純化效率和损失率分别为29.21%、70.79%。说明HPD600吸附作用集中在50%~90%之间,占总香豆素含量的80%以上。
2.2.5 AB-8型大孔吸附树脂的纯化效果 由表10可知,AB-8型大孔吸附树脂用水(0%)洗脱后,洗脱液中香豆素含量较少,纯化效率和损失率分别为9.49%、90.51%;30%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为9.24%、90.76%,50%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为90.18%、9.82%;70%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为21.95%、78.05%;90%乙醇水溶液洗脱后对香豆素的纯化效率和损失率分别为5.86%、94.14%。说明AB-8吸附作用集中在50%洗脱液部分,占总香豆素含量的90%以上。
3 小结与讨论
通过对瑞香狼毒根的活性筛选及活性跟踪分离发现,香豆素类化合物对截形叶螨、二斑叶螨和豌豆蚜具有较强的触杀活性,具有一定的除草作用。其中以瑞香苷的杀虫活性最强,本研究以活性化合物瑞香苷为标准化合物,绘制了狼毒根中总香豆素的标准曲线,采用乙醇为提取溶剂比较了冷浸、热回流、超声波辅助提取法,发现超声提取出的总香豆素含量高、杂质少、效果好。同时用单因素法对超声辅助提取条件进行了选择,研究了提取溶剂、提取温度、提取时间、料液比对总香豆素提取的影响,确定了最佳单因素条件为乙酸乙酯作为提取溶剂,温度55 ℃,提取40 min,料液比1∶15。
为了对提取物进一步纯化,选用了5种大孔吸附树脂,对提取物进行了纯化处理。结果显示,D101吸附作用集中在30%~70%之间,占总香豆素含量的80%以上;D201吸附作用集中在30%~50%之间,占总香豆素含量的70%以上;HPD400吸附作用集中在50%~70%之间,占总香豆素含量的60%以上;HPD600吸附作用集中在50%~90%之间,占总香豆素含量的80%以上;AB-8吸附作用集中在50%洗脱液部分,占总香豆素含量的90%以上。AB-8型化合物对香豆素类化合物具有明显的纯化效果,50%的乙醇水洗脱液对香豆素的纯化效率可达90%以上,通过比较分析,选择AB-8型大孔吸附树脂进行进一步纯化,以50%乙醇水洗脱液为主要活性部位。
本研究建立的提取工艺、检测方法及纯化方法为瑞香狼毒的进一步开发及有效利用提供了理论依据,对中国设施农业害虫的防治具有重要的意义。
参考文献:
[1] CUI H,JIN H,LIU Q,et al.Nematicidal metabolites from roots of Stellera chamaejasme against Bursaphelenchus xylophilus and Bursaphelenchus mucronatus[J].Pest Manag Sci,2014,70(5):827-835.
[2] 张程辉,张煜明.瑞香狼毒防治舞毒蛾的研究[J].宁夏农林科技,2007(5):40.
[3] LIU Y,LONG R,YAO T.Research progress on Stellera chamaejasme L.in grassland[J].Pratacul Sci,2004,21:55-61.
[4] XING F,SONG R.Population distribution pattern and dynamic of Stellera chamaejasme,a poisonous grassland plant[J].Pratacul Sci,2002.19:16-19.
[5] QUINTANA N,WEIR T L,DU J,et al.Phytotoxic polyacetylenes from roots of Russian knapweed Acroptilon repens(L.) DC.[J].Phytochemistry,2008,69:2572-2578.
[6] CAO C Y,FU Y,WANG W X,et al.Inhibition influence of extraction liquids from Stellera chamaejasme root on seed germination[J].J. Northeast Univ Nat Sci,2007,28:729-732.
[7] ZHOU S Q,WANG H,HUANG Z J,et al.Research on allelopathy of Stellera chamaejasme in decompose process in the soil on Alfalfa[J].Chin J Grassl,2008,30:78-32.
[8] XU Z H,QIN G W,LI X Y,et al.New biflavanones and bioactive compounds from Stellera chamaejasme L.[J].Acta Pharmaceutica Sinica,2001,36:668-671.
[9] YAN Z Q,GUO H R,YANG J Y,et al.Phytotoxic flavonoids from roots of Stellera chamaejasme L.(Thymelaeaceae)[J].Phytochemistry,2014,106:61-68.
[10] YANG G H,LIAO Z X,XU Z Y,et al.Antimitotic and antifungal C-3/C-3-biflavanones from Stellera chamaejasme[J].Chemical & Pharmaceutical Bulletin,2005,53:776-779.
[11] 王 偉,仝宝胜,师光禄,等.瑞香狼毒粗提物对朱砂叶螨的生物活性[J].中国农学通报,2010,26(11):36-39.
[12] TIKHOMIROVA L I,MARKOVA L P,TUMBAA H. Coumarins from stellera chamaejasme L.[J].Khim Prir Soedin,1974,3:402.
[13] 刘文程,王 臣.瑞香狼毒的化学成分、生物活性及应用研究进展[J].现代药物与临床,2010,25(1):26-30.
[14] 杨乾栩,程孟春,王 莉,等.活性数据离散分布下的瑞香狼毒抗肿瘤活性成分筛选研究[J].药学学报,2014,49(6):927-931.
[15] 卓兆莲,高 英,李卫民,等.瑞香狼毒药材质量标准研究[J].中药材,2008,31(1):135-137.
[16] 张国洲,王亚维,徐汉虹.瑞香狼毒杀虫活性成分的提取与分离[J].安徽农业大学学报,2000,27(4):340-344.
[17] 丛建明,陈凤清,野俊双,等.草木犀香豆素的提取工艺及抑菌活性研究[J].天然产物研究开发与应用,2014(26):588-593.
