水中壬基酚残留检测方法的研究及其应用
2017-07-15贾林贤姜蕾林勇刘迎潘波
贾林贤++姜蕾++林勇++刘迎++潘波
摘要:建立了固相萃取-高效液相色谱和浊点萃取-高效液相色谱2种方法检测水溶液中壬基酚,分析了2種方法对水溶液中壬基酚回收率的影响。固相萃取以C18小柱作为固相萃取小柱,5 mL甲醇作为洗脱液进行固相萃取,后经HPLC检测,回收率可以达到80.28%~82.38%,相对标准偏差为0.40%~4.57%,检出限为0.9 μg/L。浊点萃取以非离子表面活性剂聚乙二醇-6000(PEG-6000)作为萃取剂,在33 g/L的PEG-6000,溶液pH值为2.0,160 g/L Na2SO4,45 ℃水浴15 min条件下进行浊点萃取,用HPLC检测。壬基酚的质量浓度在0.02~2.0 mg/L时,其质量浓度与HPLC检测峰面积呈现良好的线性关系,相关系数为0.999 4,检出限为0.4 μg/L;壬基酚的萃取率为84.97%~101.64%,相对标准偏差为0.03%~4.40%,符合有机污染物检出方法要求。通过斑马鱼急性毒性试验,检测水中壬基酚含量,证明浊点萃取-高效液相色谱法用于检测水中壬基酚残留的方法可行。对比固相萃取,浊点萃取更具发展前景。
关键词:壬基酚;浊点萃取;固相萃取;高效液相色谱法;水
中图分类号: S481+.8;TQ450.2+64文献标志码: A
文章编号:1002-1302(2017)09-0147-04
壬基酚(nonylphenol,简称NP)是一种用于合成非离子表面活性剂-壬基酚聚氧乙烯醚(NPEOs)的主要原料,也是其降解产物,广泛存在于环境介质(水体、土壤、沉积物及大气)中[1-2];NPEOs作为一种农药助剂,还广泛应用于各种农药制剂中。2001年联合国环境规划署已经将NP确定为27种优先控制的持久性有毒污染物之一,欧盟于2013年7月通过了《关于统一各成员国有关限制销售和使用某些危害物质及制品的法律法规和管理条例》(2003/53/EC),该法规禁止在欧洲地区销售和使用含量超过0.1%的NPEOs或者NP的产品及其配方产品[3]。我国也在初步探讨禁止在农药制剂中添加或少添加NPEOs[4]。与NPEOs相比,壬基酚较难继续降解,毒性、亲脂性强,易富集,且有促癌作用和内分泌干扰效应[5-8]。壬基酚在水中的溶解度较低,在分析检测时往往需要进行前处理将其富集。主要的前处理技术有液-液萃取、固相萃取、微波溶出、加速溶剂萃取及超临界流体萃取等方法[9],检测方法主要为液相色谱、气相色谱或者气-质联用。
固相萃取(solid phase extraction,SPE)是指使用固体吸附剂将待测组分选择性吸附或选择性洗脱达到富集、分离、净化的一种前处理技术。吸附剂种类、用量、保留体积、流速、洗脱溶剂均是影响固相萃取效率的主要因素。除了传统的固相萃取技术以外还出现了全自动固相萃取、固相微萃取、磁力搅拌棒吸附萃取、基质分散固相萃取和分子印迹固相萃取等固相萃取技术[10]。固相萃取技术在环境样品分析检测中应用广泛,特别是针对水样的预处理。固相萃取技术与色谱和质谱等检测手段的联用是有机污染物残留检测分析的一种重要手段。
浊点萃取法(cloud point extraction,CPE)是一种环境友好型液-液萃取技术,利用表面活性剂作为萃取剂,避免使用挥发性有机溶剂,成本较低且对环境几乎无危害,可以达到令人满意的回收提取率和富集效率[11-13]。表面活性剂的分子由非极性基团——疏水基和极性基团或离子基团——亲水基组成。水溶液中表面活性剂质量浓度的增加使得疏水基聚集成核,亲水基向外张开,从而形成胶束[14]。表面活性剂的溶解度随着溶液温度的升高逐渐降低,升至一定温度后,整个溶液变浑浊,此时的温度被称为表面活性剂的浊点(cloud point,CP)。表面活性剂的水溶液在静置或离心后可以得到2个分离的透明液相:表面活性剂相(或束胶相)和水相。表面活性剂溶液分层时,疏水性物质随着疏水基进入表面活性剂相,而亲水性物质留在水相中,这种通过提升温度使溶液产生浊点现象,并将样品中对水具有不同亲合性的物质进行分离的方法被称为浊点萃取法[14]。浊点萃取技术最早应用于金属离子的检测[15],近年来浊点萃取技术作为一种前处理技术在有机污染物残留检测分析中应用也十分广泛[16]。
本研究通过建立固相萃取和浊点萃取2种萃取方法回收水中壬基酚,利用高效液相色谱进行检测,分析2种萃取方法对水中壬基酚回收率的影响,并通过斑马鱼急性毒性试验验证浊点萃取-高效液相色谱法的可行性。
1材料与方法
1.1试剂与仪器
壬基酚(异构体混合物)(上海子起生物科技有限公司);甲醇(色谱纯)、丙酮(分析纯)、乙腈(色谱纯)、超纯水(18.2 MΩ/cm);曲拉通X-100(Triton X-100)、曲拉通-114(Triton X-114)、聚乙二醇-6000(PEG-6000)、C18小柱、石墨碳黑小柱和石墨碳黑/氨基小柱。
试验用仪器有Water高效液相色谱仪、菲利普尔超纯水仪、超声仪、固相萃取仪、雷磁pH计。
1.2试验方法
1.2.1色谱方法
1.2.1.1固相萃取-高效液相色谱法
配制0.02、0.20、2.00 mg/L 的壬基酚水溶液待用。取一固相萃取小柱,用 5 mL 甲醇和5 mL超纯水进行预淋洗,加压抽干,将配制好的壬基酚水溶液5 mL过柱,弃流,再用5 mL甲醇分2次进行洗脱,收集洗脱液,待HPLC检测。
选择C18小柱、石墨碳黑小柱和石墨碳黑/氨基小柱3种小柱作为固相萃取小柱,试验浓度选择0.02、0.20、2.00 mg/L 的丙酮、甲醇、乙腈作为洗脱液,洗脱液体积为 5 mL,按上述方法进行固相萃取,而后经HPLC检测。
1.2.1.2浊点萃取-高效液相色谱法
取20 mL水样于 50 mL 离心管中,加入6.4 g Na2SO4和4.4 mL体积分数为30%的PEG-6000。用90% H2SO4调节溶液pH值至2.0;用水定容至40 mL,振荡至Na2SO4完全溶解;将离心管放入45 ℃水浴锅中平衡15 min,3 000 r/min,25 ℃离心5 min;冰水浴5 min,用吸管将表面活性剂相吸出,置于10 mL试管中,用超纯水定容至10 mL,待HPLC检测。
1.2.2色谱条件
色谱柱为Waters-Symmetry C18液相色谱柱,4.6×150 mm,5 μm。流动相水、甲醇、乙腈体积比为 22 ∶70 ∶8。流速0.7 mL/min,进样量20 μL,发射波长 275 nm,检测波长308 nm,柱温25 ℃。
1.2.3不同处理对萃取效果影响
本试验设计了21~42 g/L PEG-6000;0.5~12 pH值;100、120、140、160、180、200 g/L的Na2SO4;30、40、45、50、55 ℃的平衡温度,来研究不同处理对水中壬基酚萃取效率的影响。
1.2.4壬基酚对斑马鱼的急性毒性及水中壬基酚含量的检测
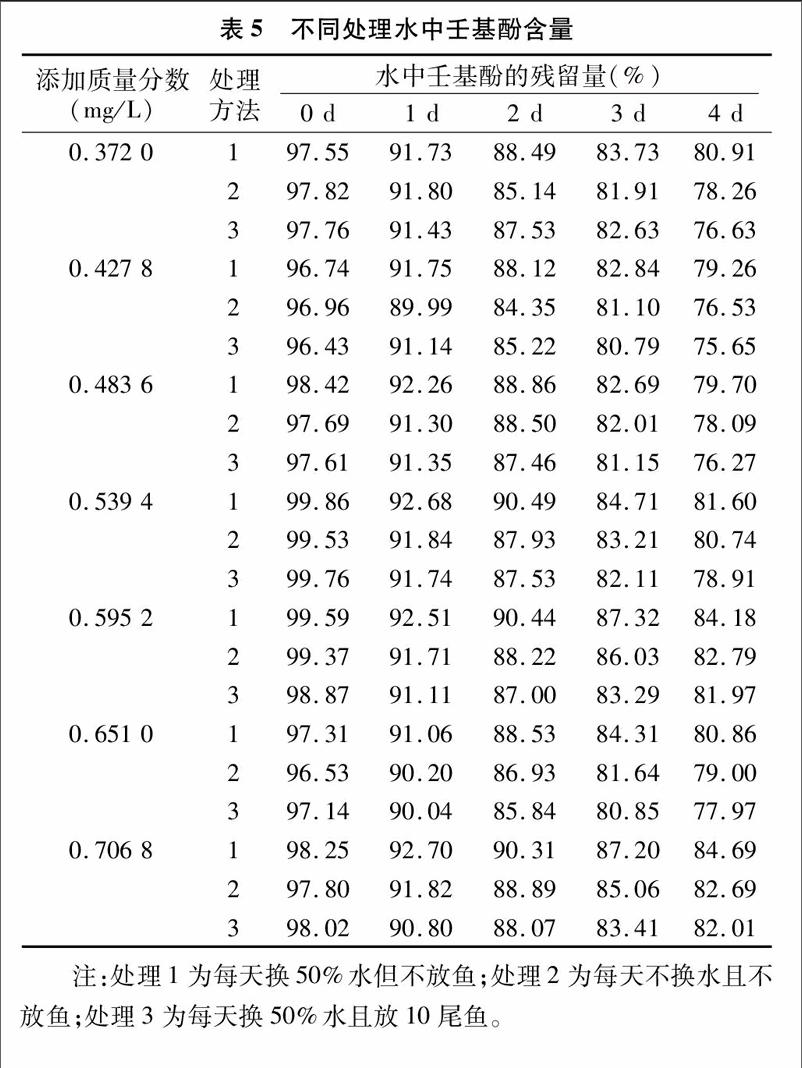
参照《化学农药环境安全评价试验准则(征求意见稿)》中斑马鱼急性毒性试验方法,设置0.372 0、0.427 8、0.492 0、0.565 8、0.650 7、0.748 3、0.860 5 mg/L等7个浓度。另设每天换50%的水但不放鱼;每天不换水且不放鱼;每天换50%的水放10尾鱼3个处理,测定不同壬基酚添加量下,0、1、2、3、4 d壬基酚残留量。
2结果与分析
2.1洗脱液种类和萃取小柱对固相萃取-高效液相色谱法萃取效果的影响
选择C18小柱、石墨碳黑小柱和石墨碳黑/氨基小柱3种小柱,使用C18小柱作为固相萃取小柱,5 mL甲醇作为洗脱液进行固相萃取,后经HPLC检测,回收率达到80.28%~82.38%,相对标准偏差为0.40%~4.57%(表1)。
2.2浊点萃取-高效液相色谱法
根据文献报道,Triton X-n在紫外区域有较强的吸收,对高效液相色谱-紫外检测会形成干扰[12,17]。Tween-80浊点较高,在进行浊点萃取时,所需温度较高,且回收率较低[18]。
而PEG-6000 则不会对高效液相色谱-紫外检测产生影响,并且其可以作为非离子表面活性剂在一定的条件下完成浊点萃取分相[19]。故本试验选择PEG-6000作为浊点萃取的萃取剂按照“1.2.2.2”节的试验方法对壬基酚进行浊点萃取。
2.2.1不同质量浓度的PEG-6000对萃取效率的影响
表面活性剂的添加量影响富集相体积大小,关系到萃取分离的效果。试验中随着萃取体系中PEG-6000质量浓度的增加,壬基酚的回收率呈现先升高后降低的趋势(图1)。在21~33 g/L之间,壬基酚的回收率逐渐升高。在33 g/L时,壬基酚的回收率达到最高,为93.10%。随着PEG-6000浓度的继续增加,壬基酚的回收率出现下降。引起这种现象的原因可能是由于在21~33 g/L之间,PEG-6000对壬基酚的萃取还未达到饱和。而PEG-6000的质量浓度超过33 g/L时,因其用量过大而对壬基酚有所稀释,从而降低了壬基酚的回收率。综上所述,试验选择33 g/L的PEG-6000做为萃取浓度。
2.2.2不同pH值对萃取效率的影响
由于被萃取物及所使用的表面活性剂的性质各异,为达到较好的萃取效率,故所需体系pH值也不尽相同。被萃取物与非离子表面活性胶束以疏水分配为主要方式,故调节pH值使得被萃取物保持分子态能取得较好的萃取效率[20]。萃取体系不同pH值对壬基酚[CM(25]的萃取回收效率影响较大(图2)。试验结果显示在溶液pH值2.0时,壬基酚的萃取回收效率最高。这可能是由于溶液处于不同的pH值,壬基酚的电离程度不一样引起的[14]。
2.2.3盐浓度对萃取效率的影响
将无机盐电解质添加到非离子表面活性剂溶液中,可以使得胶束中氢键断裂,进而引起疏水基从水相中脱离,致使浊点降低,并且可以使得目标化合物易于收集[21-22]。Na2SO4的加入会对壬基酚的萃取效果产生显著影响(图3)。随着溶液中Na2SO4质量浓度增加,壬基酚的回收率呈现先上升后下降的趋势,在160 g/L时达到最大,故本试验选择以质量浓度为160 g/L的Na2SO4作为壬基酚浊点萃取的无机盐添加浓度。
2.2.4不同平衡温度对萃取效率的影响
不同的平衡温度对萃取效率影响较大,适当地提高平衡温度可以通过破坏非离子表面活性剂与水之间的氢键作用力,使其发生脱水现象减少萃取相体积[23],增加萃取溶质的分配系数从而提高萃取效率[22]。试验结果表明,平衡温度在30~45 ℃之间萃取效率逐渐升高,在45 ℃时达到最高,超过45 ℃后萃取效率逐漸降低(图4)。故本试验选择45 ℃作为壬基酚浊点萃取的平衡温度。
2.2.5其他条件
胶束与目标提取物的作用需要一定的时间(一般为10~30 min),但时间过长(超过30 min)对萃取效率的影响不大[24-25],故本试验选择15 min作为平衡时间。离心的目的是为了让表面活性剂相和水相进行分离,有研究表明3 000 r/min,15 min即可使得分离达到较好的效果[26-27]。
2.3壬基酚标准曲线及检出限
将质量浓度系列的壬基酚标准溶液,在“1.2.1”节色谱操作条件下进行HPLC检测(图5),绘制出壬基酚水溶液的标准曲线。其线性方程、线性范围及相关性系数见表2,在002~2.0 mg/L范围内呈现良好的线性关系(r=0.999 2)。
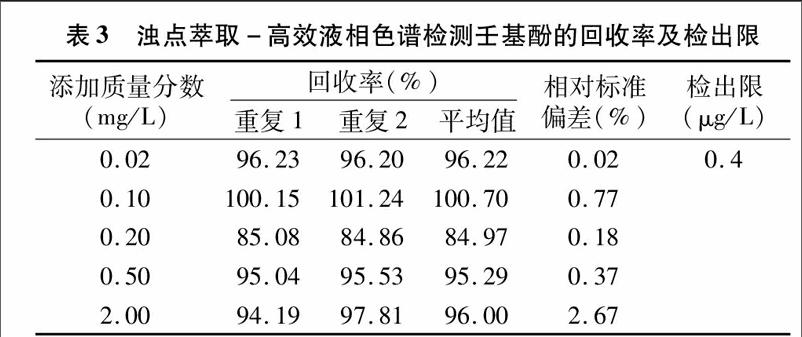
对浓度系列的壬基酚标准样品进行“1.2.2.2”节浊点萃取操作后,以“1.2.1”节色谱操作条件下测定,检测回收率、相对标准偏差及检出限见表3,绘制标准曲线。以信噪比(S/N)=3时所检测出的壬基酚浓度为仪器检测限,为 0.4 μg/L。线性方程、范围及相关系数见表2。
2.4方法评价
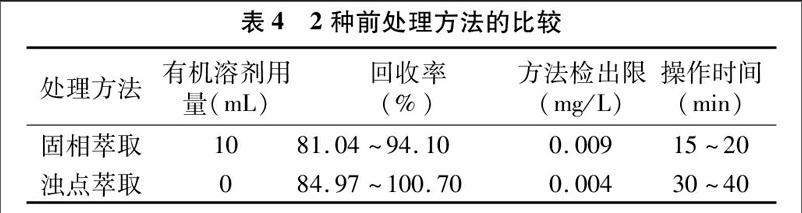
本研究建立了固相萃取法和浊点萃取法2种前处理方法回[CM(25]收水体中壬基酚并使用高效液相色谱进行检测分析,2种前处理方法的特点、准确度、操作时间及灵敏度比较见表4。
2.5壬基酚对斑马鱼的急性毒性及水中壬基酚含量的检测
壬基酚对斑马鱼的24、48、72、96 h半数致死浓度分别为0.844 6、0.666 0、0.612 5、0.560 6 mg/L,95%置信区间分别为0.768 6~0.928 1、0.600 4~0.738 3、0.547 3~0.685 4、0.503 5~0.624 1 mg/L,与戴媛媛等的报道结果[28]相近。
按照“1.2.2.2”节的方法,检测水中壬基酚每天的残留量。结果显示水中壬基酚在加药当天的的回收率为 96.43%~99.85%,证明浊点萃取-高效液相色谱法用于检测水中壬基酚残留的方法可行性。同时,随着时间的推移,水中壬基酚的残留量逐渐减少,且残留量的大小关系为每天换50%水放10尾鱼(半静态法)<每天不换水且不放鱼<每天换50%水但不放鱼(表5),其原因可能为壬基酚在水中会发生降解,且壬基酚富集于沉积物[29]。
3结论
固相萃取-高效液相色谱和浊点萃取-高效液相色谱2种方法都能满足有机污染物残留检测的要求。浊点萃取前处理技术在整个处理过程中不使用挥发性有机溶剂,使用的萃取剂-表面活性剂易于进行后续处理,同时在回收率和检出限方面也具有比固相萃取前处理技术更好的效果,但是操作时间比固相萃取长。浊点萃取作为一种环境样品有机污染物残留检测的前处理技术有较好的推广前景。
参考文献:
[1]Cheng C Y,Wu C Y,Wang C H,et al. Determination and distribution characteristics of degradation products of nonylphenol polyethoxylates in the rivers of Taiwan[J]. Chemosphere,2007,65(11):2275-2281.
[2]张婷瑜,张福金,何江,等. 壬基酚的土壤残留及其行为研究进展[J]. 农业资源与环境学报,2014,31(2):118-125.
[3]The European Union.Regulation concerning the registration, evaluation,authorization and restriction of chemicals[S]. 2006.
[4]农业部农药检定所.农药助剂禁限用名单[JP3](征求意见稿)[Z]. 2015.
[5]Naylor C G,Staples C A,Klecka G M,et al. Biodegradation of [14C] Ring-Labeled nonylphenol ethoxylate[J]. Archives of Environmental Contamination and Toxicology,2006,51(1):11-20.
[6]夏继刚,牛翠娟,高颖,等. 壬基酚长期暴露对斑马鱼雄鱼第二性征、精子活力的影响[J]. 生态毒理学报,2010,5(1):44-49.
[7]范奇元,金泰,将学之,等. 我国部分地区环境中壬基酚的检测[J]. 中国公共卫生,2002,18(11):1372-1373.
[8]吴伟,瞿建宏,陈家长,等. 壬基酚聚氧乙烯醚及其降解产物对[JP3]水生生物的毒理效应[J]. 湛江海洋大学学报,2003,23(6):39-44.
[9]张诺,贾瑞宝,孙韶华,等. 壬基酚的检测及毒理学研究进展[J]. 环境与健康杂志,2013,30(4):362-365.
[10]吴芳华. 固相萃取新技术研究进展[J]. 分析测试技术与仪器,2012,18(2):114-120.
[11]丁昱文. 浊点萃取用于有机磷农药残留的检测[J]. 清华大学学报(自然科学版),2009(3):407-410.
[12]杨远高,周光明,陈君,等. 浊点萃取石高效液相色谱法测定小儿泻速停颗粒中多酚类化合物[J]. 分析试验室,2013,32(3):10-13.
[13]Yildiz Z,Arslan G,Tor A. Preconcentrative separation of chromium(Ⅲ) species from chromium(Ⅵ) by cloud point extraction and determination by flame atomic absorption spectrometry[J]. Microchimica Acta,2011,174(3):399-405.
[14]張慧,许晓菁,杨一青,等. 浊点萃取技术及其应用研究进展[J]. 化工进展,2012,31(S1):441-445.
[15]Watanabe H,Tanaka H. A non-ionic surfactant as a new solvent [JP3]for liquid-liquid extraction of zinc(Ⅱ) with 1-(2-pyridylazo)-2-naphthol[J]. Talanta,1978,25(10):585-589.
[16]李竺,郜洪文,陈玲,等. 固相萃取萃取技术在环境中农药残留分析的研究进展[J]. 世界科技研究与发展,2005,27(5):64-71.
[17]王晓中,杨庆凤. 浊点萃取HPLC法测定穿心莲中两种内酯含量[J]. 辽东学院学报(自然科学版),2015,22(3):157-160.
[18]李健华,廖林波. 浊点萃取-气相色谱法测定水中邻苯二甲酸酯类化合物[J]. 海峡药学,2016,28(1):45-48.
[19]姚炳佳. 基于非离子型表面活性剂的新型浊点萃取的研究[D]. 上海:上海交通大学,2008:8-9.
[20]余益军,孙兆海,鲜放鸣,等. 浊点萃取在环境有机分析中的影响因素及应用[J]. 理化检验:化学分册,2008,44(7):696-700.
[21]孙梅,刘桂建,吴强华. 浊点萃取技术在环境样品痕量元素分析中的应用研究进展[J]. 环境化学,2013(6):1016-1024.
[22]姜蕾,贾林贤,林靖凌,等. 浊点萃取-超高效液相色谱法检测水中戊菌唑残留量[J]. 分析实验室,2015,34(2):155-158.
[23]Paleologos E K,Giokas D L,Karayannis M I. Micelle-mediated separation and cloud-point extraction[J]. Trac Trends in Analytical Chemistry,2005,24(5):426-436.
[24]馬岳,黄骏雄. 浊点萃取在环境化学方面的应用[J]. 上海环境科学,2000,1(7):319-324.
[25]李燕,张新艳,张晓霞. 浊点萃取-原子吸收光谱法测定水和花粉中痕量铜、铅、镉[J]. 环境监测管理与技术,2016,28(3):37-40.
[26]黄海霞,谭雪晴. TritonX-100对废水中Cd2+、Co2+的浊点萃取研究[J]. 绵阳师范学院学报,2015(2):47-50.
[27]姜蕾,贾林贤,林靖凌,等. 土壤中戊菌唑残留的分析方法[J]. 农药,2015,54(3):197-200.
[28]戴媛媛,牛海凤,董玉波,等. 壬基酚对水生生物的毒性研究进展[J]. 环境与健康杂志,2012,29(10):948-951.
[29]李艳霞,段晓勇,李先国,等. 水中壬基酚光降解机理研究[J]. 化学学报,2012,70(17):1819-1826.
