腾格里沙漠不同生物土壤结皮微生物多样性分析
2017-07-12李靖宇张琇
李靖宇, 张琇
北方民族大学生物科学与工程学院, 银川750021
腾格里沙漠不同生物土壤结皮微生物多样性分析
李靖宇*, 张琇*
北方民族大学生物科学与工程学院, 银川750021
主要采用MiSeq技术对腾格里沙漠不同生物土壤结皮中微生物16S rRNA基因V4-V5区进行测序, 分析其细菌群落结构的组成、丰度以及多样性, 通过非度量多维尺度法和 Venn图解释微生物群落结构对生物土壤结皮演化过程的响应。结果表明不同生物土壤结皮在门水平上主要以Proteobacteria、Actinobacteria和Cyanobacteria为优势类群;结皮下流沙层在门水平上主要以Actinobacteria、Proteobacteria、Chloroflexi和Acidobacteria为优势类群。在OTUs组成上, 样品之间存在共同的微生物类群, 也存在差异的微生物类群。结皮下流沙层的微生物群落结构组成相似, 与结皮中微生物群落结构的组成差异较大, 且藻结皮和藓结皮中微生物类群差异明显, 说明微生物类群对生物土壤结皮的演化过程做出了环境响应。在从流沙向藻结皮到藓结皮的演化过程中, 放线菌(Actinobacteria)、蓝细菌(Cyanobacteria)和变形菌(Proteobacteria)对结皮形成、演化的生物地球化学循环过程发挥着重要的影响。结皮中不同微生物类群丰度的差异表明其对沙漠土壤环境变化的响应以及生态功能的不同。
微生物群落; 生物土壤结皮; 沙漠; MiSeq测序
1 前言
当今世界面临最大的环境-社会-经济问题之一就是土地沙漠化。沙漠化是我国北方干旱、半干旱及部分半湿润地区由于人地关系不相协调所造成的以风沙活动为主要标志的土地退化[1]。土地沙漠化面积的迅速扩展, 造成环境退化和巨大的经济损失,使之成为全球广泛关注的热点[2]。生物结皮(biological soil crusts, BSCs) 广泛分布于荒漠生态系统中, 其覆盖度占荒漠地表活体覆盖的 40%以上, 是荒漠生态系统的重要构建者和组成成分[3]。生物结皮是由隐花植物如蓝细菌、藻类、地衣、苔藓和土壤微生物, 以及相关的其他生物体通过菌丝体、假根和分泌物等与土壤表层颗粒胶结形成的十分复杂的复合体, 在维护荒漠生态系统的稳定性、碳氮循环和生态平衡等方面发挥着重要作用[3–5]。它们与矿化土壤表面密切相关, 可以形成一层结合紧密的水平层。这些群落普遍存在于土壤表面的高光输入的生态系统中, 但是在其他的大多数陆地生态系统中至少以短暂的演替系列群落存在过。与物理结皮完全相反,BSCs通过以下方式增强土壤的质量: (1) 形成土壤颗粒团聚体, 因此降低风蚀和水蚀的作用[6]; (2) 增加土壤表面的温度[7]; (3) 改变雨水渗透平衡[8]; (4)通过碳氮固定增加土壤肥力[9]。BSCs拥有不同的生活史特征来增强它们在严酷环境中的定殖能力, 主要包括: (1) 小繁殖体的风力扩散; (2) 耐干旱[10]; (3)不同的光合保护色素[11]; (4) 氮的固定[12]; (5) 碳的固定[9]。随着人工植被-土壤系统的演替, 沙丘表面逐渐形成生物土壤结皮(biological soil crust, BSC),被认为是生态系统的先驱者, 第一个初级生产者,从蓝细菌为优势的结皮向混生的藻类(绿藻和硅藻)结皮、地衣结皮和藓类结皮逐渐演变[13], 可以固定碳和增加土壤有机质来减少风蚀和水蚀。他们在荒漠土壤中的定植可促进维管植物的生长, 并在氮平衡过程中起着重要的作用。
土壤微生物作为生态系统中重要组分之一, 推动着生态系统的能量流动和物质循环, 在维持生态系统整体服务功能方面发挥着重要作用。微生物是土壤最活跃的组成, 从定植于土壤母质的蓝细菌开始, 到土壤肥力的形成, 土壤微生物参与了土壤发生、发展、发育的全过程[14]。针对 BSCs在沙坡头沙漠固沙过程中微生物多样性, 特别是采用高通量测序技术手段解析微生物多样性的相关研究较少。本文以宁夏回族自治区中卫市沙坡头地区不同结皮类型土壤为研究对象, 采用高通量测序技术, 对其土壤微生物多样性进行了深入的探讨。
2 材料与方法
2.1 研究区域与样品采集
研究区域主要设在宁夏回族自治区中卫市沙坡头地区腾格里沙漠东南缘(37°32′N, 105°02′E)。该地区年均气温 10.0 ℃, 低温极值–25.1 °C, 高温极值38.1 °C, 全年日照时数3264 h, 年均降水量186.2 mm(1956—2012年), 年潜在蒸发量 3000 mm, 年均风速2.9 m/s, 年均沙暴天数59天[15]。
选取沙坡头人工固沙区域中藻结皮和藓结皮发育良好的位点进行垂直取样, 分为结皮层和结皮下流沙层, 共 4个样品, 分别标记为 C1_1(藻结皮样品), C1_2(藻结皮下流沙层样品), C2_1(藓结皮样品),C2_2(藓结皮下层流沙层样品)。土壤样品的采集按照S型五点取样法。将土样带回实验室冷藏保存, 用于后续MiSeq测序研究, 具体信息见图1和表1。
2.2 沙漠土壤总DNA提取
沙漠样品微生物 DNA 的提取参照 E.Z.N.A.®Soil DNA Kit提取试剂盒(Omega Bio-tek, Norcross,GA, U.S.)的说明书进行提取。
2.3 16S rRNA V4-V5区Illumina MiSeq测序
PCR采用TransGen AP221-02: TransStart Fastpfu DNA Polymerase, 20 µL 反应体系:

图1 土壤样品采集地图Fig. 1 Figure of soil samples collected

表1 不同样品的基本信息Tab. 1 Basic information for different samples
2.0 µL 2.5×10–3mol·L–1dNTPs, 0.8 µL 0.5×10–5mol·L–1515F 引物(5'-GTG CCA GCM GCC GCG G-3'), 0.8 µL 0.5×10–5mol·L–1907R 引物(5'-CCG TCA ATT CMT TTR AGT TT-3'), 4.0 µL 5×FastPfu 缓冲液, 10 ng 模板以及 0.4 µL Fast Pfu Polymerase, 最后加ddH2O到 20 μL。
反应条件: 95 °C 3 min; 95 °C 30 s, 55 °C 30 s,72 °C 45 s, 27 个循环; 72 °C 10 min。
获得的 PCR产物进行 2%琼脂糖凝胶电泳, 使用AXYGEN 公司的AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物, Tris-HCL洗脱; 使用Promega公司的QuantiFluor™ -ST蓝色荧光定量系统进行检测。按每个样品的等比例混合, 然后根据 Illumina MiSeq测序平台的标准流程进行双端测序。
2.4 测序数据分析
Miseq测序得到的是双端序列数据, 首先根据PE reads之间的overlap关系, 将成对的reads 拼接merge)成一条序列, 同时对reads的质量和merge的效果进行质控过滤, 根据序列首尾两端的barcode和引物序列区分样品得到有效序列, 并校正序列方向。数据去杂方法和参数: 过滤read尾部质量值20以下的碱基, 设置50 bp的窗口, 如果窗口内的平均质量值低于 20, 从窗口开始截去后端碱基, 过滤质控后50 bp以下的read; 根据PE reads之间的overlap关系, 将成对 reads拼接(merge)成一条序列, 最小overlap长度为10 bp; 拼接序列的overlap区允许的最大错配比率为 0.2, 筛选不符合序列; 根据序列首尾两端的barcode和引物区分样品, 并调整序列方向,barcode允许的错配数为0, 最大引物错配数为2; 且去掉包含模糊碱基的序列。
用UPARSE(version7.1 http://drive5.com/uparse/)软件聚类生成操作分类单元(Operational Taxonomic Units, OTUs), 相似度为97%。再用UCHIME软件鉴别嵌合体序列, 并将之去除。分类学比对时, 用silva (SSU115)16S核糖体RNA数据库, 算法为RDP Classifier (http://rdp.cme.msu.edu/), 置信阈值为70%。使用97%相似度的OTU, 利用mothur做rarefaction分析, 利用R语言工具制作曲线图。
3 结果与分析
3.1 测序数据概况
生物土壤结皮(BSCs)在沙漠生态系统中具有重要的作用。为了比较沙坡头沙漠固沙区不同生物土壤结皮类型的微生物多样性, 实验设计取样共4个,根据Youssef报道V4-V5区序列对微生物多样性的估计与全长16S rRNA序列得到的微生物多样性最接近, 因此本文选择V4-V5区序列进行群落结构和多样性的分析[16]。共获得有效序列146871条, 其中C1_1包含36670条, C1_2包含30126条, C2_1包含42282条, C2_2包含37793条, 平均长度为396 bp。为了得到更高质量的优化序列, 根据 uparse软件聚类, 去除单条序列和部分嵌合体被[17]。最后C1_1包含24555条, C1_2包含16214条, C2_1包含26195条, C2_2包含21705条。根据稀释性曲线, 测序深度基本可以真实反映沙漠环境中不同生物土壤结皮类型微生物群落结构的实际情况, 见图2。
3.2 细菌群落结构的组成、丰度与多样性
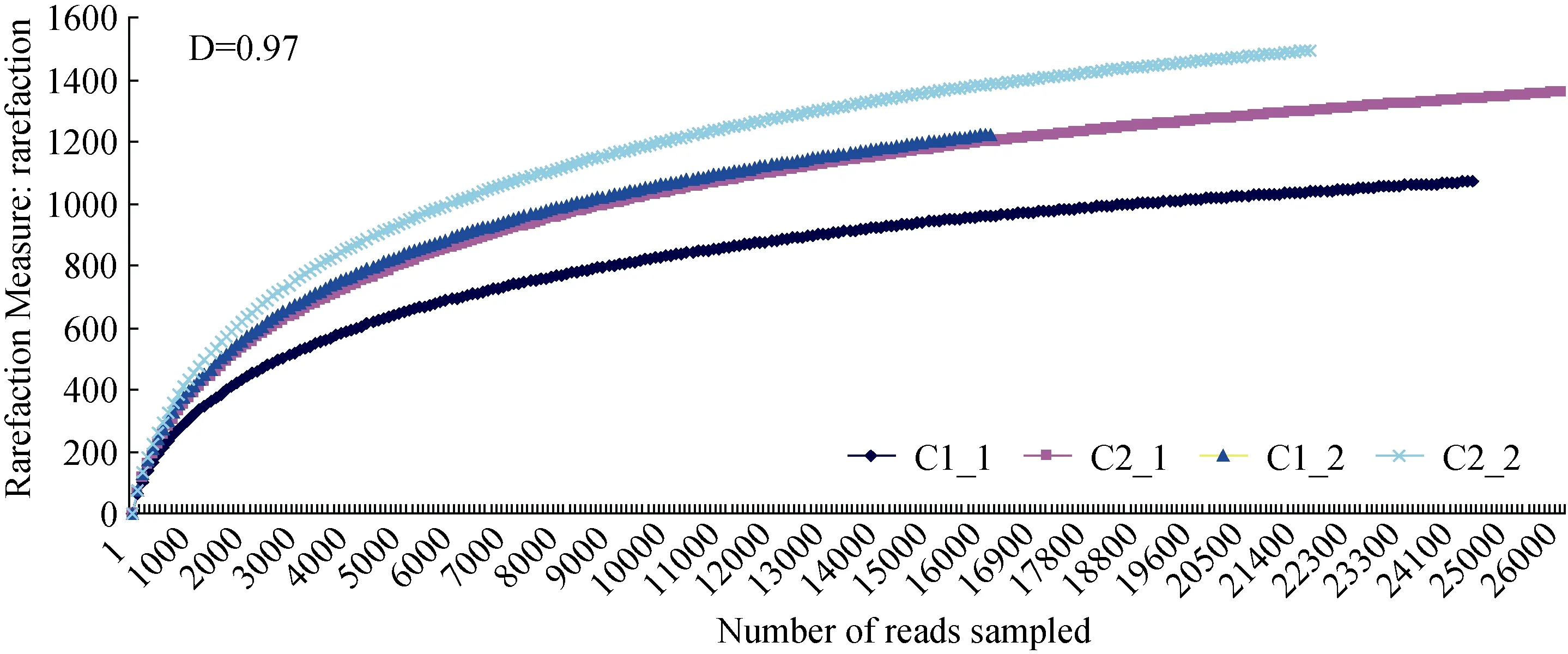
图2 样品稀释曲线图Fig. 2 Rarefaction curves of samples

表2 不同样品的基本信息Tab. 2 Basic information for different samples
在相似性为 0.97的水平上, 通过 OTUs分析,C1_1包含1070个OTUs, C1_2包含1359个OTUs,C2_1包含1220个OTUs, C2_2包含1492个OTUs,见表2。从C1_1到C2_2的4个样品中, Chao1指数范围为 1311-1798; Ace指数范围为 1295-1790。Simpson是用来估算样品中微生物多样性的指数之一, 其值越大, 说明群落多样性越低, 从 C1_1到C2_2的4个样品中, 其指数范围为0.0093-0.0265。Shannon是用来估算样品中微生物多样性指数之一,它与Simpson多样性指数常用于反映alpha多样性指数, 其值越大, 说明群落多样性越高, 从 C1_1到C2_2的4个样品中, 其指数范围为5.04-5.91。覆盖度指数范围为97.91%-98.92%(见表2)。
在门水平上, 主要涵盖了Cyanobacteria、Proteobacteria、Acidobacteria、Actinobacteria、Bacteroidetes、Chloroflexi、Planctomycetes。其中, C1_1样品中各类群相对丰度依次为: Cyanobacteria(37.32%)>Proteobacteria(14.80%)>Acidobacteria(14.01%)>Actinobacteria(12.58%)>Bact eroidetes(5.79%)>Chloroflexi(5.58%)>Planctomycetes(4.61%); C1_2样品中各类群相对丰度依次为:Actinobacteria(37.26%)>Proteobacteria(17.98%)>Chloroflexi(13.46%)>Acidobacteria(11.95%)>Planctomycetes(6.19%)>Firmicutes(3.42%); C2_1样品中各类群相对丰度依次为: Proteobacteria(29.94%)> Cyanobacteria(16.38%)>Actinobacteria(11.29%)>Bacteroidetes(10.2 5%)>Acidobacteria(9.58%)>Planctomycetes(9.30%)>Chloroflexi(4.12%)>Verrucomicrobia(3.74%); C2_2 样品中各类群相对丰度依次为: Proteobacteria(25.44%)>Actinobacteria(24.65%)>Acidobacteria(11.90%)>Chlo roflexi(10.32%)>Planctomycetes(8.66%)>Bacteroidetes(5.58%)>Firmicutes(4.09%)。

图 3 不同样地细菌群落在门水平(A)和属水平(B)上的组成和相对丰度Fig. 3 Bacteria composition and relative abundance of different samples at phylum level (A) and genus level (B)
在属水平上, 不同样品类群组成差异明显, 见图 3。其中 C1_1样品优势类群为 Others(20.94%)>Microcoleus(14.58%)>Blastocatella(9.72%)>Mastigoc ladopsis(7.92%); C1_2样品优势类群为 Others(28.76%)>Nocardioides(14.68%); C2_1样品优势类群为 Others(30.52%)>Cyanobacteria_no_rank(14.70%)>WD2101_soil_group_no_rank(5.47%)>Opitutus(3.71%)>Devosia(3.42%)>Bryobacter(3.16%); C2_2 样品优势类群为Others(33.49%)>JG34-KF-361_no_rank(8.94%)>Subgroup_6_no_rank(4.93%)>Nocardioides(4.52%)>Arthrobacter(3.510%)。在属的水平上, 无法在数据库中找到相似序列的比例明显提高, 范围值为 20.94%-33.49%。
3.3 不同结皮土壤微生物群落的比较
为了说明不同生物土壤结皮微生物群落的差异,通过 Venn图直观反映微生物群落结构组成的差异,并发现这些环境中的“核心微生物群落”[18]。经过分析可知, 在OTUs组成上, 藻结皮与藓结皮之间既有共同的微生物类群, 也存在不同的微生物类群;藻结皮下流沙层与藓结皮下流沙层之间既有共同的微生物类群, 也存在不同的微生物类群; 4个样品之间存在共同的微生物类群, 也存在不同的微生物类群。同时, 由图4可以说明, 在沙漠这种极端环境中,生物土壤结皮及其下层流沙层微生物群落变化之大,但核心类群较为明显, 可能在结皮的形成等生物地球化学循环中发挥着重要的作用。
非度量多维尺度法是一种将多维空间的研究对象(样本或变量)简化到低维空间进行定位、分析和归类, 同时又保留对象间原始关系的数据分析方法。其特点是根据样本中包含的物种信息, 以点的形式反映在多维空间上, 而对不同样本间的差异程度,则是通过点与点间的距离体现的, 最终获得样本的空间定位点图。由图5并结合实际情况可知, 2种结皮下流沙层的微生物群落结构组成相似, 但其与2种结皮中微生物群落结构的组成差异较大, 且藻结皮和藓结皮中微生物类群差异明显。在结皮形成、发育过程中存在明显的演替, 见图5。藻结皮及其下层流沙和藓结皮及其下层流沙在垂向分布上差异明显, 主要体现在两大类微生物的变化上, 放线菌(Acidobacteria)丰度从结皮下流沙层向结皮层明显下降, 蓝细菌(Cyanobacteria)丰度增加明显, 见图6A和图6B。在藻结皮向藓结皮演化的过程中, 变形菌(Proteobacteria)丰度增加明显, 蓝细菌(Cyanobacteria)丰度下降明显, 放线菌(Acidobacteria)丰度变化不明显。
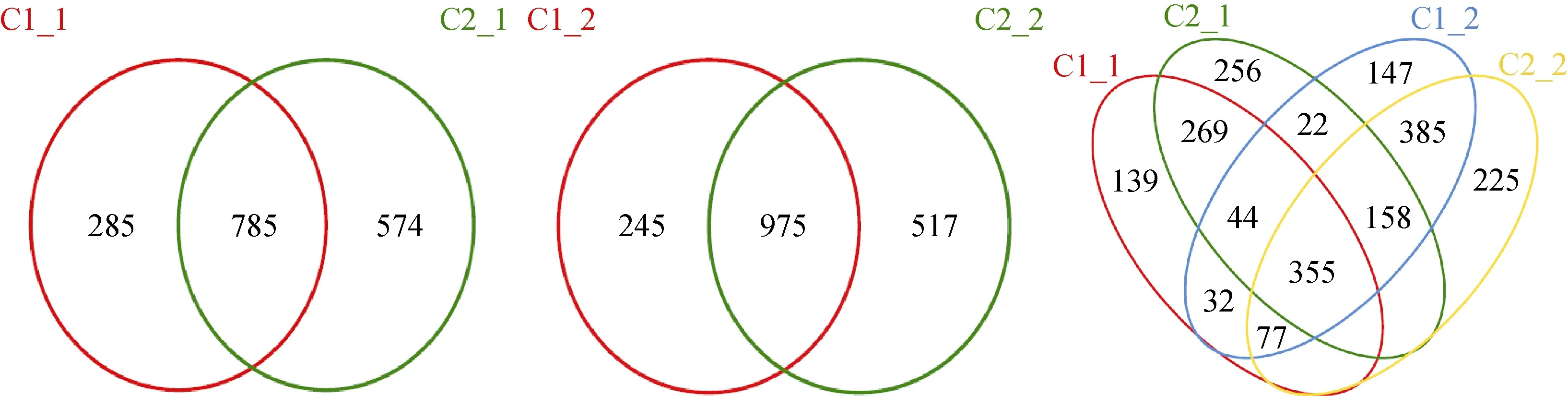
图4 不同样品之间比较的韦恩图Fig. 4 Venn diagram of representing the number of OTUs isolated from each sample and the overlap of OTUs among the samples
4 讨论
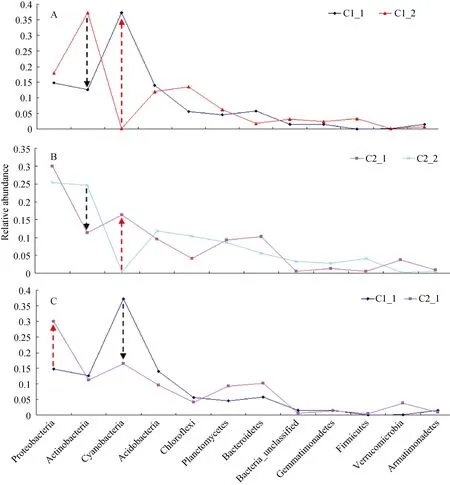
图6 不同样品间微生物类群比较Fig. 6 Comparison of microbial community between different samples
腾格里沙漠东南缘包兰铁路两侧的沙坡头地区属于典型的温带荒漠化草原向草原化荒漠的过渡带, 利用草方格固定沙丘表面并种植旱生灌木形成人工固沙植被后, 生物结皮开始发育并不断拓殖和演替, 该区域内广泛分布着不同发育阶段的生物土壤结皮[19–20]。从蓝细菌为优势的结皮向混生的藻类(绿藻和硅藻)结皮、地衣结皮和藓类结皮逐渐演变[13]。其中, 藓类结皮作为生物土壤结皮层的优势组分,其繁衍与拓殖对生态水文过程、土壤理化过程和养分循环过程具有深远影响[19]。50 年后形成了高等植物和结皮隐花植物镶嵌分布的稳定格局, 成为沙漠化逆转和生态恢复的典型案例[20]。微生物群落作为隐藏的力量在生物土壤结皮生态过程中发挥着怎样的作用, 还鲜为人知?为了深入探讨这个科学问题,本文首先从解析其微生物群落结构入手, 采用宏基因组学技术手段最大限度的反应环境中微生物群落结构的真实情况。本文采用 Miseq测序技术, 针对沙坡头2种不同生物土壤结皮及其下层流沙层微生物群落结构和多样性进行了深度测序, 覆盖度数据表明测序结果可以反映土壤样品的微生物群落结构的真实情况。结皮下层土壤微生物群落结构组成相似, 并逐渐演化为藻结皮, 然后向着藓结皮发展演变。藻结皮代表结皮发育演替的初级阶段, 但它们却能够通过改善表土微环境来增加晚期结皮物种拓殖生存的可能性, 从而促进结皮的发育演替[21]。藓结皮作为演替阶段后期的生物土壤结皮, 结皮层厚(见图 1), 土壤基质养分的有效性提高, 能够为土壤微生物提供更多、更丰富的食物来源, 因而其覆盖土壤中的微生物及线虫的丰富度较高(见表2)[22]。根据韦恩图分析结果, 尽管不同样品之间存在一定的差异, 但是存在共有微生物类群, 可能在沙坡头沙漠生态系统中发挥着核心作用, 差异微生物类群可能在结皮的形成、演化过程中发挥着重要的作用。NMDS分析验证了这一结果。其中从流沙向藻结皮到藓结皮的演化过程中, 放线菌(Acidobacteria)丰度、蓝细菌(Cyanobacteria)丰度、变形菌(Proteobacteria)丰度变化明显, 说明这 3类微生物在此过程中具有重要的作用, 其中蓝细菌(Cyanobacteria)丰度先增高后减小, 这与吴丽等[21]报道的随着结皮的发育演替, 微藻生物量呈现先增加后减少的趋势一致, 说明蓝细菌在演化过程中的藻结皮阶段具有更为重要的作用,而变形菌在藓结皮阶段具有更加重要的作用。随着结皮的发育演替, 结皮中生物群落结构不断变化,在固碳、固氮效率、抗压强度、土壤质地、土壤孔隙度等方面存在明显差别, 进而影响结皮的生态功能[21]。蓝细菌Microcoleus通过形成由外鞘包围的丝状体来增强生物土壤结皮(BSC)的物理稳定性, 具有固氮功能的蓝细菌是土壤氮源的重要来源, 蓝细菌丰度高的BSCs较丰度低的BSCs预期有较高的氮含量[23], 显著高于无结皮沙地的氮含量[24]。藓类结皮的繁衍和拓殖能够提高土壤的供氮能力, 促进氮素循环, 有助于土壤生态系统的修复[19]。
5 结论
藻结皮和藓结皮作为生物土壤结皮演化的2个重要阶段在沙漠生态系统功能中发挥着重要的作用。在从流沙向藻结皮到藓结皮的演化过程中, 放线菌(Actinobacteria)、蓝细菌(Cyanobacteria)和变形菌(Proteobacteria)对结皮形成、演化的生物地球化学循环过程发挥着重要的影响。结皮中不同微生物类群丰度的差异表明其对沙漠土壤环境变化的响应以及生态功能的不同。
1] 王涛, 朱震达. 我国沙漠化研究的若干问题—1. 沙漠化的概念及其内涵 [J]. 中国沙漠, 2003, 23(3): 209–214.
2] 王涛, 赵哈林. 中国沙漠科学的五十年 [J]. 中国沙漠,2005, 25(2): 145–165.
3] BOWKER M A. Biological soil crust rehabilitation in theory and practice: an underexploited opportunity [J].Restoration Ecology, 2007, 15(1): 13–23.
4] SERPE M D, ORM JM, BARKES T, et al. Germination and seed water status of four grasses on moss-dominated biological soil crusts from arid lands [J]. Plant Ecology,2006, 185(1): 163–178.
5] ZHANG Y M, CHEN J, WANG L, et al. The spatial distribution patterns of biological soil crusts in the Gurbantunggut desert, Northern Xinjiang, China [J].Journal of Arid Environments, 2007, 68(4): 599–610.
6] MAZOR G, KIDRON G J, VONSHAK A, et al. The role of cyanobacterial exopolysaccharides in structuring desert microbial crusts [J]. FEMS Microbiology Ecology, 1996,21(2): 121–130.
7] GOLD W G, BLISS L C. Water limitations and plant community development in a polar desert [J]. Ecology,1995, 76(5): 1558–1568.
8] KIDRON G J, YAIR A. Rainfall-runoff relationships over encrusteddune surfaces, Nizzana, western Negev, Israel [J].Earth Surface Processes Landforms, 1997, 22(12): 1169–1184.
[9] LANGE O L, MEYER A, ZELLNER H, et al.Photosynthesis and water relationships of lichen soil crusts:field measurements in the coastal fog zone of the Namib desert [J]. Functional Ecology, 1994, 8(2): 253–264.
[10] OLIVER M J, MISHLER B D, QUISENBERRY J E.Comparative measures of desiccation-tolerance in the tortula ruralis complex. I. variation in damage control and repair [J].American Journal of Botany, 1993, 80(2): 127–136.
[11] BOWKER M A, REED S C, BELNAP J, et al. Temporal variation in community composition, pigmentation, and Fv/Fm of desert cyanobacterial soil crusts [J]. Microbial Ecology, 2002, 43(1): 13–25.
[12] EVANS R D, EHLERINGER J R. A break in the nitrogen cycle of aridlands? Evidence from δ15N of soils [J].Oecologia, 1993, 94(3): 314–317.
[13] LI X R, XIAO H L, ZHANG J G, et al. Long-term ecosystem effects of sand-binding vegetation in the Tengger Desert, Northern China [J]. Restoration Ecology,2004, 12(3): 376–290.
[14] 宋长青, 吴金水, 陆雅海, 等. 中国土壤微生物学研究10年回顾 [J]. 地球科学进展, 2013, 28(10): 1087–1105.
[15] 李新荣, 张志山, 谭会娟, 等. 我国北方风沙危害区生态重建与恢复: 腾格里沙漠土壤水分与植被承载力的探讨[J]. 中国科学: 生命科学, 2014, 44: 257–266.
[16] YOUSSEF N, SHEIK C S, KRUMHOLZ L R, et al.Comparison of species richness estimates obtained using nearly complete fragments and simulated pyrosequencinggenerated fragments in 16S rRNA gene-based environmental surveys [J]. Applied and Environmental Microbiology, 2009, 75(16): 5227–5236.
[17] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads [J]. Nature Methods, 2013,10(10): 996–1000.
[18] SHADE A, HANDELSMAN J. Beyond the Venn diagram:the hunt for a core microbiome [J]. Environmental Microbiology, 2012, 14(1): 4–12.
[19] 虎瑞, 王新平, 潘颜霞, 等. 沙坡头地区藓类结皮土壤净氮矿化作用对水热因子的响应 [J]. 应用生态学报, 2014,25(2): 394–400.
[20] 胡宜刚, 冯玉兰, 张志山, 等. 沙坡头人工植被固沙区生物结皮-土壤系统温室气体通量特征 [J]. 应用生态学报,2014, 25(1): 61–68.
[21] 吴丽, 张高科, 陈晓国, 等. 生物结皮的发育演替与微生物生物量变化[J]. 环境科学, 2014, 35(4): 1479–1485.
[22] 徐冰鑫, 陈永乐, 胡宜刚, 等. 干旱过程中荒漠生物土壤结皮-土壤系统的硝化作用对温度和湿度的响应—以沙坡头地区为例[J]. 应用生态学报, 2015, 26(4):1113–1120.
[23] LANGHANS T M, STORM C, SCHWABE A. Community assembly of biological soil crusts of different successional stages in a temperate sand ecosystem, as assessed by direct determination and enrichment techniques [J]. Microbial Ecology, 2009, 58(2): 394–407.
[24] THOMAS A D, DOUGILL A J. Distribution and characteristics of cyanobacterial soil crusts in the Molopo Basin,South Africa [J]. Journal of Arid Environments, 2006, 64(2):270–283.
Microbial diversity analysis of different biological soil crusts in Tengger desert
LI Jingyu1,*ZHANG Xiu1,*
College of Biological Science & Engineering, North Minzu Univesity, Yinchuan 750021, China
MiSeq technology was used to detect soil bacterial community composition, abundance and diversity based on the V4-V5 regions of 16S rRNA gene in different biological soil crusts in Tengger desert. NMDS plot and Venn diagram were used o analyze the responses of bacterial community to evolution process of BSCs. The results showed that the overall phylum-level composition of different BSCs samples was dominated by Proteobacteria, Actinobacteria and Cyanobacteria, and dominated groups of Actinobacteria, Proteobacteria, Chloroflexi and Acidobacteria for quicksand beneath the BSCs. Core microbiome existed based on OTUs composition, although there were some differences between different samples. The composition of microbial structure was similar among samples beneath the BSCs, which was very different from that of BSCs, while there were ignificantly difference between algae crust and moss crust, indicating that microbial population had environmental responses to evolution process of different biological soil crusts. From quicksand to algal crusts followed by moss crust, Actinobacteria,Cyanobacteria and Proteobacteria played important roles in biogeochemical cycles of development and evolution of BSCs. The elative abundance of soil bacterial community composition was very different, indicating that its response to variation of desert oil environment and have different ecological function.
microbial communities; biological soil crust; desert; MiSeq sequencing
10.14108/j.cnki.1008-8873.2017.03.006
X172
A
1008-8873(2017)03-036-07
李靖宇, 张琇. 腾格里沙漠不同生物土壤结皮微生物多样性分析[J]. 生态科学, 2017, 36(3): 36-42.
LI Jingyu, ZHANG Xiu. Microbial diversity analysis of different biological soil crusts in Tengger desert[J]. Ecological Science, 2017,36(3): 36-42.
2015-11-16;
2015-12-17
北方民族大学引进人才科研启动项目(44/4400302502); 宁夏自然科学基金(NZ15098); 国家自然科学基金(41661053)
李靖宇(1986—), 男, 内蒙古包头人, 博士, 讲师, 主要从事微生物生态学研究, E-mail: lijingyu1986@126.com
*通信作者:张琇, 男, 博士, 教授, 主要从事微生物生态学研究, E-mail: zhangxiu101@aliyun.com
