实验室高锰酸钾制备的绿色化探究
2017-07-12张洪香于庆水李聪聪
张洪香,于庆水,李聪聪
(沧州师范学院化学与化工学院,河北沧州061001)
实验室高锰酸钾制备的绿色化探究
张洪香,于庆水,李聪聪
(沧州师范学院化学与化工学院,河北沧州061001)
对高锰酸钾的制备实验从减少反应用量、歧化用酸及产物再利用方面进行了绿色化探究.探究了最佳药品用量、适宜的歧化pH范围,为实验教学提供了绿色化制备方案.
绿色化;高锰酸钾;歧化法;分光光度法
绿色化学是二十世纪末发展起来的一门新兴学科,也叫清洁化学、环境无害化学或环境友好化学.绿色化学实验是在绿色化学思想指导下,用预防化学污染的新思想、新技术对常规实验进行改革而成的化学实验.其最大特点是在始端就采用预防污染的科学手段,并在实验过程和终端均为零排放或零污染[1-2].本实验采用固体碱熔氧化法制备高锰酸钾[3],对实验进行了绿色化探究,通过减少反应物的用量,确定三种反应物用量的最佳配比;采用醋酸歧化锰酸钾的方法制备高锰酸钾,确定歧化锰酸钾的最佳酸度范围[4-6],并利用实验中生成的二氧化锰作为反应物再次实验,实现了对副反应产物二氧化锰的重复利用,制得产品的产率及纯度令人满意.实验采用分光光度法测定制备的高锰酸钾纯度[7],相比常规实验的滴定法,测得结果更准确,且操作简便、快捷.
1 实验部分
1.1 实验原理
1.1.1 制备原理
在强碱性条件下,二氧化锰与强氧化剂氯酸钾共熔制备锰酸钾
3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
将锰酸钾熔融物溶于水,加醋酸歧化制备高锰酸钾
3K2MnO4+4HAc=2KMnO4+MnO2+4KAc+2H2O
将上述制得的高锰酸钾液体,抽滤、蒸发浓缩(温度控制在75℃)、冷却、结晶、烘干,即得到高锰酸钾晶体.
1.1.2 纯度检验原理
(1)用草酸钠基准试剂标定高锰酸钾标准溶液得出高锰酸钾标准溶液的准确浓度.
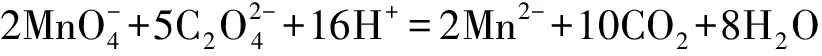
计算公式:
C=
式中,C:高锰酸钾溶液的浓度(单位:mol·L-1);m:草酸钠的质量(单位:g);M:草酸钠的摩尔质量(单位:g·mol-1);V1:滴定前滴定管中高锰酸钾溶液的体积(单位:mL);V2:滴定后滴定管中高锰酸钾溶液的体积(单位:mL).
(2)用722分光光度计测定高锰酸钾标准溶液的吸光度,绘制标准曲线,得到标准曲线方程,然后根据待测液的吸光度计算其对应浓度.
1.2 仪器与试剂
1.2.1 仪器
电子天平(EA2004N,上海精密科学仪器有限公司)、电热恒温干燥箱(202-Z,上海市实验仪器总厂)、722型分光光度计(上海精密科学仪器有限公司)、pHSJ-3F型pH计(上海精密科学仪器有限公司).
1.2.2 试剂及其配制
试剂:二氧化锰、氢氧化钾、氯酸钾、醋酸、高锰酸钾、草酸钠基准物质、pH=6.86的磷酸二氢钾和磷酸氢二钠缓冲溶液、pH=9.18的缓冲溶液.
400g/L氢氧化钾溶液的配制:称取40.0g氢氧化钾(分析纯),置于100mL洁净的烧杯中,加入新煮沸并冷却的蒸馏水溶解,继续加水到100mL,冷却后转移至塑料试剂瓶内,贴标签备用.
高锰酸钾标准溶液的配制:称取2.3g的高锰酸钾放入一洁净的大烧杯中,加入600mL的蒸馏水,盖上表面皿,加热煮沸一小时.冷却后室温暗处放置两天,过滤,滤液保存于棕色瓶中待标定.以草酸钠为基准物对高锰酸钾标准溶液进行标定,其准确浓度为0.02777mol·L-1.
2 实验内容
2.1 锰酸钾制备过程中反应物用量最佳配比探究
2.1.1 二氧化锰与氢氧化钾的最佳配比探究
固定二氧化锰的质量约1.0g,利用反应方程式中的计量数比得氯酸钾的质量为0.5g(稍高于理论值),按照二氧化锰与氢氧化钾的物质的量比1:2.0、1:2.2、1:2.4进行实验.先将氢氧化钾和氯酸钾加入镍坩埚中混合均匀,置三角架的泥三角上,小火加热至药品完全熔融时,再加入二氧化锰,迅速搅拌.随着药品粘性的增大,用力加速搅动防止药品凝结成块,等反应物完全干涸后,强热5min,制得墨绿色锰酸钾固体.待镍坩埚稍冷却后,将其用铁棒搅碎并转移至盛有20mL蒸馏水的100mL烧杯中(用蒸馏水冲洗坩埚直到坩埚内没有绿色物质为止),以小火共煮,直到熔融物全部溶解为止.
将上述盛有锰酸钾液体的小烧杯放在磁力搅拌器上,调节适宜转速,趁热向液体中缓慢滴加浓度为6mol·L-1的醋酸,调节溶液酸度pH≈10[6],至锰酸钾完全歧化(可用搅棒蘸取溶液于滤纸上,如果滤纸上只有紫红色而无绿色痕迹,即表示锰酸钾已歧化完全),静置、抽滤.将滤液转移到蒸发皿中,放恒温水浴槽水浴加热,调节温度75℃左右浓缩,至溶液表面有KMnO4晶膜出现,取出蒸发皿冷却,抽滤,得到高锰酸钾晶体.将晶体于75℃~80℃的恒温干燥箱干燥30min,取出放置干燥器中,冷却后准确称量,实验数据见表1.
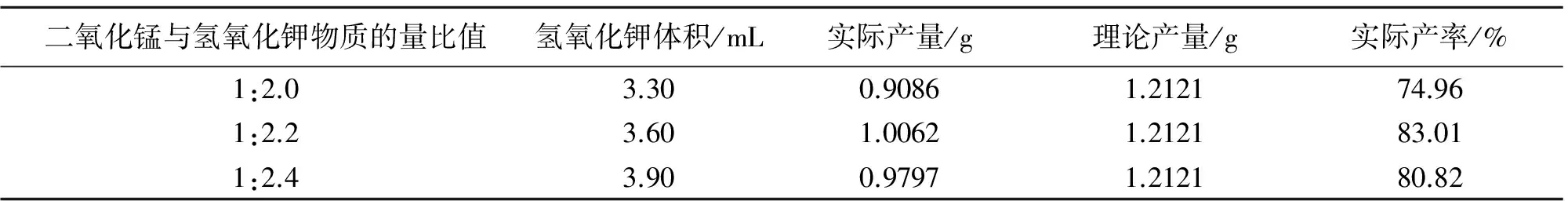
表1 二氧化锰与氢氧化钾最佳配比的探究
由表1可知,当二氧化锰为1.0002g、氯酸钾为0.5001g(比理论值稍高)时,二氧化锰与氢氧化钾的物质的量比是1:2.2时,制得的高锰酸钾产率较高.
2.1.2 二氧化锰与氯酸钾的最佳配比探究
依上述实验方案和所探究的二氧化锰与氢氧化钾的最佳配比,按照二氧化锰与氯酸钾的物质的量比为3:1.0、3:1.2、3:1.4称取药品进行实验,实验数据见表2.
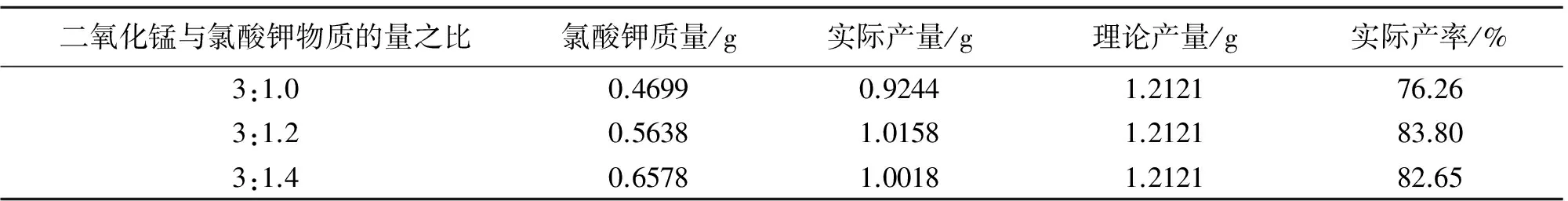
表2 二氧化锰与氯酸钾最佳配比的探究
由表2可知,当二氧化锰与氯酸钾物质的量比为3:1.2时,制得的高锰酸钾产率较高.
综上探究得:MnO2:KClO3:KOH的物质的量最佳配比是3:1.2:6.6,用醋酸歧化锰酸钾,调节溶液酸度pH≈10,进行实验,制备的产品产率较高.
2.2 歧化锰酸钾酸度范围的探究
称取约3.0g二氧化锰,按照二氧化锰、氯酸钾及氢氧化钾三者的物质的量之比为3:1.2:6.6进行实验,制得锰酸钾溶液,将其等分为六份并标记.滴加醋酸调节溶液pH值分别为8.50、9.00、9.50、10.00、10.50、11.00歧化锰酸钾.将制得的六份高锰酸钾晶体烘干、冷却、称量、计算产率.实验数据及产品产量与酸度的关系见表3.

表3 最佳酸度范围的探究
由表3知,歧化锰酸钾时pH值在10.07~10.50范围内,实验制得高锰酸钾产量较高,为最佳酸度范围.
2.3 产品纯度的检验
吸取5.00mL 0.02777mol·L-1高锰酸钾标准储备溶液,置于100mL容量瓶中,加水定容,摇匀得到高锰酸钾标准液,其质量浓度为0.2194mg·mL-1.
分别吸取1.00mL、2.00mL、2.50mL、3.00mL、4.00mL、4.50mL高锰酸钾标准液于25mL容量瓶,加水定容,摇匀得到高锰酸钾标准溶液系列.以蒸馏水为参比,用1cm比色皿,在525nm波长下测定其吸光度[7].得浓度在8.8μg·mL-1~39.4μg·mL-1之间,其线性回归方程为:A=0.00946+0.01503ρ(μg·mL-1),相关系数r=0.9998.
从表4中选取产量高且晶型较好的两组产品.准确称取0.06g~0.07g的产品,溶解、定容于100mL容量瓶中.从中吸取1.00mL溶液于25mL容量瓶中定容,测量其吸光度,并计算纯度.实验数据见表4.
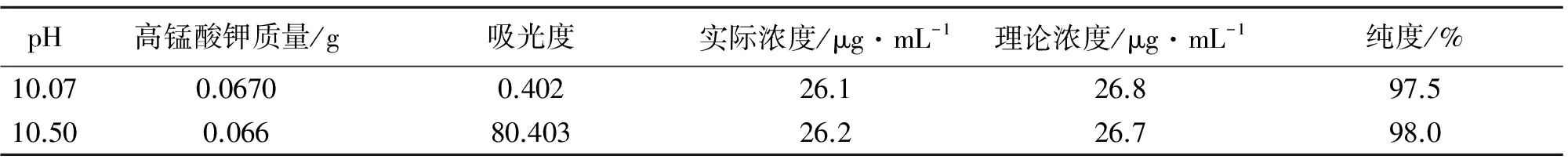
表4 产品纯度测定值
由表4可知,按最佳配比、在最佳酸度范围内制得的产品纯度较高.
2.4 产物二氧化锰的回收再利用
将实验中生成的产物二氧化锰收集、洗涤、干燥,称取约1.0g,按照以上探究的反应物用量最佳配比数值称取氯酸钾和二氧化锰的质量,歧化酸度pH值在10.07~10.50范围内,重复上述制备步骤进行实验,并将制备的高锰酸钾烘干、称量、计算产率、测定纯度.数据见表5.

表5 产率及纯度测定结果
由表5可知,利用实验产物二氧化锰作为反应物来制备KMnO4,实验重现性好.
3 实验探究讨论
3.1 药品用量的探究
在制备高锰酸钾的常规实验中,反应物用药量比较大,易导致药品受热强度不均匀,反应物转化率低,并且没有反应的药品成为了杂质,使得产品产量低、纯度低.过量的氢氧化钾在锰酸钾歧化过程中,消耗的醋酸会增多,生成相应的杂质醋酸钾;过量的氯酸钾会一直存在于溶液中,在蒸发浓缩高锰酸钾溶液时,这些杂质会随着产品一起析出,影响产品的纯度.改进后的实验,以常规实验四分之一的药量,按照二氧化锰、氯酸钾和氢氧化钾的最佳配比(3:1.2:6.6)进行实验,能够使各药品反应完全,提高了药品利用率,也减少了产品中的杂质,提高了产品产率和纯度,这使得实验更易于操作,也缩短了反应时间.
3.2 歧化酸度的探究
实验中高锰酸钾的产率与二氧化锰是否完全被氧化有关,还与锰酸钾的歧化率有关.实验采用醋酸歧化的方法,探究pH值在8.50~11.00范围内歧化锰酸钾制备高锰酸钾,分别记录对应产品的产量,得出在10.05~10.50范围内制得的高锰酸钾产量较高.
3.3 纯度检测方法的改进
高锰酸钾纯度的检验方法目前主要有草酸钠滴定法和分光光度法.其中草酸钠滴定法操作简单,应用最为广泛.但在实验中,学生们制备的产品纯度不是很高,含有少量杂质(如氯酸钾、二氧化锰等),在滴定过程中,氯酸钾和二氧化锰都会与具有还原性的草酸钠反应,使滴定体积增大,导致检测结果不准确.本实验采用分光光度法测定高锰酸钾的纯度,高锰酸钾溶液中的少量杂质都没有颜色,对光没有吸收,可以消除颜色判断误差和其他物质的干扰,而且操作简便、快捷,结果准确可靠.
3.4 产物二氧化锰的循环利用
将实验中的产物二氧化锰回收,经过洗涤、干燥,按照以上探究的反应物用量、最佳配比、最适宜歧化酸度下再次进行实验,经过对产品产率的计算和纯度的测定,实验重现性很好.实现了二氧化锰的循环利用,提高了原料利用率,符合绿色化学5R原则理论要求.
4 结论
本研究对实验室高锰酸钾制备进行了绿色化探究,用常规实验四分之一的药量,以MnO2:KClO3:KOH的物质的量配比3:1.2:6.6制备锰酸钾;在pH值10.0~10.5之间歧化锰酸钾进行实验,制备的高锰酸钾产率较高,达到80%以上,通过分光光度法测定出产品纯度达97%以上;试验了产物二氧化锰的重复利用,重现性很好.实验过程体现了绿色化学理念,为高锰酸钾的制备提供了一条绿色可行的实验方案,对实验教学有一定的实际意义.
[1] 洪丽雅.漫谈绿色化学实验[J].中国现代教育装备,2007,17(4):86-87.
[2] 钟国清.化学实验教学的绿色化改革与实践[J].实验技术与管理,2006,23(12):18-35.
[3] 郭士成,杨茂山.固体碱熔氧化法制备高锰酸钾的微型实验[J].临沂师范学院学报,2003,25(6):141-142.
[4] 陈彦玲,田丽.高锰酸钾的制备绿色化的探究[J].长春师范学院学报,2011,30(5):53-55.
[5] 杨颖群,陈志敏,李薇,等.高锰酸钾制备实验的绿色化改进[J].湖北第二师范学院学报,2010,27(8):130-132.
[6] 程春萍,阿古拉.高锰酸钾制备酸度的控制[J].阴山学刊(自然科学版),2007,21(2):67-69.
[7] 余志武.分光光度计比色法测定高锰酸钾溶液的含量[J].江西煤炭科技,2000,(1):32-48.
[责任编辑:尤书才]
A Greenization Research on the Preparation of Potassium Permanganate in Laboratory
ZHANG Hong-xiang, YU Qing-shui, LI Cong-cong
(College of Chemisty and Chemical Engineering, Cangzhou Normal University, Cangzhou, Hebei 061001, China)
The Greenization Researchon the preparation of potassium permanganate in Laboratory is carried out by means of reducing dosage of reactants,disproportionate-selecting acid, and reuse of byproducts (manganese). It also explores the best dosage of drugs, appropriate disproportionation pH range, which provides a greenization preparation for experimental teaching.
greenization; potassium permanganate; disproportionation; oxidation electrolysis
2016-10-31基金项目:河北省高等教育教学改革研究与实践项目“无机化学实验与分析化学实验课程的优化整合”,编号:No.2016GJJG254.
张洪香(1965-),女,河北献县人,沧州师范学院化学与化工学院高级实验师.
O61-4
A
2095-2910(2017)02-0039-04
