江苏H9N2亚型禽流感病毒HA和NA的遗传进化分析
2017-07-12李祥瑞赵冬敏刘青涛刘宇卓韩凯凯黄欣梅
吴 青,李 银,李祥瑞,赵冬敏,刘青涛,刘宇卓,韩凯凯,黄欣梅
(1.江苏省农业科学院,江苏 南京 210014;2.南京农业大学,江苏 南京 210095)
江苏H9N2亚型禽流感病毒HA和NA的遗传进化分析
吴 青1,2,李 银1*,李祥瑞2*,赵冬敏1,刘青涛1,刘宇卓1,韩凯凯1,黄欣梅1
(1.江苏省农业科学院,江苏 南京 210014;2.南京农业大学,江苏 南京 210095)
为了解江苏H9N2亚型禽流感病毒(AIV)的变异情况,采用RT-PCR技术对10株从江苏不同地区分离的H9N2亚型禽流感病毒的HA和NA基因进行了扩增、克隆、测序和遗传进化分析。结果显示:10株H9N2病毒间HA基因核苷酸和氨基酸的同源性分别是94.3%~99.0%、93.8%~99.6%,NA基因核苷酸和氨基酸的同源性分别是94.9%~99.9%、95.2%~100.0%,它们均属于欧亚分支中的A/Duck/Hong Kong/Y280/97亚群;10株病毒的HA裂解位点均为RSSR-GLF,受体结合位点第198位有8株为苏氨酸,2株为丙氨酸,第191位有1株为组氨酸;10株病毒NA基因在62~64位均存在缺失的现象,从而导致61位的糖基化位点缺失,NA基因第402位均出现了由天冬酰胺(N)到天冬氨酸(D)的变异,8株病毒只具有6个糖基化位点。
江苏;H9N2亚型;禽流感病毒;HA;NA;遗传进化
禽流感(Avian Influenza)被世界动物卫生组织(OIE)列入A类传染病,被中国列为一类传染病。H9N2亚型禽流感病毒(Avian Influenza Virus, AIV)属于低致病性禽流感病毒(LPAI),家禽感染此病毒后发病率和死亡率较低,临床表现为无症状带毒(隐性感染)、产蛋量下降、呼吸系统疾病等。但是,因为H9N2亚型禽流感病毒具有传播性强、变异快、逐步突破哺乳动物屏障等特点[1],因此其不仅给家禽养殖业带来了损失,而且对人和哺乳动物的健康也构成了潜在威胁。我国1994年首次报道从鸡群分离到H9N2亚型AIV[2],目前,全国各省都有H9亚型AIV的流行。自1999年以来,我国不断有人感染H9N2病毒的报道[3],其中2013年暴发的人感染H7N9亚型AIV与H9N2亚型AIV关系密切,已证实其内部基因是通过基因片段重组从H9N2亚型AIV获得的[4]。
血凝素(Hemagglutinin, HA)是构成病毒囊膜纤突的主要成分之一,在病毒吸附及穿膜过程中起关键作用,是所有流感病毒蛋白中最重要的1个。在AIV感染时,只有在HA蛋白裂解的情况下才能使病毒囊膜和小泡膜融合以及破裂。因此,HA蛋白的可裂解性对病毒的毒力有着至关重要的作用[5]。HA的第234位氨基酸非常关键[6],若是谷氨酰胺(Q),则易与唾液酸(sialic acid, SA)α-2,3-Gal受体结合;若为亮氨酸(L),则与SA α-2,6-Gal受体结合;人流感病毒优先结合SA α-2,6-Gal受体,AIV则易与SA α-2,3-Gal受体结合[7]。HA糖基化位点不仅在介导病毒传播和受体结合方面起作用,而且能够保护病毒免受机体免疫系统的作用[8]。有关研究表明HA糖基化的改变不仅影响病毒对宿主细胞的识别,而且影响自然杀伤细胞对感染细胞的识别。神经氨酸酶(Neuraminidase, NA)也是流感病毒粒子表面的1个重要抗原,NA可以将位于宿主细胞表面的流感病毒受体末端的唾液酸残基切断,从而使病毒成功侵染细胞[9];同时,NA可以切断子代病毒受体末端的唾液酸残基,使得病毒释放和成熟[10]。HA的受体结合特性和NA的受体裂解特性相互适应,共同发挥作用。HA和NA的变异会引起AIV的抗原漂移以及抗原转变,对于禽流感病毒的毒力具有很大的影响[11]。因此,对H9N2病毒的HA和NA进行遗传进化分析有着十分重要的意义。本研究中,我们对2016年从江苏各地区分离的H9N2亚型禽流感病毒HA和NA基因进行了遗传进化分析,以期为深入研究H9N2亚型禽流感病毒提供分子依据。
1 材料与方法
1.1 病毒
采集江苏省内部分地区家禽的肛拭子和咽拭子,将拭子置于运输液(加入四抗的PBS)中,将棉拭子挤压后弃去,以5000 r/min离心10 min后取上清;吸取上清液0.2 mL,接种9~10日龄的SPF鸡胚(购于南京天邦生物科技有限公司);收集接种后24~96 h死亡的鸡胚尿囊液,经HA和HI鉴定,将H9N2阳性尿囊液在-70 ℃下保存备用。
1.2 主要试剂
液体病毒RNA/DNA抽提试剂盒、凝胶回收试剂盒购自Axygen生物科技有限公司;first-strand反应缓冲液、High Pure dNTPs (10 mmol/L)、Rnase Inhibitor(40 U/μL)、反转录酶AMV、dNTPs (2.5 mmol/L)、Mg2+(25 mmol/L)、Ex Taq反应缓冲液(10×)、Ex Taq酶均购自TAKARA公司;通用引物Uni12由南京金斯瑞生物科技有限公司合成。
1.3 引物合成
参照GenBank中H9N2 AIV的基因序列,应用Primer 5.0设计引物(见表1),交由南京金斯瑞生物科技有限公司合成。

表1 HA和NA的PCR扩增引物序列
1.4 提取病毒RNA并进行反转录
用RNA提取试剂盒提取鸡胚尿囊液中H9N2流感病毒的总RNA。反转录采用20 μL体系,包括dNTPs 2 μL、5×AMV Buffer 4 μL、Reverse Transcriptase XL(AMV) 0.5 μL、Recombinant Rnase Inhibitor 0.5 μL、Unit12 1 μL、RNA 12 μL。反应程序为65 ℃ 5 min,42 ℃ 60 min,98 ℃ 5 min。
1.5 扩增目的片段并测序
以反转录产物为模板进行PCR扩增。PCR反应体系为25 μL,其中双蒸水14.75 μL,10×PCR Buffer 2.5 μL,25 mmol/L MgCl21.5 μL,dNTP (2.5 mmol/L)2.0 μL,上、下游引物(25 pmol/μL)各1.0 μL,模板DNA 2.0 μL,Ex Taq (5 U/μL)0.25 μL。PCR反应程序: 94 ℃预变性5 min;94 ℃变性40 s,52 ℃退火40 s,72 ℃延伸3 min,共35个循环;72 ℃延伸10 min。在循环反应结束后,对扩增产物进行1.5%琼脂糖凝胶电泳检测,对PCR产物进行胶回收。将回收产物送至南京金斯瑞生物科技有限公司进行测序。
1.6 HA、NA基因序列分析
用Lasergene 7.1 DNAStar软件对HA、NA基因进行序列拼接、同源性分析,并对潜在糖基化位点、唾液酸结合位点进行分析。用MEGA 5.0对10株病毒的HA、NA基因序列与GenBank中已发表的H9N2亚型AIV经典毒株进行遗传进化分析,绘制进化树。参考毒株的名称如下: TU/WS/1/66、CK/HK/Y280/1997、CK/BJ/1/1994、CK/SH/F/98、CK/HK/G9/1997、 CK/GX/10/1999、Quai/HK/G1/97、DK/HK/Y439/1997、CK/JS/HA/2012、CK/HB/31/2000。
2 结果与分析
2.1 HA、NA基因扩增及序列测定
分别提取10株H9N2亚型禽流感病毒的RNA,用RT-PCR方法扩增HA、NA基因片段。10株病毒的代号及简称如下:A/Chicken/Jiangsu/01/2016(简称A/CK/JS/01/16)、A/Chicken/Jiangsu/02/2016(简称A/CK/JS/02/16)、A/Chicken/Jiangsu/03/2016(简称A/CK/JS/03/16)、A/Chicken/Jiangsu/04/2016(简称A/CK/JS/04/16)、A/Chicken/Jiangsu/05/2016(简称A/CK/JS/05/16)、A/Chicken/Jiangsu/06/2016(简称A/CK/JS/06/16)、A/Chicken/Jiangsu/07/2016(简称A/CK/JS/07/16)、A/Chicken/Jiangsu/08/2016(简称A/CK/JS/08/16)、A/Chicken/Jiangsu/09/2016(简称A/CK/JS/09/16)、A/Chicken/Jiangsu/10/2016(简称A/CK/JS/10/16)。
2.2 HA、NA基因同源性分析
通过DNAStar软件比较分析,得出10株H9N2病毒间HA基因核苷酸的同源性为94.3%~99.0%,推导氨基酸同源性为93.8%~99.6%;NA基因核苷酸的同源性为94.9%~99.9%,推导氨基酸同源性为95.2%~100.0%。10株病毒与H9N2亚型禽流感病毒欧亚分支中Y280-like亚系代表株CK/HK/Y280/1997的亲缘性较近,HA基因核苷酸同源性为89.5%~90.4%,推导氨基酸同源性为91.0%~92.5%;NA基因核苷酸同源性为91.1%~94.1%,推导氨基酸同源性为91.3%~94.3%。
2.3 HA、NA蛋白氨基酸序列分析
将10株病毒与欧亚分支Y280-like亚系代表株CK/HK/Y280/1997进行比较分析。HA蛋白的基因裂解位点第335~341位为RSSR-GLF,只有1个碱性氨基酸,符合H9N2亚型AIV典型的低致病性特征;第198位受体结合位点有8株病毒由缬氨酸(V)变异为苏氨酸(T),2株变异为丙氨酸(A),可能会导致H9N2亚型AIV与细胞受体的结合力发生变异,对AIV的流行性可能起重要作用;第234位氨基酸与受体唾液酸α-2,3-半乳糖和唾液酸α-2,6-半乳糖的结合特性有关,禽类的H9N2亚型 AIV的第234位大多为谷氨酰胺(Q),与唾液酸α-2,3-半乳糖受体结合。而在本研究中10株病毒第234位均突变为亮氨酸(L)(表2),易与唾液酸α-2,6-半乳糖受体结合,可能引发人感染。上述结果表明这10株病毒存在引发人和其他哺乳动物流感的潜在可能。
N-糖基化位点(拥有N-X-T/S基序,X为除P以外的氨基酸)被证实对于维持蛋白分子的结构和正常生物学功能具有重要意义。10株病毒HA蛋白的第313位均由脯氨酸(P)变异为丝氨酸(S),因而在第313位新增加了1个糖基化位点;9株病毒的第218位糖基化位点由苏氨酸(T)变异为异亮氨酸(I),1株病毒由苏氨酸(T)变异为缬氨酸(V)(表2),导致第218位糖基化位点缺失;10株病毒NA蛋白第63位缺失,导致第61位的糖基化位点缺失;第402位由天冬酰胺(N)变异为天冬氨酸(D),导致10株病毒第402位糖基化位点缺失;8株病毒第264位由丝氨酸(S)变异为精氨酸(R),1株由异亮氨酸(I)变异为缬氨酸(V),导致9株病毒缺失了第264位糖基化位点(表3)。
唾液酸结合位点,即红细胞结合位点(hemadsorbing site, HB)位于NA蛋白的表面,远离神经氨酸酶酶活性区域,对病毒的复制具有重要作用。对10株病毒NA蛋白HB位点氨基酸变异情况的分析结果如表3所示:10株病毒在431~433位氨基酸比较保守,均为PQE;而在366~373区域的368、369 位氨基酸出现较大变异。
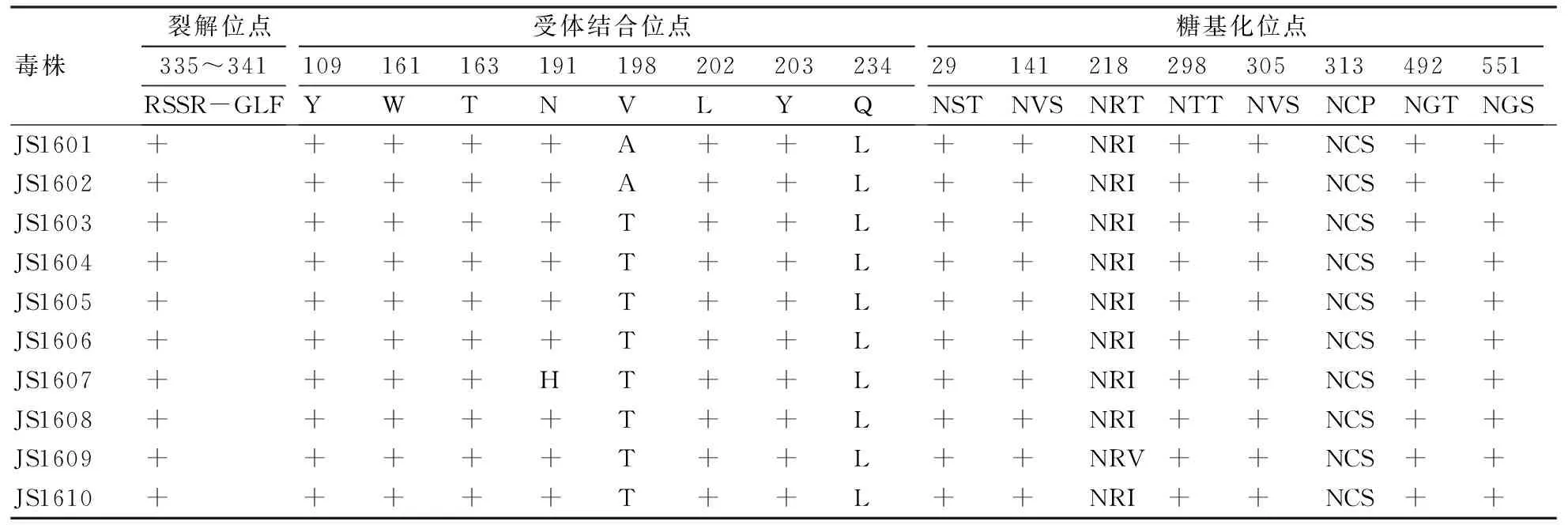
表2 H9N2亚型AIV HA基因的特殊位点
2.4 HA、NA遗传进化分析
将10株病毒的HA、NA基因核苷酸序列与参考毒株进行比较,并绘制系统进化树。如图1、图2所示:10株病毒的HA、NA基因均属于欧亚分支中以DK/HK/Y280/97为代表株的Y280-like亚分支。
3 讨论
H9N2亚型AIV是低致病性流感病毒,主要表现为高感染率和低死亡率,能引起家禽生产性能下降和免疫抑制,继发细菌感染后能造成家禽死亡,严重影响家禽业生产。禽流感病毒变异后能在人、家禽、猪体之间循环,有的能直接感染人,有的为感染人的病毒提供基因,如:2003年香港发生H9N2亚型禽流感病毒感染人的疫情,2013年感染人并引起较高死亡率的H7N9亚型禽流感病毒的6个内部基因也均来自H9N2病毒[12]。H9N2病毒的 8个基因片段为适应新的宿主环境在不断发生变化,以表面基因HA和NA的变化最为显著。本研究中的10株H9N2亚型流感病毒与参考毒株HA基因核苷酸及推导的氨基酸序列的同源率分别在89.5%~90.4%、91.0%~92.5%,NA基因核苷酸及推导的氨基酸序列的同源率分别在91.1%~94.1%、91.3%~94.3%。这就表明HA基因和NA基因随着时间的变化,其突变在积累。
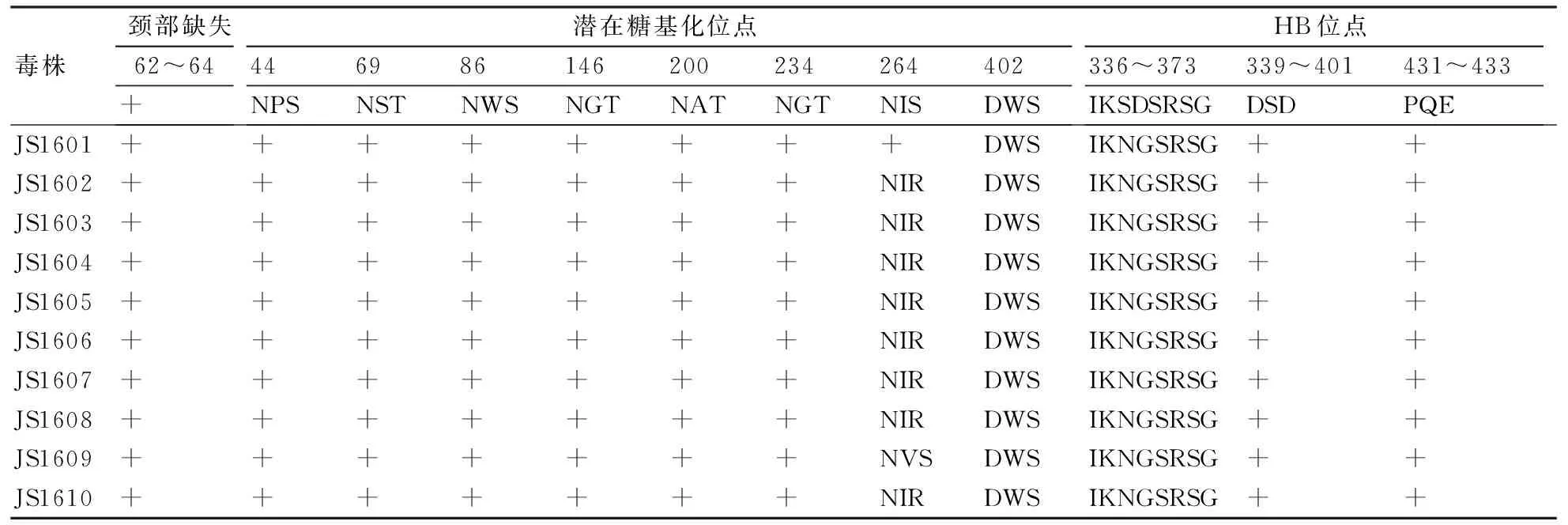
表3 H9N2亚型AIV NA基因的特殊位点
HA蛋白是流感病毒重要的表面糖蛋白,含有与病毒生物学功能相关的多个功能域,这些区域的一些氨基酸变化可能导致病毒的一些生物学功能的改变[13]。在一般情况下,高致病性禽流感病毒的裂解位点附近有多个碱性氨基酸插入,而低致病力毒株的裂解位点附近只有1个或没有碱性氨基酸。本研究中的10株病毒裂解位点均为RSSR-GLF,只有1个碱性氨基酸,具有低致病性禽流感病毒的分子特点。HA基因第234位受体结合位点变化显著,均由谷氨酰胺(Q)突变为亮氨酸(L),受体结合位点的突变可能引起流感病毒在自然进化过程中与细胞受体的亲和力发生变异。
糖基化位点能防止抗体结合对病毒的中和作用[14],是改变禽流感病毒毒力的重要因素之一。在本研究中,9株病毒HA蛋白第218位由苏氨酸(T)变异为异亮氨酸(I),1株病毒由苏氨酸(T)变异为缬氨酸(V)(表2),导致第218位糖基化位点缺失;第 313位由脯氨酸(P)变异为丝氨酸(S),因而第313位新增加了1个糖基化位点。较早的研究表明,中国大陆地区H9N2亚型AIV的NA蛋白中第63、264、402位潜在糖基化位点高度保守[15]。本研究中10株病毒NA蛋白第63位缺失,从而导致61位的糖基化位点缺失;第402位由天冬酰胺(N)变异为天冬氨酸(D),导致10株病毒第402位糖基化位点缺失;8株病毒第264位由丝氨酸(S)变异为精氨酸(R),1株由异亮氨酸(I)变异为缬氨酸(V),导致9株病毒缺失了第264位糖基化位点。与早期报道相比,本研究中病毒NA蛋白潜在的糖基化位点出现了较多的变异,这是否会影响病毒的生物学特性还有待进一步研究。
在NA基因的血凝素结合位点367~372位、399~404位和431~433位共同形成了3个环状结构,而环状结构中的氨基酸与唾液酸直接结合[16]。在本研究中,10株病毒的NA基因的血凝素结合位点HB的367~372位的氨基酸发生了变异,这可能会降低与唾液酸结合的活性,但是否会引起H9N2禽流感病毒的致病力增强尚未可知。
本研究对江苏各地区2016年分离的10株H9N2亚型AIV的HA、NA基因进行了序列分析。结果表明,HA蛋白第218位潜在糖基化位点缺失,在第313位新增潜在糖基化位点,此变异对病毒致病力的影响有待进一步研究。此外,NA蛋白的糖基化位点、HB位点发生了较大变异;值得注意的是,HA蛋白的第234位氨基酸均为L,说明这10株病毒具有潜在感染人的特性。H9N2亚型AIV能引起家禽的免疫抑制,若继发细菌感染则可造成家禽的大量死亡,会给养禽业带来巨大的经济损失。因此加强H9N2亚型AIV流行病的监测与研究,对畜禽生产和公共卫生都有非常重要的意义。
[1] Xu K M, Smith G J, BahI J, et al. The genesis and evolution of H9N2 inflluenza viruses in poultry from southern China, 2000 to 2005 [J]. J Virol, 2007, 81(19): 10389-10401.
[2] 陈伯伦,张泽纪,陈伟斌.禽流感研究:I鸡A型流感病毒分离与血清学初步鉴定[J].中国兽医杂志,1994,22(10):3-5.
[3] Sun Y, Pu J, Jiang Z, et al. Genotypic evolution and antigenic drift of H9N2 influenza viruses in China from 1994 to 2008 [J]. Vet Microbiol, 2010, 146: 215-225.
[4] Lam T T, Wang J, Shen Y, et al. The genesis and source of H7N9 influenza viruses causing human infection in China [J]. Nature, 2013, 502(7470): 241-244.
[5] Graaf D M, Fouchier R A. Role of receptor binding specificity in influenza A virus transmission and pathogenesis [J]. EMBO, 2010, 33(8): 823-841.
[6] Matrosovich M, Tuzikov A, Bovin N, et al. Early alterations of the receptor-binding properties of H1, H2, and H3 avian influenza virus hemagglutinins after their introduction into mammals [J]. Virol, 2000, 74(18): 8502-8512.
[7] Rogers G N, Paulson J C. Receptor determinants of human and animal influenza virus isolates: differences in receptor specificity of the H3 hemagglutinin based on species of origin [J]. Virology, 1983, 127(2): 361-373.
[8] Perdue M L, Latimer J, Greene C, et al. Consistent occurrence of hemagglutinin variants among avian influenza virus isolates of the H7 subtype [J]. Virus Res, 1994, 34(1): 15-29.
[9] Hay A J. The virus genome and its replication [C]//Nicholson K G, Webster R G, Hay A J. Textbook of influenza. London: Blackwell Science Ltd, 1998: 65-73.
[10] Colman P M. Structure and function of neuraminidase [C]//Nicholson K G, Webster R G, Hay A J. Textbook of influenza. London: Blackwell Science Ltd, 1998: 65-73.
[11] 金元昌,李景鹏,张龙,等.禽流感病毒分子生物学研究进展[J].动物医学进展,2003(1):1215.
[12] lius J K, Chen J. Phylogenetic diversity and distribution of type A influenza virus [J]. PLoS One, 2009, 4(3): e5022.
[13] Guan Y, Shortridge K F, Krauss S, et al. H9N2 influenza viruses possessing H5N1 like internal genomes continue to circulate in poultry in Southeastern China [J]. Virology, 2000, 74(20): 9372-9380.
[14] Baigent S J, McCauley J W. Glycosylation of hacmalutinin and stalk-length of neuraminidase combine to regulate the growth of avian influenza virus in tissue culture [J]. Virus Res, 2001, 79(1/2): 177-185.
[15] 郭霄峰,廖明,辛朝安. H9N2亚型禽流感病毒纤突蛋白基因的分析[J].中国人兽共患病杂志,2002,18(4) :17-19.
[16] Matrosovich M N, Krauss S, Webster R G. H9N2 influenza A viruses from poultry in Asia have human virus-like receptor specificity [J]. Virology, 2001, 281(2): 156-162.
[17] 邓显文,谢芝勋,谢志勤,等.H9亚型禽流感病毒血凝素单克隆抗体制备及鉴定[J].南方农业学报,2016,47(4):679-683.
(责任编辑:黄荣华)
Genetic Evolution Analysis of H9N2-subtype Avian Influenza Viruses HA and NA in Jiangsu Province
WU Qing1,2, LI Yin1*, LI Xiang-rui2*, ZHAO Dong-min1,LIU Qing-tao1, LIU Yu-zhuo1, HAN Kai-kai1, HUANG Xin-mei1
(1. Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2. Nanjing Agricultural University, Nanjing 210095, China)
In order to understand the variation situation of H9N2-subtype avian influenza virus (AIV) in Jiangsu area, we cloned the HA gene and NA gene of 10 H9N2-subtype AIV strains isolated from different regions of Jiangsu by RT-PCR amplification, and carried out the genetic evolution analysis of the HA and NA sequences. The results showed that the homology of nucleotide and amino acid of HA gene among 10 strains was 94.3%~99.0% and 93.8~99.6%, respectively; the homology of nucleotide and amino acid of NA gene among 10 strains was 94.9%~99.9% and 95.2%~100.0%, respectively; ten strains all belonged to A/Duck/Hong Kong/Y280/97 subgroup in Eurasian clade; the HA cleavage sites of all 10 isolates were RSSR-GLF; at the 198th receptor binding site, eight of ten strains had threonine, and two of ten strains had alanine; at the 191st receptor binding site, one of ten strains had histidine; the deletion of the 62~64th sites in NA gene of all 10 strains resulted in the deletion of the 61st glycosylation site; the variation from asparagine (N) to aspartic acid (D) occurred at the 402nd site of NA gene, and eight of ten H9N2-subtype AIV strains had only six glycosylation sites.
Jiangsu; H9N2 subtype; Avian influenza virus; HA; NA; Genetic evolution
2017-03-28
江苏省农业科技自主创新资金项目[cx(14)2091、cx(15)1058]。
吴青,女,硕士,主要从事动物病毒病分子生物学研究。*通讯作者:李银、李祥瑞。
S858.3
A
1001-8581(2017)07-0104-06
