百色桑枯萎病病原菌的分离与鉴定
2017-07-12欧阳秋飞黄娇丽农艳丰李荣峰杨瑞虎樊虹伶
欧阳秋飞,黄娇丽,农艳丰,李荣峰,马 博,杨瑞虎,樊虹伶
(百色学院,广西 百色 533000)
百色桑枯萎病病原菌的分离与鉴定
欧阳秋飞,黄娇丽,农艳丰,李荣峰,马 博,杨瑞虎,樊虹伶
(百色学院,广西 百色 533000)
采用组织分离法从百色市隆林县的桑枯萎病病茎部分离获得2个菌株PB0102和PS0202;通过对分离菌进行致病性测定、培养性状观察、生理生化测定、16S rDNA序列测定和系统发育分析,将PB0102和PS0202分别鉴定为Enterobactercloacae和Enterobacterasburiae。
百色市;桑枯萎病;病原菌;分离;鉴定
近年来,百色市以“东蚕西移”战略为契机,结合自身实际,大力发展桑蚕产业,使桑蚕产业逐步成为继芒果、甘蔗之后的特色农业产业,是农民增收致富的又一重要渠道[1]。百色市作为广西重要的桑蚕基地,目前有隆林、靖西、凌云、田东、平果、德保、那坡和乐业等8个县(市)进行桑蚕生产,现共有桑园21617 hm2。桑枯萎病全名为桑树细菌性枯萎病(Mulberry bacterial wilt),自2010年以来,该病相继在广西中东部宾阳县、上林县、象州县、忻城县、宜州市、横县、融安县、鹿寨县和贵港市等县(市)大面积发生,给当地桑蚕生产造成了严重的经济损失[2]。
在2015年百色市桑树细菌性病害调查中发现,隆林县平班镇的桑园中也发现了类似桑枯萎病症状的植株,感病桑树表现为叶片从叶缘开始失水萎蔫,继而褐变干枯并向叶面卷曲;随着病情的加重,叶片自下而上逐渐掉落,致使感病植株呈光杆状;剥开发病植株根茎表皮,发现木质部有褐色条纹产生。为了准确诊断病害,明确病原,本研究对该病的病原进行了分离和致病性测定,并通过培养性状观察、生理生化测定、16S rDNA序列测定和系统发育分析对该病原菌进行了鉴定,旨在为控制该病在百色市的传播蔓延提供理论依据。
1 材料与方法
1.1 材料
试验所用菌株为2015年在百色隆林县平班镇桑园发现的病桑茎段经组织分离、纯化后获得;致病性测定用桂桑优12号(购自广西桑蚕技术推广总站)进行;试验所用培养基为NA和TTC(氯化三苯基四氮唑)[3]。
1.2 病原菌的分离与纯化
病原菌的分离采用传统组织分离法进行[4],方法如下:剪取5 cm左右新鲜的病桑根、茎段,用自来水洗净后放入75%的乙醇中1 min进行表面消毒,再转入0.1%升汞溶液中消毒2 min,继而用灭菌水漂洗3~4次,用灭菌滤纸吸干水分;将已消毒的根、茎段放入有2 mL灭菌水的培养皿中,用灭菌镊子剥去表皮,再用灭菌剪刀和手术刀刮取、剪碎木质部褐变部位,充分混匀以释放病原菌;最后直接用接种环沾取一环分离液于TTC平板上划线,做好标记,放于30 ℃恒温培养箱培养48 h。对长出的菌落进行2次重新划线纯化后,再将分离菌划线于NA斜面培养基中,在30 ℃下培养48 h,保存于4 ℃冰箱。
1.3 病原菌的致病性测定
致病性测定参照蒙姣荣等(2014)的菌液浸泡法[2]接种离体桑枝。具体步骤如下:将保存于4 ℃冰箱的分离菌于NA培养基上活化,在30 ℃下培养24 h后再转接1次,再用灭菌的pH 7.0、0.005 mol/L的PBS缓冲液将平板上的菌苔洗下,制成108cfu/mL菌悬液后,分装于三角瓶中,每瓶150 mL;再将事先剪下的新鲜桑枝插入三角瓶中,每支留顶叶4片左右。每个菌株5个重复,以接种灭菌的0.005 mol/L PBS缓冲液为对照。接种后,用保鲜袋罩住桑枝,置于自然条件下,温度为24~33 ℃。自接种第2天开始观察、记录桑枝发病情况。试验结束后,采用柯赫氏法则重新分离病原菌,并与原接种菌进行对比。
1.4 病原菌生理生化指标测定
病原菌生理生化指标测定采用购自杭州天和微生物试剂有限公司的细菌微量生化反应管。测试项目有:V-P试验、M-R试验、葡萄糖、蔗糖、D-阿拉伯糖醇、赖氨酸脱羧酶、鸟氨酸脱羧酶、精氨酸双水解酶、硝酸盐还原、蜜二糖、L-果糖、D-山梨醇,每个指标的测定设3个重复。参照Zhu Bo(2011)[5]和《伯杰细菌鉴定手册》[6]对病原菌各项生理生化指标鉴定结果进行分析。
1.5 病原菌16S rDNA序列测定及系统发育树构建
使用生工Ezup柱式细菌基因组DNA抽提试剂盒提取病原菌基因组DNA。使用TAKARA MightyAmp®DNA Polymerase Ver.2(R071Q)进行PCR扩增,16S rDNA细菌通用引物为27F(5′-AGAGTTTGATCCTGGCTCA-3′)/1492R(5′-GGTTACCTTGTTACGACTT-3′),PCR目的片段大小为1400 bp,反应体系为25 μL,反应条件为:98 ℃预变性2 min,98 ℃变性10 s,56 ℃退火15 s,68 ℃ 延伸2 min,共进行35个循环;68 ℃延伸2 min。反应结束后取2 μL PCR产物点入1%琼脂糖凝胶中进行电泳,之后使用凝胶成像系统观察PCR扩增结果。将PCR扩增产物送至北京六合华大基因科技股份有限公司进行测序。
测序后所得病原菌DNA序列经Blastn同源性搜索后,选取与之同源性最高的序列利用MEGA 4.0软件构建分子系统进化树(NJ),通过1000次重复的bootstrap[7]进行检验。
2 结果与分析
2.1 病原菌的分离与培养特性
从百色隆林县平班镇桑园病桑枝条上分离得到的2株分离菌PB0102和PS0202,在NA培养基上30 ℃培养48 h后,菌落均表现为规则圆形,湿润,光滑突起,乳白色至浅黄色;在TTC培养基上,也表现为菌落圆形,湿润光滑,突起,但颜色从菌落中心开始由乳白色向粉红至深红色渐变,无流动性。挑取分离菌进行革兰氏染色,于光学显微镜下观察,两者皆为革兰氏阴性菌,且都为椭圆至短杆状,无芽孢。
2.2 病原菌的致病性测定
对分离菌PB0102和PS0202进行离体桑枝接种,接种后第4天开始叶片出现变黄、萎蔫症状;第5天叶片由叶缘开始出现失水褐化;第6天叶片焦枯向内卷曲(图1);发病桑枝随着病情加重,叶片逐渐枯萎掉落,致使枝条呈光杆状。对发病桑枝重新进行病原菌分离,得到的分离菌培养性状与所接菌株一致,且接种桑枝所表现的病症与田间病症相同,表明分离菌PB0102和PS0202为桑枯萎病的致病菌。

A:CK;B:PB0102;C:PS0202。图1 百色桑枯萎病菌PB0102和 PS0202接种离体桑枝第6天的症状
2.3 病原菌的生理生化特性
参照Zhu Bo和《伯杰细菌鉴定手册》选择了12项生理生化鉴定指标对PB0102和PS0202进行测定,并与已知菌株Enterobacterasburiae(ATCC35953T)、Enterobactercloacaesubsp. cloacae(ATCC130477T)和Enterobactercloacaesubsp.dissolvens(LMG2683T)的生理生化反应结果作比较,结果表明PB0102的生理生化特性与Enterobactercloacae完全一致,PS0202与Enterobacterasburiae完全一致。
2.4 病原菌16S rDNA序列分析及系统进化树的构建
对2株病原菌进行16S rDNA PCR扩增后,得到1条1400 bp大小的特异性条带(图2);将PCR产物直接测序后得到1200 bp的有效序列;再将所得序列提交至NCBI进行BLAST比对,结果表明: PB0102与多株Enterobactercloacae的序列的相似性达到99%; PS0202与多株Enterobacterasburiae的序列的相似性达到99%。基于16S rDNA序列分析结果,选择已报道的肠杆菌属8个种的8个菌株与本研究的2株病原菌进行分子系统发育树的构建,图3结果表明: PB0102与Enterobactercloacae(KP165015.1)聚成一簇; PS0202与Enterobacterasburiae(JF772078.1)聚成一簇;两者都与肠杆菌属内的其他种存在显著的遗传距离。结合2株病原菌的形态特征、培养性状及生理生化鉴定结果,将PB0102鉴定为Enterobactercloacae,将PS0202鉴定为Enterobacterasburiae。

表1 百色桑枯萎病菌的生理生化测试结果
注:“+”表示为阳性;“-”表示为阴性;“±”表示边界值,不能准确判断;“ND”表示无可用数据。
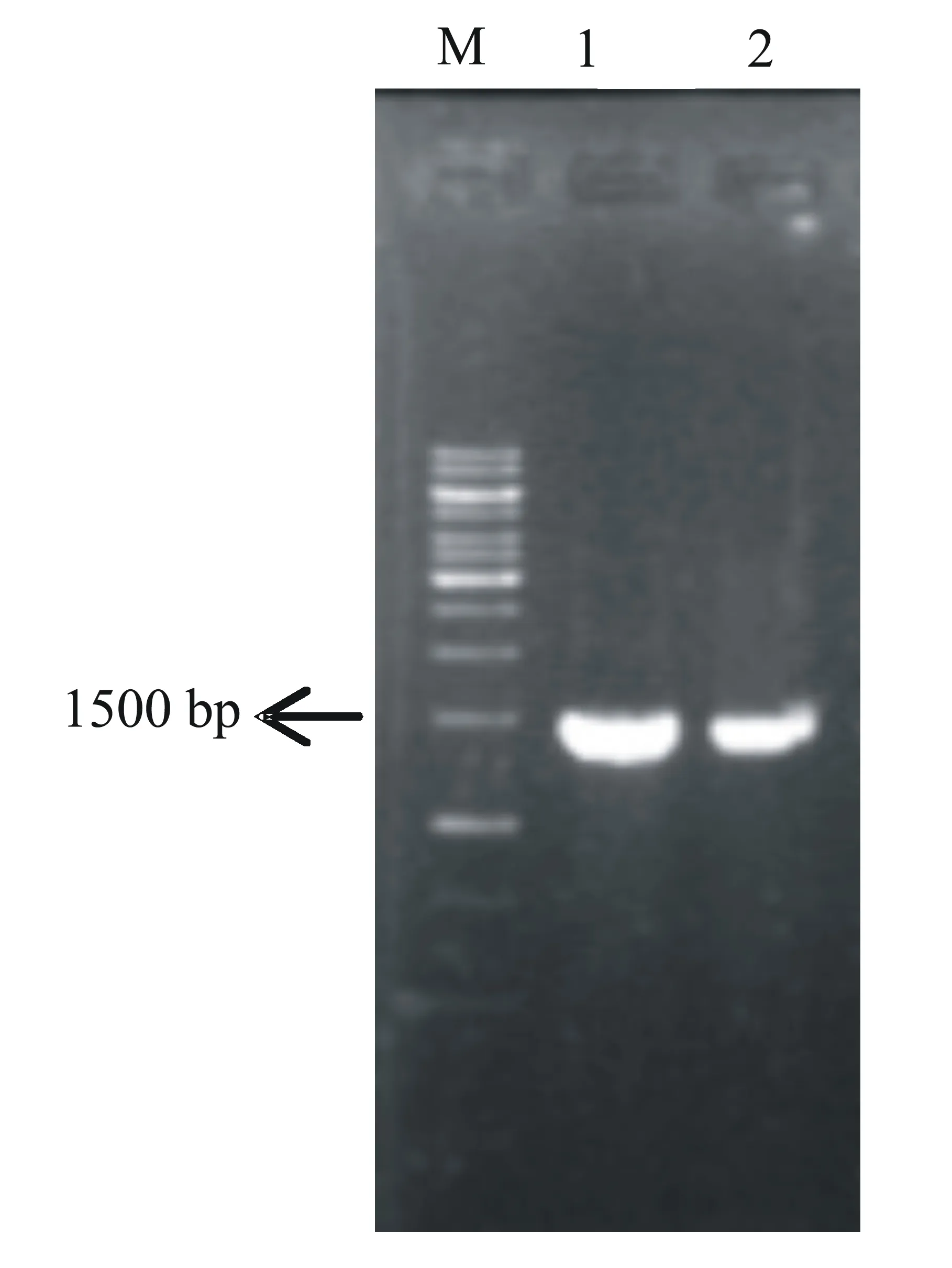
M:1 kb Maker;泳道1:PB0102;泳道2:PS0202。图2 百色桑枯萎病菌16S rDNA的PCR扩增结果
3 结论与讨论
由于肠杆菌种属间常出现交叉聚类现象,使菌株间的遗传距离较近,仅利用16S rDNA进行分子鉴定,往往不能鉴定到种[8]。因此病原菌鉴定必须以传统生理生化实验结果为基础,再以分子鉴定和系统发育分析来进一步验证。在本研究中,PB0102和PS0202的12项生理生化指标鉴定结果分别与Enterobactercloacae和Enterobacterasburiae的完全一致。再根据分离菌的致病性测定、培养性状观察、16S rDNA分子鉴定及系统发育分析,确定PB0102和PS0202分别为Enterobactercloacae和Enterobacterasburiae。
目前我国已报道能引起桑枯萎病的病原菌有肠杆菌属(Enterobacter)、克雷伯氏杆菌属(Klebsiella)和泛菌属(Pantoea)的多个种[9-12],而广西已分离到Enterobactercloacae、Enterobacterasburise、Enterobactermori、Klebsiellaoxytoca,以及未确定种Klebsiellasp.和Enterobactersp.共6种病原菌[2,13]。本研究从百色桑园分离到的病原菌确定为Enterobactercloacae和Enterobacterasburiae。这是桑枯萎病在百色桑园的首次报道,表明桑枯萎病已由广西中东部向西北部蔓延。这可能是由于近年来百色大力发展蚕业,大量引进新品种,调运苗木而导致广西其他县(市)的病原随之传入。为了防止该病继续扩展蔓延,今后在发展桑蚕生产时,应加强该病的检验检疫力度,严格进行产地检疫,并遵守“自留、自繁、自育、自用”的原则,避免从病区调运桑树苗木[14];同时,应建立全面的快速检测体系,从源头上遏制该病原菌的进一步传播。目前朱勃(2010)、Lou M M(2011)和姜星(2012)等已报道了Enterobactermori和Enterobacterspp.的快速分子检测体系,且都表现出良好的灵敏性[15-17];但由于桑枯萎病菌具有病原多样化特征,因此检测体系还应包括已报道的其他病原种类。
化学药剂是防治植物病害最直接最有效的方法。蒙姣荣(2015)等对广西分离到的6种桑枯萎病菌进行平板抑菌试验,结果表明,中生菌素、氢氧化铜、春雷·王铜、农用链霉素和嗅菌腈等对这6种病原菌均有一定的抑菌效果,且对家蚕的毒性均表现为低毒,但同一药剂对不同病原菌的抑菌效果存在明显差异[18]。今后,应继续筛选或研制对桑枯萎病菌有抑制作用的化学药剂,并进行田间小区试验以明确其在田间的实际防治效果。
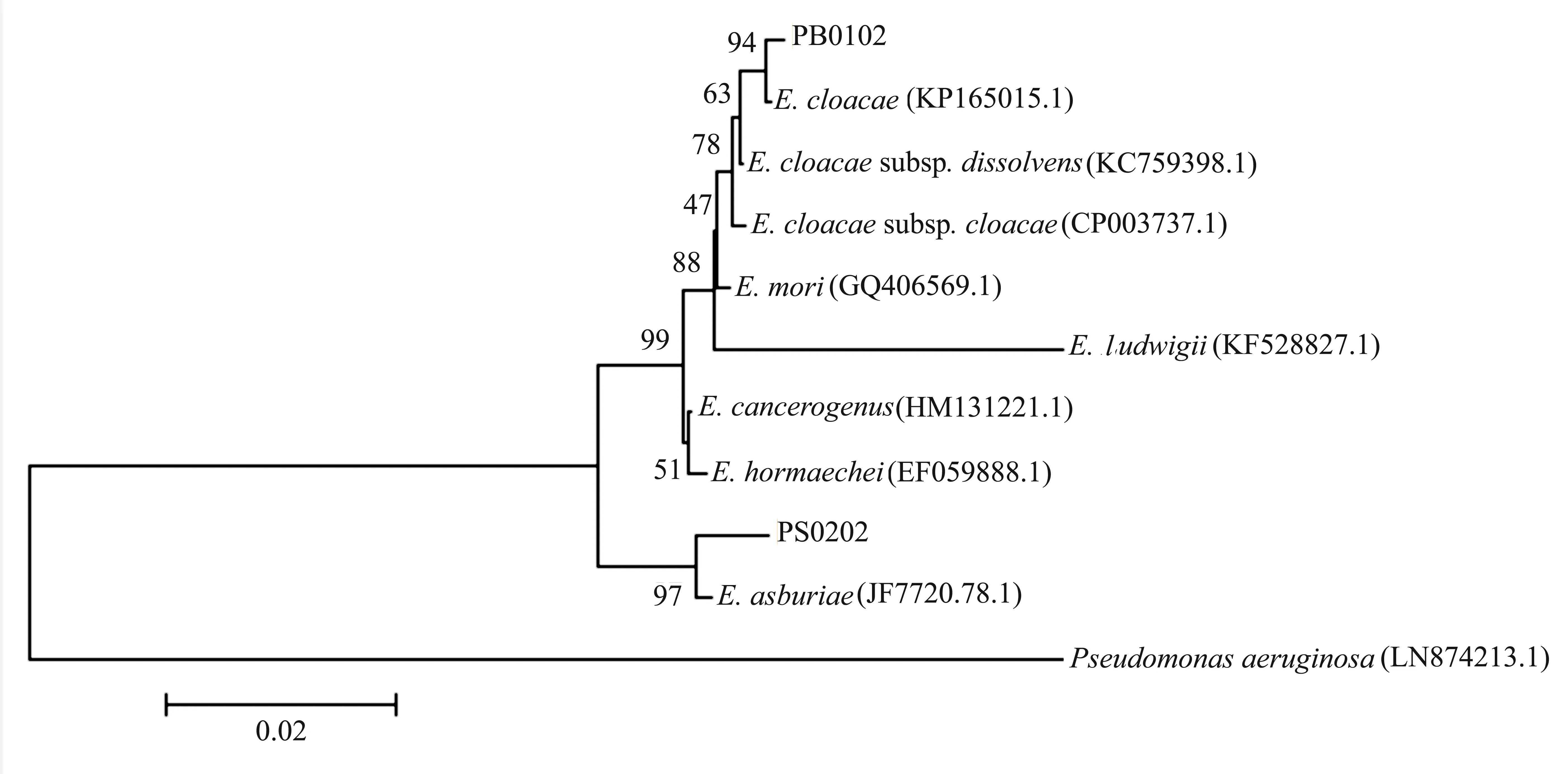
图3 百色桑枯萎病菌16S rDNA的系统发育树
[1] 文柳璎,李春平.打造百色高产优质桑蚕茧基地的思考[J].广西蚕业,2011,48(4):54-58.
[2] 蒙姣荣,欧阳秋飞,岑贞陆,等.广西桑树细菌性枯萎病菌致病力和遗传多样性分析[J].基因组学与应用微生物学,2014,33(5):1-11.
[3] 车建美,刘波,张彦,等.青枯雷尔氏菌致病性生物测定方法的研究[J].福建农业学报,2011,26(5):804-807.
[4] 方中达.植病研究法[M].北京:中国农业出版社,1998.
[5] Zhu B, Lou M M, Xie G L, et al.Enterobactermorisp. nov., associated with bacterial wilt onMorusalbaL.[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(11): 2769-2774.
[6] Buchanan R E, Gibbons N E. 伯杰细菌鉴定手册[M].中国科学院微生物研究所,译.北京:科学出版社,1984.
[7] Tamura K, Dudley J, Nei M, et al. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0 [J]. Mol Biol Evol, 2007, 24(8): 1596-1599.
[8] Hoffmann H, Roggenkamp A. Population genetics of the nomenspeciesEnterobactercloacae[J]. Applied and Environmental Microbiology, 2003, 69(9): 5306-5318.
[9] Wang G F, Praphat K, Xie G L, et al. Bacterial wilt of mulberry (Morusalba) caused byEnterobactercloacaein China [J] . Plant Disease, 2008, 92(3): 483-483.
[10] 朱勃,王国芬,谢关林,等.Enterobacterspp.:引起“桑枯萎”病的新证据[J].中国科学:C辑,2009(2):211-219.
[11] 王国芬.桑细菌性枯萎病病原学及其致病机理研究[D].杭州:浙江大学农业与生物技术学院,2009.
[12] 戴凡炜,罗国庆,王振江,等.华南蚕区桑枯萎病病原菌的分离与分子鉴定[J].蚕业科学,2012,38(6):981-987.
[13] 岑贞陆,欧阳秋飞,谢玲,等.广西桑树细菌性枯萎病病原菌的分离与鉴定[J].西南农业学报,2013,26(3):1054-1057.
[14] 祈兴良.桑树青枯病的危害与防治[J].云南农业科技,2008(B08):120-121.
[15] 朱勃.桑细菌性枯萎病病原的定名、分子检测及肠杆菌基因水平转移的研究[D].杭州:浙江大学农业与生物技术学院,2010.
[16] Lou M M, Jin G L, Tian W X, et al. Specific and sensitive detection ofEnterobactermoriusing reliable RT-PCR [J] . Plant Disease, 2011, 95(9): 1070-1074.
[17] 姜星.桑枯萎病病原细菌的分离、鉴定及分子检测方法的建立[D].南京:江苏科技大学,2012.
[18] 蒙姣荣,蒙月月,朱丽玲,等.广西桑树细菌性枯萎病菌生物学特性及防治药剂筛选[J].广西植保,2015,28(3):1-7.
(责任编辑:黄荣华)
Isolation and Identification of Pathogens Causing Mulberry Wilt Disease in Baise of Guangxi
OUYANG Qiu-fei, HUANG Jiao-li, NONG Yan-feng, LI Rong-feng,MA Bo, YANG Rui-hu, FAN Hong-ling
(Baise University, Baise 533000, China)
Through the method of tissue isolation, two pathogenic bacterial strains PB0102 and PS0202 were isolated from the stem of wilted mulberry plants in Longlin county, Baise city. By pathogenicity test, cultivation trait observation, common physiological and biochemical test, 16S rDNA sequence determination and phylogenetic analysis of the isolated pathogens, PB0102 and PS0202 were identified asEnterobactercloacaeandEnterobacterasburiae, respectively.
Baise city; Mulberry wilt disease; Pathogen; Isolation; Identification
2017-02-20
百色学院一般科研项目(2014KB04);广西中青年教师能力提升项目(KY2016YB416);广西高等学校优势特色专业群建 设项目[桂教高教(2015)41号66];百色学院特色研究团队建设项目[百院字(2015)148号]。
欧阳秋飞(1988─),女,广西百色人,讲师,硕士研究生,主要从事作物栽培及植物病害防治研究。
S888.711
A
1001-8581(2017)07-0071-04
