SOX4抑制凋亡介导食管癌顺铂耐药的实验研究*
2017-07-12符立平顾春荣熊佳时孙元珏吴敬波
符立平, 顾春荣, 熊佳时, 孙元珏, 吴敬波
201499上海,上海市奉贤区中心医院 肿瘤科(符立平 ,顾春荣,熊佳时,孙元珏);646000四川 泸州,西南医科大学附属医院 肿瘤科(吴敬波)
•基础研究•
SOX4抑制凋亡介导食管癌顺铂耐药的实验研究*
符立平, 顾春荣, 熊佳时, 孙元珏, 吴敬波△
201499上海,上海市奉贤区中心医院 肿瘤科(符立平 ,顾春荣,熊佳时,孙元珏);646000四川 泸州,西南医科大学附属医院 肿瘤科(吴敬波)
目的:探讨SOX4与食管癌顺铂耐药的关系及其耐药机制。方法:采用递增药物浓度、间歇冲击作用的方法构建顺铂食管癌耐药细胞株KYSE30/DDP;流式细胞仪检测KYSE30及KYSE30/DDP细胞凋亡情况;Western blot检测SOX4及凋亡相关指标在KYSE30及KYSE30/DDP细胞中的变化;CCK8检测干扰SOX4对KYSE30和KYSE30/DDP细胞顺铂敏感度的影响;流式细胞仪及Western blot检测干扰SOX4对KYSE30/DDP细胞凋亡及相关指标的影响。结果:成功构建了生长状态良好的KYSE30/DDP细胞株,其耐药指数为4.1;KYSE30/DDP细胞凋亡较其亲本细胞KYSE30明显降低(t=-8.414,P<0.05);Western blot结果显示,SOX4在顺铂耐药细胞KYSE30/DDP中的表达高于其亲本细胞KYSE30,KYSE30/DDP细胞中凋亡相关指标Cleaved caspase-3及Cleaved PARP表达低于KYSE30;在KYSE30/DDP细胞中干扰SOX4,其对顺铂的敏感性及凋亡细胞增加(F=625.423,P<0.05),凋亡相关指标Cleaved caspase-3及Cleaved PARP表达增加。结论:SOX4在食管癌顺铂耐药细胞KYSE30/DDP中高表达,并可通过抑制凋亡介导食管癌顺铂耐药。
食管癌; 顺铂; SOX4; 耐药
食管癌是临床上常见的消化道恶性肿瘤,其发病率和死亡率在我国所有恶性肿瘤中分别位居第5和第6位。[1]由于其早期临床症状不明显,多数患者确诊时已属于中晚期,失去手术治疗时机。尽管食管癌治疗的手段不断改进,但晚期患者5年生存率仍不足10%[2],治疗失败的原因主要是局部病灶控制不佳和复发[3]。放化疗是食管癌辅助治疗的重要手段,而肿瘤细胞对化疗药物原发性或继发性耐药是导致患者预后不佳的的重要原因之一。顺铂(DDP)是晚期食管癌化疗常用药物,但耐药常导致化疗失败。因此阐明食管癌耐药的具体分子机制,寻找新的化疗耐药预测靶点,对指导临床治疗及延长患者存活时间至关重要。近年来的研究发现核转录因子SOX4在肿瘤的恶性生物学行为中扮演着重要角色,如促进肿瘤细胞增殖、上皮间质转换(epithelial-mesenchymal transition,EMT)和肿瘤转移,抑制凋亡等[4-5]。同时有文献报道其在口腔鳞状细胞癌中与化疗抵抗相关[6],而SOX4在食管癌中与化疗耐药暂未见报道。因此本研究主要探讨SOX4与食管癌化疗抵抗的关系及相关分子机制,以期为食管癌靶向治疗提供可靠依据。
1 材料与方法
1.1 材料与试剂
食管癌细胞KYSE30购自中科院上海细胞库,顺铂注射液为江苏豪森药业股份有限公司产品,RPMI-1640及胎牛血清均为GIBCO公司产品,CCK8试剂盒为北京全式金生物技术有限公司产品,AnnexinV-FITC/PI细胞凋亡检测试剂盒为南京凯基公司产品,SOX4、Caspase-3、Cleaved caspase-3及Cleaved PARP抗体均为Abcam公司产品。SOX4干扰序列购于上海吉玛基因,干扰靶序列分别为siRNA1 5′-AAGACGACCTGCTCGACCTGA-3′,siRNA2 5′-AACTCCAAACCGGCGCAGAAA-3′,siRNA3 5′-AAGAAGGTGAAGTCCGGCAAC-3′。
1.2 细胞培养
KYSE30细胞采用含 10%胎牛血清的 RPMI 1640 完全培养基,置于 37℃ 5%CO2 培养箱内培养,取生长状态良好的细胞用于实验。
1.3 耐药细胞的构建
采用递增药物浓度、间歇冲击作用的方法构建耐药细胞株[7]。取状态良好并处于对数生长期的KYSE30细胞,从浓度为0.5μM的DDP开始培养,24h后更换为正常培养基,观察到细胞恢复正常生长,再次用初始浓度的DDP培养基培养KYSE30细胞,发现有细胞死亡后换为正常培养基,细胞稳定生长并传代3次,测定IC50。随后提高DDP浓度反复作用直至细胞能在10μMmDDP的培养基中维持培养并连续传代3次,最后测KYSE30的DDP耐药细胞株IC50为20.9,命名为KYSE30/DDP,此过程持续180天。
1.4 CCK8法测定细胞对DDP的敏感度
将细胞以2×104/孔的密度接种于96孔板,24h后将不同浓度的顺铂加入对应培养孔,每种浓度设5个平行复孔。培养24h后弃上清,加入含10%体积分数的CCK-8完全培养液,继续培养2h后在酶标仪上检测各孔450nm波长的吸光度值。细胞抑制率=(1 -加药孔吸光度值/对照孔吸光度值)×100%,所有实验均重复3次统计IC50值。耐药指数(RI)=耐药细胞IC50/亲本细胞IC50。
1.5 Western blot检测细胞中蛋白的表达
收集细胞,用细胞裂解液冰上裂解40min,14 000r/min离心10min,收集上清用BCA法测定蛋白浓度。根据蛋白浓度计算上样体积,20μg蛋白样品在10% SDS-PAGE凝胶中电泳分离、转膜,5%脱脂奶粉封闭1h,一抗4℃孵育过夜,TBST 5min/次摇床洗膜3次,加入辣根过氧化物酶标记的二抗,室温摇床孵育1 h,TBST 5min/次摇床洗膜3次后ECL显色。
1.6 RNA的提取
采用Trizol法提取细胞总RNA。将待提取细胞按每106个细胞加1mL trizol,反复吹打至不粘稠后转移到1.5mL EP管中室温静置5min,每1mL trizol加入0.2mL氯仿,剧烈震荡混匀后室温静置10min,12 000r/min离心10min,吸取上清转移到新的EP管,加入与上清等体积的异丙醇,室温静置5min,12 000r/min离心10min,弃上清后用75%酒精洗涤,12 000r/min离心5min,弃上清后室温风干5min,加20μL DEPC水吹打混匀后测浓度。
1.7 实时荧光定量PCR(reverse transcription-polymerase chain reaction,RT-PCT)检测SOX4的表达
严格按照Takara公司说明书进行操作,采用PrimeScriptTM RTMaster Mix制备cDNA,按RNA 0.5μg,5×PrimeScript RT Master Mix 2μL,加 ddH2O 至总体积10μL后在37℃ 15 min,85℃ 5 s条件下反应生成cDNA,产物加DEPC水稀释 5 倍后用于RT- PCR。通过SYBR Green法进行PCR反应,反应体系参考 SYBR PremixExTaqTM II。反应条件为:95℃预变性30s,95℃变性5s,60℃延伸34s,共40个循环。
1.8 Annexin Ⅴ-FITC/PI 双标法检测细胞凋亡
取生长状态良好的细胞用含10μg/mLDDP的培养基培养24h进行凋亡诱导,随后用不含EDTA的胰酶消化,制备细胞悬液,PBS洗涤2次,2000rpm离心5min,收集1~5×105细胞,加入500μL的Binding Buffer悬浮细胞,加入5μL的FITC标记的AnnexinⅤ混匀后,加入5μL PI混匀,室温避光反应5~15min,流失细胞仪检测。
1.9 统计学分析
采用SPSS 20.0软件进行数据分析。计量资料用均数±标准差表示,两样本均数比较采用t检验, 多组间的均数比较采用单因素方差分析(One-Way ANOVA)。P<0.05为差异有统计学意义。
2 结 果
2.1 KYSE30/DDP耐药细胞株的建立及耐药测定
CCK8结果显示,KYSE30及KYSE30/DDP细胞经不同顺铂药物浓度处理后,IC50值分别为5.1和20.9,见图1A、1B。KYSE30/DDP细胞同时也显示出对5-FU、紫杉醇耐药(RI分别为2.69和2.03,P<0.05,见表1)。

图1 KYSE30耐药及亲代细胞对顺铂的敏感性及IC50比较(A.CCK8检测KYSE30耐药亲代细胞对顺铂的敏感性,B.顺铂IC50比较)

表1 不同药物在KYSE30及KYSE30/DDP中的IC50及耐药指数
2.2 Annexin Ⅴ-FITC/PI 双标法检测KYSE30及KYSE30/DDP细胞凋亡
流式细胞仪检测结果显示,KYSE30/DDP细胞及KYSE亲本细胞早期凋亡率分别为(6.533±0.351,11.300±0.917),与亲本细胞KYSE30相比,KYSE30/DDP细胞凋亡明显降低(t=-8.141,P<0.05),见图2。
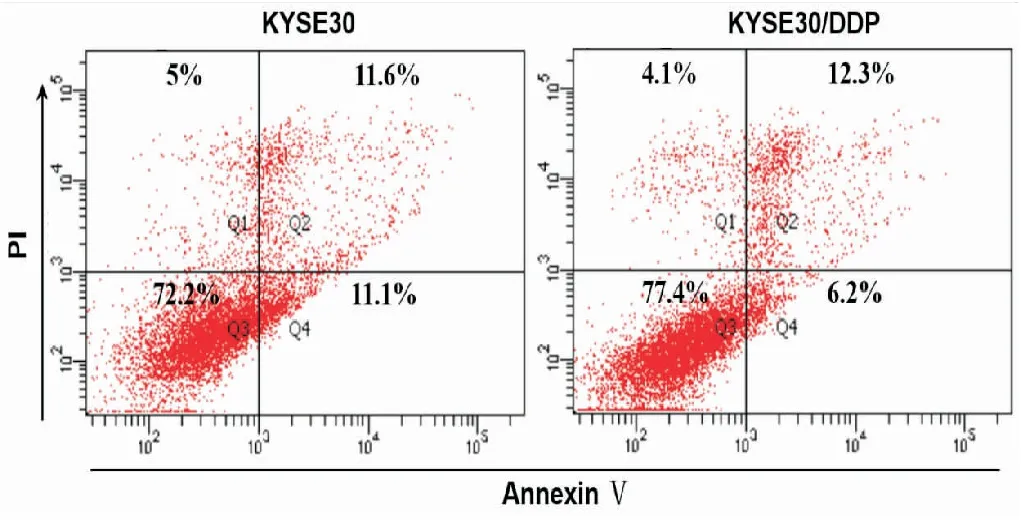
图2 流式细胞仪检测KYSE30及KYSE30/DDP细胞凋亡
2.3 SOX4在KYSE30及KYSE30/DDP细胞中的表达
Western blot及RT-PCR结果均显示,SOX4在KYSE30及KYSE30/DDP细胞中均有表达,顺铂耐药细胞KYSE30/DDP中SOX4的表达高于其亲本细胞KYSE30,见图3。

图3 Western blot及RT-PCR检测SOX4在KYSE30耐药细胞及亲代细胞中的表达(A.Western blot检测;B.SOX4蛋白表达相对变量;C.RT-PCR检测mRNA表达)
2.4 KYSE30及KYSE30/DDP细胞中凋亡相关指标的变化
Western blot结果显示,KYSE30/DDP细胞中凋亡相关指标Cleaved caspase-3及Cleaved PARP的表达低于其亲本细胞KYSE30,见图4。

图4 Western blot检测凋亡相关指标在KYSE30耐药细胞及亲代细胞中的表达
2.5 SOX4对KYSE30/DDP细胞顺铂敏感度的影响
RT-PCR及Western blot结果显示SOX4的干扰片段干扰均有效,其中siRNA-2干扰效率最高,选取siRNA-2干扰片段进行后续实验,见图5A、5B。CCK8结果显示,在KYSE30亲本细胞及耐药细胞中干扰掉SOX4,其对顺铂的敏感性增加(F=198.342,P<0.05),在KYSE30/DDP耐药细胞中干扰SOX4的表达可以逆转其对顺铂的耐药(F=625.423,P<0.05),见图5C、5D。
2.6 Annexin Ⅴ-FITC/PI 双标法检测SOX4对KYSE30/DDP细胞凋亡的影响
流式细胞仪检测结果显示,KYSE30/DDP细胞早期凋亡率为(5.167±0.321),KYSE30/DDP细胞中干扰掉SOX4后其早期凋亡率为(7.333±0.513),凋亡明显增加(P<0.05),见图6。
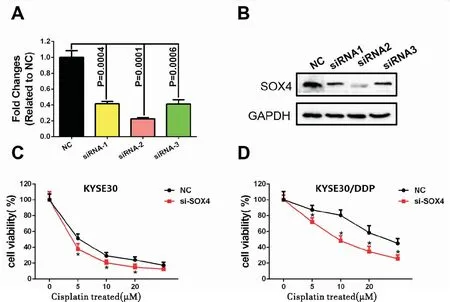
图5 A、B分别为RT-PCR和Western blot检测SOX4的干扰效率;C、D分别为CCK8检测KYSE30亲本细胞和耐药细胞中干扰SOX4后顺铂敏感性的变化
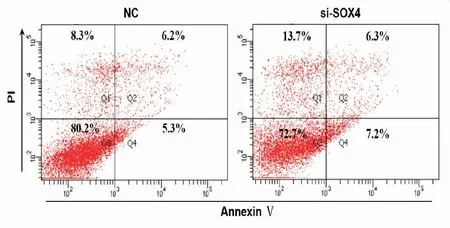
图6 流式细胞仪检测干扰SOX4后KYSE30/DDP细胞凋亡的变化
2.7 SOX4对KYSE30/DDP细胞中凋亡指标的影响
Western blot结果显示,在KYSE30/DDP细胞中干扰掉SOX4,Cleaved caspase-3及Cleaved PARP表达增加,见图7。

图7 Western blot检测在耐药细胞KYSE30/DDP中干扰SOX4的表达对凋亡相关指标的影响
3 讨 论
食管癌是全世界高发的恶性肿瘤之一,死亡率高居各种恶性肿瘤第6位,五年生存率不足10%。2012年,全球约有456 000新发病例和400 000死亡病例,严重威胁人类健康[8]。根据组织学分型,食管癌分为食管鳞癌和食管腺癌。在亚洲,食管癌以鳞状细胞癌为主,而美国则以腺癌居多[8-9]。对于早期食管癌,手术治疗是最佳选择。但因食管癌早期症状不明显,多数患者发现时已处于中晚期。顺铂是一种经典的细胞毒性化疗药,被广泛应用于多种实体肿瘤的一线治疗,包括睾丸癌、卵巢癌、结直肠癌、膀胱癌、肺癌等[10]。在食管癌中,无论是术前的新辅助化疗或者联合放化疗,顺铂均能显著改善患者预后[11-12]。但是原发性或继发性的化疗抵抗,导致长期生存率不足25%[13]。因此阐明食管癌顺铂耐药的机制,对解决化疗抵抗瓶颈,延长患者预后具有重要意义。
转录因子SOX4属于SRY(sex-determining region Y)家族成员之一,因与高迁移族蛋白(high-mobility-group,HMG)保守区高度同源,命名为SOX(SRY-related high-mobility-group-box)亚族[14]。SOX4被发现在多种肿瘤中高表达,如乳腺癌[15-16]、前列腺癌[17-18]、结直肠癌[19-20]等。研究证实,SOX4是TGF-β的下游,TGF-β可通过SOX4以及其下游信号通路促进肿瘤上皮间质转化(epithelial-mesenchymal transition,EMT),从而参与肿瘤侵袭转移[16,19-20]。前列腺癌中,Bilir等发现SOX4参与多条肿瘤相关信号传导,如PI3K/AKT通路,Wnt/β-catenin通路以及AR通路;同时,SOX4又是PTEN/PI3K/AKT/mOTR的下游,即SOX4形成信号通路相关正反馈回路,促进前列腺癌进展[17]。无独有偶,在食管癌中,SOX4与EZH2和HDAC3组成抑制复合物,结合到miR-31的启动子区域,通过表观遗传学途径抑制miR-31的表达。同时,SOX4本身又是miR-31的靶点,通过正反馈环路,促进食管癌转移[21]。除了参与肿瘤的侵袭转移,SOX4还参与其他多种恶性生物学行为,包括耐药和凋亡。宫颈癌中,SOX4通过上调多重耐药基因ABCG2的表达,降低CaSki细胞的顺铂化疗敏感性[22]。口腔鳞状细胞癌中,体外实验证实SOX4的敲除增加HNSCC细胞对放疗的敏感性和顺铂化疗的敏感性。肿瘤耐药的具体分子机制仍不清楚,文献报道凋亡是肿瘤耐药的常见机制之一。SOX4被证实也参与肿瘤的凋亡调控。Hur等报道在肝癌中,SOX4可抑制p53诱导的凋亡,是肝癌患者不良预后的有效分子标志物[23]。在腺囊癌细胞ACC3中敲除SOX4的表达后,细胞凋亡比例较对照组提高73%,证实SOX4可能是抑制细胞凋亡、促进细胞存活的关键因子[24]。然而,迄今为止尚无SOX4与食管癌顺铂耐药的相关研究,其在顺铂耐药中的作用与机制亟需进一步探索。
本研究中,通过构建顺铂耐药株KYSE30/DDP,证实耐药株KYSE30/DDP具有更低的顺铂化疗敏感性和更高的抗凋亡能力,实验发现较亲代细胞KYSE30相比,SOX4在耐药株中的表达显著上调。通过siRNA特异性干扰SOX4内源性表达,证实干扰SOX4可增加顺铂药敏,并部分逆转耐药株的顺铂抗性。同时SOX4的干扰促进凋亡指标Cleaved caspase-3及Cleaved PARP的表达,说明SOX4介导顺铂耐药的机制可能与其抗凋亡能力相关。通过本研究,明确了SOX4在食管癌顺铂耐药中的关键作用,抑制食管癌细胞SOX4的表达有望成为解决化疗抵抗、改善病人预后的新方向。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
[1] Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[2] Thomas G, Paulson BJR. Focus on Barrett’s esophagus and esophageal adenocarcinoma[J]. Cancer cell,2004,11(1):11-16.
[3] 刘锐锋,张秋宁,魏世鸿,等. IMRT与3D-CRT治疗胸部食管癌的剂量学评价[J]. 肿瘤预防与治疗,2015,28(3):117-121.
[4] Zhou Y, Wang X, Huang Y, et al. Down-regulated SOX4 expression suppresses cell proliferation, metastasis and induces apoptosis in xuanwei female lung cancer patients[J]. Journal of Cellular Biochemistry,2015,116(6):1007-1018.
[5] Zhang F, Luo Y, Shao Z, et al. MicroRNA-187, a downstream effector of TGFβ pathway, suppresses Smad-mediated epithelial-mesenchymal transition in colorectal cancer[J]. Cancer Letters,2016,373(2):203-213.
[6] Yoon TM, Kim S, Cho WS, et al. SOX4 expression is associated with treatment failure and chemoradioresistance in oral squamous cell carcinoma[J]. BMC Cancer,2015,15(1):888.
[7] 李敏,王志举,李文涛,等. 人食管癌顺铂耐药细胞系Ec9706/cDDP的建立及其生物学特征[J]. 世界华人消化杂志,2006,14(34):3257-3260.
[8] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA: A Cancer Journal for Clinicians,2015,65(2):87-108.
[9] Arnold M, Soerjomataram I, Ferlay J, et al. Global incidence of oesophageal cancer by histological subtype in 2012[J]. Gut,2015,64(3):381-387.
[10]Galluzzi L, Senovilla L, Vitale I, et al. Molecular mechanisms of cisplatin resistance[J]. Oncogene,2012,31(15):1869-1883.
[11]Medical RC. Surgical resection with or without preoperative chemotherapy in oesophageal cancer: a randomised controlled trial[J]. The Lancet,2002,359(9319):1727-1733.
[12]Matsuda S, Tsubosa Y, Niihara M, et al. Comparison of transthoracic esophagectomy with definitive chemoradiotherapy as initial treatment for patients with esophageal squamous cell carcinoma who could tolerate transthoracic esophagectomy[J]. Annals of Surgical Oncology,2015,22(6):1866-1873.
[13]Enzinger PC, Mayer RJ. Esophageal cancer[J]. N Engl J Med,2003,349(23):2241-2252.
[14]Bowles J, Schepers G, Koopman P. Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators[J]. Dev Biol,2000,227(2):239-255.
[15]Lee H, Goodarzi H, Tavazoie SF, et al. TMEM2 is a SOX4 regulated gene that mediates metastatic migration and invasion in breast cancer[J]. Cancer Res,2016,76(17):8105-8110.
[16]Tiwari N, Tiwari VK, Waldmeier L, et al. Sox4 is a master regulator of epithelial-mesenchymal transition by controlling Ezh2 expression and epigenetic reprogramming[J]. Cancer Cell,2013,23(6):768-783.
[17]Bilir B, Osunkoya AO, Wiles WT, et al. SOX4 is essential for prostate tumorigenesis initiated by PTEN ablation[J]. Cancer Res,2016,76(5):1112-1121.
[18]Liu P, Ramachandran S, Ali SM, et al. Sex-determining region Y box 4 is a transforming oncogene in human prostate cancer cells[J]. Cancer Res,2006,66(8):4011-4019.
[19]Bu P, Wang L, Chen KY, et al. MiR-1269 promotes metastasis and forms a positive feedback loop with TGF-beta[J]. Nat Commun,2015,6:6879.
[20]Zhang F, Luo Y, Shao Z, et al. MicroRNA-187, a downstream effector of TGFbeta pathway, suppresses Smad-mediated epithelial-mesenchymal transition in colorectal cancer[J]. Cancer Lett,2016,373(2):203-213.
[21]Koumangoye RB, Andl T, Taubenslag KJ, et al. SOX4 interacts with EZH2 and HDAC3 to suppress microRNA-31 in invasive esophageal cancer cells[J]. Molecular Cancer,2015,14(1):24.
[22]Sun R, Jiang B, Qi H, et al. SOX4 contributes to the progression of cervical cancer and the resistance to the chemotherapeutic drug through ABCG2[J]. Cell Death and Disease,2015,6(11):e1990.
[23]Hur W, Rhim H, Jung CK, et al. SOX4 overexpression regulates the p53-mediated apoptosis in hepatocellular carcinoma: clinical implication and functional analysis in vitro[J]. Carcinogenesis,2010,31(7):1298-1307.
[24]Pramoonjago P, Baras AS, Moskaluk CA. Knockdown of Sox4 expression by RNAi induces apoptosis in ACC3 cells[J]. Oncogene,2006,25(41):5626-5639.
ExperimentalStudyofSOX4MediatedCisplatinResistanceinEsophagusCancerbyInhibitingApoptosis*
Fu Liping1, Gu Chunrong1, Xiong Jiashi1, Sun Yuanjue1, Wu Jingbo2△
(1.DepartmentofOncology,CentralHospitalofShanghaiFengxianDistrict,Shanghai201499,China;2.DepartmentofOncology,TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,Sichuan,China)
Objective: To explore the relationship between cisplatin resistance and the expression of SOX4, and related drug resistance mechanisms in esophagus cancer.Methods: The cisplatin resistance cell line KYSE30/DDP was established in culture by a program of treating KYSE30 parent cells in culture with increasing concentration of cisplatin. The apoptosis of KYSE30 and KYSE30/DDP cells were determined by flow cytometry. Western blot detected the expression of SOX4 and apoptosis related indicators in KYSE30 and KYSE30/DDP cells. The influence of drug sensitively by knockdown the expression of SOX4 in KYES30 and KYSE30/DDP cell was measured by CCK8 assay.The change of apoptosis and related indicators in KYSE30/DDP cell after knockdown the expression of SOX4 was evaluated by western blot and flow cytometry.Results: CCK8 assay showedthe cisplatin resistance cell line KYSE30/DDP was successfully built, and the resistance index was 4.1. The apoptosis of KYSE30/DDP cell was significantly decreased compared with KYSE30 parent cell(P<0.05). Western blot indicated the expression of SOX4 are higher in KYSE30/DDP cell compared to its parent cell. And the expression of apoptosis related indicators lower in KYSE30/DDP cell. Knock down the expression of SOX4 in KYSE30/DDP cellfacilitated thecisplatin sensitivity andpromoted cell apoptosis(P<0.05),with the increase expression of apoptosis related indicators .Conclusion: SOX4 was high-expression in cisplatin resistance cell KYSE30/DDP, and mediated cisplatin resistance by inhibiting apoptosis.
Esophagus Cancer;SOX4;Apoptosis;Cisplatin Resistance
2016- 11- 15 [
] 2017- 02- 20
*泸州市政府-西南医科大学联合项目(编号:2013LZLY-J40)
△吴敬波,E-mail:wjb6147@163.com
R735.1;R730.53
A
10.3969/j.issn.1674- 0904.2017.03.002
Fu LP, Gu CR, Xiong JS, et al. Experimental study of SOX4 mediated cisplatin resistance in esophagus cancer by inhibiting apoptosis[J]. J Cancer Control Treat, 2017,30(3):158-163 .[ 符立平 ,顾春荣,熊佳时,等. SOX4抑制凋亡介导食管癌顺铂耐药的实验研究 [J].肿瘤预防与治疗,2017,30(3):158-163.]
