水溶性Salen-Pd配合物纯水相中催化Suzuki-Miyaura反应
2017-07-10刘洋刘亚帅刘岩刘平马晓伟薛梅
刘洋,刘亚帅,刘岩,刘平*,马晓伟,薛梅
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,新疆 石河子 832003)
水溶性Salen-Pd配合物纯水相中催化Suzuki-Miyaura反应
刘洋,刘亚帅,刘岩,刘平*,马晓伟,薛梅
(石河子大学化学化工学院/新疆兵团化工绿色过程重点实验室,新疆 石河子 832003)
联芳烃类化合物作为一种重要的结构单元,在天然产物、医药中间体、农药和液晶等方面的应用广泛,过渡金属钯催化的Suzuki-Miyaura偶联反应是构建芳基碳-碳键的重要方法之一,发展纯水相中钯催化C-C偶联具有重要的理论意义和应用价值。本文设计合成了一种水溶性好、结构稳定的Salen-Pd配合物,并将其应用于纯水相中催化Suzuki-Miyaura反应,实现了芳基C-C键的有效构建;邻位带有空间位阻的底物(溴代芳烃或芳基硼酸)都能够顺利的发生偶联反应,反应产率在中等和优秀之间;最佳催化反应条件为:溴代芳烃 (0.5 mmol),芳基硼酸 (0.75 mmol),三乙胺 (1.0 mmol),Salen-Pd配合物 (1 mol%),H2O(1.0 mL),反应温度100℃,反应时间3 h。该体系具有反应条件温和,底物适用范围广,原料廉价易得,不需要任何的有机溶剂、表面活性剂或相转移催化剂等优点。
钯催化;Suzuki-Miyaura反应;联苯化合物;水
化学给人类带来巨大的物质文明,同时化学反应及相关的化学工业也成为当今世界严重污染的主要来源,其中绝大部分来自于反应过程中使用的大量有机溶剂。为实现化学工业及整个社会的可持续发展,保护人类赖以生存的生态环境,必须发展绿色化学,从根本上减少并逐渐消除化学反应及化工产品对环境造成的污染。
过渡金属催化的Suzuki-Miyaura偶联反应由于有机硼试剂毒性低、稳定性好、适用范围广,易于制备等优点一直是构建芳基碳-碳的有效方法[1],并广泛用于药物、天然产物、精细化工中间体及功能材料的合成中[2]。近年来,Buchwald,Fu,Nolan,以及Beller等课题组在钯催化的Suzuki-Miyaura偶联反应方面取得了较大的进展[3-6],但是目前大多数研究是在有机溶剂中进行的,并使用有毒的、昂贵的膦配体。目前,随着绿色化学的不断发展,水作为无毒、廉价易得的环境友好溶剂在有机合成中得到了广泛的应用,水作为环境友好溶剂越来越成为合成化学的研究热点[7]。另外,配位催化具有反应条件温和、速度快、选择性好等优点,符合绿色化学的发展要求。因此,开发出适宜的催化剂,实现碳–碳键形成反应能够在水相中顺利进行,具有良好的应用前景和重要的理论意义。本课题组长期致力于水相中过渡金属催化的C-C键形成反应的研究[8-13],本文利用水溶性的Salen-Pd配合物在纯水相中对催化Suzuki-Miyaura偶联反应进行了探索。
1 实验部分
1.1 实验仪器与试剂
1H NMR(400 MHz)以 TMS 为内标,用 Bruker-DPX 400型核磁共振仪(CDCl3为溶剂);甲苯用金属钠干燥、蒸馏;薄层色谱板为青岛海洋化工厂GF254硅胶板;柱层析硅胶为青岛海洋化工厂生产,200-300目;其它化学试剂均为分析纯或化学纯购于阿达玛斯-泰坦科技有限公司。
1.2 Salen-Pd钯配合物的合成与表征
先取1 mmol的邻苯二胺与1 mmol的水杨醛-5-磺酸钠溶于5 mL的50%乙醇中,60℃下搅拌5 h;再用 5 mL的 50%乙醇溶解 0.5 mol的 Pd(OAc)2后,将Pd(OAc)2溶液缓慢滴加到邻苯二胺与水杨醛-5-磺酸钠的溶液中,之后在60℃下反应2 h。反应完成后冷却到室温,有固体析出;抽滤,并用丙酮洗涤,得到Salen-Pd(II)配合物,产率65%。
1H NMR(400 MHz,DMSO-d6):δ 9.29(s,2H),8.44-8.41(m,2H),8.11(s,2H),7.63-7.60(m,2H),7.45-7.42(m,2H),6.96(d,J=8.0 Hz,2H)ppm。13C NMR(100 MHz,DMSO-d6):δ 166.50,155.69,143.60,136.39,134.52,133.72,128.76,120.36,119.7 5,117.87 ppm。元素分析C20H12N2Na2O8PdS2,理论值(%):C,38.44;H,1.94;N,4.48;S,10.26; 实际值(%):C,38.36;H,1.96;N,4.52;S,10.18。HRMS(ESI):m/z[M-2Na+3H]+理论值:580.9306,实际值:580.9299。
1.3 实验步骤及产物的结构表征
1.3.1 Salen-Pd钯配合物催化Suzuki-Miyaura反应的一般过程
将溴代芳烃(0.5 mmol)、芳基硼酸 (0.75 mmol)、三乙胺 (1.0 mmol)做碱,配合物1(1 mol%)、H2O(1.0 mL)加入到25 mL Schlenk反应管中,加热到100℃搅拌反应5 h。冷却到室温后,向反应管中加入水,用乙酸乙酯萃取(3×10 mL),合并乙酸乙酯层,用无水Na2SO4干燥,滤液浓缩,柱层析分离提纯(石油醚或石油醚/乙酸乙酯)得到产物2a-2u。
1.3.2 目标化合物的结构表征
2a:4-Methoxy-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.54(t,J=8.8Hz,4H),7.41(t,J=7.6 Hz,2H),7.23(t,J=7.6 Hz,1H),6.97(d,J=8.8 Hz,2H),3.85(s,3H)。
2b:4-Chloro-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.56–7.48(m,4H),7.47-7.32(m,5H)。
2c:4-Nitro-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ8.33-8.28(m,2H),7.76-7.71(m,2H),7.63(m,2H),7.53-7.42(m,3H)。
2d:1-([1,1'-Biphenyl]-4-yl)ethanone。1H NMR(400 MHz,CDCl3):δ 8.05–8.03(m,1H),8.03–8.01(m,1H),7.70–7.69(m,1H),7.68-7.67(m,1H),7.64(t,J=1.7 Hz,1H),7.62(q,J=1.8 Hz,1H),7.50-7.44(m,2H),7.43-7.37(m,1H),2.64(s,3H)。
2e:3-Methoxy-1,1'-biphenyl。1H NMR(400 MHz,DMSO-d6):δ 7.68-7.64(m,2H),7.48-7.43(m,2H),7.40-7.34(m,2H),7.22(m,1H),7.19-7.17(m,1H),6.94(m,1H),3.82(s,3H)。
2f:3-Chloro-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.56(m,1H),7.55-7.52(m,2H),7.43(m,3H),7.37-7.29(m,3H)。
2g:2-Methoxy-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ 7.54(d,J=7.1 Hz,2H),7.36(dt,J=14.3,7.5 Hz,5H),7.01(dd,J=24.4,7.7 Hz,2H),3.79(s,3H)。
2h:2-Chloro-1,1'-biphenyl。1H NMR(400 MHz,DMSO-d6):δ7.58-7.53(m,1H),7.48-7.37(m,8H)。
2i:[1,1'-Biphenyl]-2-amine。1H NMR(400 MHz,DMSO-d6):δ7.47-7.39 (m,4H),7.35-7.31(m,1H),7.04(m,1H),6.98(dd,J=7.5,1.6Hz,1H),6.78-6.74(m,1H),6.64(td,J=7.4,1.2 Hz,1H),4.74(s,2H)。
2j:4-Fluoro-4'-methoxy-1,1'-biphenyl。1H NMR(400 MHz,DMSO-d6):δ7.73-7.65(m,8H),7.50-7.46(m,2H),7.38(d,J=7.4Hz,1H),7.06-7.03(m,2H),3.81(s,3H)。
2k:4-Methoxy-4'-(trifluoromethyl)-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.51-7.44(m,4H),7.12-7.06(m,2H),6.99-6.97 (m,1H),6.96-6.94(m,1H),3.84(s,3H)。
2l:4-Methoxy-4'-methyl-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.53-7.47(m,2H),7.45(d,J=8.0 Hz,2H),7.22(d,J=7.8 Hz,2H), 6.99-6.93(m,2H),3.84(d,J=0.5 Hz,3H),2.38(s,3H)。
2m:4-Methoxy-4'-propyl-1,1'-biphenyl。1H NMR(400MHz,DMSO-d6):δ7.59-7.55(m,2H),7.52-7.49(m,2H),7.25-7.22 (m,2H),7.02-6.98(m,2H),3.78(s,3H),2.59-2.54(m,2H),1.64-1.57(m,2H),0.91(t,J=7.3 Hz,3H)。
2n:4'-Methoxy-3-methyl-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.54-7.50(m,2H),7.37-7.29(m,3H),7.12(d,J=7.0 Hz,1H),6.98-6.95(m,2H),3.84(s,3H),2.41(s,3H)。
2o:2-(4-Methoxyphenyl)naphthalene。1H NMR(400 MHz,CDCl3):δ8.05(s,1H), 8.03(s,1H),7.67-7.66(m,1H),7.65(d,J=3.3 Hz,2H),7.63(s,1H),7.32(dd,J=8.8,0.9 Hz,2H),2.64(s,3H)。
2p:1-(2'-Methyl-[1,1'-biphenyl]-4-yl)ethanone。1 H NMR(400 MHz,CDCl3):δ8.04-7.99(m,2H),7.45-7.40(m,2H),7.30-7.20(m,4H),2.65-2.63(m,3H),2.27(s,3H)。
2q:2-Methyl-4'-nitro-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ8.30-8.29 (m,1H),8.28-8.26(m,1H),7.51-7.50(m,1H),7.49-7.48(m,1H),7.34-7.26(m,3H),7.23-7.20(m,1H),2.27(s,3H)。
2r:4'-Methoxy-2-methyl-1,1'-biphenyl。1H NMR(400 MHz,DMSO-d6):δ7.28-7.21(m,5H),7.16(m,1H),7.01-6.97(m,2H)。
2s:3'-Chloro-2-methyl-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.31-7.29(m,3H),7.26-7.23(m,2H),7.23-7.19(m,1H),7.19-7.16(m,2H),2.24(d,J=3.0 Hz,3H)。
2t:2-Methoxy-2'-methyl-1,1'-biphenyl。1H NMR(400 MHz,CDCl3):δ7.40(m,1H),7.33-7.27(m,3H),7.23(m,2H),7.07(m,1H),7.02(d,J=8.3 Hz,1H),3.82(s,3H),2.20(s,3H)。
2u:2'-Methyl-[1,1'-biphenyl]-2-amine。1H NMR(400 MHz,CDCl3):δ7.30-7.13(m,5H),7.00(m,1H),6.84-6.73(m,2H),3.47(s,2H),2.17(s,3H)。
2 结果与分析
2.1 条件优化
选取苯硼酸和4-甲氧基溴苯作为模型反应底物,筛选Salen-Pd催化Suzuki-Miyaura偶联反应的最佳催化体系,结果如表1所示。

表1 反应条件的优化aTab.1 Optimized reaction conditionsa
由表1可知:
(1)以1 mol%的Salen-Pd为催化剂,K3PO4为碱,水为溶剂,80℃下反应3 h后,该反应仅得到40%的产率(序号1)。
(2)选取强碱NaOH或弱碱Na2CO3作为碱时,产率略有提高,分别获得53%和59%的收率(序号2和3)。相同反应条件下,利用Cs2CO3和Et3N作为碱时,则该偶联反应产率得到明显提高,分别获得81%和85%的收率(序号4和5)。
(3)当反应温度降低到60℃,4-甲氧基溴苯转化不完全,仅得到73%的分离产率(序号6);当反应温度提高到100℃时,产率可达到98%(序号8)。
(4)随着催化剂量的降低,偶联反应的产率也随之有所下降(序号9和10)。
(5)综上所述,确定最佳反应条件为:1 mol%Salen-Pd为催化剂,苯硼酸0.75 mmol、4-甲氧基溴苯为0.5 mmol、2.0 mol/L当量的Et3N做碱,溶剂为水(1 mL),反应温度为100℃。
2.2 底物拓展
在最优催化条件下,对钯催化Suzuki-Miyaura偶联反应底物进行了拓展研究。首先,研究了Salen-Pd催化不同溴代芳烃与苯硼酸Suzuki–Miyaura反应,结果如表2所示。由表2可知:
(1)对于对位取代的溴代芳烃底物,电子效应对Salen-Pd催化的偶联反应结果没有明显的影响,无论是供电子基团还是吸电子基团底物都能够与苯硼酸顺利发生反应,并给出82%-99%(2a-2d)的较高产率。
(2)对于间位取代的溴代芳烃与苯硼酸反应时,带有供电子基的溴代芳烃产率明显高于吸电子基取代的溴代芳烃,分别给出89%(2e)和74%(2f)的产率。
(3)对于邻位取代的溴代芳烃也存在相似的反应规律,4-甲氧基溴苯和4-氨基溴苯与苯硼酸反应分别给出82%(2g)和86%(2i)的产率,而2-氯溴苯仅仅给出63%(2h)的产率。
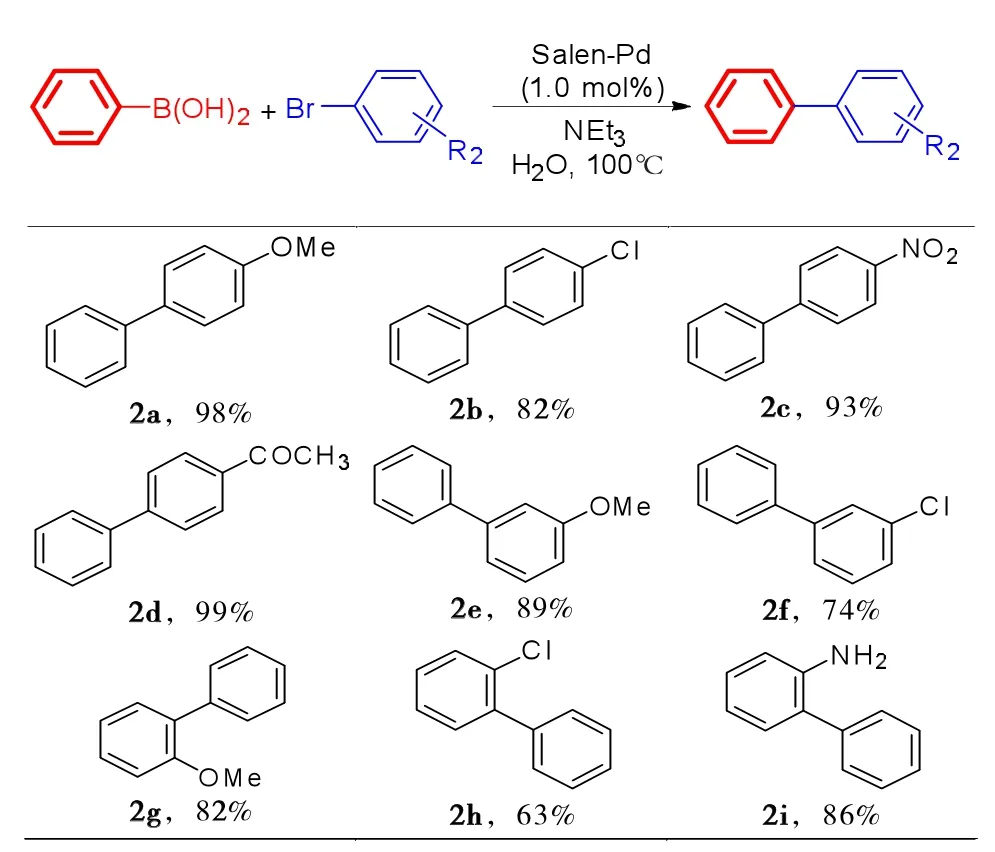
表2 Salen-Pd催化溴代芳烃与苯硼酸Suzuki–Miyaura 反应a,bTab.2 Salen-Pd catalysed theSuzuki-Miyaura reactions of arylbromides with phenylboronic acida,b
其次,考察Salen-Pd催化对溴苯甲醚与不同芳基硼酸Suzuki–Miyaura反应,结果如表3所示。由表3可知:
(1)4-位连有吸电子基团的芳基硼酸底物,如4-氟苯硼酸、4-三氟甲基硼酸与4-甲氧基溴苯反应,分别给出98%(2j)和91%(2k)的优秀产率;
(2)对于供电子基团取代的硼酸,如4-甲基苯硼酸与4-甲氧基溴苯反应,也能够给出93%(2l)的优秀产率;但是,4-丙基苯硼酸作为反应底物时,仅得到66%(2m)的产率,这可能是由4-丙基苯硼酸在水中较低的溶解度导致的。
(3)间位甲基取代苯硼酸与4-甲氧基溴苯反应,只得到51%(2n)的产率;同时,我们发现2-萘基硼酸也能够有效的与4-甲氧基溴苯发生作用,得到78%(2o)的产率。
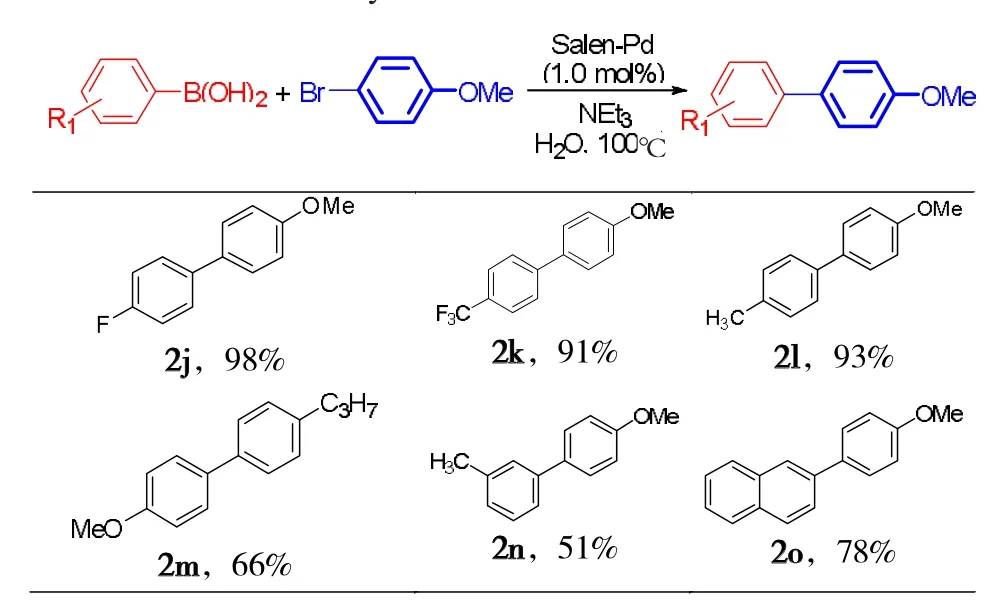
表3 Salen-Pd催化对溴苯甲醚与芳基硼酸Suzuki–Miyaura 反应a,bTab.3 Salen-Pd catalysed the Suzuki-Miyaura reactions of 1-bromo-4methyoxylbenzene with arylboronic acidsa,b
最后,分析了Salen-Pd催化不同溴代芳烃与邻甲基苯硼酸Suzuki–Miyaura反应,结果如表4所示。
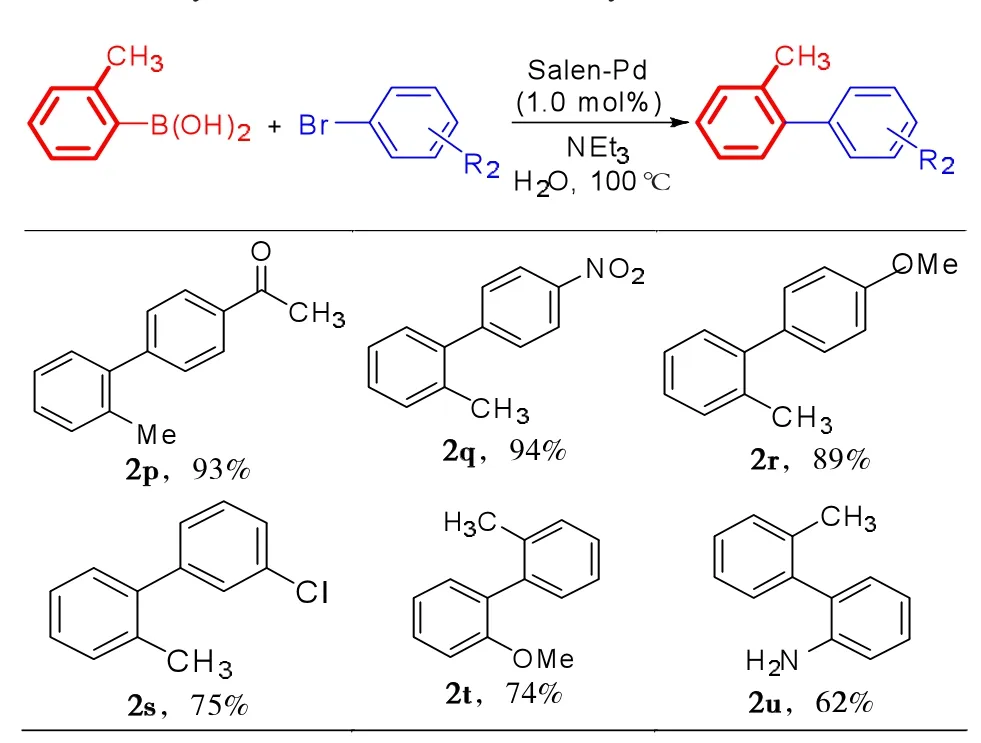
表4 Salen-Pd催化溴代芳烃与邻甲基苯硼酸Suzuki–Miyaura 反应a,bTab.4 Salen-Pd catalysed the Suzuki-Miyaura reaction of arylbromides with ortho-tolyboronic acida,b
由表4可知:
(1)对于取代的溴代芳烃,4-位连有吸电子基团的底物反应活性明显高于4-位连有给电子基团的底物。例如,4-溴苯乙酮和4-硝基溴苯与2-甲基苯硼酸反应分别给出93%(2p)和94%(2q)的产率;4-位连有供电子基团的底物反应活性略低一些,如4-甲氧基溴苯底物,但也能够获得89%(2r)的良好产率。
(2)对于间位氯基团取代的溴苯与2-甲基苯硼酸发生偶联反应可得到75%(2s)的中等产率。
(3)当邻位具有一定空间位阻基团取代的溴代芳烃与2-甲基苯硼酸发生反应时,2t和2u产率略有下降,分别获得74%和62%的产率。
3 结论
(1)在水溶性Salen-Pd催化下,成功实现了纯水相中溴代芳烃与芳基硼酸的Suzuki-Miyaura偶联反应。这一方法不仅适用于间位或对位芳烃底物,也适用于邻位具有空间位阻基团取代的芳烃底物,产率在51-99%之间。其最佳催化反应条件为:溴代芳烃 (0.5 mmol),芳基硼酸 (0.75 mmol),三乙胺 (1.0 mmol)做碱,Salen-Pd配合物 (1 mol%),H2O (1.0 mL),反应温度100℃,反应时间3 h。
(2)上述催化体系具有反应条件温和,底物适用范围广,原料廉价易得,反应能够在纯水相中进行等优点,在联苯类液晶化合物的绿色合成方面具有重要的应用前景和实用价值。
4 讨论
(1)本研究实现了纯水相中钯催化的Suzuki偶联反应。与有机溶剂中卟啉钯或金属铁盐催化的Suzuki偶联反应[10-11]相比,以水作为溶剂具有绿色、无毒、廉价易得、使用安全等优点,而且水相中的反应产率与有机相中的产率相当,反应成本大大降低,反应体系更加绿色,符合绿色化学的发展要求。
(2)相关研究[3-6]多数采用有毒、昂贵的有机膦化合物作为配体,虽然获得了较好的催化效果,但是有机膦配体对空气较明感,反应需要在无水无氧的条件下进行,反应条件较为苛刻;而本文中采用了2N2O的Salen型化合物作为配体,成功实现了水相中钯催化芳基C-C键的形成,催化剂对空气和水稳定,不需要惰性气体保护同样获得良好的催化效果。
(3)对于底物的适用范围,很少有报道具有空间位阻的溴代芳烃或者是芳基硼酸底物在水相中实现偶联反应,主要是因为催化剂对水分子比较明感,容易发生分解,从而失去催化活性。本文采用的对空气和水稳定的Salen-Pd配合物作为催化剂,成功解决了这一难题。该体系催化反应速率很快,即使对于邻位带有空间位阻的底物,偶联反应也能够在3 h内顺利完成,产率为62%-94%。
(4)水相中钯催化的Suzuki偶联多数针对碘代芳烃与芳基硼酸的反应,对于廉价易得的溴代芳烃底物催化效果并不理想,一般产率为43%-90%[7],因此限制了水相中钯催化Suzuki偶联反应的进一步发展,而本研究采用的催化体系成功实现了溴代芳烃与芳基硼酸的偶联反应,产率在51%-98%之间。
(5)尽管本研究实现了钯催化具有空间位阻的溴代芳烃与芳基硼酸在水相中的Suzuki偶联反应,但是对于水相中活性较低的氯代芳烃底物的偶联还未能实现;此外,对催化剂的循环使用也是今后研究的重点内容。
[1] Miyaura N,SuzukiA.Palladium-catalyzed cross-coupling reactions of organoboron compounds[J].Chem Rev,1995,95(7):2457-2483.
[2] Stanforth S P.Catalytic cross-coupling reactions in biaryl synthesis[J].Tetrahedron,1998,54:263-303.
[3] Bruno N C,Tudge M T,Buchwald S L.Design and preparation of new palladium precatalysts for C–C and C–N cross-coupling reactions[J].Chem Sci,2013,4:916-920.
[4] Kudo N,Perseghini M,Fu G C.A versatile method for Su zuki crosscoupling reactions of nitrogen heterocycles[J].Angew Chem Int Ed,2006,45:1282-1284.
[5] Marion N,Navarro O,Mei J,et al.Modified (NHC)Pd(allyl)Cl(NHC=N-heterocyclic carbene)complexes for roomtemperature Suzuki Miyaura and Buchwald-Hartwig reactions[J].J Am Chem Soc,2006,128:4101-4111.
[6] Zapf A,Beller M.Palladium/phosphite catalyst systems for efficient cross coupling of aryl bromides and chlorides with phenylboronic acid[J].Chem Eur J,2000,6:1830-1833.
[7] Li C J,Chen L.Organic chemistry in water[J].Chem Soc Rev,2006,35:68-82.
[8] Ma X,Gu N,Liu Y,et al.One-pot synthesis of polyfluoroterphenyls via palladium-catalyzed Suzuki-Miyaura coupling of chlorobromobenzene and C-H bond functionalization of perfluoroarenes[J].Appl Organomet Chem,2015,29(1):50-56.
[9] Ma X,Liu Y,Liu P,et al.Palladium-catalyzed direct arylation of polyfluoroarene and facile synthesis of liquid crystal compounds[J].Appl Organomet Chem,2014,28(3):180-185.
[10] 刘岩,谢建伟,代斌,等.卟啉钯配合物催化Suzuki-Miyaura偶联反应的研究[J].石河子大学学报(自然科学版),2012,30(5):630-634.Liu Yan,Xie Jianwei,Dai Bin,et al.Suzuki-Miyaura reactions catalyzed by porphyrins palladium complexes[J].Journal of Shihezi University(Natural Science Edition),2012,30(5):630-634.
[11] 刘岩,谷宁宁,刘亚帅,等.简单铁盐催化的Suzuki-Miyaura偶联反应研究[J].石河子大学学报(自然科学版),2014,32(1):93-96.Liu Yan,Gu Ningning,Liu Yashuai,et al.Simple iron salts catalyzed Suzuki-Miyaura coupling reactions [J].Journal of Shihezi University (Natural Science Edition),2014,32(1):93-96.
Water-soluble Salen-Pd complex catalyzed Suzuki-Miyaura reaction in pure water
LIU Yang,LIU Yashuai,LIU Yan,LIU Ping*,MA Xiaowei,XUE Mei
(School of Chemistry and Chemical Engineering/Key Laboratory for Green Processing of Chemical Engineering of Xinjiang Bingtuan,Shihezi University,Shihezi,Xinjiang 832003,China)
Biaryl units as important building blocks have been found in natural products, pharmaceutical intermediates,pesticides,and liquid crystals.Palladium-catalyzed Suzuki-Miyaura coupling reaction is one of the most important methods for the formation of Caryl-Caryl bond.Water has gained wide attention for it is cheap, readily available, non-corrosive,non-flammable and non-toxic.Therefore,it is necessary to develop an efficient system for facilitating this coupling reaction in purewater.In thispaper, awater-soluble salen-Pd complex wassynthesized and used asefficient catalystsforthe Suzuki-Miyaura reactions in pure water.Notably,the reactions of substrates with sterically demanding ortho substituents(aryl bromides and/or arylboronic acids)proceed smoothly to generate corresponding products with moderate to high yields.The optimal reaction conditions were as follows:aryl bromide(0.5 mmol), arylboronic acid(0.75 mmol), Et3N(1.0 mmol)as base, salen-Pd complex (1 mol%), H2O (1.0 mL)as solvent, reaction temperature 100 ℃,reaction time 3 h.Importantly, the catalytic system has the wide substrate scope and the high tolerance to various functional groups.Moreover,the system was carried out in the absence of any organic solvent, surfactant, or phase transfer agent.
palladium catalyzed;Suzuki-Miyaura reaction;biphenyl compounds;water
O625.13
A
10.13880/j.cnki.65-1174/n.2017.02.017
1007-7383(2017)02-0231-05
2016-08-27
国家自然科学基金(21563025),石河子大学杰出青年科技人才培育计划(2014ZRKXJQ05),石河子大学青年启动基金计划(RCZX201408)项目
刘洋(1991-),男,硕士研究生,专业方向为配位催化反应。
*通信作者:刘平(1979-),男,副教授,从事配位催化、绿色化学反应研究,e-mail:liuping@shzu.edu.cn。
