辛酰溴苯腈高效降解菌的筛选、分离与鉴定研究
2016-11-09孙义峰青岛市环境监测中心站山东青岛266000
徐 静,曲 伟,孙义峰(青岛市环境监测中心站,山东青岛266000)
辛酰溴苯腈高效降解菌的筛选、分离与鉴定研究
徐 静,曲 伟,孙义峰(青岛市环境监测中心站,山东青岛266000)
本研究从生产辛酰溴苯腈农药厂废水处理池中污泥中经过富集、分离、筛选得到一株能以辛酰溴苯腈为唯一碳源生长的菌株,根据表型特征、生理生化特性,结合16SrRNA基因序列同源性比较,将菌株初步鉴定为不动杆菌属(Acinetobacter sp.),命名为XB2。在辛酰溴苯睛最终浓度为100mg·L-1的工业废水经菌株XB2处理7d后,辛酰溴苯睛的去除率达到92.78%,说明菌株XB2在废水处理中具有很好的应用前景。
辛酰溴苯睛;不动杆菌属;分离鉴定
辛酰溴苯腈(Bromoxynil octanoate)是一种选择性除草剂,广泛应用于小麦和玉米田中防除杂草,化学名称为3,5-二溴-4-辛酰氧苯甲腈[1]。该药对土壤、环境造成严重危害,对人类健康也带来潜在危害。经研究证明,微生物对土壤和水环境中的农药降解起着关键作用[2~3]。
本研究从生产辛酰溴苯腈农药厂污水处理池的活性污泥中分离筛选出一株能够以辛酰溴苯腈为唯一碳源生长并将其快速降解的高效降解菌,并经过鉴定为不动杆菌属(Acinetobacter sp.),命名为XB2,并对其进行了降解效果研究,以期为在实践中利用微生物消除环境中辛酰溴苯腈的污染提供理论依据。
1 材料与方法
1.1 培养基与试剂
无机盐培养基 (g·L-1):NaCl1.0,(NH4)2SO41.0,KH2PO40.5,K2HPO41.5,MgSO4·7H2O 0.2,去离子水补足至1000mL,pH7.0。
LB培养基(g·L-1):NaCl 10.0,蛋白胨 10.0,酵母粉 5.0,pH7.0;添加质量分数为2%的琼脂即为固体培养基。
富集分离培养基:无机盐培养基中添加辛酰溴苯腈储备液作为唯一碳源,浓度视要求添加,添加质量分数为2%的琼脂即为固体培养基。
辛酰溴苯腈(纯度≥97%)购自江苏苏州某农药厂。使用前将辛酰溴苯睛原药溶于丙酮溶液并过滤除菌,试验按所需浓度添加到各培养基中。二氯甲烷、丙酮为分析纯,甲醇为色谱纯,购自Sigma公司。活性污泥取自江苏苏州某农药厂的污水处理池。
1.2 辛酰溴苯腈含量的测定
取待测定辛酰溴苯睛无机盐培养基,加等体积二氯甲烷,振荡萃取后取下层有机相过无水硫酸钠柱,紫外扫描。再利用液相色谱仪进一步定量,待二氯甲烷吹干后,加入甲醇(色谱纯)重新溶解,经0.45μm有机滤膜过滤,采用高效液相色谱法测定,测定条件如下:ultimate C18(2μm,250mm×4.6mm)色谱柱,流速1.0mL/min;流动相:甲醇(色谱纯),经0.45μm滤膜过滤,并用超声波清洗器脱气30min;检测波长229nm,进样体积20μL,采用外标法按峰面积定量。
1.3 降解菌株的富集、分离与纯化
取农药厂污水处理池中的活性污泥5g,加入到100mL辛酰溴苯腈浓度为 100mg·L-1的无机盐培养基中,30℃、160r· min-1条件下培养,每隔5d以5%(体积分数,下同)的接种量接入到新鲜富集分离培养基中,连续转接4次。富集液经紫外扫描仪和液相色谱法测定,富集培养液经测定降解效果达90%以上的富集液,即为有活性的富集液。取1mL活性富集液作梯度稀释,用无菌水分别稀释到10-2~10-6五个梯度,取稀释过的液体各0.2mL涂布于300mg·L-1无机盐固体培养基平板上,30℃培养,挑取单菌落划线分离纯化。纯化后的菌株转接至加有100mg·L-1辛酰溴苯腈的无机盐培养基中,30℃、160r· min-1摇床培养5d后检测其降解效果。
1.4 降解菌株的鉴定
1.4.1 降解菌株的培养特征及生理生化鉴定
将降解菌株采用平板涂布法接种于LB固体培养基上,30℃恒温培养48h后观察菌落形态。并用光学显微镜观察菌体形态,降解菌的鉴定参照 《常见细菌系统鉴定手册》[4]和《Bergey’smanual of determinative bacteriology》[5]进行。
1.4.2 降解菌株16SrRNA基因序列测定与分析
采用SDS高盐沉淀法[6]提取菌体总DNA。提取菌体总DNA作为模板,进行16SrRNA基因扩增。16S rRNA基因采用通用引物[7]进行PCR扩增,上游引物为5′-AGAGTTTGATCCTGGCTCAG-3′(Escherichia colibases8 to27),下游引物为5′-TACCTTGTTACGACTT-3′(Escherichiacolibases1507 to1492)。采用PCR回收试剂盒回收目的片段,将回收的DNA酶连到T载体上。参照《精编分子生物学指南》[8]进行质粒DNA的小量提取,提取的质粒进行验证,将质粒正确的转化子送至测序公司。测序结果通过在线分析,与EzTaxon server 2.1基因库中已有的16S rRNA基因序列进行同源性比较,并构建系统发育树。
1.5 含辛酰溴苯睛废水的生物处理
取农药厂含辛酰溴苯睛废水200mL,加入100mL的去离子水,再加入20mL的5倍浓度的无机盐培养基,调节pH至7.0,按10%的体积分数接入降解菌株XB2种子液,在30℃、160r·min-1摇床培养7d,测定辛酰溴苯睛残留量。
2 结果与分析
2.1 降解菌株的分离筛选及降解效果验证
通过多次富集转接,得到降解效果明显的富集液,从该富集液中,分离纯化得到一株能以辛酰溴苯腈为唯一碳源生长的菌株,命名为XB2,降解辛酰溴苯腈的效果如图1所示,通过HPLC测定,经过XB2处理后辛酰溴苯腈含量由100mg·L-1降为3.28mg·L-1,降解率高达96%以上,降解效果显著。
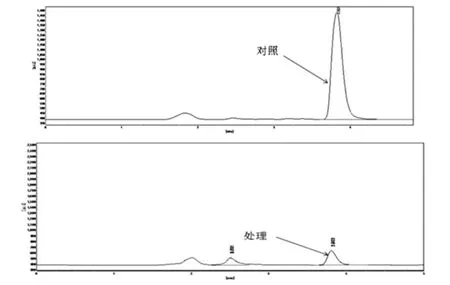
图1 XB2降解辛酰溴苯腈的液相色谱检测
2.2 菌株XB2的生理生化特征及系统发育定位

表1 XB2的生理生化特征
测序结果显示扩增所得的16SrRNA总共1496个碱基,登录号是 HM149349。发现菌株 XB2与 Acinetobacter calcoaceticus同源性为99%。根据生理生化结果及序列特征,菌株XB2被鉴定为Acinetobacter sp.,其系统发育树见图2。
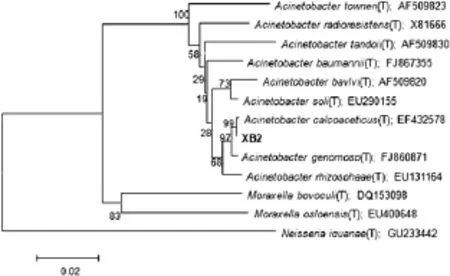
图2 菌株XB2的系统发育树
2.3 菌株XB2处理含辛酰溴苯睛的废水
由于高浓度的辛酰溴苯睛对菌株具有一定毒性抑制其生长,所以对辛酰溴苯睛废水进行了稀释,再把菌株接种到废水中进行处理。实验结果表明,经过稀释处理后的废水,辛酰溴苯睛的去除效果良好。在经过稀释处理后的含辛酰溴苯睛浓度为100mg·L-1的工业废水中,加入一定体积的无机盐培养基,接种10%体积的菌株XB2培养7d后,辛酰溴苯睛的残留量为7.22mg·L-1,去除率达到92.78%,所以菌株XB2在含辛酰溴苯睛的工业废水的生物处理中具有很好的应用潜力。
3 结论
(1)通过富集培养,获得一株能以辛酰溴苯睛为唯一碳源的降解菌株XB2,运用16S rRNA基因扩增和Blastn软件分析等方法,XB2菌株初步鉴定为不动杆菌属(Acinetobacter sp.)。该菌株为革兰氏阴性菌。不动杆菌属(Acinetobacter)是一种比较常见的微生物[9~10],广泛存在于土壤和水体中。
(2)经过辛酰溴苯睛降解菌株XB2处理后辛酰溴苯腈含量由100mg·L-1降为3.28mg·L-1,降解率高达96%以上,降解效果显著。
(3)废水小试实验表明,在经过稀释处理后的含辛酰溴苯睛浓度为100mg·L-1的工业废水中,加入一定体积的无机盐培养基,接种10%体积的菌株XB2培养7d后,辛酰溴苯睛的去除率达到92.78%,所以菌株XB2在含辛酰溴苯睛的工业废水的生物处理中具有很好的应用潜力。
[1]徐 妍,马 超,胡奕俊.辛酰溴苯腈生产现状与市场分析[J].山东农药信息,2009(08):18~20.
[2]Courteix A,Bergel A.Horseradish peroxidase-catalyzed hydroxylation of phenol:I.Thermodynamic analysis[J].Enzyme and Microbial Technology,1995,17(12):1087~1093.
[3]Sogorb M A,Vilanova E.Enzymes involved in the detoxification of orga nophosphorus,carbamate and pyrethroid insecticides through hydrolysis[J].Toxicology Letters,2002,128(1~3):215~228.
[4]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].科学出版社,2001:267~273.
[5]Buchanan,R.E.and N.E.Gibbons.Bergey′s manual of determinative bacteriology[M].8thedition.TheWilliams&wilkins Company,1986.
[6]Miller,S.A.,D.D.Dykes,H.F.Polesky.A simple salting out procedure for extractingDNA from human nucleated cells[J].Nucleic AcidsRes,1988,16(3):12~15.
[7]Stackebrandt E,Goodfellow M.Nuecleic acid techniques in bacterial systematics[M].UK:John Wiley&Sons,1991:371~375.
[8]F·奥斯伯,R·布伦特,R·E·金斯顿,等.精编分子生物学指南[M].北京:科学技术出版社,1999:36~40.
[9]郑永良,高强,王 玮,等.甲胺磷农药降解菌HS-A32的分离鉴定及降解特性[J].应用与环境生物学报,2006,12(3):399~403.
[10]王永杰,李顺鹏,沈 标.有机磷农药乐果降解菌的分离及其活性研究[J].南京农业大学学报,2001,24(2):71~74.
X172
A
2095-2066(2016)29-0004-02
2016-10-3
