绵羊母源基因TRIM28克隆、表达及生物信息学分析
2017-07-10罗健王立民张译元郭延华唐红周平刘守仁
罗健,王立民,张译元,郭延华,唐红,周平,刘守仁*
(1石河子大学动物科技学院,新疆 石河子 832003;2新疆农垦科学院/绵羊遗传改良与健康养殖省部共建国家重点实验室,新疆 石河子 832000)
绵羊母源基因TRIM28克隆、表达及生物信息学分析
罗健1,2,王立民2,张译元2,郭延华2,唐红2,周平2,刘守仁2*
(1石河子大学动物科技学院,新疆 石河子 832003;2新疆农垦科学院/绵羊遗传改良与健康养殖省部共建国家重点实验室,新疆 石河子 832000)
为了研究TRIM28基因在绵羊早期克隆胚胎发育过程中基因组去甲基化与重新甲基化及其维持的机制,探索母源关键基因在体细胞克隆效率中的作用,本研究通过提取中国美利奴细毛羊卵巢组织RNA,经反转录获得cDNA,利用特异性引物扩增TRIM28基因编码区序列,测序后采用生物信息学软件对编码区序列及氨基酸序列进行相关生物信息学分析和结构预测,进一步采用RT-PCR对绵羊不同组织中TRIM28表达量进行检测。结果显示:克隆获得了绵羊TRIM28基因编码区序列全长2441 bp,编码811个氨基酸。生物信息学分析结果表明,不同物种TRIM28基因编码区核苷酸和氨基酸序列具有较高保守性。组织表达谱结果显示,TRIM28 mRNA在中国美利奴细毛羊肺脏、脾脏和卵巢中高丰度表达,且与Zfp57表达情况一致。结论:TRIM28基因结构和进化方面高度保守,推测其在不同组织中行使转录中介因子这一特定的生物学功能相关,TRIM8与ZFP57复合体在分化组织中对基因组甲基化的维持起着重要作用。
TRIM28;Zfp57;母源基因;DNA甲基化;生物信息学
哺乳动物早期胚胎发育是由卵母细胞中储存的特定RNA和蛋白来调控,这些因子是在卵子发生、成熟过程中合成并贮存,即母源基因。受精后,这些母源物质指导和支持着早期胚胎发育,直至合子基因激活,部分母源因子甚至作用时间更久,所以母源基因表达模式对于早期胚胎发育的重要性已引起学者们的关注。母源基因的缺陷可能涉及不孕、流产、胎儿早产以及一些出生缺陷和先天性疾病。因此,阐明母源因子的功能及作用机制,对胚胎工程的发展具有重要作用。2012年Messerschmidt等[1]首次在小鼠上鉴定TRIM28作为母源因子,在植入前早期胚胎发育过程中对基因组甲基化印记维持与调控起着重要作用,母源TRIM28缺失可导致小鼠胚胎死亡,对早期胚胎发育至关重要。
TRIM28(又称Tif1 β 或 Kap1)是一种转录调控因子,最早在1996年作为KRAB-ZFPs结构域的互作中介蛋白被发现[2]。目前,已经发现的TRIM家族蛋白超过75个,在N末端均拥有1个高度保守的结构域——RBCC(RING,B-boxes,coiled-coil)结构。通过这个特殊结构域,TRIM28与KRAB-ZFPs结合参与转录抑制调控。RING结构域是由40-60个氨基酸残基结合到锌原子上形成的特殊锌指节构,具有激活E3泛素连接酶活性,与其它一些蛋白互作过程中发挥重要功能[3]。B-boxes结构域是B1和B2 2个各自由约40个氨基酸残基构成的CH3H2锌指结构,两者同时存在或是只存在B2结构域,其功能未有明确报道。Coiled-coil结构域是由多个α-螺旋复合形成的超二级结构,在同源寡聚过程中起重要作用。与其它TRIM家族蛋白最大的区别是 TRIM28蛋白 C末端含有 HP1、PHD、BROMO 3个保守结构域,这些结构使得TRIM28能作为骨架蛋白,通过招募异染色质蛋白1(HP 1)、组蛋白甲基化转移酶SETDB1、组蛋白去乙酰化酶NuRD等染色质修饰酶和转录抑制因子,共同作用启动异染色质形成,以达到抑制转录的作用[4-8]。研究[9]发现TRIM28在哺乳动物基因沉默、DNA损伤修复、细胞增殖与分化、凋亡、免疫反应、肿瘤性转化等多种细胞过程中发挥重要作用。
目前,TRIM28的研究主要集中在小鼠和人上,而其他动物的研究甚少,且绵羊TRIM28 CDS序列尚未见报。基于此,本研究对绵羊TRIM28基因 CDS区序列进行了克隆并进行了组织表达谱分析和相关的生物信息学分析,旨在为TRIM28基因在绵羊卵母细胞成熟和早期胚胎发育过程中的分子机理研究提供前期资料依据。
1 材料与方法
1.1 材料
成纤维细胞采自新疆农垦科学院试验羊场1只2岁中国美利奴细毛羊母羊,心脏、肝脏、脾脏、肺脏、肾脏、肌肉、卵巢取自试验羊场3只体型一致、健康状况良好的18-36月龄中国美利奴细毛羊,取出后迅速置于液氮保存,备用。
1.2 方法
1.2.1 总RNA提取及cDNA合成
参照Trizol Reagent(Invitrogen)说明书,分别提取中国美利奴羊各组织总 RNA,1%琼脂糖凝胶电泳检测其完整性,并利用核酸蛋白分析仪测定 RNA的浓度和纯度。采用M-MLV FirstStrandKit(Invitrogen)反转录试剂盒进行cDNA第一链合成。
1.2.2 绵羊Trim28 cDNA的克隆
根据牛Trim28 mRNA序列(GenBank登陆号:BC148899.1)设计特异引物,由Invitrogen公司合成,引物序列及相关信息见表1。PCR扩增体系为25 μL, 其 中 5×PrimeSTAR Buffer5 μL、dNTP Mixture 2 μL、上下游引物 (10 μmol/L) 各 0.5 ddH2O 15.75 μL,绵羊卵巢 cDNA 1 μL。PCR 扩增条件为:94 ℃预变性5 min;94 ℃变性30 s、56℃复性 30 s、72℃延伸 150 s,共 35个循环;最后72℃延伸10 min。PCR产物经琼脂糖凝胶电泳后将目的片段用Tiangen琼脂糖DNA凝胶回收试剂盒对目的片段进行回收,回收片段克隆到pGEM-T Easy(Promega)载体,转化 STBL3 感受态细胞,筛选阳性克隆,提取质粒后送Invitrogen公司进行测序。
1.2.3 实时荧光定量PCR检测绵羊不同组织中Trim28表达量
分别以中国美利奴细毛羊心脏、肝脏、脾脏、肺脏、肾脏、肌肉、卵巢组织cDNA为模板,以绵羊GAPDH为内参,用Roche罗氏LightCycler 480II仪器进行实时荧光定量PCR检测。反应体系25 μL,其中:2×QuantiFast SYBR Green PCR Master Mix 12.5 μL,上下游引物(10 μmol/L)各 1 μL,ddH2O 9.5 μL,绵羊各组织cDNA 1 μL。每个组织样本设3个技术重复和3个生物学重复,并同时设无模板对照组。RT-qPCR条件为:95℃预变性5 min;98℃变性10 s、60℃复性和延伸30 s,共45个循环。扩增结束后,以 0.1℃/s的速度进行溶解曲线分析。分别读取目的基因和持家基因的 CT值,利用ΔCt法(Qr=2-ΔΔCt)计算 TRIM28基因在绵羊不同组织中的相对表达量。
1.2.4 生物信息学分析
TRIM28基因序列比对及同源性分析使用DNAMAN及 NCBI网站在线分析工具(http://www.ncbi.nlm.nih.gov);蛋白质亲水性疏水性预测采用Epasy服务器上的 protscale程序(http://web.expasy.org/protscale/);信号肽预测采用 SignalP 4.0;蛋白质二级结构预测采用SOPMA软件(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html),并利用SWISS-MODLE软件(http://swissmodel.expasy.org/)进行三级结构预测;使用MEGA6.0软件构建系统进化树。
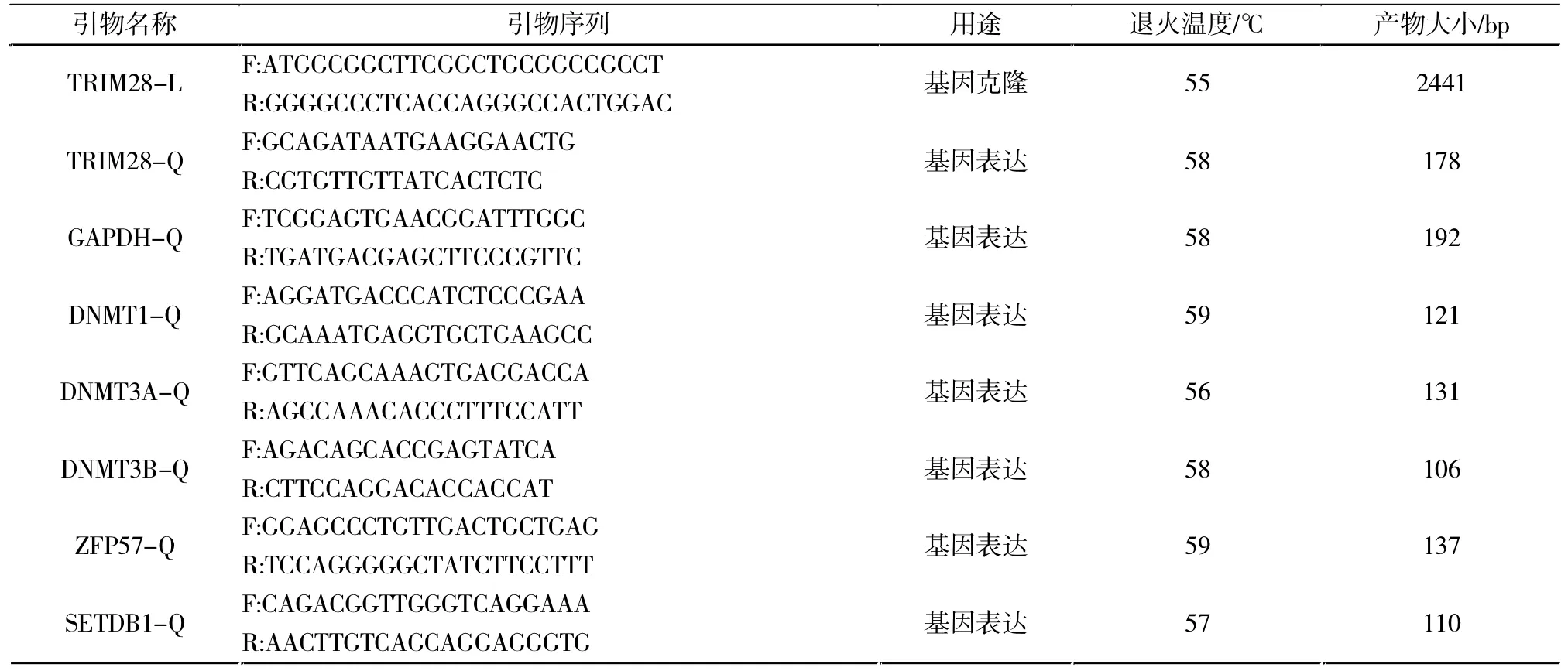
表1 PCR引物Tab.1 Primers of PCR
2 结果与分析
2.1 不同组织RNA提取
各组织样品总RNA经1%琼脂糖凝胶电泳后,均可清晰见到18S、28S、5S条带,无蛋白和基因组污染。核酸蛋白分析仪检测所有样品A260/A280均介于1.9-2.0。说明RNA质量达到反转录要求。
2.2 绵羊TRIM28基因CDS区克隆及生物信息学分析
以中国美利奴细毛羊卵巢组织cDNA为模板,克隆获得2441 bp目的片段,克隆测序后比对,与UCSC绵羊基因组序列100%一致,与GeneBank公布的牛TRIM28序列同源性达到97.62%,因此,确定其为绵羊TRIM28基因。
2.2.1 绵羊TRIM28蛋白的理化性质
运用ExPASy软件对绵羊TRIM28蛋白的氨基酸序列进行基本理化性质分析,其分析结果(图1)表明:蛋白总共811个氨基酸,分子量为86503.4 u,理论等电点pI=5.47;含有20种氨基酸,其中含量最高的是 Ala(10.1%),含量最低的是 Trp(0.6%);280 nm的摩尔吸光系数为44400 M-1·cm-1;蛋白平均亲水系数为–0.387。


图1 绵羊TRIM28基因CDS碱基和氨基酸序列Fig.1 The nucleotide and amino acid sequence of sheep TRIM28 gene
2.2.2 蛋白亲水/疏水性分析
运用ProtScale程序对绵羊TRIM28亲水性/疏水性进行了分析,如图2所示。第50位精氨酸(Arg)亲水性最强(最低分值为-2.922);第687位亮氨酸(Leu)疏水性最强(最高分值为1.778)。序列包含1个富含半胱氨酸的基序,可以与2个锌离子以一种特异的交叉联结体系结合。由于锌离子的螯合作用,此区域形成了1个公共的疏水核心,而且在保守的连接区之间变化的序列则提供了蛋白相互识别、相互作用的特异性。
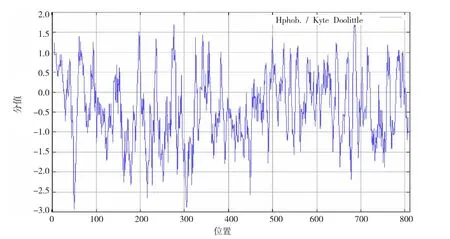
图2 绵羊TRIM28蛋白疏水性分析Fig.2 Analysis of hydrophobicity of sheep TRIM28 protein
2.2.3 绵羊TRIM28蛋白高级结构预测
经SOPMA服务器分析,绵羊的TRIM28蛋白二级结构由α-螺旋、延伸带、β-折叠及无规则卷曲4种结构组成,其中各种结构所占比例分别为34.90%、14.67%、7.40%和43.03%。运用SWISS-MO DEL进行同源建模,结果(图3)显示:绵羊TRIM28蛋白的三级结构预测也是由α-螺旋、延伸带、β-折叠及无规则卷曲构成。

图3 绵羊TRIM28蛋白预测三级结及结构域Fig.3 Putative Tertiary structure of sheep TRIM28 protein
2.2.4 绵羊TRIM28同源性及系统发育分析
从NCBI数据库中查找另外10个物种的TRIM28基因编码蛋白序列,采用MegAlign软件进行同源性比对分析,结果显示其与其他物种具有较高同源性。用NJ法构建绵羊、人、狼、兔、牛、黑猩猩、鼠兔、马、鼠、鸡、骆驼、非洲爪蟾12个物种TRIM28基因的系统发育树(图4),结果显示,牛与绵羊在系统发育树中关系最近。

图4 不同物种TRIM28基因进化树Fig.4 The evolution of TRIM28 bases sequences among different species
2.3 实时荧光定量PCR检测TRIM28基因及相关互作基因在绵羊各个组织器官中的表达
以3只美利奴细毛羊不同组织的cDNA为模板,对 TRIM28、Dnmt1、Dnmt3a、Dnmt3b、Zfp57、Setdb1和Gapdh基因的表达量进行实时荧光定量PCR检测,TRIM28 mRNA在绵羊的心脏、肝脏、脾脏、肺脏、肾脏、肌肉、卵巢组织中均有表达,TRIM28基因在肺脏中表达量最高,在肝脏中最低(图5)。

图5 绵羊TRIM28基因mRNA表达谱Fig.5 The TRIM28 gene mRNA expression patterns in different tissues of sheep
另外,对与其互作参与甲基化调控的基因进行了表达量的检测,并用HemI 1.0:Heatmap Illustrator软件绘制出各个基因在不同组织中表达量的热点图(图6),热点图形象直观描述出TRIM28基因和与其相互作用参与DNA甲基化调控的相关基因在绵羊不同组织中的差异表达情况。根据软件的聚类分析结果,发现TRIM28与Zfp57在不同组织中的表达情况基本一致。

图6 TRIM28及互作甲基化调控相关基因在绵羊不同组织中表达的聚类分析Fig.6 Clustering of differentially expressed TRIM28 and methylation-related genes in tissues of sheep
3 讨论
(1)本研究克隆得到了绵羊TRIM28基因完整CDS序列,长度为2441 bp。 获得的该基因核苷酸序列及所编码的氨基酸序列与人、牛、猪、小鼠等动物核苷酸序列和氨基酸序列具有非常高的一致性,并且其蛋白结构与TRIM家族蛋白的典型保守结构域相符,说明其在不同物种间具有高度保守性,而这种高度保守结构也证明了绵羊TRIM28基因具有特定或是广泛的生物学功能作用。
(2)本研究表明TRIM28在美利奴细毛羊不同分化组织中均有表达。与TRIM28在小鼠卵巢和早期胚胎中高表达相比较,在正常分化细胞中几乎检测不到存在差异,这种现象可能是物种差异造成。TRIM28在癌症研究中较为热门的是与肺癌有关,TRIM28在绵羊肺部组织中的表达量最高,这可能与其在肺部具有某些特定功能有关联。目前对TRIM28蛋白确切功能及其作用机制尚不清楚,尤其是其作为母源因子涉及卵母细胞发育成熟和附植前早期胚胎发育过程中广泛的生理生化功能。小鼠早期胚胎发育的研究表明,TRIM28能通过与ZFP57结合,作为中央支持骨架与H3K9组蛋白甲基转移酶SETDB1,核小体重塑和组蛋白去乙酰化复合体NuRD,异染色质蛋白 HP1,DNA甲基转移酶DNMT1,DNMT3A,DNMT3B组成一个多重功能的阻遏复合结构,在表观重编程中起到印记基因甲基化维持作用。本研究通过检测绵羊正常分化组织中上述基因的表达情况,聚类分析结果表明TRIM28与Zfp57表达情况最相似,这可能ZFP57/TRIM28复合结构在正常分化细胞分裂增殖过程中DNA甲基化的维持也同样起着重要作用。
TRIM28是具有多重结构域的转录调控因子,与一系列基因的激活与抑制密切相关,涉及广泛的生物学或生理学过程。TRIM28的表达异常直接导致细胞生长、发育、分化的紊乱[1,10-12]。肿瘤生物学上研究发现,TRIM28作为P53的辅阻遏物能够结合到MDM2上,可抑制P53的表达和乙酰化作用[13]。TRIM28在癌细胞和肿瘤中表达量较正常组织升高,Lu Chen等发现TRIM28能通过HDAC1/E2F作用减缓早期肺癌细胞的增殖,揭示了其在抑制癌症方面的重要作用[14]。近几年,TRIM28在干细胞领域研究中成为热点,研究发现 TRIM28在精子生成,胚胎干细胞(ESCs)和诱导多能干细胞(iPS)的维持中发挥重要作用[15-18]。此外,除了作为转录调控因子的广泛重要作用,TRIM28对发生在异染色质区域的DNA双链断裂损伤修复也起着重要作用[19]。由于TRIM28在大动物早期胚胎发育过程方面的研究处于起步阶段,其功能尚需进一步研究。
4 结论
采用RT-PCR技术获得TRIM28基因完整的编码区序列,其序列全长2441 bp,编码811个氨基酸,与其他物种存在较高的相似性。TRIM28结构和进化的高度保守,可能与其在不同组织中行使转录中介因子这一特定的生物学功能相关。组织表达谱结果显示,TRIM28 mRNA在中国美利奴细毛羊肺脏、脾脏和卵巢中高丰度表达,且与Zfp57 mRNA在所有检测组织中表达情况一致。本实验扩增的TRIM28基因为进一步研究TRIM28作为母源因子在卵母细胞成熟和早期胚胎发育过程中所起的作用奠定了必要的基础。
[1] Messerschmidt D M,de Vries W,Ito M,et al.Trim28 is required for epigenetic stability during mouse oocyte to embryo transition[J].Science,2012,335(6075):1499-1502.
[2] Moosmann P,Georgiev O,Le Douarin B,et al.Transcriptional repression by RING finger protein TIF1β that interacts with the KRAB repressor domain of KOX1[J].Nucleic Acids Research,1996,24(24):4859-4867.
[3] Pineda C T,Ramanathan S,Fon Tacer K,et al.Degradation of AMPK by a cancerspecific ubiquitin ligase[J].Cell,2015,160(4):715-728.
[4] Quenneville S,Verde G,Corsinotti A,et al.In embryonic stem cells,ZFP57/KAP1 recognize a methylated hexanucleotide to affect chromatin and DNA methylation of imprinting control regions[J].Molecular Cell,2011,44(3):361-372.
[5] Iyengar S,Farnham P J.KAP1 protein:an enigmatic master regulator of the genome[J].Journal of Biological Chemistry,2011,286(30):26267-26276.
[6] Schultz D C,Ayyanathan K,Negorev D,et al.SETDB1:a novel KAP-1-associated histone H3,lysine 9-specific methyltransferase that contributes to HP1-mediated silencing of euchromatic genes by KRAB zinc-finger proteins[J].Genes&Development,2002,16(8):919-932.
[7] Schultz D C,Friedman J R,Rauscher F J.Targeting histone deacetylase complexes via KRAB-zinc finger proteins:the PHD and bromodomains of KAP-1 form a cooperative unit that recruits a novel isoform of the Mi-2α subunit of NuRD[J].Genes&Development,2001,15(4):428-443.
[8] Zuo X,Sheng J,Lau H T,et al.Zinc finger protein ZFP57 requires its co-factor to recruit DNA methyltransferases and maintains DNA methylation imprint in embryonic stem cells via its transcriptional repression domain[J].Journal of Biological Chemistry,2012,287(3):2107-2118.
[9] Cheng C T,Kuo C Y,Ann D K.KAPtain in charge of multiple missions:emerging roles of KAP1[J].World J Biol Chem,2014,5(3):308-320.
[10]Chen L,Chen D T,Kurtyka C,et al.Tripartite motif containing 28(Trim28)can regulate cell proliferation by bridging HDAC1/E2F interactions[J].Journal of Biological Chemistry,2012,287(48):40106-40118.
[11]Hu G,Kim J,Xu Q,et al.A genome-wide RNAi screen identifies a new transcriptional module required for selfre-newal[J].Genes&Development,2009,23(7):837-848.
[12]Chikuma S,Suita N,Okazaki I M,et al.TRIM28 prevents autoinflammatory T cell developmentin vivo[J].Nature Immunology,2012,13(6):596-603.
[13]Wang C,Ivanov A,Chen L,et al.MDM2 interaction with nuclear corepressor KAP1 contributes to p53 inactivation[J].The EMBO Journal,2005,24(18):3279-3290.
[14]Chen L,Chen D T,Kurtyka C,et al.Tripartite motif containing 28(Trim28)can regulate cell proliferation by bridging HDAC1/E2F interactions[J].The Journal of biological chemistry,2012,287(48):40106-40118.
[15]Fasching L,Kapopoulou A,Sachdeva R,et al.TRIM28 represses transcription of endogenous retroviruses in neural progenitor cells[J].Cell Reports,2015,10(1):20-28.
[16]Kulcenty K,Oleksiewicz U,Wiznerowicz M.[Nr 82]Role of epigeneticregulator-KAP1/TRIM28 in reprogrammingof human induced pluripotent stem cells(iPS)[J].Zeszyty Naukowe WCO,Letters in Oncology Science,2013,10:45.
[17]Quenneville S,Turelli P,Bojkowska K,et al.The KRABZFP/KAP1 system contributes to the early embryonic establishment of sitespecific DNA methylation patterns maintained during development[J].Cell Reports,2012,2(4):766-773.
[18]Rowe H M,Kapopoulou A,Corsinotti A,et al.TRIM28 repression of retrotransposon-based enhancers is necessary to preserve transcriptional dynamics in embryonic stem cells[J].Genome Research,2013,23(3):452-461.
[19]Tubbs A T,Dorsett Y,Chan E,et al.KAP-1 promotes resection of broken DNA ends not protected by gamma-H2AX and 53BP1 in G(1)-phase lymphocytes[J].Mol Cell Biol,2014,34(15):2811-2821.
Cloning and bioinformatics analysis of the CDS of ovis aries TRIM28 gene
Luo Jian1,2,Wang Liming2,Zhang Yiyuan2,Guo Yanhua2,Tang Hong2,Zhou Pin2*,Liu Shouren2*
(1 College of Animal Science and Technology,Shihezi University,Shihezi,Xinjiang 832003,China;2 Key Laboratory for Sheep Improvement and Healthy Production,Xinjiang Academy of Agricultural and Reclamation Science,Shihezi,Xinjiang 832000,China)
In order to study the mechanisms of TRIM28 in the establishment of methylation and demethylation during somatic cell nuclear transfer (SCNT)early embryonic development,which could help to explain the role of key maternal factor for reprograming of somatic cell.The RNA was extracted from ovary,and cDNA was obtained by reverse transcription.Specific primers were designed to amplify the coding sequence of TRIM28 gene.The sequence of coding region and amino acid of TRIM28 were analyzed and predicted by bioinformatics methods.The expression patterns in different tissues were detected by real-time RT-PCR.The results showed that we obtained the sheep TRIM28 gene 2441 bp cDNA coding sequence,coding 811 amino acids.TRIM28 mRNA expression level showed that the levels were the highest in lung and the lowest in liver,which was in according with the level of Zfp57.The TRIM28 is highly conserved with other species and may act as an essential transcriptional regulator and a multifunctional adaptor protein with the same to model animals.Moreover,the Zfp57/Kap1 complex can play important role in epigenetic regulation system controlling of DNA methylation in the differentiated tissues.
TRIM28; Zfp57; maternal gene; DNA methylation; bioinformatics
S826.2
A
10.13880/j.cnki.65-1174/n.2017.02.002
1007-7383(2017)02-0139-07
2016-03-24
国家转基因重大专项(2014ZX08008001),国家自然科学基金项目(31160227、3166090049),新疆兵团种质资源创新专项(2012BB042)
罗健(1989-),男,硕士研究生,专业方向为动物遗传育种与繁殖,e-mail:luojian_bio@126.com。
*通信作者:刘守仁(1934-),男,中国工程院院士,博士生导师,从事绵羊遗传育种与繁殖研究,e-mail:nkyysb@163.com。
