小檗碱对NIT-1细胞胰岛素分泌的影响
2017-07-10胡亚耘
胡亚耘,董 慧
(1.武汉市第一医院 内分泌科,湖北 武汉 430000;2.华中科技大学同济医院中西医结合研究所,湖北 武汉 430030)
小檗碱对NIT-1细胞胰岛素分泌的影响
胡亚耘1,董 慧2
(1.武汉市第一医院 内分泌科,湖北 武汉 430000;2.华中科技大学同济医院中西医结合研究所,湖北 武汉 430030)
目的探讨小檗碱对NIT-1细胞胰岛素分泌的影响及可能的作用机制。方法采用小檗碱干预后,用MTT法、放射免疫法及Western blotting确定小檗碱干预的合适浓度范围及检测NIT-1细胞胰岛素水平和腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)蛋白的表达。结果小檗碱在浓度为100 μmol/L时对基础培养基和高糖培养基干预的NIT-1细胞的增殖存在显著性抑制作用(P<0.05);而小檗碱在浓度为30 μmol/L时就明显抑制高脂培养基诱导的NIT-1细胞的增殖(P<0.05)。小檗碱分别对基础、高糖和高脂诱导的NIT-1细胞短时相干预(1 h)后,显示葡萄糖刺激胰岛素分泌(GSIS)被明显抑制 (P<0.05);小檗碱对高糖高脂诱导的NIT-1细胞长时相干预(24 h)后显示基础胰岛素分泌和GSIS均有一定的增加(P<0.05,P<0.01)。小檗碱可以促进高糖高脂诱导的NIT-1细胞AMPK蛋白的表达。结论小檗碱不仅仅作为一种AMPK激活来调节胰岛素分泌,其也可能通过其他的通路进一步影响胰岛素分泌。
小檗碱;NIT-1细胞;胰岛素
本文引用:胡亚耘,董 慧.小檗碱对NIT-1细胞胰岛素分泌的影响[J].湖南中医药大学学报,2017,37(7):730-735.
在2型糖尿病的发病过程中,胰岛素抵抗和胰岛β细胞功能受损作为两个重要的发病环节参与其中[1]。在糖尿病前期,胰岛β细胞一方面代偿性分泌胰岛素会引起机体的高胰岛素血症,另一方面当代偿性分泌进展为失代偿后,出现胰岛β细胞功能受损,从而导致糖尿病的发生。这一点与2型糖尿病中胰岛素分泌由相对不足最终逐渐进展为胰岛素分泌绝对不足是相符合的。胰岛β细胞的功能主要通过分泌胰岛素从而起到调节血糖的作用;而目前促进胰岛细胞分泌与释放胰岛素是磺脲类和格列奈类降糖药物的主要作用机制[2]。但也有报道二甲双胍及罗格列酮等降糖药物通过激活AMPK途径抑制胰岛素分泌从而起到很好的降糖作用,一是可以增加胰岛素的敏感性从而改善胰岛细胞功能[3-5],二是可以延缓胰岛细胞功能的耗竭,保证正常功能的胰岛细胞的数量。除了促进胰岛细胞胰岛素的分泌,保护胰岛β细胞功能也有望成为糖尿病治疗中的一个新的治疗方向和研究热点。
小檗碱(berberine),又被称为黄连素,目前临床上已被广泛应用于2型糖尿病的治疗,但其降糖调脂的作用机制还并未被完全阐明。已经证实小檗碱能通过改善脂肪细胞、肝细胞、骨骼肌细胞等外周组织的胰岛素敏感性来实现治疗2型糖尿病的功效[6],而小檗碱对胰岛β细胞胰岛素的分泌及其功能的影响尚未阐明。前期有试验提出小檗碱可作为胰岛素促泌剂促进胰岛素的分泌[7]。而Zhou L等[8]也得出小檗碱可能通过 AMPK途径抑制胰岛细胞胰岛素的分泌的结论。因此,为明确小檗碱对β细胞功能的影响,我们采用软脂酸和高糖分别诱导NIT-1细胞,进一步观察小檗碱对NIT-1胰岛β细胞胰岛素分泌的急慢性调节作用和机制。
1 材料与方法
1.1 药物与试剂
小檗碱、腺苷酸活化蛋白激酶即AMPK激活剂(5-Aminoimidazole-4-carboxamide-β-D-ribofuranoside,AICAR)、腺苷酸活化蛋白激酶抑制剂即AMPK inhibitor(Compound C)、胰蛋白酶、软脂酸(PA)、牛血清白蛋白(BSA),均购自美国 Sigma 公司;胎牛血清(FBS)、1640 培养基、DMEM 高糖培养基、二甲基亚砜,均购自美国Thermo公司;MTT试剂盒、血清胰岛素放免试剂盒,均购自北方生物技术研究所(中国)。
1.2 细胞培养
NIT-1细胞为华中科技大学基础医学院的NIT-1细胞株的传代细胞,将传代后的细胞接种于细胞培养瓶,用分别含有100 U/mL青霉素,100 U/mL链霉素,10%胎牛血清的1 640培养基在37℃、5%CO2培养箱内培养。NIT-1细胞生长到 70%~80% 融合后,弃原培养基,分别加入高糖或者高脂培养基中诱导24 h后建立高糖模型和高脂模型。
1.3 MTT实验
采用MTT法检测细胞增殖。将NIT-1细胞以1×105的密度接种于96孔板中,待细胞融合至60%~70%后,分别在完全培养基(空白对照组,Con)、高糖培养基(高糖模型组,Mod)和高脂培养基(高脂模型组,Mod)中培养,然后加入含有不同浓度的小檗碱(1 μmol/L,3 μmol/L,10 μmol/L,30 μmol/L,100 μmol/L)进行干预,其中每组各设定4个复孔。干预24 h后加入 5 g/L MTT 溶液 50 μL,在 37 ℃、5%CO2培养箱中放置4 h后,倒掉培养液,加入100 μL DMSO,混合均匀后,将酶标仪设定为490 nm检测吸光度。
1.4 胰岛素分泌实验
将细胞以1×105的密度接种到24孔板中,待细胞生长至60%~70%融合后分别给予不同的培养基(完全培养基、高糖培养基、高脂培养基)培养24 h后予以干预,具体方法如下:弃去板中的培养基,用无糖的克林缓冲液(KRBH)[NaCl 118.5 mmol/L,CaCl2·2H2O 2.54 mmol/L,KH2PO41.19 mmol/L,KCl 4.74 mmol/L,NaHCO325 mmol/L,MgSO41.19 mmol/L,Hepes10 mmol/L,1 g/L 牛血清蛋白,pH 7.4]清洗 1次,然后再用相同浓度的KRBH预孵育30 min以使细胞处于基础代谢状态,弃去KRBH,再将各种条件不同的KRBH (含葡萄糖 2.8 mmol/L、含葡萄糖16.7 mmol/L、含小檗碱并同时含有葡萄糖 2.8 mmol/L或者16.7 mmol/L、含软脂酸0.4 mmol/L、含小檗碱并同时含有软脂酸 0.4 mmol/L)孵育1 h,收集上清液保存于-20℃待测,用放射免疫试剂盒测定。
1.5 AMPK蛋白表达测定
将NIT-1细胞用高糖高脂诱导24 h后提取蛋白,检测蛋白浓度。每组各取总蛋白30 μg,分别经恒定电压分离(100 V,2 h)和恒定电流(278 mA)进行转膜45 min,转膜至NC膜上后用TBST溶液在室温环境中封闭2 h。加入一抗在4℃过夜,用TBST漂洗5次,每次10 min,然后加入二抗室温反应1 h,TBST漂洗5次,每次10 min。最后用Odyssey系统扫描后进行分析。其中一抗为鼠抗AMPK(1∶4 000稀释),二抗为荧光标记的兔抗鼠(1∶20 000稀释)。
1.6 统计学方法
2 结果
2.1 MTT法检测小檗碱对NIT-1细胞增殖的影响
结果表明,空白对照组:与对照组BBR 0 μmol/L相比,小檗碱在 1、3、10、30 μmol/L 时对细胞的增殖无明显影响,在100 μmol/L时明显降低NIT-1细胞的存活率 (P<0.05)。高糖模型组:与对照组BBR 0 μmol/L相比,小檗碱在1 μmol/L时对细胞的增殖有促进作用,在3、10、30 μmol/L时细胞的增殖略有下降,小檗碱在100 μmol/L时细胞的存活率明显下降 (P<0.05)。高脂模型组:与对照组BBR 0 μmol/L相比,小檗碱在1、3、10 μmol/L时NIT-1细胞存活率略有下降,小檗碱在30、100 μmol/NIT-1细胞存活率明显下降(P<0.05)。 各组细胞吸光度见表 1。
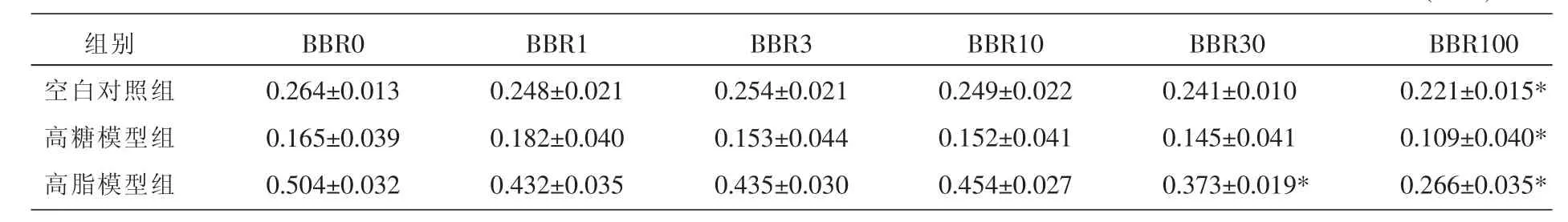
表1 MTT法检测小檗碱在不同培养基中对NIT-1细胞的增殖抑制作用 (n=4)
2.2 小檗碱对NIT-1细胞胰岛素分泌的影响
2.2.1 10 μmo/L小檗碱对NIT-1细胞基础状态、葡萄糖刺激胰岛素分泌(GSIS)和软脂酸刺激胰岛素分泌(PSIS)的影响
结果表明,与对照组相比,10 μmo/L小檗碱对NIT-1细胞基础状态、GSIS和PSIS均有抑制作用。见表2。

表2 10 μmo/L小檗碱对NIT-1细胞基础状态(Glu 2.8 mmol/L)、GSIS(Glu 16.7 mmol/L)和 PSIS(PA 0.4 mmol/L)的影响 (n=4,mu/L)
2.2.2 10 μmo/L小檗碱干预24 h对高糖诱导的NIT-1细胞胰岛素分泌的影响 结果表明,与模型组比较,小檗碱组的基础分泌量和糖刺激分泌量均增加(P<0.05,P<0.01); 阳性对照组即 AMPK 激动剂AICAR组的基础分泌量减少(P<0.01);阴性对照组即AMPK抑制剂Compound C组糖刺激分泌量增加(P<0.05)。 见表 3。
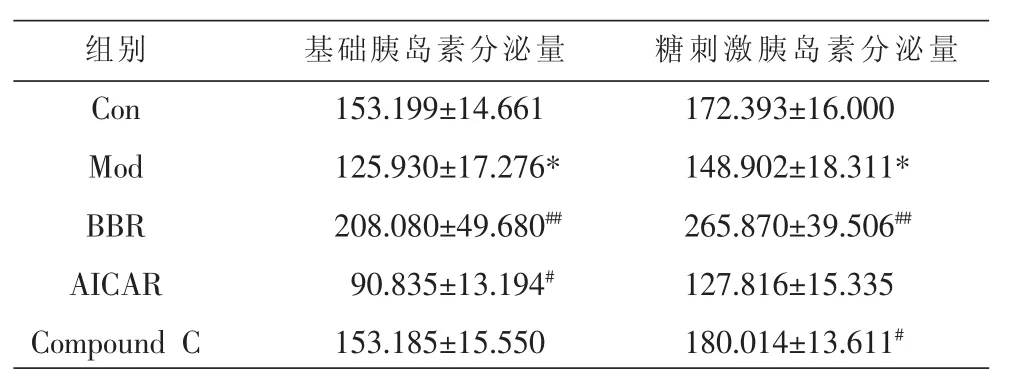
表3 10 μmo/L小檗碱干预24 h对高糖诱导的NIT-1细胞胰岛素分泌的影响 (n=4,mu/L)
2.2.3 10 μmo/L小檗碱干预24 h对高脂诱导的NIT-1细胞胰岛素分泌的影响 结果表明,与模型组比较,小檗碱组的基础分泌量和糖刺激分泌量均增加(P<0.01);与模型组比较,阳性对照AMPK 激动剂AICAR组基础分泌量和糖刺激分泌量均有一定降低,但差异无统计学意义(P>0.05);阴性对照即AMPK抑制剂Compound C组基础分泌量和糖刺激分泌量均增加(P<0.05)。 见表 4。

表4 10 μmo/L小檗碱干预24 h对高脂诱导的NIT-1细胞胰岛素分泌的影响 (n=4,mu/L)
2.3 小檗碱对NIT-1细胞AMPK蛋白表达的影响
2.3.1 小檗碱对高糖诱导的NIT-1细胞AMPK蛋白表达的影响 将NIT-1细胞分为对照组、模型组、小檗碱组、阳性对照组(AICAR)、阴性对照组(Compound C)及雷帕霉素(Rapamycin,RAPA)组。各组细胞分别给予完全培养基及含有小檗碱(10 μmol/L)、AICAR (0.5 mmol/L)、Compound C(10 μmol/L)、RAPA(50 nmol/L)的高糖培养基进行干预,干预24 h后运用Western-blot法检测AMPK蛋白的表达。 结果表明,25 mmol/L葡萄糖作用24 h后,模型组的AMPK蛋白表达较对照组明显降低 (P<0.05,P<0.01); 而与模型组比较, 小檗碱、AICAR、RAPA均可以一定程度促进AMPK蛋白的表达 (P<0.05,P<0.01),Compound C 则抑制 AMPK蛋白的表达(P<0.05,P<0.01)。 见图 1-2。
2.3.2 小檗碱对高脂诱导的NIT-1细胞AMPK蛋白表达的影响 将NIT-1细胞给予完全培养基及分别含有小檗碱(10 μmol/L)、AICAR(0.5 mmol/L)、Compound C(10 μmol/L)、RAPA(50 nmol/L)的高脂培养基干预24 h,采用Western-blot检测AMPK蛋白的表达。结果表明,0.25 mmol/L软脂酸作用24 h后,模型组的AMPK蛋白表达较对照组明显降低(P<0.05,P<0.01);与模型组比较,小檗碱、AICAR、RAPA均可以一定程度促进AMPK蛋白的表达 (P<0.05,P<0.01),Compound C 则抑制 AMPK 蛋白的表达(P<0.05,P<0.01)。 见图 3-4。
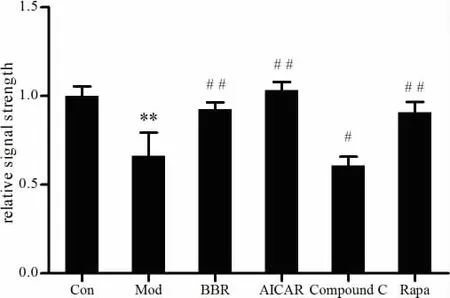
图1高糖诱导的NIT-1胰岛细胞中各组AMPK蛋白的表达 (n=4)

图2高糖诱导的NIT-1胰岛细胞中各组AMPK蛋白的表达 (n=4)
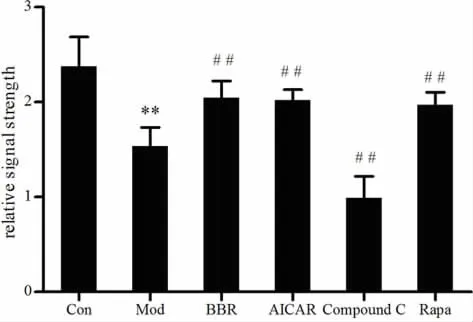
图3高脂诱导的NIT-1细胞各组AMPK蛋白的表达 (n=4)

图4高脂诱导的NIT-1细胞各组AMPK蛋白的表达 (n=4)
3 讨论
当今,伴随着社会人口老龄化的发展、饮食结构的不合理、肥胖人数的增加,2型糖尿病(T2DM)发病率一直呈上升趋势。T2DM发病的重要特征是胰岛素抵抗(insulin resistance,IR)和胰岛β细胞功能不足。胰岛素抵抗一方面是糖尿病进展和血糖难以控制的一个重要原因,另一方面因为代偿性分泌胰岛素也会导致残存的胰岛β细胞的数量和生理功能进一步降低最终失代偿出现胰岛β细胞功能的丧失,表现为胰岛素分泌的绝对不足。因此降糖药如何通过调节胰岛β细胞胰岛素的分泌,一方面稳定地控制血糖,另一方面能较好地保护胰岛β细胞的功能也成为临床治疗糖尿病时的一个关注热点。
小檗碱,又名黄连素,是中药黄连的主要成份;黄连性苦味寒,具有清热燥湿的疗效。中医学认为机体湿热内蕴、耗伤阴津、阴虚燥热从而导致消渴病,故黄连是我国中医治疗糖尿病的经典用药。近年来小檗碱也广泛应用于糖尿病的治疗,并取得了肯定的疗效。戴建峰等[9]试验后提出,经黄连素治疗后,2型糖尿病大鼠 “三多一少”症状明显改善,血糖、血压、血脂明显降低。但现代医学研究对小檗碱的降糖机制还并未完全阐明。小檗碱在外周组织可能是通过抑制肝脏的糖原异生和(或)促进葡萄糖酵解而发挥降血糖作用。在胰岛细胞中,小檗碱对胰岛素分泌的调节作用作为一种降糖机制也是研究热点,王永刚等[10]提出黄连及其黄连素具有一定的降糖作用,并且推论黄连素和黄连总碱的降糖作用可能不是通过胰岛素的分泌和释放,而是通过受体后效应增加胰岛素敏感性。到目前为止,小檗碱对胰岛β细胞胰岛素释放和分泌的影响存在着无影响、促进分泌或抑制分泌这三种互相矛盾的报道,至今没有定论[2]。
我们的前期试验发现小檗碱可以通过促进胰岛素分泌起到降糖作用。目前研究表明小檗碱是AMPK的激活剂[11-13]。在外周组织如肝脏、脂肪细胞和骨骼肌细胞中激活AMPK后对物质代谢起到了重要作用[14-17];在胰腺组织中,邵莉等[16-19]人发现抑制AMPK活性可以促进胰岛素分泌,而降糖药二甲双胍可通过激活AMPK活性抑制胰岛素分泌。故得出一个推论性假设:AMPK的激活与胰岛素的分泌可能呈负相关。故本实验旨在探讨小檗碱是否仅作为一种AMPK激活剂来调节NIT-1胰岛细胞胰岛素的分泌作用,以期能进一步研究小檗碱如何通过调节胰岛细胞胰岛素分泌来降血糖的作用机制。
实验发现,随着小檗碱浓度的增加,对NIT-1细胞生长抑制作用逐渐增强,并且在100 μmol/L时对NIT-1细胞出现明显抑制作用。分别用葡萄糖和软脂酸诱导NIT-1细胞成为高糖和高脂胰岛β细胞模型后,小檗碱在浓度为30 μmol/L时即有明显毒性。NIT-1细胞与正常胰岛β细胞功能相似,可作为分析胰岛分泌功能的一种理想的细胞模型[20]。本实验结果表明,在正常NIT-1胰岛细胞中,小檗碱可以降低基础分泌量、糖刺激分泌量及软脂酸刺激的胰岛素分泌量,且随着小檗碱浓度的增加,其对NIT-1细胞胰岛素分泌的抑制作用加强。分别用葡萄糖和软脂酸诱导NIT-1细胞成为高糖和高脂胰岛β细胞模型后,分别用小檗碱进行短时相干预(1 h)和长时相干预(24 h),结果表明,在短时相干预中小檗碱可以抑制正常对照组及模型组的糖刺激胰岛素分泌;而小檗碱干预24 h后显示小檗碱一定程度促进模型组的胰岛素分泌包括基础分泌量和糖刺激分泌量。
综上所述,在正常组NIT-1细胞中,小檗碱可以抑制基础分泌量、糖刺激分泌量和软脂酸刺激胰岛素分泌量,且随着浓度的增加抑制作用增强,提示小檗碱可能通过激活AMPK活性,降低胰岛素分泌的作用从而保护胰岛细胞功能。小檗碱对高糖、高脂诱导的NIT-1细胞胰岛素分泌的急相作用(1 h),表明小檗碱可以抑制高糖、高脂模型NIT-1细胞的糖刺激胰岛分泌量,而小檗碱对高糖、高脂诱导的NIT-1细胞胰岛素分泌的持续作用(24 h),则表明一定程度上小檗碱又可以促进高糖、高脂模型NIT-1细胞的胰岛素分泌包括基础和糖刺激胰岛素分泌量。小檗碱对NIT-1细胞胰岛素分泌的急相和持续作用分别表现为抑制和促进作用,提示小檗碱对胰岛素分泌的调节可能具有非常复杂的机制,不仅有可能作为胰岛素增敏剂来通过抑制胰岛素分泌,改善胰岛素抵抗,保护胰岛β细胞,减缓病情的进展;而且有可能在长期用药过程中作为温和的胰岛素促泌剂,通过保护胰岛β细胞、促进胰岛β细胞分泌胰岛素来调节糖代谢,缓解临床症状。综上使得小檗碱在2型糖尿病的临床治疗中存在广阔的应用前景。而且小檗碱可能并不仅仅作为一种AMPK激活剂来调节胰岛素分泌的机制,其调节胰岛素分泌机制的同时,也可能与cAMP及钙离子通道等其他途径存在着一定的联系,还需要我们进一步研究和探讨。
参考文献:
[1]Nguyen DM,El-Serag HB.The epidemiology of obesity[J].Gastroenterol Clin North Am,2010,39(1):1-7.
[2]周吉银,周世文.小檗碱降糖调脂作用机制的研究进展[J].解放军药学学报,2007,23(3):201-204.
[3]Eto K,Yamashita T,Matsui J,et al.Genetic manipulations of fatty acid metabolism in beta-cells are associated with dysregulated insulin secretion[J].Diabetes,2002,51(3):S414-S420.
[4]Leclerc I,Woltersdor WW,da Silva Xavier G,et al. Metformin,but leptin,regulates AMP-activated protein kinase in pancreatic islets:impact on glucose-stimulated insulin secrertion[J].Am J Physiol Endocrinol Metab,2004,286(6):E1023-E1031.
[5]Viollet B,Lantier L,Devinleclerd J,et al.Targeting the AMPK pathway for the treatment of type 2 diabetes[J].Front Biosci,2009,14(9):3380-3400.
[6]殷 俊,胡仁明,陈名道,等.小檗碱、齐墩果酸和大蒜新素对糖代谢作用的体外研究[J].北京中医药大学学报,2003,26(2):36-39.
[7]王增四,陆付耳,陈 广,等.小檗碱对NIT-1细胞胰岛素分泌和葡萄糖激酶活性的影响[J].药理学报,2007,42(10):1045-1049.
[8]Zhou L,Wang X,Shao L,et al.Berberine Acutely inhibits insulin secretion from β-Cells through 3',5'-cyclicAdenosine 5'-monophosphate signaling pathway[J].Endocrinology,2008,149(9):4510-4518.
[9]戴建峰,陈美娟,郭 睿.黄连素对2型糖尿病大鼠血糖、血脂、血压、胰岛素敏感指数的影响[J].内蒙古中医药,2014,33(9):126-128.
[10]王永刚,尤金枝,尚俊平,等.四黄降糖颗粒对胰岛素抵抗模型大鼠降糖作用的研究[J].湖南中医药大学学报,2012,32(11):16-19.
[11]Li Y,Wang P,Zhuang Y,et al.Activation of AMPK by berberine promotes adiponectin multimerization in 3T3-L1 adipocytes[J].FEBS Lett,2011,585(12):1735-1740.
[12]Kim WS,Lee YS,Cha SH,etal.Berberine improves lipid dysregulation in obesity by controlling central and peripheral AMPK activity[J].Am J Physiol Endocrinol Metab,2009,296(4):E812-E819.
[13]Jeong HW,Hsu KC,Lee JW,et al.Berberine suppresses proinflammatory responses throngh AMPK activation in macrophages[J].Am J Physiol Endocrinol Metab,2009,296(4):E955-E964.
[14]Lee YS,Kim WS,Kim KH,et al.Berberine,a natural plant product,activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states[J].Diabetes,2006,55(8):2256-2264.
[15]Cheng Z,Pang T,Gu M,et al.Berberine stimulated glucose uptake in L6 myotubes involves both AMPK and p38 MAPK[J].Biochim Biophysica Acta,2006,1760(11):1682-1689.
[16]Richards SK,Parton LE,Leclerc I,et al.Over-expression of AMP-activated protein kinase impairs pancreatic β-cell function in vivo[J].J Endocrinol,2005,187(2):225-235.
[17]da Silva Xavier G,Leclerc I,Salt IP,et al.Role of AMP-activated protein kinase in the regulation by glucose of islet βcell gene expression[J].Proc Natl Acad Sci USA,2000,97(9):4023-4028.
[18]邵 莉,李凤英,周丽斌.二甲双胍激活MIN6细胞AMPK活性并抑制其胰岛素分泌[J].放射免疫学杂志,2008,21(2):100-102.
[19]Hardie DG,Scott JW,Pan DA,et al.Management of cellular energy by the AMP activated protein kinase system[J].FEBS Lett,2003,546(1):113-120.
[20]Hohmeier HE,Newgard CB.Cell lines derived from pancreatic islets[J].Mol Cell Endocinol,2004,228(2):121-128.
(本文编辑 李 杰)
Effect of Berberine on Insulin Secretion in NIT-1 Cells
HU Yayun1,DONG Hui2
(1.The First Hospital of Wuhan,Wuhan,Hubei 430000,China;2.Institute of Integrative Traditional Chinese and Western Medicine of Tongji Hospital,Huazhong University of Science and Technology,Wuhan,Hubei 430030,China)
ObjectiveTo investigate the effect of berberine on insulin secretion of NIT-1 cells and the possible molecular mechanism.MethodsThe proper concentrations of berberine,insulin secretion level of NIT-1 cells,protein expression of AMP-activated protein kinase (AMPK)were detected by MTT,radioimmunoassay,and Western blotting.ResultsIn ordinary culture medium and in high glucose contained cultured medium,berberine significantly inhibited the proliferation of NIT-1 cells at the concentration of 100 μmol/L (P<0.05).However,berberine significantly inhibited the proliferation of NIT-1 cells in high fat cultured medium.Berberine,at the concentration of 10 μmol/L,acutely (at 1 hour incubation)decreased but chronically (at 24 hours incubation)increased insulin secretion from NIT-1 cells in high glucose and palmitic acid contained culture medium (P<0.01,P<0.05).Berberine could promote the expression of AMPK protein in NIT-1 cells induced by high glucose and high fat.ConclusionBerberine not only acts as a AMPK activator to regulate insulin secretion,but also may affect insulin secretion through other pathways.
berberine;NIT-1 cells;insulin
R285
A
10.3969/j.issn.1674-070X.2017.07.009
2015-12-10
国家自然科学基金资助项目(81673757,30973896)。
胡亚耘,女,硕士,研究方向:内分泌及代谢方向,E-mail:407347509@qq.com。
