外源Ca2+对莲藕幼苗盐胁迫的缓解效应
2017-07-10李淑艳蒋润枝杨健君程立宝李良俊
李淑艳,印 荔,蒋润枝,杨健君,程立宝,李良俊*
(1.扬州大学广陵学院,江苏 扬州 225009;2.扬州大学园艺与植物保护学院,江苏 扬州 225009)
莲藕(Nelumbo nuciferaGaertn)是睡莲科多年水生草本植物,原产于中国、印度,现在中国、日本及东南亚地区均有种植,是中国种植面积最大的水生蔬菜。莲藕产品主要有鲜藕、藕粉和莲籽,均含有丰富的淀粉、蛋白质、维生素以及矿物质,具有较好的营养保健功能,深受国内外广大消费者的喜爱。近年来中国莲藕制品开发力度加大,加工产品种类日益丰富,出口创汇数不断增加,现已稳据日韩市场的70%以上,成为重要的出口创汇蔬菜之一,所以有关性状的研究越来越多[1]。
土壤中的盐(主要是NaCl)是影响植物生长的重要环境因子之一,盐含量过高会导致植物生长受抑,严重时会导致植株死亡。渗透胁迫是盐害的表现形式之一。随着土壤中盐含量的增加,土壤溶液水势降低,植物吸水能力逐渐减弱,细胞膨压与渗透势发生变化,引起细胞失水[2]。离子毒害是盐害的另一种表现。细胞膜系统受到过量Na+和Cl-离子的伤害,导致膜透性增大,胞内电解质外渗,细胞代谢失调。当大量Na+在细胞内积累,导致K+外渗,使Na+/K+值增大,离子平衡被打破[3]。盐害可以通过产生活性氧,造成活性氧代谢失调,进而破坏蛋白质、不饱和脂肪酸和核酸等生物分子,引起蛋白质降解、脂质过氧化、酶失活和色素脱色等[4]。
钙在细胞中起到第二信使的作用,参与植物生长发育的各个过程的调控。在植物受到逆境胁迫时,植物能通过提高细胞质中游离的Ca2+浓度,将胞外信号变为胞内信号,进而调控细胞代谢[5]。张乃华[6]发现外源Ca2+可减轻盐胁迫对玉米叶片膜结构的伤害,降低叶绿素的降解。另外Ca2+能维持根系细胞膜结构的稳定、促进根细胞质膜K+通道的开放及根系对K+的选择性吸收[7]。Ca2+能够提高盐胁迫下幼苗根细胞质H+-PPase活性及根系呼吸强度,为液泡膜的Na+-H+交换提供能量。外源Ca2+可减少植株根中Na+向地上部运输,使Na+较多地滞留在根部,叶片的Na+/K+和Na+/Ca2+值下降[8]。
本试验研究了莲藕幼苗在盐胁迫下对外源钙离子的响应,通过分析各项生理指标的变化,了解外源钙离子对盐胁迫的缓解作用,为深入研究莲藕耐盐机制和耐盐种质改良提供参考。
1 材料和方法
1.1 试验材料
试验材料为莲藕H2品种,种植于扬州大学水生蔬菜试验基地。选取生长健壮的种藕栽植于小缸(上口直径30 cm,下口直径18 cm,深度24 cm)内,缸内土壤取自于试验田中同一区域,加入少量饼肥后混匀,每个缸中装土9 kg。
1.2 试验设计
待植株长出2~3片立叶时,利用0(CK)、50、100、150 mmol/L的NaCl对材料进行盐胁迫处理,再分别对NaCl处理进行10、20、30 mmol/L的Ca(NO3)2处理。分别于处理后1、2、3、4 d取样,测定各项生理指标。各处理重复3次。
1.3 试验方法
1.3.1 叶绿素含量测定
参照李合生[9]的方法。取新鲜叶片,擦净,剪碎混匀,称0.2 g的叶片放入50 mL的离心管(3次重复),加入25 mL 95%乙醇,放在黑暗处浸提至叶片变白无绿色,期间摇动数次,加速提取。将提取液倒入比色杯中,以95%乙醇为空白对照,测定在波长652 nm下的OD值。

式中:V:提取液总量(mL);m:叶片鲜质量(mg);n:稀释倍数(此处为1)。
1.3.2 细胞膜透性测定
参照张志良等[10]的方法。称取0.2 g鲜样,用无离子水洗净,剪碎后放入试管中并加入20 mL无离子水,震荡30 min后再在室温下静置30 min,用DDS-IIA型电导率仪测定溶液的电导率(E1),然后置于沸水浴中10 min,冷却后测定溶液总电导率(E2),无离子水电导率为E0,相对电导率(P)按以下公式计算:
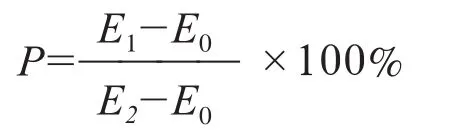
1.3.3 蛋白质含量测定
参照李合生[9]的方法。
1.3.3.1 考马斯亮蓝G-250蛋白染色剂与蛋白质标准溶液的配制
称取100 mg考马斯亮蓝G-250,溶于50 mL 95%乙醇中,加入100 mL 85%正磷酸,最后加蒸馏水至1 000 mL,搅拌后放置过夜,过滤后贮于棕色瓶中备用,常温下可放置1个月。
称取100 mg牛血清蛋白,溶于蒸馏水中,定容至100 mL,制成1 000 μg/mL母液。
1.3.3.2 标准曲线制作
取6支10 mL具塞试管,分别加入0、20、40、60、80、100 μL牛血清蛋白母液,用蒸馏水定容至100 μL,以上各管中分别加入5 mL考马斯亮蓝G-250蛋白染色剂,将试管置于涡旋混匀器上充分混匀后放置2 min,于595 nm下比色制作标准曲线。
1.3.3.3 酶液制备和样品测定
称取叶片0.2 g,加入2~4 mL pH为7.8的磷酸缓冲液(PBS)并研磨,15 000 r/min(4 ℃)下离心15 min,取上清液定容至5 mL,取部分上清液经适当的稀释后用于蛋白测定。取0.1 mL粗提液于10 mL具塞试管中,加入5 mL考马斯亮蓝G-250蛋白染色剂,将试管置于涡旋混匀仪上充分混匀后放置2 min,于595 nm下比色,再从标准曲线上算得待测样品中蛋白质的含量。
1.3.3.4 丙二醛(MDA)含量的测定
参照李合生[9]的方法。称取1 g叶片,加入10%三氯乙酸(TCA)2 mL和少许石英砂研磨,再加入8 mL TCA进一步研磨后装入10 mL具塞试管中,于离心机中12 000 r/min离心10 min,提取上清液。取3 mL上清液于具塞试管中,对照管中加入3 mL 10%TCA,再分别加入3 mL 0.6%硫代巴比妥酸(TBA),混合后于沸水浴上反应15 min,冷却后12 000 r/min离心10 min,以对照调零,于紫外可见分光光度计532、600、450 nm处比色。按以下公式计算MDA含量:

1.3.4 脯氨酸含量的测定
参照李合生[9]的方法。
1.3.4.1 标准曲线制作
分别吸取0.00、0.50、1.25、2.50、5.00、7.50、10.00、15.00 mL标准母液加入50 mL容量瓶中,定容。吸取标准溶液2 mL、冰醋酸2 mL、茚三酮2 mL,加入到10 mL具塞试管中,沸水浴15 min,测定520 nm处的OD值。利用测定结果及脯氨酸浓度制作标准曲线。
1.3.4.2 提取与测定
称取3份样品,每份1 g,剪碎后加入80%乙醇及少许石英砂研磨。研磨后的匀浆转移至20 mL试管中,用80%乙醇清洗定容,80 ℃水浴20 min,之后加入约0.4 g的人造沸石和0.2 g活性炭,强烈振荡5 min,过滤,滤液备用。吸取上述提取液2 mL,加入2 mL冰醋酸和2 mL茚三酮试剂,于沸水浴中反应15 min,冷却后测定520 nm处各样品的OD值,从标准曲线上查出每毫升被测样品中脯氨酸的含量。
1.3.5 超氧化物歧化酶(SOD)活性测定
参照张志良等[9]的方法。吸取3 mL的反应混合液(54 mL 14.5 mmol/L甲硫氨酸、2 mL 3 μmol/L EDTA、2 mL 2.25 mmol/L氯化硝基四氮唑蓝(NBT)、2 mL 60 μmol/L核黄素),然后加入酶液,对照管中加入磷酸缓冲液(PBS),在4 000 lx光照培养箱或日光灯下照光20 min,以对照管调零,测定560 nm处的OD值。
1.4 数据分析
试验数据采用SPSS软件及Duncan多重比较法(P<0.05)进行统计分析。
2 结果与分析
2.1 外源Ca2+对盐胁迫下莲藕叶片叶绿素含量的影响
研究表明,不同浓度盐胁迫下,除50 mmol/L NaCl处理外,莲藕叶片叶绿素含量随胁迫时间的延长大致呈先升高后下降的变化趋势(图1A)。在50 mmol/L盐胁迫下,随着施加Ca2+浓度的升高,30 mmol/L的Ca2+处理在第4天比未施Ca2+的盐胁迫处理叶绿素含量有所增加(图1B);在100 mmol/L盐胁迫下,20 mmol/L的Ca2+处理中的叶绿素含量高于其他处理组(图1C);在150 mmol/L盐胁迫下,所有浓度的Ca2+处理第4天的叶绿素含量显著高于未施Ca2+的盐胁迫处理(图1D)。
2.2 外源Ca2+对盐胁迫下莲藕叶片细胞膜透性的影响
随盐胁迫浓度的提高和处理时间的延长,莲藕叶片细胞的相对电导率总体上呈增加趋势,第4天后均显著高于对照(图2A)。施加Ca2+后,莲藕叶片相对电导率总体表现先上升后下降的趋势,说明Ca2+对盐胁迫具有缓解作用;在50 mmol/L盐胁迫下,外源Ca2+处理使得叶片相对电导率上升趋势减缓(图2B);在100 mmol/L盐胁迫下,外源Ca2+处理的叶片相对电导率在第4天均显著低于未施Ca2+的盐胁迫处理(图2C);在150 mmol/L盐胁迫下,施加Ca2+第4天莲藕叶片相对电导率虽显著高于CK植株,但均低于未施加Ca2+的处理(图2D)。
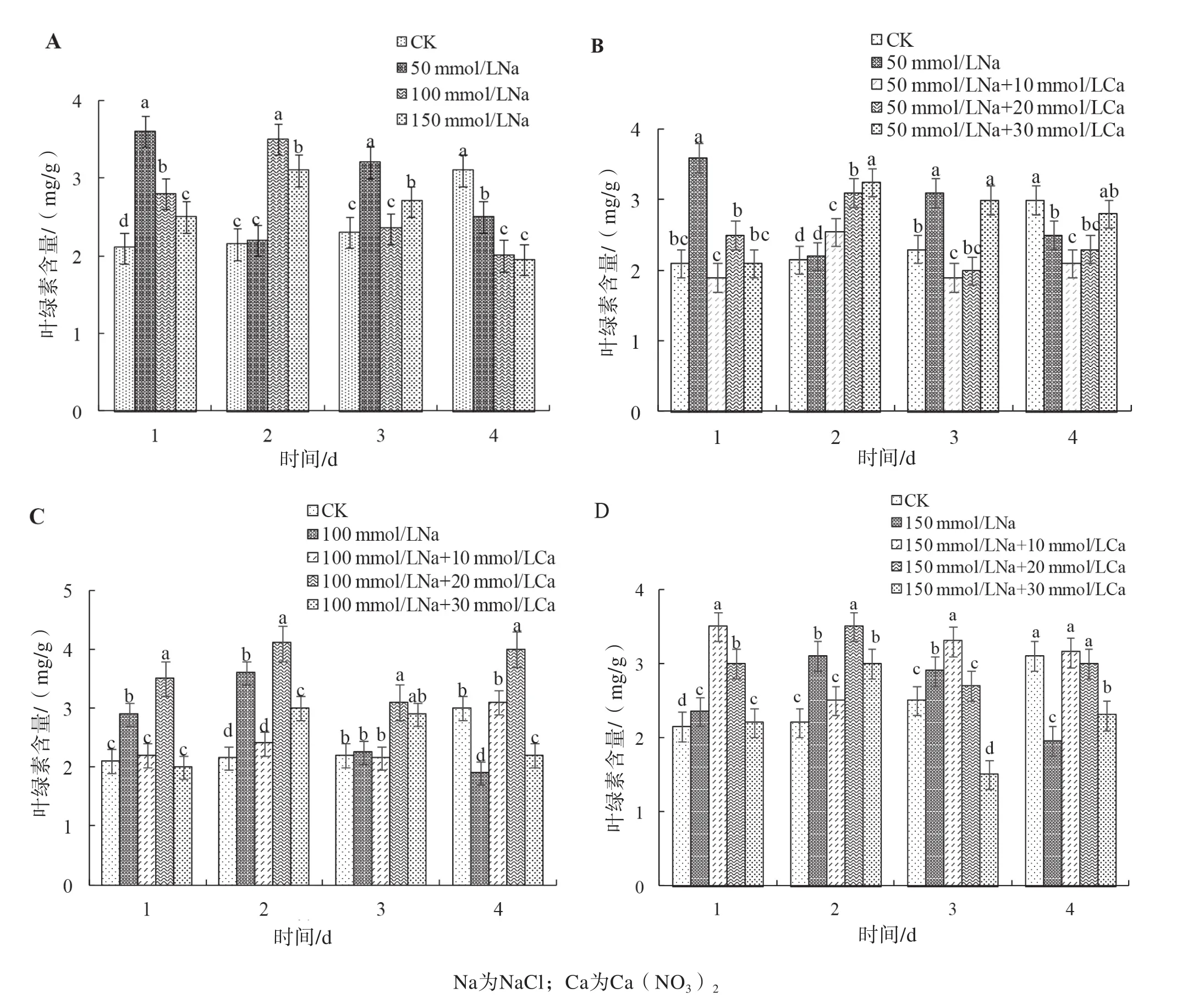
图1 外源Ca2+对盐胁迫下莲藕叶片叶绿素含量的影响
2.3 外源Ca2+对盐胁迫下莲藕叶片可溶性蛋白含量的影响
受盐胁迫后,莲藕幼苗叶片可溶性蛋白含量总体呈先上升后下降趋势(图3A)。施加外源Ca2+可增加盐胁迫后叶片的可溶性蛋白含量,且不同浓度的Ca2+对可溶性蛋白含量增加的效果不同。在50 mmol/L盐胁迫下,30 mmol/L的Ca2+处理效果最明显(图3B);100 mmol/L盐胁迫下,各浓度Ca2+处理中可溶性蛋白含量先上升,第3天后效果有所下降(图3C);150 mmol/L盐胁迫下,10 mmol/L的Ca2+处理效果最好(图3D)。
2.4 外源Ca2+对盐胁迫下莲藕叶片SOD活性的影响
NaCl处理下,随着盐浓度升高,莲藕幼苗叶片SOD活性总体呈上升趋势(图4A)。加入Ca2+处理后,SOD活性也呈现上升趋势,且上升幅度高于对照。在50 mmol/L盐胁迫下,SOD活性在30 mmol/LCa2+处理下显著增强(图4B);100 mmol/L盐胁迫下,各浓度Ca2+对SOD活性均有较好的增加效果(图4C);150 mmol/L盐胁迫下,10 mmol/L和20 mmol/L的Ca2+处理效果最好(图4D)。
2.5 外源Ca2+对盐胁迫下莲藕叶片丙二醛含量的影响
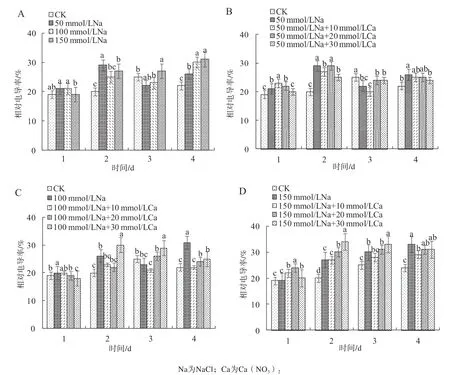
图2 外源Ca2+对盐胁迫下莲藕叶片相对电导率的影响
受盐胁迫后,莲藕幼苗叶片丙二醛(MDA)含量随处理时间的延长呈上升趋势(图5A),加入Ca2+处理后,MDA含量总体呈现先上升后下降的趋势(图5B~D)。由此说明,一定浓度的外源Ca2+能降低盐胁迫下膜脂受伤害的程度,增强植物对盐环境的抗性。在50 mmol/L盐胁迫下,MDA含量在Ca2+处理后总体呈先上升后下降的趋势,第3~4天比未施Ca2+处理均显著降低,100 mmol/L盐胁迫下,MDA含量在10、20 mmol/L Ca2+处理下均表现为先上升后下降;150 mmol/L盐胁迫下,MDA含量在Ca2+处理下总体也呈现先上升后下降的趋势。
2.6 外源Ca2+对盐胁迫下莲藕叶片脯氨酸含量的影响
随着盐胁迫浓度增加,莲藕叶片的脯氨酸含量呈逐渐上升趋势(图6A);随着外源Ca2+处理浓度的升高,不同盐处理下的脯氨酸含量均有不同程度的升高(图6B~D)。50、100 mmol/L盐处理下,20 mmol/L与30 mmol/L的Ca2+处理可使脯氨酸含量的积累速率加快;150 mmol/L盐处理下,10 mmol/L与20 mmol/L的Ca2+可加速脯氨酸含量的积累。
3 结论
3.1 不同浓度的Ca2+对莲藕叶片可溶性蛋白含量增加的效果不同。在50 mmol/L盐胁迫下,30 mmol/L的Ca2+效果最明显;100 mmol/L盐胁迫下,各浓度Ca2+处理可溶性蛋白含量先上升,第3天后有所下降;150 mmol/L盐胁迫下,10 mmol/L的Ca2+处理效果最佳。
图3 外源Ca2+对盐胁迫下莲藕叶片可溶性蛋白含量的影响
3.2 在50 mmol/L盐胁迫下,叶片SOD活性在30 mmol/L的Ca2+处理下显著增强;100 mmol/L盐胁迫下,各浓度Ca2+对SOD活性均有较好的增加效果;150 mmol/L盐胁迫下,10 、20 mmol/L的Ca2+处理效果最佳。
3.3 加入不同浓度Ca2+的处理下,植株体内的MDA含量总体呈现先上升后下降的趋势,各浓度Ca2+处理表现基本一致。
3.4 50、100 mmol/L盐处理下,20 mmol/L与30 mmol/L的外源Ca2+可使莲藕叶片脯氨酸含量的积累速率增加;150 mmol/L盐处理下,10 mmol/L与20 mmol/L的外源Ca2+能够显著提高脯氨酸含量。
4 讨论
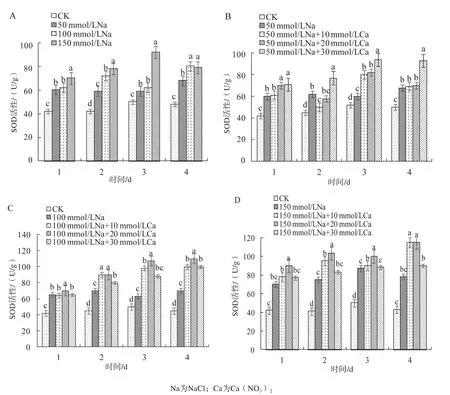
图4 外源Ca2+对盐胁迫下莲藕叶片SOD活性的影响
植物在盐胁迫环境下,自身有机体的功能会产生变化以适应环境,当盐浓度过高,超出植物自身调节范围时,则导致植物生长受到影响甚至死亡。植物受到盐胁迫后,最先受到影响的是细胞质膜,因细胞中钠离子的过度积累,具有保护膜脂作用的Ca2+被置换,膜结构及膜的稳定性遭到破坏[11]。钙元素是一种植物生长必需的矿质营养,也是细胞内生理生化反应的第二信使,它可维持质膜及膜结合蛋白的稳定,调控酶活性,调节离子运输[12-13]。在植物受到盐胁迫时,施加外源钙提高植物细胞质中游离Ca2+浓度,可保护质膜结构,抑制活性氧生成,维持植物正常光合作用,进而缓解盐害效应。薛延丰等[14]研究表明,外源Ca2+可增强植株光合作用,维持较高的SOD活性,降低MDA含量和细胞膜透性。马淑英等[15]研究结果表明,Ca2+通过提高拟南芥对盐胁迫的适应而增加脯氨酸含量,增强植物抗离子、渗透和氧化等胁迫的能力,从而缓解盐对幼苗的伤害,提高拟南芥的耐盐性。本试验结果发现,外源Ca2+处理后,莲藕幼苗叶片MDA的含量降低,与对照比较差异不显著,可能是由于钙对质膜与膜结合蛋白的稳定作用,将受到破坏的磷脂双分子层及镶嵌其中的蛋白结构恢复,也使得植株内的蛋白质含量略有增加。外源Ca2+能够使脯氨酸含量显著增加,提高SOD活性,这与前人研究结果相似,说明外源Ca2+处理可缓解盐对莲藕的伤害,提高其耐盐性。
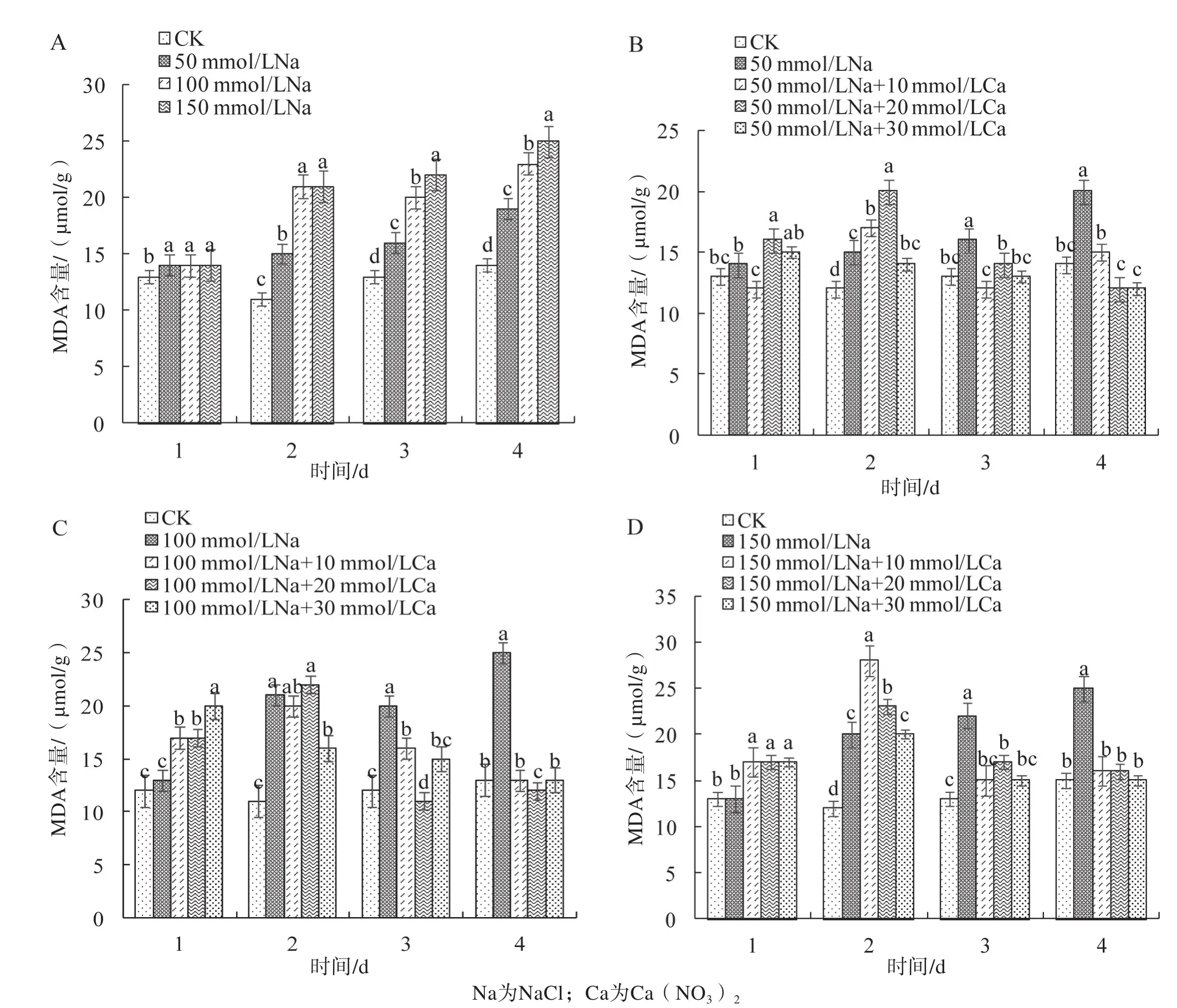
图5 外源Ca2+对盐胁迫下莲藕叶片丙二醛含量的影响
在盐胁迫下脯氨酸含量的增加可有效保护植物体内的酶活性[16],防止质膜受损,保护多核糖体的功能[17]。盐胁迫下植物光合作用受到抑制的机理非常复杂,与植物光合系统的诸多方面均有关。盐胁迫能提高叶绿素酶的活性,加快叶绿素b的分解,进而影响植株发育[18],影响类囊体的组成,降低其膜的垛叠能力,为保持叶肉细胞的水势,叶片气孔关闭也严重影响二氧化碳的进入,进而影响光合作用。本试验中,不同浓度的盐胁迫下,莲藕叶片内的叶绿素含量显著降低,而加入Ca2+后,莲藕叶片内的叶绿素含量均显著提高,说明外源Ca2+能缓解莲藕的盐害效应。
[1] CHENG L B, LI S Y, YIN J J, et al. Genome-Wide Analysis of Differentially Expressed Genes Relevant to Rhizome Formation in Lotus Root (Nelumbo nuciferaGaertn) [J].PLOS ONE,2013,8(6): e67116.
[2] SILAMBARASAN N, NATARAJAN S. Impact of NaCl stress on plant growth and antioxidant property ofClerodendron inerme[J]. International Journal of Advanced Scientif i c and Technical Research,2014,4(2):430-438.
[3] RAO A A, LAKHO M H, LEGHARI N, et al. Effect of Salt (NaCl) Stress on Seed Germination Seedling Growth and Na+, K+Uptake in Maize[J]. European Academic Research,2016,5(4):4188-4206.
[4] 杨淑慎,高俊凤.活性氧、自由基与植物的衰老[J].西北植物学报,2001,21(2):36-41.
[5] BRAAM J, DAVIS R W. Rain, wind and touch-induced expression of calmodulin and calmodulin related genes inArabidopsis[J]. Cell,1990,60:357-364.
[6] 张乃华.外源Ca2+对盐胁迫玉米叶片光抑制的缓解效应[D].泰安:山东农业大学,2004.
[7] JIN J, CUI H M, YANG Y F, et al. Exogenous CaCl2reduces salt stress in sour jujube by reducing Na+and increasing K+, Ca2+, and Mg2+in different plant organs[J]. The Journal of Horticultural Science and Biotechnology,2017,92(1):98.
[8] 章文华,陈亚华,刘友良.钙在植物细胞盐胁迫信号转导中的作用[J].植物生理学通讯,2000,36(2):146-153.
[9] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[10] 张志良,瞿伟箐.植物生理学实验指导[M].北京:高等教育出版社,2003.
[11] 丁红瑾,陈彦云,曹君迈,等.外源钙对贮藏期马铃薯细胞膜及过氧化物酶的影响[J].中国农学通报,2013,29(14):103-106.
[12] GUIMARAES F V A, DE LACERDA C F, MARQUES E C. Supplemental Ca2+does not improve growth but it affects nutrient uptake in NaCl-stressed cowpea plants[J].Brazilian Journal of Plant Physiology,2012,124(1):9-18
[13] 余叔文,汤章城.植物生理与分子生物学[M].2版.北京:科学出版社,1998:316-317.
[14] 薛延丰,刘兆普.Ca2+对盐胁迫下菊芋幼苗的生长、生理反应和光合能力的影响理论[J].农业工程学报,2006(9):44-47.
[15] 马淑英,赵明.钙对拟南芥耐盐性的调节[J].作物学报,2006,32(11):1706-1711.
[16] ARAKAWA T, TIMASHEFF S N. The stabilization of proteins by osmolytes[J]. Biophysical Journal,1985,47:411.
[17] RUDOLPH A S, CRPWE J H, CROWE L M. Effects of three stabilizing agentsproline. Betaine,and trehaloseon membrane phospholipids[J]. Archives of Biochemistry& Biophysics, 1986, 245(1):134.
[18] SOZHARAJAN R,NATARAJAN S. Influence of NaCl salinity on plant growth and nutrient assimilation ofZea maysL.[J]. Journal of Applied and Advanced Research,2016,1(1):54-61
