测序分析转录因子网络调控阿司匹林刺激下血管内皮细胞中的可变表达
2017-07-09刘芳单伟李舒王鹤鸣孙苑红
刘芳,单伟,李舒,王鹤鸣,孙苑红
(沈阳医学院附属中心医院,辽宁 沈阳 110024)
1 研究目的
分析药物(阿司匹林)刺激人脐静脉血管内皮细胞后基因差异表达,通过高通量测序分析差异基因的表达及相关的调控,以及对基因富集分析。
阿司匹林已应用百年,是医药史上三大经典药物之一,至今仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂。此外,研究已经证实阿司匹林具有抗炎抗栓等多种细胞保护作用[1]。阿司匹林因能使环加氧酶活性中心的丝氨酸乙酰化而失活,从而阻断血栓素合成以抑制血小板聚集,起到防止血栓形成的作用,因此,阿司匹林已被作为心脑血管病患者的一级和二级预防的主要措施[2]。阿司匹林是最早被应用于抗栓治疗的抗血小板药物,已经被确立为治疗急性脑梗死、心肌梗死(AMI)、不稳定心绞痛及心肌梗死(MI)Ⅱ期预防的经典用药。COXs是AA生成TXA2和前列腺素I2(PGI2)过程中的关键限速酶,在人体内有COX-1和COX-2两种形式,COX-1是PLT固有的[3]。尽管阿司匹林有明显的益处,但在最佳剂量和阿司匹林抵抗问题上仍存争议[4]。随着对抗血小板聚集药物研究的不断深入,临床面临的主要问题是确定抗血小板聚集药物的疗效和副作用的实验室监测指标。
2 实验方法
2.1 细胞传代
⑴将细胞取回后,放入37℃的培养箱中预温1~2 h后再做处理,以稳定细胞状态,待细胞密度达到90%以上时,对细胞进行传代。⑵吸光培养基,加入0.25%的胰蛋白酶液,37℃静置5 min。⑶加1640培养基终止消化,吹打,悬浮细胞。⑷离心(1 000rpm,5 min),弃上清,加 1640培养基(10%FBS+1%PS+1%EGS),吹打沉淀,形成重悬细胞。⑸以1传2或3接种于新培养瓶中,在CO2细胞培养箱中培养。
2.2 细胞冻存
⑴待细胞密度达到90%以上时,吸光培养基,加入0.25%的胰蛋白酶液,37℃静置5 min。⑵加1640培养基终止消化,吹打,悬浮细胞。⑶离心(1 000rpm,5 min),弃上清,加培养基,吹打沉淀,形成重悬细胞,离心,弃上清。⑷加冻存液,重悬,将细胞转移至冻存管中,-80℃冻存盒过夜,第2天取出冻存管,移入液氮容器内(冻存液配制:10%DMSO,90%小牛血清)。
2.3 细胞复苏
⑴从液氮容器中取出冻存管,迅速浸入37℃温水中,并不时摇动令其尽快融化。⑵待融化后,立即从37℃水浴中取出冻存管,在安全柜中打开盖子,用吸管吸出细胞悬液,转移至含有10倍以上培养液的离心管中,混匀。⑶离心(1 000 rpm,5 min),弃去上清液,加入培养液重悬细胞,计数,调整细胞密度,接种培养瓶,37℃培养箱静置培养。⑷次日更换一次培养液,继续培养。
2.4 阿司匹林实验
CCK-8实验检测阿司匹林对HUVEC细胞增殖影响:⑴铺96孔板,每孔8×103人脐静脉血管内皮细胞(HUVEC)。阿司匹林药业的配制:800 mg阿司匹林加入1 L ddH2O中,混匀,得到的浓度为1600 mg/L,作为母液使用。分别稀释成800mg/L,400mg/L备用。⑵第2天,处理细胞。药物处理组稀释药物浓度后的阿司匹林加入100μL的96孔板中,使阿司匹林的终浓度为 800 mg/L,400 mg/L,200 mg/L,100 mg/L,处理4 d。不加入阿司匹林作为对照组。⑶处理4 d后,加入10μL CCK-8至96孔板中,37℃反应4 h左右,用酶标仪在450 nm处检测吸光度。阿司匹林对HUVEC细胞有明显的增殖作用,在400 mg/L时,对细胞的增殖能力达到最大。
2.5 测序样本的处理
⑴将HUVEC消化,计数,用1640培养基(10%FBS+1%PS+1%EGS)稀释,铺平皿(60 mm平皿),每个平皿为2×105细胞。⑵第2天,加入阿司匹林使终浓度为400 mg/L,处理细胞4 d。对照组为加入完全培养基。⑶处理细胞4 d后收集细胞,加入1 mL TRizol,保存于-80℃。⑷待建库及测序。
3 实验步骤
3.1 RNA的提取
收获孵育后的细胞,RNAs用Trizol(Invitrogen Carlsbad,CA)提取。然后,RNA采用2%琼脂糖凝胶电泳与Agilent 2100生物分析仪进行验证,RNA纯度根据在260 nm和280 nm吸光光度值,(ABS)验证(标准:abs260/ABS280>1.8)。
3.2 CDNA文库构建与RNA测序
根据NEBNext Ultra RNA Library Prep Kit for Illumina 构建 CDNA文库((Invitrogen,Carlsbad,CA)。首先,利用聚合酶链反应扩增cDNA 12个周期循环。此后,构建CDNA文库。利用IlluminaHiSeq2500测序仪进行RNA测序(Illumina,San Diego,CA,USA)。参数设置如下:模式,HiSeq 2500 V4 100 PE;策略、双末端测序;读长,125 nt;数据大小>2 G。
3.3 读取滤过数据和成图
原始的读取数据包含一些低质量的读取数据,其20%或更多的碱基对质量评估得分小于20。因此,用NGS QC Toolkit(Patel and Jain 2012)重新读取数据,产生无异质的读取数据。然后,利用TopHat2 tool(Kim et al.2013)对比参考人类基因组(hg19)用 Bno-mixed模式进行数据成图,并从加州大学克鲁兹的网站下载RefSeq注释文件读取数据。
3.4 微分表达分析和聚类分析
基因的差异表达被定义为差异表达基因(DEGS)。为了确定阿司匹林组和对照组之间的差异表达基因,用Cuffdiff softwar(Trapnell et al.2012)对计算得到的差异表达基因值进行分析,这项分析的标准为P值<0.05,log2中心性介数(FC)>0.58。为了确定阿司匹林组和对照组之间的差异表达基因的特异性,用pheatmap软件执行双向聚类分析(Kolde 2012)。也用Euclidean distances相似模式进行聚类分析差异基因表达(Deza 2009)。
3.5 通路富集分析
为了确定差异表达基因的生物学通路,采用GOFunction package(Wang et al.2012),通路富集分析。注释文件设置标准:基因计数≥2和P值<0.05。
3.6 PPI网络的建设
构建蛋白质-蛋白质相互作用(PPI)网络:相关的差异表达基因是从 STRINGdatabase(Franceschini et al.2013)提取,选择PPIs结合评分>0.7。然后,利用Cytoscape软件(Smoot et al.2011)构建,并将PPI网络可视化。
3.7 差异表达基因的转录因子分析
基于TRED database (Jiang et al.2007)数据库,对调节差异表达基因的转录因子进行确定,构建转录因子目标调控网络,应用Cytoscape software将其可视化。
3.8 外显子的使用和选择性剪接
为了找出阿司匹林组与对照组的差异表达外显子,使用软件包DexSeqsoftwarepackage(Anders et al.2012)进行外显子应用分析。标准:生物传导的错误发生率<0.1。此后,对比阿司匹林组与对照组的HUVECs,确定相应的选择性剪接事件。
4 实验结果
4.1 目标调节网络
红圈的节点代表差异表达基因阿司匹林组上调,绿色圆圈代表节点度下调阿司匹林组,和黄色的钻石节点代表转录因子。某一节点的大小与该节点的度呈正相关。阿司匹林组与对照组间的基因差异表达。
4.2 通路富集分析
差异表达基因显著富集于11条通路(P值<0.05和基因计数≥2),而这些途径主要与细胞因子受体相互作用和趋化因子信号粘着相关。主要通路为细胞因子受体相互作用(Cytokine-cytokine receptorinteraction),ECM 受体相互作用(ECM-receptor interaction),类风湿性关节炎(Rheumatoid arthritis),粘着(Focal adhesion),补体与凝血级联 (Complement and coagulation cascades),轴突指导 (Axon guidance),疟疾(Malaria),趋化因子信号转导通路(Chemokine signaling pathway),糖胺聚糖合成硫酸软骨素(Glycosaminoglycan biosynthesis-chondroitin sulfate),粘蛋白型O-聚糖的生物合成(Mucin type O-glycan biosynthesis)及RIG-I样受体信号通路。通路富集分析,差异表达基因显著富集于11条通路(P值<0.05和基因计数≥2)
5 结论
⑴筛选出119个差异表达基因(DEGS)识别于阿司匹林组和对照组之间,发现它们都富集在与细胞因子受体相互作用和趋化因子信号相关的11条通路上。⑵构建阿司匹林刺激下的差异表达基因蛋白质-蛋白质相互作用网络,发现ISG15和MX1是关键枢纽性差异表达基因。构建差异表达基因和转录因子调控网络(TFS)发现CCL2和FN1(枢纽中心性表达基因)受NFKB1和RELA共同调节(枢纽性转录因子TFS)。⑶分析外显子的使用和选择性剪接发现在阿司匹林刺激下ADORA2A剪接发生改变。阿司匹林可影响血管内皮细胞的增殖和迁移,可能通过调节 ISG15,MX1,CCL2,FN1 以及 ADORA2A 的表达来参与血管生成过程。

图1 阿司匹林组与对照组之间的基因差异表达
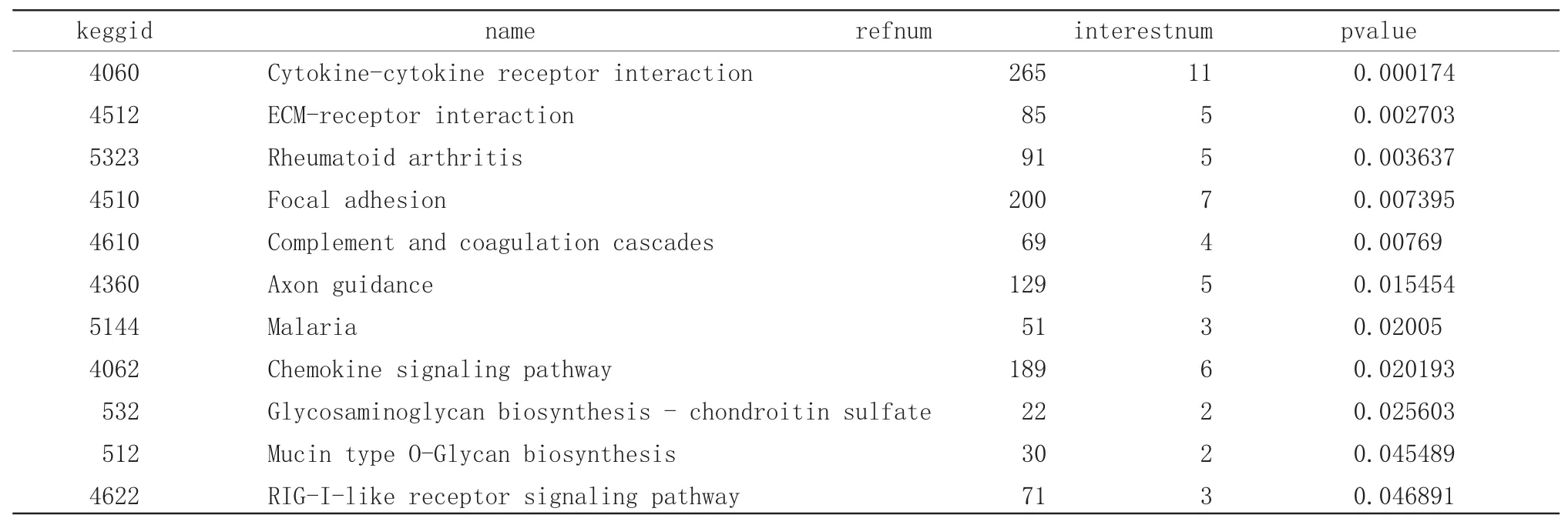
表1 差异表达基因通路富集分析
6 讨论
本文首先对RNA-seq数据进行常规化处理,筛选差异表达基因;再对差异基因进行富集分析,获取差异基因影响的生物学通路信息;然后对差异基因进行富集分析,查看差异基因之间的互作关系并给出与其他差异基因互作较多的差异基因;对差异基因进行转录调控网络分析;对序列比对文件进行外显子使用分析,筛选阿司匹林可能引起的基因选择性剪接。在体外,阿司匹林可诱导人脐静脉血管内皮细胞(HUVECs)增殖和迁移,并且促进血管形成,有益于脑卒中后功能恢复[5](Yin et al.2007)。然而,相应的机制还没有得到清楚的理解,特别是在转录因子目标调节和选择性剪接方面。在这项研究中,使用和未使用阿司匹林处理过的人脐静脉血管内皮细胞,进行转录组测序和生物信息学分析。测定结果,像ISG15和Mx1这些差异表达基因(DEGs)在蛋白质-蛋白质相互作用(PPI)网络有高度的表达,CCL2和 FN1这些差异性表达基因被NFKB1和 RELA共同调解。此外选择性剪切差异表达基因ADORA2被确定[6]。在以上的DEGs差异性表达基因中,ISG15编码的干扰素刺激基因15,对炎症介导的动脉粥样硬化及心血管疾病起作用。在阿司匹林刺激下,在HUVECs中ISG15和MX1表达显著下调,说明阿司匹林可能通过调节ISG15和MX1的表达影响动脉粥样硬化进程。编码的趋化因子配体2(C-C配型),CCL2被发现参与细胞因子及其受体相互作用和趋化因子的信号通路[7]。推测阿司匹林可能通过调节FN1的表达影响内皮细胞的迁移,阿司匹林可能通过调节ISG15和MX1的表达影响动脉粥样硬化的进程,影响趋化因子信号通路通过,调节CCL2和FN1表达后的增殖和迁移,通过调节剪接表达ADORA2A促进内皮细胞增殖[8]。虽然更多的研究仍然需要验证这些预测,这项研究的结果可能为进一步研究阿司匹林刺激背后的响应机制提供方向。此外,这些结果可能为临床使用阿司匹林恢复中风后功能提供基础知识。此外,未来的研究将更加关注本研究确定的差异性基因表达和选择性剪接。提示阿司匹林不仅能抗血小板聚集,预防血栓形成,而且有促进血管内皮因子生成的作用,可以上调相关血管生长因子的表达,促进血管新生,从而增加缺血部位的侧支循环,改善供血及预防血管狭窄、血栓形成[9]。在临床治疗血管疾病应用中,阿司匹林极其便捷,且价格便宜,临床应用前景广泛。
[1]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学学组.中国脑血管病一级预防指南2015[J].中华神经科杂志,2015,48(8):629-643.
[2]左凤同,刘辉,吴慧君,等.阿司匹林联合氯吡格雷治疗伴有血管狭窄的脑梗死的临床观察[J].现代生物医学迸展,2015,15(31):6104-6149.
[3]Laufs U,La Fata V,Plutzky J,et al.Upregulation of endothelial nitric oxide synthase by HMG-CoA reductase inhibitors[J].Circulation,1998,97(12):1129-1135.
[4]张鹏,邓亚萍,赵婷,等.抗血小板药阿司匹林对内皮祖细胞的影响[J].第二军医大学学报,2013,34(7):787-789.
[5]Channon KM.The Endothelium and the Pathogenesis of A-therosclerosis[J].Medicine,2006,30(4):54-58.
[6]何志旭,廖清奎,须学聚.阿司匹林诱导内皮细胞铁蛋白表达与抗氧化损伤作用的研究[J].中华医学杂志,2001,81(9):532-535.
[7]Weigand JE,Boeckel JN,Gellert P,et al.Hypoxia-induced alternative splicing in endothelial cells[J].PLoS One 7:e42697.
[8]Yin L,Morishige K,Takahashi T,et al.Fasudil inhibits vascularendothelial growth factor-induced abgiogenesis in vitro and in vivo[J].Mol Cancer Ther,2007,6:1517-1525.
[9]Zhang JY,Liu B,Wang YN,et al.Effect of rosuvastatin on OX40L and PPAR-gamma expression in human umbilical vein endothelial cells and atherosclerotic cerebral infarction patients[J].J Mol Neurosci,2014,52:261-268.
