抗白粉病黄瓜叶微卷突变体的叶片结构分析
2017-07-08戎福喜秦亚光陈菲帆张朝文赵子瑶胡亮亮李玉红
戎福喜,秦亚光,陈菲帆,张朝文,赵子瑶,胡亮亮,李玉红
(西北农林科技大学园艺学院 陕西杨凌 712100)
抗白粉病黄瓜叶微卷突变体的叶片结构分析
戎福喜,秦亚光,陈菲帆,张朝文,赵子瑶,胡亮亮,李玉红
(西北农林科技大学园艺学院 陕西杨凌 712100)
为了探讨黄瓜卷叶突变体的叶片结构与白粉病的抗性相关性,从植物抗性组织结构角度,分别对突变体和野生型材料的叶片、栅栏组织、海绵组织、上下表皮的厚度、表皮毛密度及叶片蜡质含量进行了显微形态观察与检测。结果表明,突变体的叶片形态结构发生了显著变化,叶片上、下表皮细胞增厚、栅栏组织变窄、海绵组织加厚且排列紧密;突变体表皮毛形态、数量无显著差异;突变体叶片蜡质含量显著高于野生型。叶片蜡质含量显著增高可能是突变体对白粉病抗性增强的原因之一。
黄瓜;突变体;白粉病;抗性;叶片结构
白粉病是黄瓜主要的真菌病害之一,严重影响产量和品质[1-2]。喷施杀菌剂是目前最主要的防治方法,但会导致环境污染、农药残留及病原菌抗药性增强等一系列问题[3],培育抗病品种是防治黄瓜白粉病最为经济有效的措施[4]。而挖掘新的抗性资源、解析其抗性机制是培育抗病新品种的基础和前提,不仅有助于加速抗病品种育种进度,而且也为白粉病防治提供新的思路。
植物先天的形态结构或经病原菌诱导而产生的变异组织结构是植物重要的物理抗病机制之一。前人研究发现植物的叶片表皮蜡质层及形态结构特征均与抗病性有关[5-8],如水稻叶片表面的蜡质层阻碍了纹枯病病原菌的繁殖,抗病品种的叶片蜡质含量明显高于感病品种[9];用氯仿除去油菜抗病品种叶表面蜡质后,抗性品种变得易感病[10];桉树叶片的蜡质层是抵抗和延迟病原菌侵入的最外层防线[11];向日葵抗病品种叶片的栅栏组织排列整齐、紧密,而且层数相对较多,可以抵抗病菌的侵入和扩展[12];在瓜类作物上,抗病苦瓜品系叶片的蜡质含量显著高于感病品系,叶片、下表皮、栅栏组织均增厚,叶片结构紧密度明显高于感病品系,可以作为苦瓜白粉病抗性鉴定的参考指标[13]。
由于白粉病抗性多为数量性状且表型鉴定易受环境的影响,以致黄瓜白粉病抗性研究进展缓慢。创制新种质、解析其抗性机制,是推进黄瓜白粉病抗性机制研究的另一个途径和方法。课题组在创制的黄瓜EMS突变体库中,筛选到一个叶微卷突变体‘C1561’,在白粉病的抗性方面与野生型差异极为明显。前期的遗传分析表明,突变体卷叶和白粉病的抗性性状均受同一个显性突变基因控制(暂时将其命名为PMrl),因此可用卷叶性状作为标记性状来解析突变体对白粉病的抗性机制。为解析PMrl所导致的白粉病抗性与叶片组织结构的相关性,笔者以突变体‘C1561’和野生型‘CCMC’为材料,从叶片的蜡质含量、上下表皮毛密度、叶片厚度等方面,对突变体和野生型的叶片组织结构特性进行分析,以期为后续的PMrl基因在白粉病抗性中的作用机制研究奠定基础。
1 材料与方法
1.1 材料
本研究所用的材料为叶微卷突变体‘C1561’和野生型‘CCMC’,其中突变体来自本课题组创制的EMS突变体库,并经过2代的自交筛选,性状稳定遗传。突变体‘C1561’与野生型‘CCMC’对白粉病的抗性差异显著(突变体‘C1561’的白粉病病情指数为 20.42±4.16,‘CCMC’的白粉病病情指数为50.60±12.73)。
1.2 方法
1.2.1 叶片组织结构测定 在成株期,从长势一致的突变体和野生型植株的第5片叶取样,每片叶选取具有代表性的5个部位,每个材料各取5片叶,设置3次重复。组织观察采用杨捷频[14]的石蜡切片方法,取样(样品规格5 mm×7 mm)、固定(4℃、24 h)、整染(42℃、12 h)、脱水、透明、浸蜡、包埋、切片、脱蜡、染色(番红-固绿)、封固、烘片,在BX-51型多功能显微镜下观察并拍照。用测微尺测量叶片横切面的厚度、上下表皮厚度、栅栏组织厚度、海绵组织厚度。叶片结构紧密度(CTR)、疏松度(SR)的计算,参考田丽波[13]等的方法。
CTR/%=(栅栏组织厚度/叶片厚度)×100;SR/%=(海绵组织厚度/叶片厚度)×100。
1.2.2 表皮毛密度测定 应用扫描电子显微镜对突变体、野生型植株叶片上、下表皮毛进行观察,样品选取方法同1.2.1。常规扫描电镜技术流程按照李波等[15]的方法略加修改,取样(样品规格5 mm×5 mm)、固定(4%戊二醛,2 h以上)、漂洗(pH 6.8,浓度0.1 mol·L-1,PBS 缓冲液浸洗 4 次,每次 10 min)、脱水(30%-50%-70%-80%-90%乙醇各1次,每次20min,100%乙醇3次,每次30 min)、中间液置换(酸异戊酯1次,20min)、干燥(真空)、粘台、镀膜、JSM-6360LV扫描电镜观察拍照。上、下表面各20个样品,3次重复。
1.2.3 蜡质含量测定 参照田丽波[13]的方法进行蜡质含量测定。各取10个叶片,3次重复。
1.3 数据处理
简单数据处理整理软件Excel,差异显著性分析软件SPSS 23.0,绘图软件GraphPad Prism 5。
2 结果与分析
2.1 突变体与野生型叶片横切面显微结构特征分析
叶片组织排列紧密有利于抵制病原菌侵入。突变体与野生型的叶片横切面显微结构显示,突变体与野生型叶片横切面结构存在明显差异,其叶片横切面变窄,上、下表皮细胞加厚;栅栏组织变短,海绵组织变厚,细胞排列紧密(图1)。
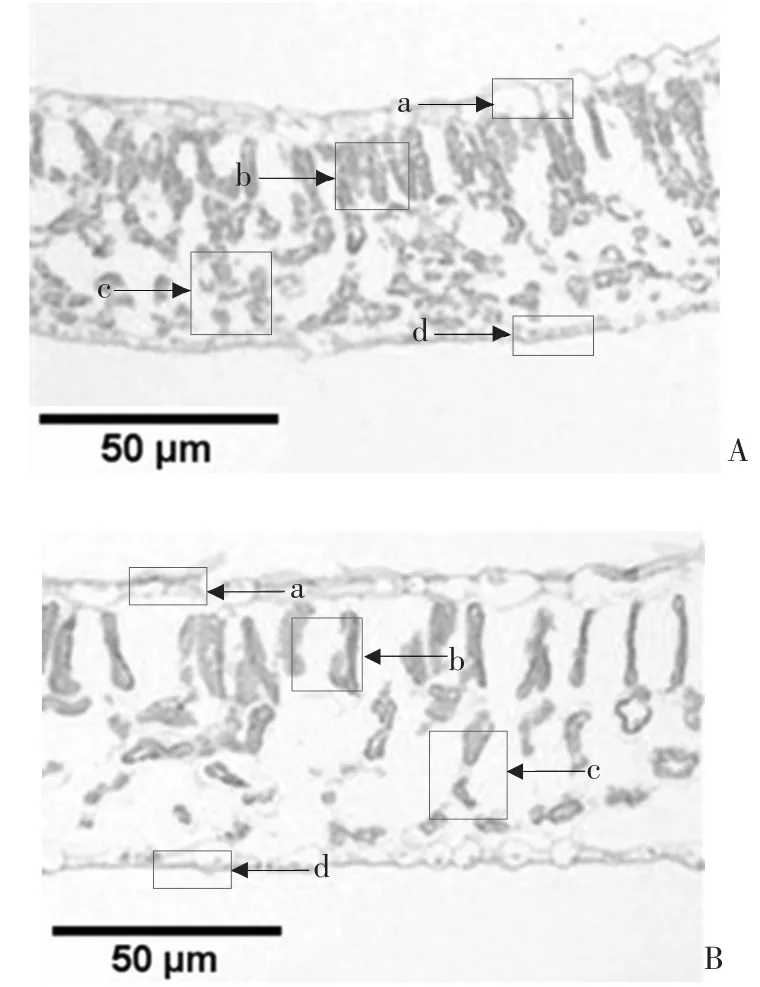
图1 黄瓜突变体‘C1561’(A)与野生型‘CCMC’(B)的叶片横切面结构
对突变体与野生型的叶片、栅栏组织、海绵组织厚度进行了测量(表1),结果表明,突变体叶片变薄,叶片厚度为 96.85 μm,而野生型为 123.10 μm,差异极显著。在叶片上、下表皮厚度上,突变体均大于野生型,二者在下表皮厚度上差异显著,其中野生型上、下表皮平均厚度分别为10.67、6.24 μm,突变体为13.08、8.06 μm。在栅栏组织、海绵组织上,突变体与野生型差异极为显著,突变体栅栏组织和海绵组织均变小,野生型的栅栏组织、海绵组织的厚度分别为37.28、67.04 μm,突变体为20.66、55.06 μm。野生型栅栏组织、海绵组织占整个叶片横切面的比例分别为30.28%、53.82%,突变体分别为21.43%、56.60%,与野生型相比,突变体叶片结构紧密度降低、疏松度提高,紧密度差异极显著。

表1 黄瓜突变体和野生型显微结构差异分析
2.2 野生型与突变体叶片表皮毛比较分析
由图2和图3可以看出,突变体与野生型在表皮毛形态上无显著差异;在表皮毛数量上,野生型叶片正、背面表皮毛密度分别为3.9、7.4个·mm-2,而突变体为4.0、8.0个·mm-2,二者无显著差异。
2.3 突变体与野生型叶片蜡质含量比较分析
突变体‘C1561’叶片的蜡质含量显著增多,突变体叶片蜡质平均质量分数为13.43 mg·g-1,而野生型叶片蜡质平均质量分数为6.90 mg·g-1,二者差异极显著(图4)。
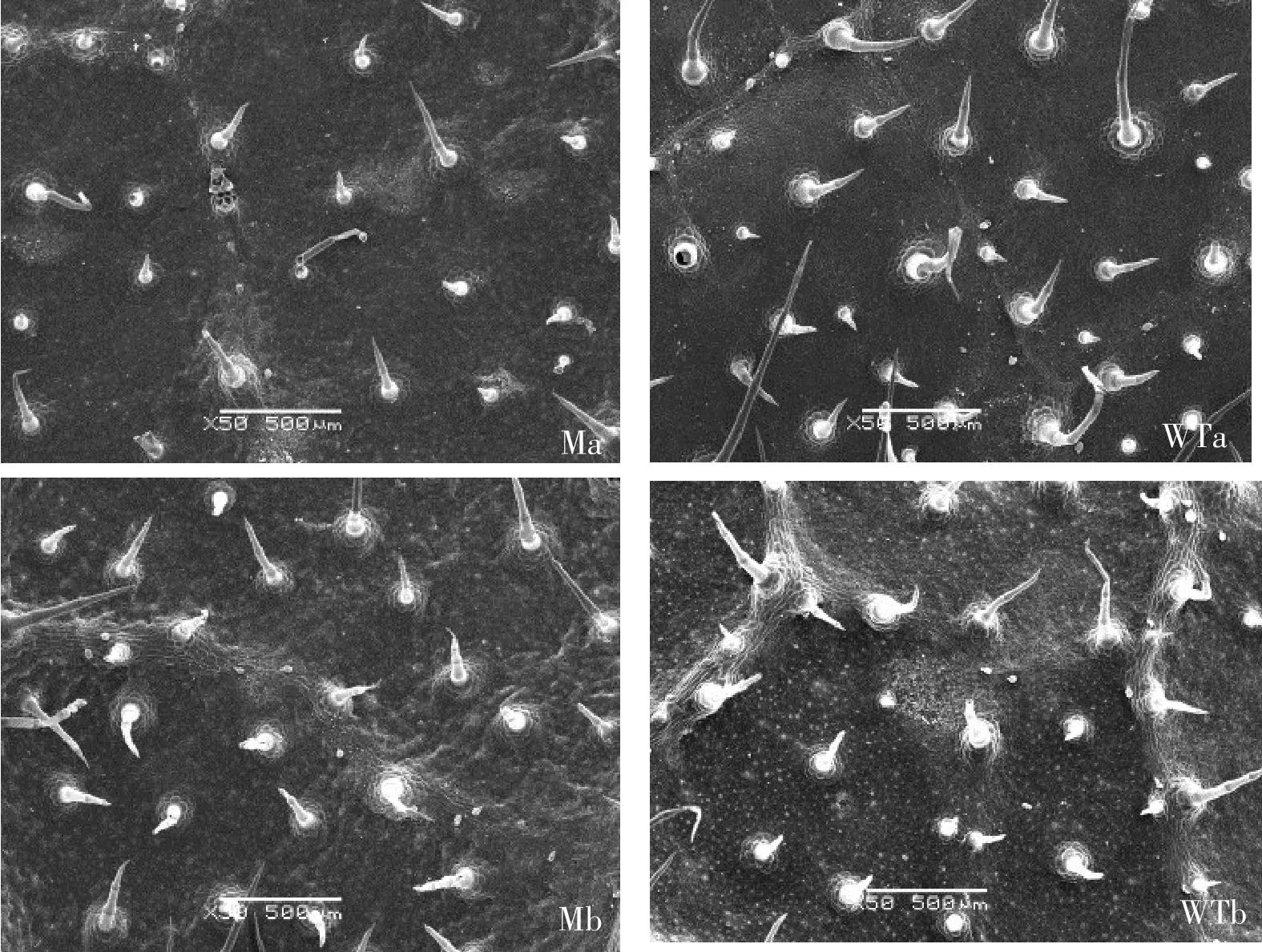
图2 突变体与野生型叶片表皮毛扫描电镜观察
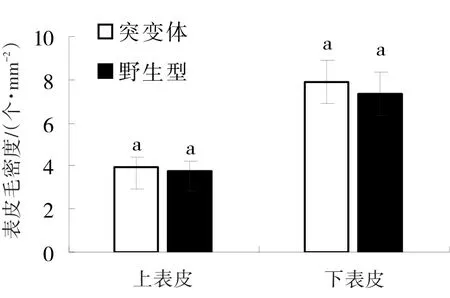
图3 黄瓜突变体和野生型叶片表皮毛密度差异分析

图4 黄瓜突变体和野生型叶片蜡质含量差异分析
3 讨 论
植物在与病原菌相互作用、相互适应的长期进化过程中,形成了一套完整的自我防御结构,如形成角质层、蜡质层、木栓层、气孔、表皮毛、紧密排列的组织等。比较一致的观点认为,木栓层、角质层厚,表皮毛密度大,气孔密度小,叶片组织结构紧密、排列整齐,细胞壁较厚,可能是抗白粉病的原因之一[16]。对苦瓜叶片结构与抗白粉病关系的研究认为,叶片厚度、栅栏组织厚度、下表皮厚度、叶片结构紧密度与白粉病抗性呈正相关,而海绵组织厚度、叶片结构疏松度与抗性呈负相关[13]。笔者对黄瓜突变体及野生型叶片横切面显微形态组织结构观察显示,与野生型相比,突变体叶片栅栏组织、海绵组织结构排列致密,上、下表皮细胞层均加厚。依此可以从组织结构上解释突变体增强了对白粉菌入侵的抵抗性。
叶表面蜡质层是植物与外界环境直接的接触面。真菌在叶表面附着与侵染时,表皮蜡质层最先起到抵抗与延缓的作用,因此,蜡质被认为是植物抵抗生物及非生物逆境、自我防护的一道结构屏障。在水稻[9]、番茄[17]、甘蓝型油菜[10]等多种植物上均有相关报道。大部分研究结果都表明,植物蜡质含量与抗病性呈正相关,抗病植株的叶片蜡质含量显著高于感病植株[18-19];如蜡质层有助于大豆延缓和抵抗灰斑病病原菌的入侵[20];清除叶片蜡质的甘蓝型抗病油菜抗病性显著减弱,由此认为蜡质的结构及组分可能是产生抗病效应的机制之一[10];苦瓜蜡质含量与白粉病抗性呈显著正相关,叶片蜡质含量越高的品系,对白粉病的抗性越强[13]。本研究中突变体叶片蜡质含量显著高于野生型,可能是由于基因突变而引起蜡质含量或组成成分发生改变,从而对白粉病产生了一定的抗性。
[1] XU X,YU T,XU R,et al.Fine mapping of a dominantly inherited powdery mildew resistance major-effect QTL,Pm1.1,in cucumber identifies a 41.1 kb region containing two tandemly arrayed cysteine-rich receptor-like protein kinase genes[J].Theoretical and Applied Genetics,2016,129(3):507-516.
[2] LEBEDA A,KŘÍSTKOVÁ E,SEDLÁKOVÁ B,et al.Cucurbit powdery mildews:methodology for objective determination and denomination of races[J].European Journal of Plant Pathology,2016,144(2):399-410.
[3] FUKINO N,YOSHIOKA Y,SUGIYAMA M,et al.Identification and validation of powdery mildew(Podosphaera xanthii)-resistant loci in recombinant inbred lines of cucumber(Cucumis sativus L.)[J].Molecular breeding,2013,32(2):267-277.
[4] ZHANG P,ZHU Y,WANG L,et al.Mining candidate genes associated with powdery mildew resistance in cucumber via super-BSA by specific length amplified fragment(SLAF)sequencing[J].BMC Genomics,2015,16(1):1-14.
[5] STEINKAMP M P,MARTIN S S,HOEFERT L L.Ultrastructure of lesions produced by Cercospora beticola in leaves of Beta vulgaris[J].Physiological Plant Pathology,1979,15(1):13-26.
[6] ESPELIE K E,SADEK N Z,KOLATTUKUDY P E.Composition of suberin-associated waxes from the subterranean storage organs of seven plants:Parsnip,carrot,rutabaga,turnip,red beet,sweet potato and potato[J].Planta,1980,148(22):468-476.
[7] FISHER I .The role of exocarp thickness in the production,consumption and selection of paprika for consumption[J].Genet Breed Capsicum,1994,8:106-109.
[8] KOLLER W.PARKER D M,BECKER C M.Role of cutinase in the penetration of apple leaves by Venturia inaequalis[J].Phytopathol,1991,81:1375-1379.
[9] 陈志宜.水稻纹枯病抗性机制的研究[J].中国农业科学,1996,25(4):41-46.
[10] 王婧,刘泓利,宋超,等.甘蓝型油菜叶表皮蜡质组分及结构与菌核病抗性关系[J].植物生理学报,2012,48(10):958-964.
[11] 冯丽贞,刘玉宝,郭素枝,等.桉树叶片的解剖结构与其对焦枯病抗性的关系[J].电子显微学报,2008,27(3):229-234.
[12] 王丽芳.向日葵抗锈病生理机制及超微结构的研究[D].呼和浩特:内蒙古农业大学,2008.
[13] 田丽波,商桑,杨衍,等.苦瓜叶片结构与白粉病抗性的关系[J].西北植物学报,2013,33(10):2010-2015.
[14] 杨捷频.常规石蜡切片方法的改良[J].生物学杂志,2006,23(1):45-46.
[15] 李波,于海龙.12种苜蓿叶片表面微形态结构的比较[J].电子显微学报.2016,35(2):156-162.
[16] 李淼,檀根甲,李瑶,等.猕猴桃品种叶片组织结构与抗溃疡病的关系[J].安徽农业科学,2002,30(5):740-742.
[17] 康立功,齐凤坤,许向阳,等.番茄叶片蜡质和角质层与芝麻斑病菌侵染的关系[J].中国蔬菜,2010(18):47-50.
[18] 顾俊,王飞,张鹏,等.植物叶表皮蜡质的生物学功能[J].江苏农业学报,2007,23(2):144-148.
[19] WANG F,ZHANG P,QIANG S,et al.Interaction of plant epicuticular waxes and extracellular esterases of curvularia eragrostidis during infection of digitaria sanguinalis and festuca arundinacea by the fungus[J].International Journal of Molecular Sciences,2006,7(9):346-357.
[20] 李海英,刘亚光,杨庆凯.大豆叶片结构与灰斑病抗性的研究Ⅱ.大豆叶片组织结构与灰斑病抗性的关系[J].中国油料作物学报,2002,24(2):58-60.
The leaf structure in cucumber slightly curly leaf mutant of resistance to powdery mildew
RONG Fuxi,QIN Yaguang,CHEN Feifan,ZHANG Chaowen,ZHAO Ziyao,HU Liangliang,LI Yuhong
(College of Horticulture,Northwest A&F University,Yangling 712100,Shaanxi,China)
To explore the relationship between the leaf structure of slightly curly leaf in cucumber mutant and resistance to powdery mildew,the mutant and wild cucumber material were observed and detected respectively from plant resistance organization structure.The indexes mainly included the leaf thickness,palisade tissue thickness,sponge tissue thickness,thickness of upper and lower epidermis,the density of trichomes and blade wax content.The results showed that the mutant leaf morphological structure changed significantly.The transverse section and palisade tissue of mutant leaf blade narrowed down,upper and lower epidermal cells were thicker,sponge tissue thicken and packed closely.There was no significant difference in the morphology and density of the mutant trichomes;the leaf wax content of the mutant is significantly higher than that of the wild type.These results suggested that higher wax content play an important role in resistance to powdery mildew.
Cucumber;Mutant;Powdery mildew;Resistance;Leaf structure
2016-11-11;
2017-02-10
国家自然科学基金(31071791;31471891);高校基本科研业务费专项资金(YQ2013003);西北农林科技大学国际科技合作基金项目
戎福喜,男,在读博士研究生,主要从事蔬菜育种与生物技术研究。E-mail:191186282@qq.com
李玉红,女,教授,主要从事黄瓜种质资源与生物技术研究。E-mail:Liyuhong73@126.com.
