CHPPC联合静脉化疗对老年胃癌患者肿瘤标志物含量及免疫功能的影响
2017-07-07于嘉伟袁洪新马利林孙乃至
于嘉伟,袁洪新,马利林,孙乃至
(南通大学附属医院1.胃肠外科,2.肿瘤化疗科,江苏 南通 226000)
·论 著·
CHPPC联合静脉化疗对老年胃癌患者肿瘤标志物含量及免疫功能的影响
于嘉伟1,袁洪新2,马利林1,孙乃至1
(南通大学附属医院1.胃肠外科,2.肿瘤化疗科,江苏 南通 226000)
目的:探讨循环腹腔热灌注化疗(CHPPC)联合静脉化疗对老年胃癌患者术后肿瘤标志物含量及机体免疫功能的影响。方法:将104例胃癌患者按数字表法随机纳入对照组(行单纯静脉化疗)和研究组(行CHPPC联合静脉化疗)各52例,比较两组患者短期化疗效果、肿瘤标志物表达量、免疫功能、药物毒副作用、复发率及生存率的差异。结果:研究组与对照组短期治疗有效率(67.3%vs28.8%)及肿瘤标志物CEA(3.42±2.44vs9.64±4.53)、CA199(15.44±4.35vs29.52±9.53)、CA242(4.31±2.52vs18.7±7.45)差异均具有统计学意义(P<0.05);且两组CD3+、CD4+、CD8+及CD4+/CD8+值差异也有统计学意义(P<0.05);此外研究组复发率(19.2%)低于对照组(48.0%)(P<0.05)。结论:采用CHPPC联合静脉化疗治疗老年胃癌患者,有助于提高患者短期治疗效果,并降低患者肿瘤标志物表达水平,提高免疫功能。
循环腹腔热灌注化疗; 胃癌; 免疫功能; 肿瘤标志物
据统计,胃癌在全球恶性肿瘤发病率中位居第4;死亡率位居第2[1],已严重威胁到人类健康;同时,全球人口老年化加剧及不良生活、饮食现象的增加,使得每年胃癌发病率及死亡率显著增加。此外,由于我国开展癌症早期筛查项目起步晚,早期诊断技术水平有限,使得大部分确诊患者多已处于中晚期[2]。而作为进展期胃癌患者,即使是采取规范的肿瘤根治术及辅助治疗,仍有40%以上几率会出现腹腔内复发转移,使得患者5年生存率大大降低[3]。因此,针对常见癌症术后腹腔内复发转移问题,采用循环腹腔热灌注化疗(continuous hyperthermic peritoneal perfusion chemotherapy, CHPPC)技术被认为具有实质性疗效。其特点在于将热疗与化疗相结合,通过高热不仅能抑制大多数肿瘤细胞生长,同时也有利于抗肿瘤药物的热动力学效应[4]。本研究旨在探讨胃癌患者采取CHPPC联合静脉化疗或单纯静脉化疗情况下,对其血液中肿瘤标志物表达量及免疫功能的影响,从而进一步验证CHPPC在肿瘤临床治疗中的应用效果。
1 资料与方法
1.1 一般资料
采用前瞻性研究法,将2010年4月至2014年3月在我院诊治且符合纳入标准的老年胃癌患者共计104例,按其入院时顺序编号后以数字表法分别纳入研究组(采用CHPPC联合静脉化疗)和对照组(采用单纯静脉化疗),每组52例。两组患者年龄、性别、病变部位、病理类型、T分期、Borrmann分型等差异均无统计学意义(P>0.05),见表1。
表1 两组患者一般资料比较
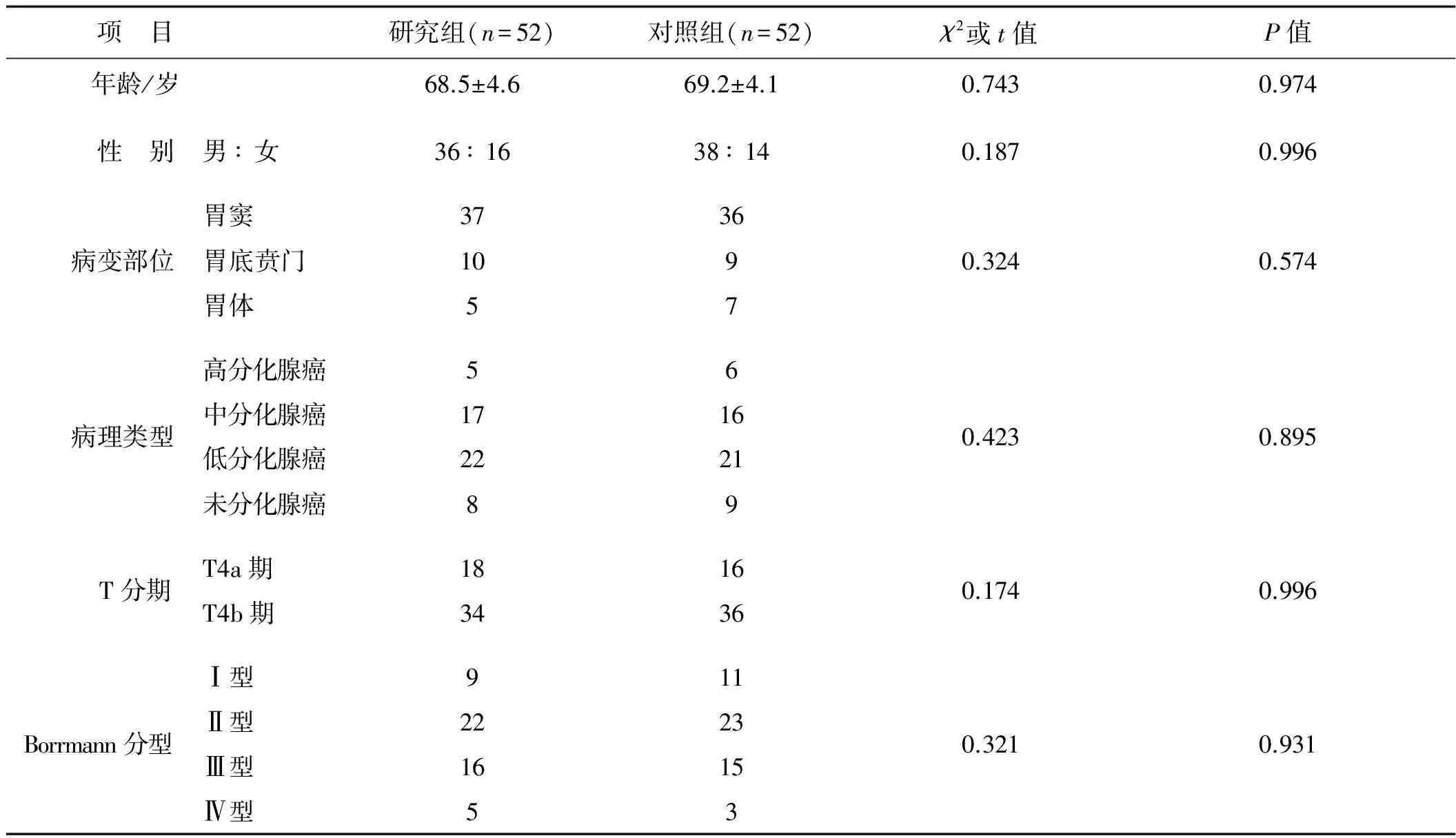
项 目研究组(n=52)对照组(n=52)χ2或t值P值 年龄/岁68.5±4.669.2±4.10.7430.974 性 别男∶女36∶1638∶140.1870.996病变部位胃窦3736胃底贲门109胃体570.3240.574病理类型高分化腺癌56中分化腺癌1716低分化腺癌2221未分化腺癌890.4230.895 T分期T4a期1816T4b期34360.1740.996Borrmann分型 Ⅰ型911Ⅱ型2223Ⅲ型1615Ⅳ型530.3210.931
注:表中数据单位除标注者外均为例
纳入标准:(1)病理诊断确诊为胃癌,且胃癌处于T4a期或T4b期;(2)无手术及化疗禁忌;(3)术前腹腔无手术史;(4)化疗前患者各项检查如血常规、尿常规、肝功能、肾功能及心电图指标均正常;(5)患者年龄60~75岁之间。
排除标准:(1)术前3个月内有放、化疗史;(2)有严重的心、肝、肾等脏器疾病;(3)存在腹腔感染、肠梗阻或腹腔粘连及各种瘘。
以上研究经我院伦理委员会审核通过,所有患者知情并签署知情同意书。
1.2 治疗方法
研究组在采用对照组相同静脉化疗基础上,早期进行CHPPC,步骤如下:先清除引流管内坏死脱落组织、血块等,将50 mg顺铂溶于2 000~3 000 ml生理盐水,并经热化疗机加热至38 ℃后,由引流管注入腹腔(流速100~300 ml·min-1),待患者适应水温后,逐渐调温至42~45 ℃,维持1 h。灌注过程中对患者进行心电监测,必要时予盐酸布桂嗪注射液缓解疼痛。灌注完毕,放出灌注液至剩余液体约1 000 ml,将灌注管连接引流袋,使腹腔内剩余灌注液流出。
1.3 评估标准
1.3.1 短期疗效判断 参考文献[5],采用实体肿瘤疗效评价标准1.1版本(Response Evaluation Criteria in Solid Tumors 1.1,RECIST 1.1)对治疗8周后患者肿瘤反应情况,按完全缓解、部分缓解、疾病稳定及疾病进展进行评估,其中治疗总有效率=(完全缓解例数+部分缓解例数)/总例数。

1.3.3 免疫功能检测 采用流式细胞仪检测患者CD3+、CD4+、CD8+及CD4+/CD8+值,大致步骤如下:化疗完成后8周,空腹采取患者外周血,加入肝素钠抗凝后,加入相应的荧光标记抗体,室温避光15~20 min,加入溶血素,室温避光15~20 min,离心弃上清,PBS洗涤细胞,离心,加入固定液后上机(BD流式细胞仪C6)。
1.3.4 毒副反应 治疗期间按国际卫生组织所制定的毒性反应标准[6]对患者异常症状进行记录及分级。
1.3.5 随访 两组患者治疗后每3个月定期来我院复查,由专人记录是否存在早期复发或肿瘤转移情况,并对患者生存期进行汇总。
1.4 统计学处理

2 结 果
2.1 短期治疗效果
研究组短期治疗总有效率高于对照组,差异具有统计学意义(χ2=15.41,P=0.004),见表2。
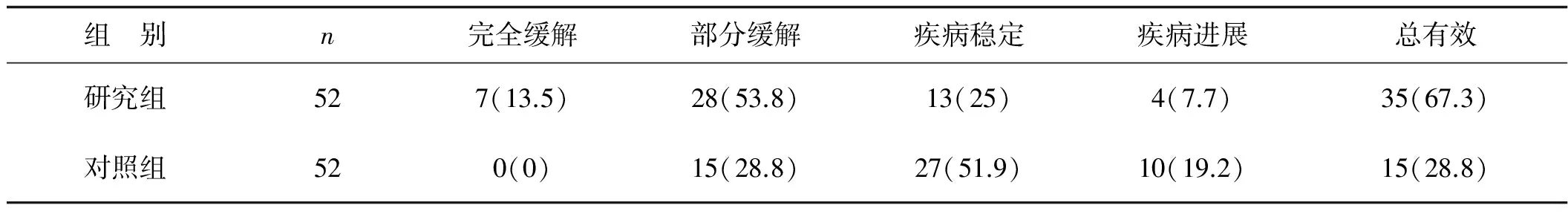
表2 两组患者短期疗效比较 例
注:括号中为百分率
2.2 肿瘤标志物含量
两组肿瘤标志物CEA、CA199、CA242表达量治疗前差异无统计学意义(P>0.05),化疗完成8周后差异具有统计学意义(P<0.05),见表3。
2.3 免疫功能
化疗完成8周后,研究组患者CD4+、CD3+百分比及CD4+/CD8+值均高于对照组,CD8+百分比低于对照组,差异均有统计学意义(P<0.05),见表4。
表3 两组患者治疗前后肿瘤标志物含量比较

时 间组 别nCEA/μg·L-1CA199/U·ml-1CA242/U·ml-1治疗前研究组5229.83±17.4352.95±21.4137.92±18.44对照组5228.72±16.3551.81±19.7737.15±19.14t值0.3420.3130.369P值0.9540.8940.915治疗后研究组523.42±2.4415.44±4.354.31±2.52对照组529.64±4.5329.52±9.5318.7±7.45t值6.4647.8858.735P值0.0380.0390.041
表4 两组患者治疗后免疫功能指标比较

组 别nCD3+/%CD4+/%CD8+/%CD4+∶CD8+研究组5258.32±2.4547.11±2.8329.74±1.451.58±0.09对照组5242.40±4.3332.56±2.6938.12±1.740.85±0.09t值4.3524.1143.5142.591P值0.0480.0390.0420.044
2.4 不良反应
灌注过程中患者可有轻微腹胀、出汗、胸闷、头昏等不适,若出现突然腹痛、大汗、胸闷不适,则立即停止灌注,并予吸氧、补液等相应处理。经统计,两组患者局部烫伤、骨髓抑制、恶心呕吐、脱水以及肾、肝功能损伤等不良反应发生率差异均无统计学意义(P>0.05),见表5。
表5 两组患者不良反应发生情况比较

组 别毒副反应程度局部烫伤骨髓抑制恶心呕吐脱水肾功能损伤肝功能损伤研究组Ⅰ+Ⅱ度5+3(15.4)19+13(61.5)13+17(57.7)8+5(25.0)9+4(25.0)8+4(23.1)Ⅲ+Ⅳ度0(0)2+1(5.8)7+5(23.1)1+1(3.9)1+0(1.9)0(0)对照组Ⅰ+Ⅱ度0(0)14+10(46.2)11+14(48.1)9+5(30.8)7+5(23.1)9+6(28.8)Ⅲ+Ⅳ度0(0)2+0(3.8)5+3(15.4)2+0(3.9)0(0)1+0(1.9)χ2值8.6670.6643.8730.0450.2050.782P值0.070.9560.4230.9990.9950.941
注:括号中为百分率
2.5 复发率及生存率
随访显示,研究组5例(9.6%)发生腹腔内转移,5例(9.6%)发生肝转移,均低于对照组[17例(32.7%),8例(15.4%)],两组复发率差异具有统计学意义(χ2=9.689,P=0.046)。此外,截至2016年5月对随访2年以上患者死亡率进行统计显示,研究组死亡2例(3.8%),1例为肝转移,1例为腹腔内复发;对照组死亡8例(15.4%),3例为肝转移,5例为腹腔内复发。
3 讨 论
肿瘤患者实施胃癌根治术后,其腹腔内残留的微小癌病灶以及游离的癌细胞是导致术后出现腹腔内癌症复发及肝转移的主要因素[7]。但是,即使腹腔内存在少量游离癌细胞,其发生腹腔内癌细胞种植转移的几率也远远高于血管或淋巴管内转移。此外,手术中无法完全切除的微小癌病灶在纤维蛋白凝固物等物质包围下还可形成用于抵抗免疫细胞吞噬的隔离层[8],从而增加癌症转移或复发的风险。目前广泛应用的全身辅助性化疗,虽然能在一定程度上减少癌细胞向其他部位转移的几率,但是大多数化疗药物达到腹腔时,药物浓度已经不足以杀灭癌细胞,而增加给药剂量,患者往往无法耐受药物的毒副作用。因此,采取一种更为直接及有效的化疗方式迫在眉睫。
近年来,CHPPC技术因其针对性强、疗效显著、安全性高等优点而逐渐被临床医务工作者所认可。其可能的作用机理如下[9]:(1)局部较高的血药浓度有利于直接杀伤癌细胞;(2)高热可抑制肿瘤细胞核酸及蛋白合成、诱导细胞凋亡基因等;(3)高热可提供机体免疫功能,促进抗原抗体结合,发挥免疫杀伤作用;(4)热疗灌注途经门静脉后入肝,可避免癌细胞经门静脉等途经发生转移。但是盲目地采用CHPPC也并非可取,临床研究[10]报道,化疗药物多针对表面游离肿瘤,且抗肿瘤药物仅能穿透5~6层细胞,其穿透能力有限,无法提高血液中药物浓度;此外,部分化疗药物热增敏效果仍不确定。因此本研究根据患者身体状况,对研究组患者采取CHPPC联合静脉化疗,其目的是在提高局部药物浓度的同时,也增加血液中药物浓度,从而获得更好的肿瘤杀伤效果。而结果证实,研究组患者其短期治疗效果(67.3%)显著高于对照组(28.8%),且随访期间,研究组19.2%的患者存在肿瘤转移或复发,显著低于对照组的48.1%。提示该联合方案确实具有明显优势。但是,两组在2年随访时间内死亡率上差异并无统计学意义(χ2=3.983,P=0.408),其可能原因是随访时间较短而使两组差异未显现。
为进一步揭示化疗效果,本研究选用了临床上常见的肿瘤标志物CEA、CA199、CA242作为判断标准之一。结果显示,研究组患者经化疗后CEA、CA199、CA242表达水平均较化疗前有明显下降,且下降程度高于对照组。我们推测,CHPPC对微小癌灶及游离癌细胞起到了确切的杀伤作用。与此同时,免疫细胞相关检测结果也证实了研究组患者免疫功能恢复较快。而这与热疗能提高免疫细胞活性,诱导免疫细胞再分布及提高某些细胞因子的表达从而改善免疫功能具有一定相关性[11]。另外,关注药物治疗效果的同时,对其可能引起的毒副作用也应当引起重视。本研究结果显示,研究组8例患者出现局部烫伤,其可能原因是个体差异以及温度上升过快所致,但两组在副毒作用等方面差异无统计学意义(P>0.05),可见,CHPPC联合静脉化疗其本身安全性并不会降低。
综上所述,对于老年胃癌患者,术后采用CHPPC联合静脉化疗方案,有利于提高患者短期治疗效果,提高免疫功能,减少肿瘤复发率及转移率。而后续研究应在增加纳入病例数的基础上,增加随访时间,从而使结果更具有说服力。


[6] 李家泰.临床药理[M].北京:人民卫生出版社,1996:594.


Effect of CHPPC combined with intravenous chemotherapy on tumor marker contents and immune function in elderly patients with gastric cancer
(1.DepartmentofGastrointestinalSurgery; 2.DepartmentofOncologyandChemotherapy,HospitalAffiliatedtoNantongUniversity,Nantong226000,China)

continuous hyperthermic peritoneal perfusion chemotherapy; gastric cancer; immune function; tumor markers


R735.2; R730.53
A


