不同饵料组成对花鲈幼鱼生长和生理活性影响研究
2017-07-07温海深李吉方张美昭张凯强王晓龙常志成
田 源, 温海深, 李吉方, 张美昭, 张凯强, 王 伟, 王晓龙, 常志成
(中国海洋大学 水产学院 海水养殖教育部重点实验室, 山东 青岛 266003)
不同饵料组成对花鲈幼鱼生长和生理活性影响研究
田 源, 温海深, 李吉方, 张美昭, 张凯强, 王 伟, 王晓龙, 常志成
(中国海洋大学 水产学院 海水养殖教育部重点实验室, 山东 青岛 266003)
为探究不同饵料组成对北方人工繁育花鲈(Lateolabrax maculatus)幼鱼生长和生理活性的影响,优化花鲈幼鱼饵料组成, 作者采用投喂不同组成的饵料研究其对花鲈幼鱼的生长和消化酶活性的影响,实验采用63日龄幼鱼, 设4个处理组, 分别组1投喂卤虫(Artemia)、组2高蛋白配合饲料、组3低蛋白配合饲料和组4冰鲜桡足类, 共40 d。结果表明, 组2的生长速度、最终体长、体质量、特定生长率、绝对生长率、增质量率均大于其余3组, 组3的生长状况次之, 但与其他2组并无显著性差异(P<0.05); 除组1的蛋白酶最大活性出现在实验中期, 其他3组的蛋白酶变化与其生长状况相符, 最大值均出现在103日龄, 各组间差异显著; 4组的淀粉酶活性呈上升趋势, 在103日龄时, 组1的淀粉酶活性大于组2, 并显著大于组3和组4; 组1的脂肪酶活性在实验后期迅速上升, 并在103日龄达到最大值, 而其余3组的脂肪酶活性呈下降趋势, 103日龄时组3和组4脂肪酶活性显著小于组2和组1 (P<0.05)。研究表明, 花鲈幼鱼摄食高蛋白配合饲料生长状况最好, 摄食低蛋白配合饲料生长状况次之,摄食卤虫状况最差, 出于经济的考虑, 建议投喂低蛋白配合饲料。
花鲈(Lateolabrax maculatus)幼鱼; 不同饵料; 生长; 消化酶活性
花鲈 (Lateolabrax maculatus) 隶属于鲈形目科(Serranidae)、花鲈属(Lateolabrax),为东北亚特有种类, 主要分布于中国、日本、朝鲜沿海, 属广温广盐性浅海近岸中下层鱼类, 为中国南、北方重要的网箱与池塘养殖经济鱼类之一[1], 肉质细腻营养丰富, 深受消费者欢迎。
近10余年来, 北方花鲈苗种多数来自捕捞, 不仅年际波动大, 而且对渔业资源造成了巨大损伤。因此,北方花鲈苗种产业对全国花鲈养殖产业的发展尤为重要。北方花鲈工厂化育苗技术虽日趋完善, 但饵料问题仍然是工厂化育苗的关键问题之一。国内对花鲈仔鱼、稚鱼饵料组成方面已有过研究[2-5], 但对幼鱼时期的优质饵料组成并没有进行深入的探索。目前, 南方花鲈幼鱼时期主要依靠投喂鲜活桡足类, 而北方幼鱼生产时期由于自然条件的限制, 不能人工培育大量桡足类来满足产业化育苗的需要, 因此, 优化花鲈幼鱼饵料组成是促进花鲈苗种产业发展的关键因素之一。
生物学指标可以从表面上宏观反应出幼鱼的生长和健康状况, 而鱼类消化酶活性不仅可以反应基本的消化生理特征, 还可以作为衡量鱼类对饲料营养成分消化、吸收和利用的重要指标[6-7], 其活性的高低决定鱼类对营养物质的消化吸收的能力大小[8-9]。 (Perciformes)、作者从北方的花鲈养殖生产实际出发, 选取4种常规饵料来探究对花鲈幼鱼生长性能和消化酶活性的影响, 以期了解饵料与消化酶之间的关系, 提高花鲈幼鱼对饵料的消化利用率, 为花鲈苗种培育技术的完善提供科学参考。
1 材料与方法
1.1 实验材料
实验用鱼是来自东营市利津县双瀛水产苗种有限责任公司自繁的花鲈幼鱼, 初始规格: 体长 2.21 cm ± 0.15 cm, 体质量 0.24 g ± 0.08 g。实验所用活饵为卤虫(Artemia)无节幼体, 37℃卤虫卵孵化36 h, 用120目筛绢滤过后充气12 h后, 用强化剂(裂壶藻(Schizochytrium sp.)强化培育12 h; 商业高蛋白配合饲料(粗蛋白≥55, 粗脂肪≥8, 粗灰分≥16, 粗纤维≥3); 商业低蛋白配合饲料 (粗蛋白≥44.5, 粗脂肪≥6.68, 粗灰分≥9.5, 粗纤维≥1.77) 颗粒饲料大小均为0.84~1.1 mm; 冰鲜桡足类购自福建漳州育苗场,储存于–20℃的冰箱中保鲜 (粗蛋白≥43.2, 粗脂肪≥4.42); 实验用水为当地海水 (盐度为30 ± 0.5), 使用前经过蓄水池沉淀, 沙滤池过滤, 筛绢网过滤(120目)。实验养殖容器为12个120 L (70 cm× 50 cm×40 cm)的白色透光水箱。
1.2 实验设计与日常管理
养殖实验从2016年1月25日开始至3月11日结束, 历时47 d。
实验共设4个处理组, 分别编号组1、组2、组3、组4, 依次投喂鲜活卤虫、高蛋白配合饲料、低蛋白配合饲料以及冰鲜桡足类, 每组设3个重复。实验开始前从25 m³水泥池中选取体格健壮、活力较好、大小均匀的花鲈幼鱼1 800尾, 平均分布在12个水箱内, 每个水箱150尾。暂养驯化1周后, 开始进行实验 (花鲈幼鱼63日龄)。实验期间, 每天8: 00、16: 00饱食投喂, 以投喂结束30 min后水中有少量残饵为标准; 投喂结束40 min后用直径2 cm的塑料管吸底, 每10 d清洗水箱1次, 为更好地模拟工厂化养殖模式, 建立流水养殖系统, 每天7: 00~19: 00循环水12 h, 换水量为200%, 投饵前30 min停水, 投饵后40 min分钟开始流水; 实验期间水温保持14 ℃不变, 连续充气, 保证溶氧充足; 水质指标为pH: 7.8~8.15, DO≥6.0 mg/L, NO2-N≤0.10 mg/L。
1.3 取样和指标的测定方法
1.3.1 生长指标
在63日龄、73日龄、83日龄、93日龄、103日龄取样5次, 取样前停食24 h, 每个重复每次取12尾幼鱼, 分别记录体长和体质量。吸纸吸取幼鱼体表水分, 直尺测量幼鱼体长(cm, 精确到0.01 cm); 分析天平记录幼鱼的体质量(g, 精确到0.01 g), 在整个实验过程中记录死亡幼鱼数量。实验结束计算成活率、特定生长率、绝对生长率、增质量率。
成活率(%) = (N–N1)/N×100%
特定生长率(%·d)= (lnm1–lnm2)/t
绝对生长率(g·d)= (m1–m2)/t
增质量率 (%)= (m1–m2)/m2×100%
公式中的N为实验开始前的幼鱼总数, N1为实验中死亡鱼的数量, m1为终末幼鱼的质量(g), m2为实验初始幼鱼的质量(g), t为实验时间(d)。
1.3.2 消化酶指标
5个取样点均为停食24 h后取样, 在冰盘上, 解剖各处理组幼鱼, 取出内脏团用生理盐水冲洗并用滤纸吸干后, 装入1.8 mL冻存管, 放入液氮保存备用。
消化酶测定前, 将冻存管放入冰水中缓慢解冻。每个重复取4个内脏团, 分别装入两个预冷的1.5 mL EP管中, 按照质量 (g)︰体积(mL)= 1︰9分别加入生理盐水和PBS缓冲液, 用手持式匀浆机 (IKA3420025)冰浴匀浆, 低温离心(4 ℃, 2 500 r/min, 10 min),吸取上清液备测酶活。
1.3.3 酶的定义和测定方法
胃蛋白酶活性定义、胰蛋白酶活性定义、淀粉酶活性定义和脂肪酶活性定义详见南京建成试剂盒说明书。整个实验酶活性的测定均使用南京建成生物工程研究所生产的试剂盒, 蛋白浓度测定方法为考马斯亮蓝染色法。
1.4 数据处理和统计
实验数据以平均值±标准差 (M ± SD) 表示, 用Excel和SPSS 19.0统计软件进行统计处理。运用单因素方差分析 (One-way ANOVA) 检验各组的各项生长指标, 应用Duncan多重比较检验各组数据间差异显著性, P<0.05为显著性水平。
2 结果
2.1 不同饵料组成对生长的影响
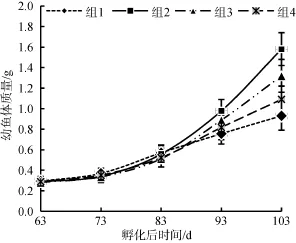
图1 不同饵料组成对花鲈幼鱼体质量增长曲线Fig. 1 Weight changes in Lateolabrax maculatus juveniles fed different diets
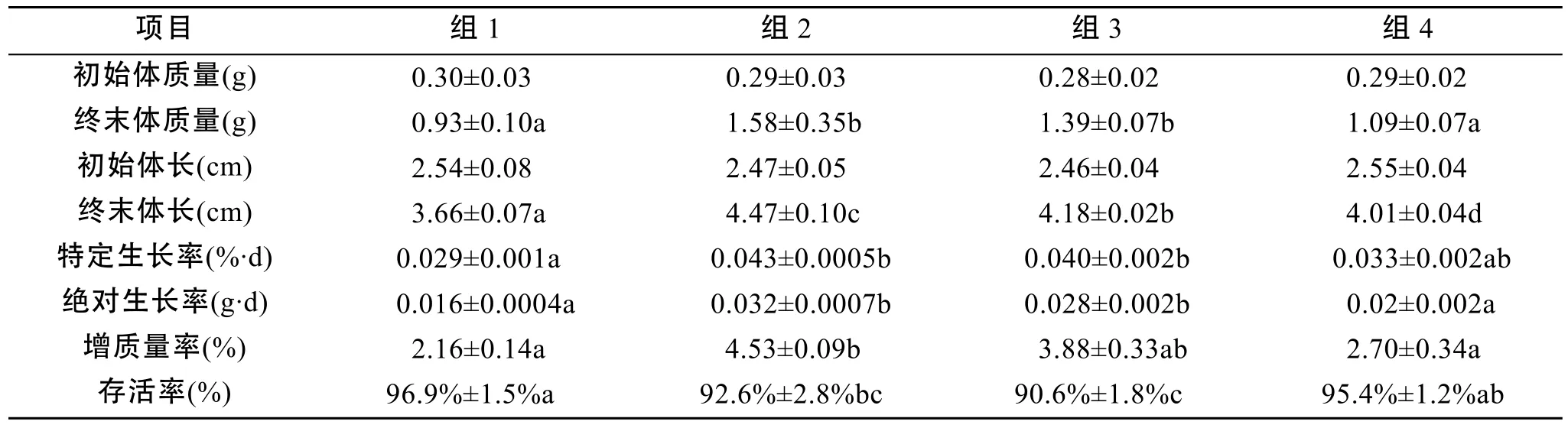
表1 不同饵料组成条件下花鲈幼鱼生长的情况Tab. 1 Growth of Lateolabrax maculatus juveniles fed different diets
实验结束后, 各处理组间花鲈幼鱼生长指标差异显著 (图1、表1)。组2最终生长状况最佳, 体长、体质量、特定生长率、绝对生长率和增质量率均大于其他3组; 组3生长状况次之, 最终体长、体质量显著大于组4(P<0.05); 组1生长较缓慢; 投喂生物饵料的组1和组4存活率明显高于组2和组3。
从图1中可以看出, 在63~83 d期间, 组1的体质量略大于组2、组3、组4, 而20 d之后其他3组的体质量均超过组1, 除组1外的其余3组曲线的斜率逐渐增大, 表明幼鱼的生长速率逐渐变快。随后的83~103 d, 组2的生长速率最快, 大于组3、组4的生长速率, 组1生长速率最慢。组1的曲线斜率出现先上升后下降, 说明组1的生长速率先增高后降低,在实验结束时体质量, 组2>组3>组4>组1。
2.2 不同饵料组成对胃蛋白酶活性的影响
从图2明显看出, 不同饵料组成对花鲈幼鱼的胃蛋白酶活力影响显著 (P<0.05)。组1中花鲈幼鱼的胃蛋白酶活性呈现先上升后下降的趋势, 并在83日龄时达到最高值62.63 U/mg蛋白, 而组1、组2、组3的胃蛋白酶活性呈现上升的趋势, 均在103日龄活性最高, 其中组2的胃蛋白酶活性最高(81.16 ± 3.50)U/mg蛋白, 组3为(63.47 ± 1.74 )U/mg蛋白, 而组1和组4活性较低分别为(27.79 ± 2.27)、(46.62 ± 0.29) U/mg蛋白; 在93和103日龄的胃蛋白酶活性从高到低依次为组2>组3>组4>组1, 各组间差异显著(P<0.05)。
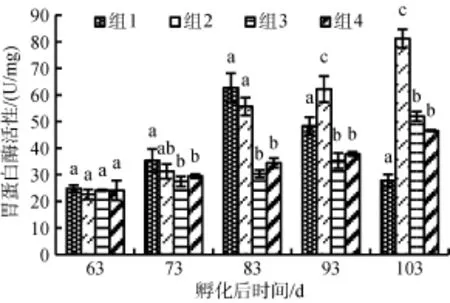
图2 不同饵料组成对花鲈幼鱼胃蛋白酶的活性的影响Fig. 2 Effects of different diets on pepsin activity in Lateolabrax maculatus juveniles
2.3 不同饵料组成对胰蛋白酶活性的影响
图3中显示, 胰蛋白酶活性变化趋势与胃蛋白酶活性相似, 组1的胰蛋白酶在83日龄时最大为(1 427.82)U/mg蛋白; 其他3组的胰蛋白酶活性则在103日龄时达到最大值。实验前期, 组1胰蛋白酶活性显著大于组1、组2和组3, 但这3组间并不存在显著性差异 (P<0.05)。在103日龄时, 组2的胰蛋白酶活性最高为(1 285.70 ± 22.39)U/mg 蛋白; 组3的胰蛋白酶活性 次之(1 240.56 ± 245.8)U/mg蛋白, 显著大于组1和组4的活性。
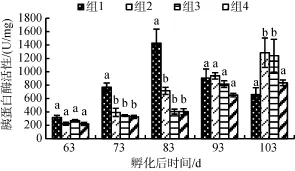
图3 不同饵料组成对花鲈幼鱼胰蛋白酶活性的影响Fig. 3 Effects of different diets on trypsin activity in Lateolabrax maculatus juveniles
2.4 不同饵料组成对花鲈幼鱼淀粉酶活性的影响
淀粉酶与蛋白酶的变化趋势不同。图4中, 4组淀粉酶活性均呈上升趋势。组1淀粉酶先是缓慢上升, 实验后期急速上升, 并在103日龄达到最大值(1.39 ± 0.18)U/mg蛋白, 大于组2并显著性大于组3、组4 (P<0.05)。组2和组3的淀粉酶活性较高, 在103日龄, 组2为(1.26 ± 0.09)U/mg蛋白, 组3为(1.06 ± 0.02)U/mg蛋白。这两组间不存在显著性差异(P<0.05), 而组4淀粉酶活性虽呈上升趋势, 但一直活性较小, 显著小于其余3组 (P<0.05)。
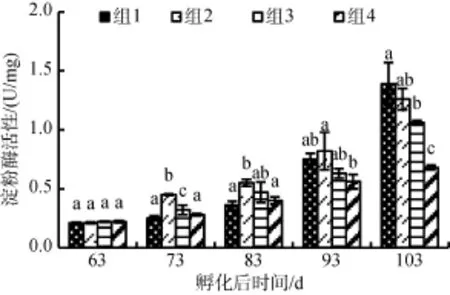
图4 不同饵料组成对花鲈幼鱼淀粉酶活性的影响Fig. 4 Effects of different diets on amylase activity in Lateolabrax maculatus juveniles
2.5 不同饵料组成对花鲈幼鱼脂肪酶活性的影响
与蛋白酶不同, 脂肪酶活性除组1呈上升趋势外, 其余3组均呈下降趋势(图5)。在实验开始时, 组4脂肪酶活性偏低为(418.85 ± 23.95)U/g蛋白, 但其他各组间并不存在显著性差异。经过40 d的实验,在103日龄时, 组1的脂肪酶活性迅速上升达到(1 186.01 ± 124.2)U/g蛋白, 并显著大于组2, 组3和组4, 是组2活性的6倍, 组2, 组3和组4的脂肪酶的活性降到最低值, 分别为: (195.53 ± 5.53)、(264.34 ± 22.32)、(179.09 ± 12.85) U/g蛋白, 组2和组4显著小于组3。
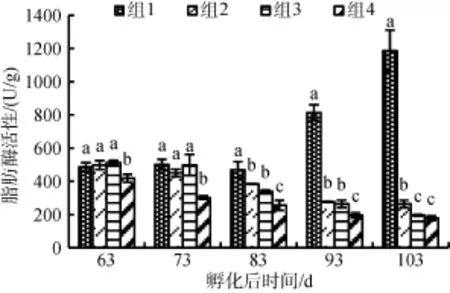
图5 不同饵料组成对花鲈幼鱼脂肪酶活性的影响Fig. 5 Effects of different diets on lipase activity in Lateolabrax maculatus juveniles
3 讨论
3.1 不同饵料组成对花鲈幼鱼生长性能的影响
饵料组成对鱼类幼鱼的生长起着决定性作用,特别是投喂活饵和配合饲料之间差异显著[10]。实验最后体质量大小为: 组2>组3>组4>组1。组1在前20 d中生长速度最快, 但实验后期生长速率减小,原因可能有以下几点: (1)适口性的问题, 随花鲈幼鱼的生长, 口裂逐渐大, 卤虫无节幼体无法适应花鲈幼鱼的摄食需求; (2)随花鲈幼鱼迅速生长, 卤虫无节幼体所提供的营养并不能满足高速细胞分裂和蛋白合成所需要的营养物质和能量; (3)幼鱼会因搜索和捕食饵料生物消耗部分的能量影响鱼的进一步生长[11]。而另一方面幼鱼的生长使消化系统更加完善, 对配合饲料的利用率逐渐提高, 是组2和组3后期生长较快的原因, 蛋白质含量高低则是组2和组3出现生长差距的主要原因。组4生长速度较慢, 可能是鲜活的桡足类经过冰冻失去了活饵诱食性, 改变了活饵中存在的一些微量活性物质, 蛋白含量较低,无法提供足够的氨基酸和氮源供机体发育可能也是导致生长较慢的主要原因, 这与蒋阳阳[12]的研究结果相似。
3.2 不同饵料组成对胃蛋白酶、胰蛋白酶的影响
消化酶(胃蛋白酶、胰蛋白酶、淀粉酶和脂肪酶)是水生生物体内重要的消化指标, 能反应机体对饲料消化能力的强弱[13], 而鱼类的消化和吸收能力在生长中扮演着重要的角色[14-16], 进而影响鱼类的摄食生长[17]。组1中胃蛋白酶活性与幼鱼的生长状况变化趋势吻合, 实验前期胃蛋白酶活性较高, 可能是卤虫粗蛋白含量较高, 活饵的诱食性较好, 以及活饵中有一些微量活性物质能提高幼鱼分泌蛋白酶的能力[18]。而在83日龄后酶活下降, 主要由于幼鱼生长口裂变大, 卤虫无节幼体不再适口。饵料中粗蛋白可以诱发蛋白酶的合成, 组2、组3粗蛋白含量较高, 饵料大小适口, 而组2的胃蛋白酶活性显著高于组3, 这可能与饵料中粗蛋白含量呈相关性, 这与南亚野鲮 (Labeo rohjta)[19]鲌和翘嘴红 (Erythroculter ilishaeformis)[20]等研究相似, 组2和组3的粗蛋白含量是造成胃蛋白酶活性显著不同的主要原因。组4的胃蛋白酶活性较低, 由于冰鲜的桡足类蛋白含量较低以及冰鲜的桡足类失去了活饵优势, 不能满足幼鱼生长的需要。
胰蛋白酶的活力主要受幼鱼发育过程中饲料蛋白水平和氨基酸组成的影响[21-22]。胰蛋白酶活性与胃蛋白酶活性趋势基本一致, 除卤虫外, 其余组胰蛋白酶活性随着饲料蛋白水平增加, 呈上升趋势,这与Nagase[23]先前研究结果相似。原因可能是肠道蛋白酶与底物接触面积增加, 进而提高了其活性[24],或者随着幼鱼的生长, 分泌能力增强, 蛋白酶活性增高, 这与Ma[22]等结果一致。而组1胰蛋白酶的变化可能与胃蛋白酶的原因相同。配合饲料组2、组3胰蛋白酶活性不存在显著性差异, 粗蛋白含量过高时, 蛋白酶活性有所下降, 这也与李贵峰[25]的研究结果相同, 原因可能是随着饲料中粗蛋白含量的提高使蛋白酶活性升高, 吸收体内的蛋白质随之增加,但过剩的蛋白被自身代谢而被消耗或分解供能, 使鱼的负担加重[12,24]。
3.3 不同饵料组成对淀粉酶、脂肪酶的影响
淀粉酶的活力受饲料中糖原和碳水化合物组成和含量的影响[22], 与蛋白含量无关[26-27], 在83日龄时组2的淀粉酶活性比组3的淀粉酶活性高, 并显著高于组1和组4, 碳水化合物含量是导致淀粉酶活性差异的主要原因。配合饲料组淀粉酶活性偏高, 生物饵料组偏低, 这也与逯尚尉[28]的结果相似。组1在实验后期淀粉酶活快速上升, 并在103日龄组1的淀粉酶活性最高, 大于其他3组, 可能是此时卤虫的不适口, 存在饥饿现象, 碳水化合物和脂质在鱼类的中扮演重要的非蛋白能量源角色[29-30], 所以幼鱼利用自身糖原的分解功能维持自身需要, 淀粉酶活性升高。
脂肪酶活性和饵料组成不呈线性关系[27]。有的鱼类脂肪酶活性与饵料脂肪含量呈正相关, 如黄鳝(Monopterus albus)[15]、瓦颡鱼 (Pelteobaggrus vachelli)[16]。有的鱼类呈负相关, 如真鲷 (Pagrpspmus major)[31], 还有的鱼类不存在相关性, 如莫桑比克罗非鱼 (Tilapia mossambica)[23]、点带石斑鱼 (Epinephelus coioiaes)[28]、长鳍篮子鱼(Siganus canaliculatus)[29]。本实验中, 脂肪酶活性与粗脂肪含量呈正相关。卤虫经过强化脂肪酸含量较高, 脂肪酶活性较高, 但后期异常升高, 可能与淀粉酶活性变化原因相似, 由于存在饥饿现象进行脂肪动员维持自身稳态。配合饲料粗脂肪含量高可能是组2和组3大于组4脂肪酶活性的主要原因, 组3大于组2的脂肪酶活性, 可能是肠道脂肪酶活性随着碳水化合物水平增加而减少, 同样的结果也出现在金鲳 (Trachinotus ovatus)幼鱼[9]和花鲈成鱼中[32]。而冰鲜桡足类粗脂肪含量较低, 这可能是导致组4脂肪酶活性快速降低的主要原因。
总之, 组1的生长状况较差, 鲜活的卤虫无节幼体随着花鲈幼鱼的生长不再能满足生长的需要; 组2生长状况最好, 但高蛋白配合饲料价格昂贵; 组3的低蛋白配合饲料不仅能满足花鲈幼鱼生长的需要,而且价格低廉, 较为理想; 组4生长状况较差, 不建议使用。
[1] 张美昭, 高天翔, 阮树会, 等. 花鲈亲鱼人工培育与催产技术研究[J]. 青岛海洋大学学报, 2001, 31(2): 195-200. Zhang Meizhao, Gao Tianxiang, Ruan Shuhui, et al. Study on artificial cultivation and spawning inducement technique of Latelabrax japonicus[J]. Journal of Ocean University of Qingdao, 2001, 31(2): 195-200.
[2] 张雅芝, 刘卫. 不同饵料对花鲈稚鱼生长发育及存活的影响[J]. 集美大学学报(自然科学版), 2003, 8(2): 123-129. Zhang Yazhi, Liu Wei. Effects of diets on growth and survival rates of artificially produced juveniles of Lateolabrax Japonicus[J]. Journal of Jimei University (Natural Science), 2003, 8(2): 123-129.
[3] 张雅芝, 郑金宝, 谢仰杰, 等. 花鲈仔、稚、幼鱼摄食习性与生长的研究[J]. 海洋学报, 1999, 21(5): 110-119. Zhang Yazhi, Zheng Jinbao, Xie Yangjie, et al. The feeding habits and growth of larval, juvenile and young Lateolabrax japonicus[J]. Acta Oceanologica Sinica, 2003, 8(2): 123-129.
[4] 常青, 梁萌青, 王家林, 等. 花鲈对不同饲料原料的表观消化率[J]. 水生生物报, 2005, 29(2): 172-176. Chang Qing, Liang Mengqing, Wang Jialin, et al. Apparent digestibility coefficients of various feed ingredients for Japanese sea bass (Lateolabrax japonicus)[J]. Acta Hydrobiologica Sinica, 2005, 29(2): 172-176.
[5] 张雅芝, 戴立欣, 叶兆弘. 饲养密度和饵料密度对花鲈稚鱼生长及存活的影响[J]. 集美大学学报(自然科学版), 2003, 8(1): 1-7. Zhang Yazhi, Dai Lixin, Ye Zhaohong. The effect of stocking density and bait density on the growth and survival of juvenile Lateolabrax joponicus[J]. Journal of Jimei University (Natural Science), 2003, 8(1): 1-7.
[6] Fernandez I, Moyano F J, Diaz M, et al. Characterization of α-amylase activity in five species of Mediterranean sparid fishes (Sparidae, Teleostei)[J]. Journal of Experimental Marine Biology and Ecology, 2001, 262(1): 1-12.
[7] 茹小尚, 高天翔, 刘石林, 等. 温度对刺参繁殖期消化酶和代谢酶活力的影响[J]. 海洋科学, 2015, 39(3): 1-6. Ru Xiaoshang, Gao Tianxiang, Liu Shilin, et al. Effects of temperature on digestive and metabolic enzymes activities of sea cucumber (Apostichopus japonicus) broodstock[J]. Marine Sciences, 2015, 39(3): 1-6.
[8] 刘襄河, 叶超霞, 郑丽勉, 等. 饲料糊精水平对暗纹东方魨幼鱼生长、消化酶活性和血液生化指标的影响[J]. 水产学报, 2013, 37(9): 1359-1368. Liu Xianghe, Ye Chaoxia, Zheng Limian, et al. Effect of dietary dextrin levels on growth, activities of digestive enzyme and blood biochemical indices of juvenile obscure puffer (Takifugu obscurus)[J]. Journal of Fisheries of China, 2013, 37(9): 1359-1368.
[9] Zhou Chuangpeng, Ge Xianping, Jin Niu, et al. Effect of dietary carbohydrate levels on growth performance, body composition, intestinal and hepatic enzyme activity, and growth hormone gene expression of juvenile golden pompano, Trachinotus ovatus[J]. Aquaculture, 2015, 437: 390-397.
[10] 施永海, 张根玉, 张海明, 等. 配合饲料和活饵料对刀鲚幼鱼生长、存活和消化酶、费特异性免疫酶、代谢酶及抗氧化酶活性的影响[J]. 水产学报, 2014, 38(12): 2029-2038. Shi Yonghai, Zhang Genyu, Zhang Haiming, et al. Effects of compound feed and live feed on the growth, survival, and the activities of digestive enzyme, nonspecific immunity enzyme, metabolic enzyme, and antioxidant enzyme of young fish Coilia nasus[J]. Journal of Fisheries of China, 2014, 38(12): 2029-2038.
[11] 殷名称. 鱼类仔鱼期摄食和生长[J]. 水产学报, 1995, 19(4): 335-341. Yin Mingcheng. Feeding and growth of the larva stage of fish[J]. Journal of Fisheries of China, 1995, 19(4): 335-341.
[12] 蒋阳阳, 李向飞, 刘文斌, 等. 不同蛋白质和脂肪水平对1龄团头鲂生长性能和体组成的影响[J]. 水生生物学报, 2012, 36(5): 826-836. Jiang Yangyang, Li Xiangfei, Liu Wenbin, et al. Effects of different protein and lipid levels on the growth performance and body composition of blunt snout bream (Megalobrama amblycephala) yearlings[J]. Acta Hydrobiologica Sinica, 2012, 36(5): 826-836.
[13] HakimY, Uni Z, Hulata G, et al. Relationship between intestinal brush border enzymatic activity and growth rate in tilapias fed diets containing 30% or 48% protein[J]. Aquaculture 2006, 257: 420-428.
[14] 汪远, 蒋霞敏, 乐可鑫, 等. 饲料蛋白质水平对拟目乌贼生长前期的生长性能、肌肉成分和酶活的影响[J].海洋科学, 2016, 40(3): 87-94. Wang Yuan, Jiang Xiamin, Le Kexin, et al. Effects of dietary protein level on growth, muscle composition, and enzyme activity of Sepia lycidas during early growth period[J]. Marine Sciences, 2016, 40(3): 87-94.
[15] 杨代勤, 严安生, 陈芳, 等. 不同饵料对黄鳝消化酶活性的影响[J]. 水产学报, 2003, 27(6): 558-563. Yang Daiqin, Yan Ansheng, Chen Fang, et al. Effects of different diets on activities of digestive enzymes of Monopterus albus[J]. Journal of Fisheries of China, 2003, 27(6): 558-563.
[16] 李芹, 刁晓明. 不同饵料对瓦氏黄颡鱼稚鱼生长和消化酶活性的影响[J]. 水生态学杂志, 2009, 2(1): 98-102. Li Qin, Diao Xiaoming. Growth and digestive enzyme activities of Pelteobagrus vachelli juvenile fed on different diets[J]. Journal of Hydroecology. 2009, 2(1): 98-102.
[17] 徐钢春, 徐跑, 顾若波, 等. 池养刀鲚(Coilia nasus)鱼种的摄氏和生长[J]. 生态学杂志, 2011, 30(9): 2014- 2018. Xu Gangchun, Xu Pao, Gu Ruobo, et al. Feeding habits and growth characteristics of pond-cultured Coilia nasus fingerlings[J]. Chinese Journal of Ecology, 2011, 30(9): 2014-2018.
[18] Personle R J, Alexandre J C, Thebaud L, et al. Marine fish larvae feeding formulated diets or live pery[J]. World Aquaculture Soc, 1993, 24(2): 211-224.
[19] Debnath D, Pal A K, Sahu N P, et al. Digestive enzymes and metabolic profile of Labeo rohjta fingerlings fed diets with different crude protein levels[J]. Comparative Biochemistry and Physiology-B Biochemistry and Molecular Biology, 2007, 146(1): 107-114.
[20] 钱曦, 王桂芹, 周洪琪, 等. 饲料蛋白水平及豆粕代替鱼粉比例对翘嘴红鲌消化酶活性的影响[J]. 动物营养学报, 2007, 19(2): 182-187. Qian Xi, Wang Guiqin, Zhou Hongqi, et al. Effect of dietary protein on the activities of digestive enzymes of topmouth culter(Erythoculter ilishaeformis Bleeker)[J]. Chinese Journal of Animal Nutrition, 2007, 19(2): 182-187.
[21] Chantal Cahu, Jose Luis. Substitution of live food by formulated diets in marine fish larvae[J]. Aquaculture, 2001, 200(2): 161-180.
[22] Ma H M, Cahu C L, Zambonino Infante J L, et al. Activities of selected digestive enzymes during larval development of large yellow croaker(Pseudosciaena crocea)[J]. Aquaculture, 2005, 245(2): 239-248.
[23] Nagase G. Contribution to the physiology of digestion in Tilapia mossambica digestive enzymes and the effects of diets on their activity[J]. Vergl Physiol, 1964, 49: 270-284.
[24] Giri S S, Sahoo S K, Sahu A K, et al. Effect of dietary protein level on growth, survial, feeding utilization and body composition of hybrid Clarias catfish (Clarias batrachus×Clarias gariepinus)[J]. Animal Feeding Science of Technology, 2003, 104(1/4): 169-178.
[25] 李贵锋, 蒋广震, 刘文斌, 等. 不同蛋白质和能量水平对建鲤幼鱼生长性能、体组分和消化酶活性的影响[J].上海海洋大学学报, 2012, 21(2): 226-232. Li Guifeng, Jiang Guangzhen, Liu Wenbin, et al. Ef-fects of dietary protein and energy levels on growth performance, body composition and digestive enzyme activities of juvenile Jian carp (Cyprinus carpio var. jian)[J]. Journal of Shanghai Ocean University, 2012, 21(2): 226-232.
[26] 吴永恒, 王秋月, 冯政夫, 等. 饲料粗蛋白含量对刺身消化酶及消化道结构的影响[J]. 海洋科学, 2012, 36(1): 36-41. Wu Yongheng, Wang Qiuyue, Feng Zhengfu, et al. The effect of dietary protein on the enzymes and intestinal structure of Apostichopus japonicus[J]. Marine Sciences, 2012, 36(1): 36-41.
[27] Tu Yongqin, Xie Shouqi, Han Dong, et al. Growth performance, digestive enzyme, transaminase and GH-IGF-I axis gene responsiveness to different dietary protein levels in broodstock allogenogynetic gibel carp (Carassius auratus gibelio) CAS III[J]. Aquaculture, 2015, 446: 290-297.
[28] 逯尚尉, 刘兆普, 余燕. 不同饵料对点带石斑鱼幼鱼生长、营养成分及组织消化酶活性的影响[J]. 上海海洋大学学报, 2010, 19(5): 648-653. Lu Shangwei, Liu Zhaopu, Yu Yan. Effect of different diets on growth, nutritive composition and digestive enzyme activities of juvenile Epinephelus malabaricus[J]. Journal of Shanghai Ocean University, 2010, 19(5): 648-653.
[29] 杨金海, 章龙珍, 庄平, 等. 工养殖长鳍篮子鱼消化道指数及3种消化酶活性分布[J]. 海洋科学, 2009, 33(7): 44-50. Yang Jinhai, Zhang Longzhen, Zhuang Ping, et al. The digestive tube index and the activity distribution of three kinds of digestive enzymes in the digestive organs of cultured Siganus canaliculatus[J]. Marine Sciences, 2009, 33(7): 44-50.
[30] Gao W, Liu Y J, Tian L X, et al. Effect of dietary carbohydrate-to-lipid ratios on growth performance, body composition, nutrient utilization and hepatic enzymes activities of herbivorous grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2010, 16: 327-333.
[31] 王重刚, 陈品健, 顾勇, 等. 不同饵料对真鲷稚鱼消化酶活性的影响[J]. 海洋学报, 1998, 20(4): 103-106. Wang Chonggang, Chen Pinjian, Gu Yong, et al. Effect of different diets on digestive enzymes activity of Pagrosomus major juvenile[J]. Acta Oceanologica Sinica, 1998, 20(4): 103-106.
[32] Infante J L Z, Cahu C L. High dietary lipid levels enhance digestive tract maturation and improve (Dicentrarchus labrax) larval development[J]. Nutr, 1999, 129: 1195-1200.
Effects of different diets on growth performance and physiological activities in Lateolabrax maculatus juveniles
TIAN Yuan, WEN Hai-shen, LI Ji-fang, ZHANG Mei-zhao, ZHANG Kai-qiang, WANG Wei, WANG Xiao-long, CHANG Zhi-cheng
(The Key Laboratory of Aquaculture, Ministry of Education, Fisheries College, Ocean University of China, Qingdao 266003, China)
Jun. 28, 2016
Lateolabrax maculatus juveniles; different diets; growth; digestive enzymes
We fed juvenile Lateolabrax maculatus with Artemia (group 1), high protein (group 2), low protein (group 3), and frozen copepods (group 4) from 63 days after hatching (DAH) to 103 DAH to elucidate effects of different diets on growth performance and physiological activities. Final body length/weight, specific growth rate, average growth rate, and weight gain of group 2 were higher than those in the other groups. Pepsin and trypsin activities of group 1 peaked in the middle of the experiment, while the activities of the other groups peaked 103 DAH with significant differences. Amylase (AMS) activity of all groups increased during the experiment with the maximum in group 1 at 103 DAH. In addition, AMS activity of group 1 was significantly higher than that in groups 3 and 4. Lipase activity of group 1 tended to increase, whereas that in the other groups decreased. Lipase activity of group 1 was maximum at 103 DAH, whereas that in groups 3 and 4 was significantly lower than lipase activity in groups 1 and 2. These results show that L. maculatus juveniles displayed better growth performance with protein-contained feed and that the Artemia diet led to poor growth performance, suggesting that low protein compound feed is cost-effective for rearing L. maculatus juveniles.
S917.4
A
1000-3096(2017)04-0031-07
10.11759//hykx 20160628001
(本文编辑: 谭雪静)
2016-06-28;
2016-11-25
国家“十二五”国家科技支撑计划重大资助项目(2011BAD13B03); 东营市海洋与渔业局资助项目(20150217)
[Foundation: National Key Technology Research and Development Program of the Ministry of Science and Technology of China During the “12th Five-Year Plan”, No.2011BAD13B03; The Program Supported by Administration of Ocean and Fisheries of Dongying, No.20150217]
田源(1992-), 男, 山东人, 硕士研究生, 主要从事鱼类生理学研究, E-mail: yuan102379@163.com; 温海深, 通信作者, 教授, E-mail: wenhaishen@ouc.edu.cn
