紫外辐射对孔石莼抗氧化酶活性及其同工酶表达的影响
2017-07-07李丽霞王秀静赵吉强
李丽霞, 王秀静, 赵吉强
(烟台大学 生命科学学院, 山东 烟台 264005)
紫外辐射对孔石莼抗氧化酶活性及其同工酶表达的影响
李丽霞, 王秀静, 赵吉强
(烟台大学 生命科学学院, 山东 烟台 264005)
潮间带海藻不可避免地要遭受UV-B的胁迫。本研究以孔石莼(Ulva pertusa)为试材, 研究了UV-B胁迫对其抗氧化酶体系中SOD、CAT、POX、APX、GR、GPX活性及前4种酶的同工酶表达的影响。结果显示: SOD、CAT、POX酶活性应激反应较为迅速; APX活性始终保持较稳定水平; GR、GPX酶应激表达启动稍晚, 酶活高峰在处理中期6d时出现。SOD同工酶谱有4条酶带, 在UV-B3种剂量处理下, SODⅠ及SODⅡ同工酶活性有所增加; POXⅡ同工酶活性呈小幅增加; 在UV-B诱导下, CAT产生了2条新的同工酶谱带CATⅠ及CATⅡ; APX同工酶仅有1条谱带, 在UV-B处理下与对照差异不大。抗氧化成分AsA及GSH含量在处理前中期与对照相近。孔石莼的特定增长率(SGR)在1.6 kJ/(m2·d)、4.8 kJ/(m2·d)和9.6kJ/(m2·d)3种剂量UV-B辐射处理下均呈下降趋势, 且在后两种剂量处理下降低尤为显著, 而相应的H2O2及TBARS含量呈不同程度增加。上述结果表明: 孔石莼对UV-B辐射具有一定程度的耐受性, 可以通过提高酶促过氧化体系活性来应答UV-B导致的氧化胁迫, 并且酶活性变化体现出剂量和时间效应。
UV-B辐射; 孔石莼(Ulva pertusa); 抗氧化体系; 同工酶
平流层中臭氧层的减薄是当今最引人注目的全球重大环境问题之一。由于臭氧层的侵蚀和破坏使到达地面的紫外线, 尤其是对生物具有显著作用的紫外线B波段(ultraviolet-B, UV-B, 280-320nm)的辐射增强[1-2]。在我国, 总臭氧层也呈现显著的降低趋势[3-4]。近年来, 尽管导致臭氧降解的化学物质排放已受到控制, 但由于温室气体效应, 臭氧层的完全恢复将被延滞, 而基于一个全球气候变化的模型预测, 最严重的臭氧层衰减将在2010~2019年发生[5]。
潮间带是陆地生态系统和海洋生态系统的交错地带, 属生物圈中最敏感的生态系统之一。生活于潮间带的大型海藻要经受波动范围最大的光辐射环境, 尤其在低潮时, 干露的大型海藻必将暴露于全光照条件下, 因而受到的UV-B辐射的直接危害将比淹没时更加严重[6-7]。迄今, 关于UV-B辐射对潮间带大型海藻的影响, 研究多集中在紫外辐射对海藻的生长[8]、光合作用[9]、DNA伤害[7,10]、单一抗氧化酶活性[11]等方面, 而迄今对潮间带大型绿藻体内抗氧化保护体系及其同工酶对UV-B辐射增强时的响应尚缺乏系统研究。已经证明, 大量活性氧(Reactive oxygen species, ROS)在细胞内的生成及滞留是UV-B辐射对海藻产生毒性与伤害作用的主要缘故之一[12-13], 而当遭受到紫外胁迫时, 海藻中能够诱导产生适应及修复的机制, 因此, 紫外辐射的危害在一定程度上是可忍受、可抵消、可避免的[14]。抗氧化系统是植物抗胁迫保护机制的一个主要组成部分, 其整体活性高低决定其对活性氧自由基的清除能力, 而这一能力与植物适应或抵抗胁迫能力的增加息息相关[13]。
孔石莼(Ulva pertusa)又名海白莱, 是潮间带大型海藻的1种常见类型, 在我国各沿海地区分布广泛, 具备生长快、适应环境能力强、营养丰富、方便易得等特性, 因而具有良好的综合应用价值和经济发展前景[15]。本文中, 笔者测定了孔石莼中各种重要的抗氧化酶(剂)活性及同工酶类型的增减规律, 结合过氧化氢(Hydrogen peroxide, H2O2)及硫代巴比妥酸活性物质(Thiobarbituric acid reactive substances, TBARS)的动态变化, 分析了UV-B辐射程度与同工酶表达趋势及调控的相关性, 以期为进一步了解潮间带大型海藻有效应对紫外光胁迫的生化机制及保护机理提供理论依据。
1 材料和方法
1.1 海藻和处理
孔石莼采集自青岛太平角中潮带, 采样后立刻用消毒海水反复冲洗去除可见的附生物及沉积物。新鲜海藻用打孔器制备成直径约1 cm的圆片, 约20 g鲜质量作为一个处理, 预培养于盛有2.5 L灭菌海水的玻璃缸中, 缸直径为50 cm。海水持续充气并每日更换。
经过3 d的预培养后, 海藻材料置于6个直径为18 cm平皿内接受紫外辐射处理。采用北京师范大学生产的UV-B 型紫外辐射强度仪测定辐射强度。在预试验的基础上, 设计3种不同辐射剂量的处理组: 1.6 kJ/(m2·d)为轻度剂量 (Luv), 4.8 kJ/(m2·d)为中度剂量 (Muv), 9.6 kJ/(m2·d)为高度剂量UV-B辐射(Huv)[6]。对照(ck)采用正常日光灯管照射, 光强为 3 500 lx, 培养温度保持在20~25℃, 光周期为12 h︰12 h。试验周期为12 d。
1.2 生长测定
为测定生长情况, 20片新鲜海藻另培养于装有300 mL海水的规格为500 mL的锥形瓶中, 每个处理3次重复组。按照2种海藻的最终湿质量来计算其特定生长率(specific growth rate, RSG), 计算公式为:
RSG(%/d)= (lnWT–lnW0)/t×100%
式中, WT和W0分别表示藻体的最终湿质量和初始湿质量(g); t为试验周期(d)。
1.3 抗氧化酶活性测定
取1 g藻体材料用5 mL提取缓冲液(构成为0.05 mol/L pH=7.0的磷酸缓冲液PBS中包含1%PVP, 0.001 mol/L EDTA)在冰浴条件下研磨提取后, 14 000 r/min 离心15 min, 立即取上清液用于测定超氧化物歧化酶(Superoxide dismutase, SOD)、过氧化氢酶(Catalase, CAT)及过氧化物酶(Peroxidase, POX)活性。酶液保存及相应的活性测定都在0~4℃条件下进行, 设置3次重复, 每3 d测定1次。
SOD活性测定波长为560 nm, 依据氮蓝四唑(Nitro blue tetrazolium, NBT)的光抑制反应[16]进行。CAT活性测定依据Chance等[17]的方法, 测定H2O2在240 nm下的降解速度。POX测定由于愈创木酚的形成导致470 nm下光吸收的增加[18]。
抗坏血酸过氧化物酶(Ascorbate peroxidase, APX)的提取缓冲液包含0.05 mol/L PBS (pH7.0), 0.001 mol/L EDTA, 0.002 mol/L AsA 及 1% PVP。APX的活性测定是检测290 nm下基于抗坏血酸的氧化而使光吸收降低的速度[19]。
谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX)及谷胱甘肽还原酶(Glutathione reductase, GR)的提取缓冲液中包括(0.055 mol/L pH=7.0 PBS; 0.001 mol/L EDTA-Na2; 1%PVP; 0.005 mol/LMgcl2; 0.001 mol/L AsA)。取适量材料加入提取液冰浴研磨匀浆, 4℃下10 000r/min离心10 min, 取上清酶液用于酶活测定。GPX测定基本参照黄爱缨等[20]的方法并略作改进,测定反应酶液在412 nm的光吸收值。GR测定方法参照Knörzer[21]的方法并作改进, 此方法是基于还原型辅酶Ⅱ的氧化反应在340 nm下的吸光度的减少来测量。
1.4 H2O2含量的测定
H2O2含量测定参照沙爱华等[22]的方法进行,并加以改进。提取液为预冷的冷丙酮液研磨匀浆后14 000 r/min离心20 min, 取上清加入反应物后测定吸光值A410。同样方法制作H2O2标准曲线。
1.5 TBARS含量测定
取冷冻的海藻材料0.3 g用1%TCA溶液3 mL研磨提取, 14 000 r/min 离心10 min。TBARS含量计算参照Health及Packer[23]方法, 基于535 nm和600 nm的光吸收值来计算。
1.6 电泳及同工酶谱分析
电泳试验均于处理12 d时进行, 采用非变性不连续垂直板聚丙烯酰胺凝胶电泳, 4℃下20 mA/gel稳流电泳。SOD同工酶染色方法参照Laemmli[24]的方法, 将凝胶在黑暗条件下于0.25 mmol/LNBT中浸泡20 min后, 置于含8 mmol/L EDTA 的0.05 mmol/L核黄素溶液中20 min, 曝光至蓝紫色背景上出现透明条带, 根据其对KCN及H2O2不同的敏感性进一步确认其同工酶谱带的3种类型[25]。CAT同工酶染色根据Woodbury等[26]的方法, 将凝胶于0.003 3 mol/L H2O2中浸没25 min后, 再放置于1% FeCl3和1% K3Fe (CN6)溶液中染色, 直至绿色条带出现。POX同工酶染色时将凝胶在包含0.3% H2O2和0.002 mol/L联苯胺的0.2 mol/L的醋酸溶液中染色20 min后, 褐色条带显现[27]。用于APX电泳检测的条件与上述条件均相同, 但需在电泳缓冲液中包含0.002 mol/L的AsA, 以便使预电泳30 min让AsA进入胶内。APX活性染色按照以下方式进行: 将凝胶浸没于含0.002 mol/L AsA 的0.05 mol/L磷酸缓冲液(pH7.0)中30 min后, 于含0.004 mol/L AsA 及0.002 mol/L H2O2的0.05 mol/L PBS (pH7.0)中温育20 min。最后转移至包含0.002 5 mol/L NBT及0.03 mol/L TEMED的0.05 mol/L PBS (pH7.8)溶液中10 min左右, 直至APX谱带显现[28]。采用凝胶成像系统照相保存。
1.7 抗氧化成分抗坏血酸(Ascorbate, AsA)及谷胱甘肽(Glutathione, GSH)含量测定
参照Marschner等[29]的方法稍加改进测定AsA含量, 海藻材料用5%偏磷酸研磨提取, 24 000 r/min离心15 min, 取上清测定。GSH提取液为50 mmol/L pH=7.0的PBS溶液, 其中加入适量AsA, 测定反应体系在412nm处的光吸收值[30]。
1.8 数据分析
研究结果采用SPSS 19.0软件进行单因素方差分析, 处理结果之间的多重比较采用Duncan’s检验方法。图表采用Sigma Plot 10.0软件绘制, 图中的误差棒表示基于3次重复值的均值标准差。
2 结果
2.1 特定增长率的变化
UV-B对孔石莼生长的影响见图1。轻度剂量下SGR值呈下降趋势, 但与对照并未达到差异显著水平(P>0.05); 中度剂量照射下的SGR值显著下降(P<0.05), 高度剂量辐射处理下降低更为显著, 与对照之间的差异达到极显著水平(P<0.01)。
2.2 孔石莼抗氧化体系对UV-B辐射的响应
图2显示出孔石莼抗氧化体系的几种关键酶对UV-B辐射的响应变化。在UV-B辐射诱导下, 前期SOD酶应激反应迅速, 其活性呈大幅度上升, 其中中度剂量处理下的酶活在3~6 d时均与对照组达到极显著差异(P<0.01); 轻度剂量胁迫下SOD活性也始终高于对照水平; 高度剂量处理下酶活性初期显著升高, 随胁迫时间进一步延长, 酶活明显回落 (图2a)。POX酶活性见图2b。由图可知, 在UV-B辐射处理初期, 轻度及中度剂量胁迫下POX活性增加显著, 分别与对照达到极显著(P<0.01)及显著水平(P<0.05); 在处理中后期, 轻度胁迫下POX仍然与对照活性水平相近, 而中度及高度处理水平的酶活性显著降低(P<0.05); 在试验期间对照的POX活性也表现出较大的变化幅度, 中期时(6 d) 酶活性最高。CAT活性在UV-B处理初期即诱导出较高的活性表达, 与对照值均达到显著以上水平(P<0.05); 在处理中期6 d时, 中度剂量UV-B处理下CAT活性达到峰值, 随后明显下降; 在处理后期, 不同剂量UV-B处理水平下的CAT酶仍维持较高活性水平, 与对照值之间差异显著或极显著(P<0.05; P<0.01, 图2c)。图2d显示出孔石莼APX活性与上述酶活性变化规律不同, 除在9d时轻度剂量UV-B处理下活性短暂增加外(P<0.05), 其他时间始终保持较稳定水平, 对照与3种辐射处理间差异皆不明显(P>0.05)。
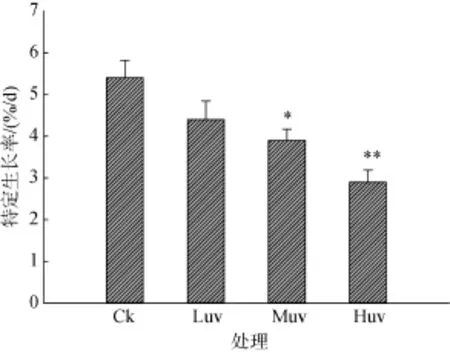
图1 UV-B处理下孔石莼的特定生长率Fig.1 SGR of Ulva pertusa following exposure to different doses of UV-B radiationsLuv、Muv、Huv分别表示轻度、中度及高度剂量UV-B辐射, Ck为对照, 下同Luv, Muv, and Huv indicate mild, moderate, and high doses of UV-B radiation, respectively; Ck is the control, the same below
GR酶活性在处理中期6 d时有较大幅度的升高,但其中仅有轻度UV-B胁迫下的GR酶活性与对照相比差异达到显著水平(P<0.05), 随后呈现出缓慢下降的趋势; 高度剂量UV-B处理下GR酶活性下降较多,至试验期末12 d时活性显著低于对照的相应值(P<0.05, 图2e)。UV-B处理下GPX 酶活性变化见图2f。轻度及中度UV-B辐射诱导GPX酶活性先表现上升趋势, 轻度UV-B辐射水平下上升幅度更大, 在处理6d时出现峰值 (P<0.05); 中度剂量UV-B处理下后期GPX酶活急剧下降, 与对照差异显著(P< 0.05); 而重度UV-B胁迫使GPX酶活性始终保持在较低水平。
2.3 UV-B辐射对孔石莼AsA及GSH含量的影响

图2 不同剂量UV-B辐射下孔石莼SOD(a)、POX(b)、CAT(c)、APX(d)、GR(e)及GPX (f)酶的活性变化Fig. 2 Activities of SOD(a), POX(b), CAT(c), APX(d), GR(e), and GPX(f) in Ulva pertusa following exposure to different doses of UV-B radiation

图3 UV-B辐射下孔石莼的AsA(a)及GSH(b)含量Fig. 3 AsA (a) and GSH (b) contents in Ulva pertusa following exposure to different doses of UV-B radiation
孔石莼体内抗氧化成分AsA及GSH含量在不同剂量UV-B辐射时的变化状况如图3所示。从图3a可以看出, 处理初期及中期(3~6 d)时, 轻度及中度胁迫水平下AsA水平均呈上升趋势, 并且中度处理的AsA含量升高幅度较大, 在6 d时与对照间的差异达到显著水平(P<0.05); 随胁迫时间的延长, 各个处理下的孔石莼AsA水平均显著降低(P<0.05; P<0.01)。由图3b可知, UV-B辐射初始阶段, 孔石莼体内GSH活性水平变化不明显, 至处理9 d时, 高度剂量下处理的GSH含量明显下降(P<0.01); 至试验期末12 d时, 中度UV-B辐射处理的GSH含量亦显著地低于对照水平(P<0.01), 而轻度UV-B处理的孔石莼的GSH含量虽然低于对照值, 但其差异并未达到显著水平(P>0.05)。
2.4 同工酶检测
从图4a可以看出孔石莼SOD同工酶有4条酶带, 分别表示为SODⅠ、SODⅡ、SODⅢ、 SODⅣ。本研究进一步鉴定SODⅠ、SODⅢ及SODⅣ谱带类型均为Mn-SOD, 而SODⅡ排除为Mn-SOD的可能,而未能准确鉴定为Fe-SOD或者CuZn-SOD。与对照组相比较, 3种UV-B剂量处理下孔石莼的SODⅠ及SODⅡ2条同工酶活性有所增加; 而SODⅢ与SODⅣ同工酶活性与对照组相比, 无明显变化。由图4b可知, POX同工酶主要有2条酶带。轻、中度及重度UV-B照射使POXⅡ同工酶活性呈小幅增加; 同时在重度UV-B胁迫下POXⅠ同工酶活性有所下降。

图4 孔石莼的SOD (a), POX (b), CAT(c) 及 APX (d)同工酶对UV-B辐射的响应Fig. 4 SOD (a), POX (b), CAT (c), and APX (d) isoforms in Ulva pertusa in response to exposure to UV-B radiation
孔石莼具有较高的CAT酶活性, 在同工酶谱上即表现为高亮度的条带(图4c)。在UV-B诱导条件下,除CATⅢ谱带比相应对照明显增强外, CAT酶还出现2条新的、较细的同工酶谱带CATⅠ及CAT, Ⅱ且在低度及中度剂量下其活性高于高度剂量下相应的同工酶活性。
图4d显示出孔石莼APX同工酶的活性状态, 在UV-B处理下APX酶仅有1条谱带, 且与对照的APX活性差异不大。
2.5 UV-B辐射对孔石莼H2O2及TBARS含量的影响
由图5a可知, 在不同剂量UV-B处理下孔石莼体内的H2O2含量并未快速积累, 处理后期9~12 d时,中度及高度剂量下的H2O2水平比对照显著增加(P<0.05), 而轻度UV-B辐射条件下H2O2含量始终与对照值差异不明显(P>0.05)。由图5b可知, TBARS含量变化与H2O2水平的变化规律相似, 在试验前期时, 3种剂量水平处理下的TBARS含量与相应对照差异不大, 随处理时间延长, TBARS含量逐步升高, 6 d时高度剂量处理下TBARS含量与对照差异已达显著水平(P<0.05), 至12 d时, 轻度及中度剂量处理的TBARS含量也比对照显著增加(P<0.05)。
3 讨论

图5 UV-B辐射下孔石莼H2O2(a)及TBARS(b)含量Fig. 5 H2O2and TBARS contents in Ulva pertusa following exposure to different doses of UV-B radiation
活性氧(ROS)是植物生理生化代谢过程中不可避免的副产物。近年来研究表明, ROS清除系统的各组分之间存在共调节机制, 抗氧化酶的活性平衡对细胞内ROS的稳定水平起着关键作用, 改变这些酶的平衡就会诱发补偿机制, 海藻抗UV-B辐射的能力与抗氧化系统间协同作用、基础活性、应激性和敏感性差异等因素均有密切关系[31-32]。如在胁迫条件下, 抗坏血酸(AsA)减少, APX由于缺乏底物而失活或活性降低, 此时CAT会增加防止H2O2过度累积,同样, CAT活性降低时, APX和GPX的转录水平增加使表达提高[33]。Kono等[34]指出因为O·2会抑制CAT活性, 而SOD在活性氧清除反应过程中第一个发挥作用, 可以歧化O2·, 故而SOD活性高的个体CAT活性也应该高。本研究结果基本符合这一结论。孔石莼SOD、CAT与POX活性应激反应较为迅速, 均在处理的前期显著增加(图2a、图2b、图2c), 而APX、GPX及GR等酶活性高峰在中后期出现(图2d、图2e、图2f), 且低度及中度剂量下酶活性增加尤其明显。这是UV-B 辐射胁迫诱导的结果, 可能是孔石莼细胞为了适应逆境胁迫条件的一种调节性应激梯度反应, 产生类似的“毒物兴奋效应”。此种效应具有低剂量促进高剂量抑制特征, 是机体内稳态受到外界胁迫条件扰动后的响应, 即生物体在最初的抑制反应之后会出现补偿效应, 这个补偿效应可能会逐渐超过控制行为, 从而导致一种净刺激效应[35]。该效应能够在一定程度上使酶系统活性增加, 抑制活性氧在短期内爆发性累积, 从而增强孔石莼对UV-B胁迫的抵抗力; 但伴随着辐射剂量的增加及辐射时间继续延长, 藻体细胞内活性氧分子如H2O2会过量生成(图5a), 最终超越了防御系统的清除能力, 此时,作为表示脂质过氧化程度的有效指示器TBARS含量亦显著增加(图5b), 表明细胞脂质过氧化程度加剧, 酶活部分丧失, 机体生长代谢受损。
进一步对连续测定的H2O2及TBARS含量与各类型、不同处理下酶活性相关分析表明, CAT活性与TBARS含量之间存在显著的负相关关系(相关系数r =–0.9296); 高度剂量处理下GPX活性与H2O2含量之间亦存在显著的负相关关系(相关系数r = –0.8924),其他抗氧化酶活性与活性氧之间的相关性并未达到显著水平。解析其原因, 一方面在试验期间内连续5次测定, 这些指标均表现为一定阈值内的动态性变化, 另一方面也同时印证孔石莼通过多种抗氧化酶协同作用来控制细胞内活性氧水平, 而并非由某一种酶发挥绝对核心作用。
作为抗氧化体系的另一主要成分, AsA具有多种抗氧化功能, 可以还原, 清除·OH, 猝灭及H2O2等从而使植物体内的活性氧维持在较低范围[36]。此外, 海藻藻体内GSH含量能够受到UV-B辐射的显著影响, 并且其变化情况与辐射剂量及辐射时间的改变关系密切, 如海洋绿藻Ulva fasciata随辐射剂量加大, AsA从较小值跃升至峰值并一直保持在较高水平; GSH含量随辐射剂量加大, GSH含量也逐渐增大, 但超过一定范围后, GSH含量反而又降至较低水平[11]。本文的研究结果与前人稍有不同。本试验发现孔石莼具有较高的AsA及GSH基础含量, 在低、中剂量时, 二者在处理的初中期均会被诱导升高,但高度剂量及较长时间的辐射胁迫又会使其含量呈下降的必然趋势(图3a, 图3b), 这可能是由于试验中辐射剂量不同及种间差异性导致。Roleda同样指出对紫外线的敏感性取决于海藻的种类及生态型[37]。进一步相关性分析表明, 高度剂量处理下AsA含量与H2O2水平之间存在极显著的负相关关系(相关系数r = –0.9848), 与TBARS含量之间则相关显著(相关系数r = –0.9381)。
同工酶是催化反应相同而结构及理化性质不同的酶的分子类型, 是植物细胞代谢的重要调节成分。本研究中, 孔石莼不但表现出较高的SOD应激活性,并且SOD同工酶也在UV-B作用下发生了一定的改变。SOD是一种金属蛋白酶, 根据其金属辅基的不同又分为3种类型, 分别为Mn-SOD、Cu/Zn-SOD及Fe-SOD, 分布于细胞中的不同部位[38]。在本研究中,孔石莼中鉴定出SODⅠ、SODⅢ及SODⅣ谱带类型均为Mn-SOD(图4a)。有的研究者曾经报道O3及UV-B处理能够诱导Cu/Zn-SOD, 但不能影响Mn-SOD[39]。然而, 本研究结果显示Mn-SOD (SODI)在UV-B诱导下活性显著增加, 这些实验结果的差异, 亦可能为SOD同工酶的种间差异所导致。此外, 上述结果同时表明海藻中SOD同工酶对不同剂量紫外辐射的响应可以在转录及转录后水平。Sano等[40]研究发现,一种海藻Galdieria partita中至少含有两种APX同工酶, 这是海藻细胞中关于APX同工酶的最早报道。本研究中, 孔石莼APX同工酶变化相对稳定(图4d),而CAT酶同工酶活性相对较高, 在电泳图上表现为高亮度的谱带(图4c), 表明藻体细胞具有一定的紫外保护能力, 能在一定程度上降低对藻体的伤害。笔者推测, 某些SOD或CAT保留或加强的同工酶与孔石莼对紫外的抗性紧密相关。
生长速率的变化亦被普遍用于衡量胁迫水平[41]。在本研究中, 轻度剂量导致轻微胁迫, 而中、高度剂量导致中度及严重胁迫。与中、高度剂量相比, 海藻在轻度剂量下SGR相对较高(图1), 表明孔石莼能在较温和的胁迫下保持一定生长速度, 而在更严重的胁迫下受到伤害。
综上所述, 孔石莼中抗氧化系统在紫外处理下表现出不同程度的响应。SOD、POX、CAT及在紫外处理初期均有不同程度增加, GR、GPX、APX酶活性应激反应滞后, 在处理中、后期活性上升, 尤其在低度及中度剂量下上升幅度较大; 然而, 随着紫外剂量的加大, 保护酶活性亦受抑, 正常代谢受阻,脂质过氧化产物累积, SGR不可避免呈降低趋势。因此, 孔石莼通过提高抗氧化系统活性作为一种生化防御机制来应对紫外辐射所产生的氧化胁迫, 仅可在一定程度及一定范围内发挥作用。
[1] Madronich S, McKenzie R L, Björn LO, et al. Changes in biologically active ultraviolet radiation reaching the earth’s surface[J]. Journal of Photochemistry & Photobiology B: Biology, 1998, 46(1-3): 5-19.
[2] Roleda M Y. Photosynthetic response of Arctic kelp zoospores exposed to radiation and thermal stress[J]. Photochemical & Photobiological Science, 2009, 8(9): 1302-1312.
[3] 王晶, 侯红英. 青岛地区太阳紫外线辐射研究[J]. 中国海洋大学学报, 2006, 36(4): 671-676. Wang Jing, Hou Hongying. Research of solar ultraviolet radiation in the Qingdao region[J]. Periodical of Ocean University of China, 2006, 36(4): 671-676.
[4] Li G, Gao K S, Gao G. differential impacts of solar uv radiation on photosynthetic carbon fixation from the coastal to offshore surface waters in the South China Sea[J]. Photochemistry & Photobiology, 2011, 87(2): 329-334.
[5] Shindell D T, Rind D, Lonergan P. Increased polar stratospheric ozones losses and delayed eventual recovery owing to increasing greenhouse-gas concentrations[J]. Nature, 1998, 392: 589-592.
[6] Li L X, Zhao J Q, Tang X X. Ultraviolet irradiation induced oxidative stress and response of antioxidant system in an intertidal macroalgae Corallina officinalis L[J]. Journal of Environment Sciences, 2010, 22(5): 716-722.
[7] Van de Poll W H, Eggert A, Buma A G J, et al. Effects of UV-B-induced DNA damage and photoinhibition on growth of temperate marine red macrophytes: habitat-related differences in UV-B tolerance [J]. Journal of Phycology, 2001, 37(1): 30-38.
[8] Han T, Han YS, Kim K Y, et al. Influences of light and UV-B on growth and sporulation of the green alga Ulva pertusa Kjellman[J]. Journal of Experimental Marine Biology and Ecology, 2003, 290(1): 115-131.
[9] Roleda M Y, Nyberg C D, Wulff A. UVR defense mechanisms in eurytopic and invasive Gracilaria vermiculophylla (Gracilariales, Rhodophyta)[J]. Physiologia Plantarum, 2012, 146(2): 205-216.
[10] Roleda, M Y, Hanelt D, Wiencke C. Growth and DNA damage in young Laminaria sporophytes exposed to ultraviolet radiation: implication for depth zonation of kelps on Helgoland (North Sea) [J]. Marine Biology, 2006, 148(6): 1201-1211.
[11] Shiu C T, Lee T M. Ultraviolet-B-induced oxidative stress and responses of the ascorbate-glutathione cycle in a marine macroalga Ulva fasciata[J]. Journal of Experimental Botany, 2005. 56(421): 2851-2865.
[12] Rijstenbil J W. Assessment of oxidative stress in the planktonic diatom Thalassiosira pseudonana in response to UVA and UVB radiation[J]. Journal of PlanktonResearch, 2002, 24(12): 1277-1288.
[13] Schweikert K, Burritt D J. The organophosphate insecticide coumaphos induces oxidative stress and increases antioxidant and detoxification defences in the green macroalgae Ulva pertusa[J]. Aquatic Toxicology, 2012, 122-123(3): 86-92.
[14] Larkum A W D, Wood W F. The effect of UV-B radiation on photosynthesis and respiration of phytoplankton, benthic macroalgae and seagrasses [J]. Photosynthesis Research, 1993, 36(1): 17-23.
[15] 吕冬伟, 刘峰, 李兴佐. 大型海藻孔石莼在工厂化海水养殖中的生物修复及其应用前景[J]. 海洋科学, 2012, 36(12): 95-98. LǗ Dongwei, Liu Feng, Li Xingzuo. The integrated development and application of macro algae Ulva pertusa on factory marine aquaculture[J]. Matine Sciences, 2012, 36(12): 95-98.
[16] Giannopolitis C N, Ries S K. Superoxide dismutase: I. Occurrence in higher plants[J]. Plant Physiology, 1977, 59(2): 309-314.
[17] Chance B, Sies H, Boveris A. Hydroperoxide metabolism in mammalian organs[J]. Physiological Reviews, 1979, 59(3): 527-605.
[18] Dias M A, Costa M M. Effect of low salt concentrations on nitrate reductase and peroxidase of sugar beet leaves [J]. Journal of Experimental Botany, 1983, 34(5): 537-543.
[19] Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant & Cell Physiology, 1981, 22(5): 867-880.
[20] 黄爱缨, 吴珍龄. 水稻谷胱甘肽过氧化物酶的测定法[J]. 西南农业大学学报, 1999, 21(4): 324-327. Huang Aiying, Wu Zhenling. Determination of glutathione peroxidase in rice seedlings[J]. Journal of Southwest Agricultural University, 1999, 21(4): 324-327.
[21] Knörzer O C, Durner J, Böger P. Alterations in the antioxidative system of suspension-cultured soybean cells (Glycine max) induced by oxidative stress[J]. Physiologia Plantarum, 1996, 97(2): 388-396.
[22] 沙爱华, 黄俊斌, 林兴华, 等. 水稻白叶枯病成株抗性与过氧化氢含量及几种酶活性变化的关系[J]. 植物病理学报, 2004, 34(4): 340-345. Sha Aihua, Huang Junbin, Lin Xinghua, et al. The change in hydrogen peroxide content and enzyme activity related to adult plant resistance to Rice bacterial blight[J]. Acta Phytopathologica sinica, 2004, 34(4): 340-345.
[23] Health R L, Packer G. Photoperoxidation in isolated chloroplasts. I. Kinetics and stoichiometry of fatty acid peroxidation[J]. Archives of Biochemistry and Biophysics, 1968, 125(1): 189-198.
[24] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.
[25] Beauchamp C, Fridovich I. Superoxide dismutase: improved assays and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 1971. 44(1): 276-287. [26] Woodbury W, Spencer A K, Stahmann M A. An improved procedure using ferricyanide for detecting catalase isozymes[J]. Analytical Biochemistry, 1971, 44(1): 301-305.
[27] Van Loon L C. Tobacco polyphenoloxidases: A specific staining method indicating non-identify with peroxidases[J]. Phytochemistry, 1970, 10(3): 503-507.
[28] Mittler R, Zilinskas B A. Detection of ascorbate peroxidase activity in native gels by inhibition of the ascorbate-dependent reduction of nitroblue tetrazolium[J]. Analytical Biochemistry, 1993, 212(2): 540-546.
[29] Cakmak I, Marschner H. Magnesium deficiency and high light intensity enhance activities of superoxide dismutase, ascorbate peroxidase, and glutathione reductase in bean leaves[J]. Plant Physiology, 1992, 98(4): 1222-1227.
[30] Ellman G L. Tissue sulfhydryl groups [J]. Archives of Biochemistry & Biophysics, 1959, 82(1): 70-77.
[31] Rautenberger R, Wiencke C, Kai B. Acclimation to UV radiation and antioxidative defence in the endemic Antarctic brown macroalga Desmarestia anceps along a depth gradient[J]. Polar Biology, 2013, 36(12): 1779-1789.
[32] Zhao J Q, Li L X. Effects of UV-B irradiation on isoforms of antioxidant enzymes and their activities in red alga Grateloupia filicina (Rhodophyta)[J]. Chinese Journal of Oceanology and limnology, 2014, 32(6): 1364-1372.
[33] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Annual Review of Plant Biology, 2004, 55(1): 373-399.
[34] Kono Y, Fridovich I. Superioxide radical inhibits catalase [J]. Journal of Biological Chemistry, 1982, 257(10): 5751-5754.
[35] Calabrese E J, Baldwin L A. Toxicology rethinks its central belief-Hormesis demands a reappraisal of the way risks are assessed [J]. Nature, 2003, 421(6924): 691-692.
[36] Buckland S M, Price A H, Hendry G A F. The role of ascorbate in drought-treated cochlearia atlantica Pobed. and Armeria maritima (Mill) willd[J]. New Phytologist, 1991, 119(1): 155-160.
[37] Roleda M Y. Photosynthetic response of Arctic kelp zoospores exposed to radiation and thermal stress[J].Photochemical & Photobiological Sciences, 2009, 8(9): 1302-1312.
[38] Bowler C, Camp W V, Montagu M V, et al. Superoxide dismutase in plants[J]. Critical Reviews in Plant. Sciences, 1994, 13(3): 199-218.
[39] Rao M V, Paliyath G, Ormrod D P. Ultraviolet-B- and ozone-induced biochemical changes in antioxidant enzymes of Arabidopsis thaliana[J]. Plant Physiology, 1996, 110(1): 125-136.
[40] Sano S, Ueda M, Kitajima S, et al. Characterization of ascorbate peroxidases from unicellular red alga Galdieria partita[J]. Plant & Cell Physiology, 2001, 42(4): 433-440.
[41] 凌晶宇, 梁洲瑞, 王飞久, 等. 温度胁迫对掌状海带幼苗生长、抗氧化系统及叶绿素荧光的影响[J]. 海洋科学, 2015, 39(12): 39-45. Ling Jingyu, Liang Zhourui, Wang Feijiu, et al. Effects of temperature stress on the growth, antioxidant system, and chlorophyll fluorescence of Laminaria digitate[J]. Matine Sciences, 2015, 39(12): 39-45.
Effect of UV radiation on the activities of antioxidant enzymes and their isoforms in Ulva pertusa (Chlorophyta)
LI Li-xia, WANG Xiu-jing, ZHAO Ji-qiang
(College of Life Sciences, Yantai University, Yantai 264005, China)
Jul. 5, 2016
UV-B radiation; Ulva pertusa; antioxidant system; isoenzyme
The marine ecosystem inevitably undergoes stress because of exposure to enhanced UV-B radiations. The response of the antioxidant defense system, including that of SOD, CAT, POX, APX, GR, and GPX, of the intertidal macroalgae Ulva pertusa to different doses of UV-B radiation and the first four isoenzyme patterns were investigated. SOD, CAT, and POX rapidly responded to UV-B radiation. The response significantly increased during the initial stage of UV-B treatments. The APX activity remained at a more stable level throughout the exposure. The responses of GR and GPX to UV-B stress were observed later, and an activity peak appeared on day 6. The enzymatic assay revealed four distinct bands of SOD, and SODⅠ and SODⅡ activities increased following exposure to UV-B radiation. The activity of POXⅡ isoenzyme slightly increased following the exposure to UV-B radiation. In addition, new bands of CATⅠ and CATⅡ were detected in response to UV treatments. Only one APX band was detected, and there was no significant difference with respect to Ck. The concentrations of antioxidants such as AsA and GSH were similar to those in the control during the early-to-medium term. SGR reduced following exposure to all three doses, including 1.6, 4.8, and 9.6 kJ/(m2·d), and significantly decreased in the latter two treatments. H2O2and TBARS concentrations significantly increased compared with those in the control. These data suggested that the protection mechanisms of the antioxidant defense system are partly inducible by UV-B to prevent damage and that the enzyme activities change in response to UV-B radiation in a time- and dose-dependent manner.
X171.5
A
1000-3096(2017)04-0001-09
10.11759/hykx20160528002
(本文编辑: 梁德海)
2016-07-05;
2016-11-13
国家自然科学基金青年项目(31300326)
[Foundation: National Natural Science Foundation of China , No.31300326]作者简介: 李丽霞(1975-), 女, 河北行唐人, 副教授, 博士, 主要从事海藻抗逆性研究, 电话: 0535-6902638, E-mail: lilixianet@126.com
