利用分离型内含肽DnaE表达抗菌肽
2017-07-07张晨瑶刘敏王飞孙斌马立新余晓岚
张晨瑶,刘敏,王飞,孙斌,马立新,余晓岚
(生物资源绿色转化湖北省协同创新中心,湖北大学,生命科学学院,湖北 武汉 430062)
利用分离型内含肽DnaE表达抗菌肽
张晨瑶,刘敏,王飞,孙斌,马立新,余晓岚
(生物资源绿色转化湖北省协同创新中心,湖北大学,生命科学学院,湖北 武汉 430062)
拟验证天然断裂内含肽Npu DnaE、Ssp DnaE的反式剪接反应对嵌合蛋白形成的影响,探讨依据此方法表达抗菌肽的可行性,规避抗菌生物表达中对宿主的毒害作用.将花蝉属抗菌肽ADP-1(Amblyommadefensin peptide 1)拆分为N端和C端两部分,其N端与断裂型内含肽Npu DnaE的N端融合,C端与Ssp DnaE的C端融合,并分别构建到原核表达载体pET-23a(Amp+)和pET-30a(Kan+)上,获得重组表达质粒pET-23a-ADP-1-N-Npu和pET-30a-Ssp-ADP-1-C,然后单独或共转化大肠杆菌感受态细胞BL21.实验结果表明,两个重组质粒分别单独或组合转化至Bl21(DE3),经IPTG诱导后,SDS-PAGE检测转化的菌株中都表达了目的蛋白,共转化的菌株诱导表达破菌后其上清液有抑菌活性.该实验验证以两种天然断裂型内含肽Ssp DnaE和Npu DnaE及搭载的ADP-1 N端和C端可在大肠杆菌中获得表达,且共转化的两段内含肽可在离体上清中发生反式剪接,促进融合在内含肽上的ADP-1两部分形成完整具有抑菌活性产物.
抗菌肽;Npu DnaE;Ssp DnaE;反式剪接;抑菌活性
0 引言
抗菌肽(antibacterial peptide,ABP)是生物细胞特定基因编码产生的一类小分子多肽,是宿主防御病原微生物入侵的重要分子屏障[1].它具有广谱抗菌、抗原虫、抗病毒、抗真菌和杀伤肿瘤细胞等作用[2].更为重要的是抗菌肽对真核细胞几乎没有破坏作用,仅作用于原核细胞及发生病变的真核细胞.实验表明,抗菌肽无致畸变作用,无蓄积毒性,还不容易产生抗药性[3].抗菌肽不仅自身具有良好的抗菌活性,不同抗菌肽之间以及抗菌肽与传统抗生素之间具有协同作用,两者联用可提高抗菌肽和传统抗生素的药物疗效,甚至拓宽传统抗生素的抗菌谱[4-5],可望成为新一代抗生素的来源和抗菌、抗病毒、抗癌的药物.
然而,在临床应用方面,抗菌肽面临的主要问题是生产成本高.天然的可提取抗菌肽的材料分布零散、数量有限且分离率低;化学合成方法因为需要保持合成的抗菌肽的生物活性,因此对合成工艺要求较高,导致成本增加.
内含肽是某些蛋白质成熟过程中发生自剪接的主要遗传元件,它的编码基因插入到编码前体蛋白质的基因序列中,和两侧的序列一起转录成mRNA,并翻译成多肽链,之后这段担负自我催化作用的内含肽被切掉,蛋白质外显肽连接成成熟的蛋白质[6]根据内含肽的剪接方式,可将内含肽分为顺式剪接内含肽(cis-splicing intein)和反式剪接内含肽(trans-splicing intein)[7].顺式剪接内含肽的剪接区域共同存在于同一多肽片段上,而反式剪接内含肽的剪接区域分裂成两段,位于不同多肽片段上,即在2条多肽链前体分子之间进行剪接.完整内含肽属于顺式剪接,断裂型内含肽均属于反式剪接类型[8].
本研究利用分离型内含肽为介导,将抗菌肽蛋白拆分成两段,分别与分离型的内含肽的两端融合,研究不同内含肽之间、杂合内含肽以及拆分位点处氨基酸变化反式剪接反应的影响,探讨此种方法表达抗菌肽的可行性,规避抗菌肽生物表达中对宿主的毒害作用.另外,内含肽本身作为融合标签可以提高重组蛋白的可溶性表达.
1 材料和方法
1.1 菌株 大肠杆菌菌株XL10-Gold购自Stratagen 公司,大肠杆菌菌株BL21(DE3)、Micrococcusluteus、E.Coli、Staphylococcusaureus、Bacillussubtilis、含有断裂性内含肽Npu DnaE的N端序列的质粒、Ssp DnaE的C端序列的质粒由本实验室保存.
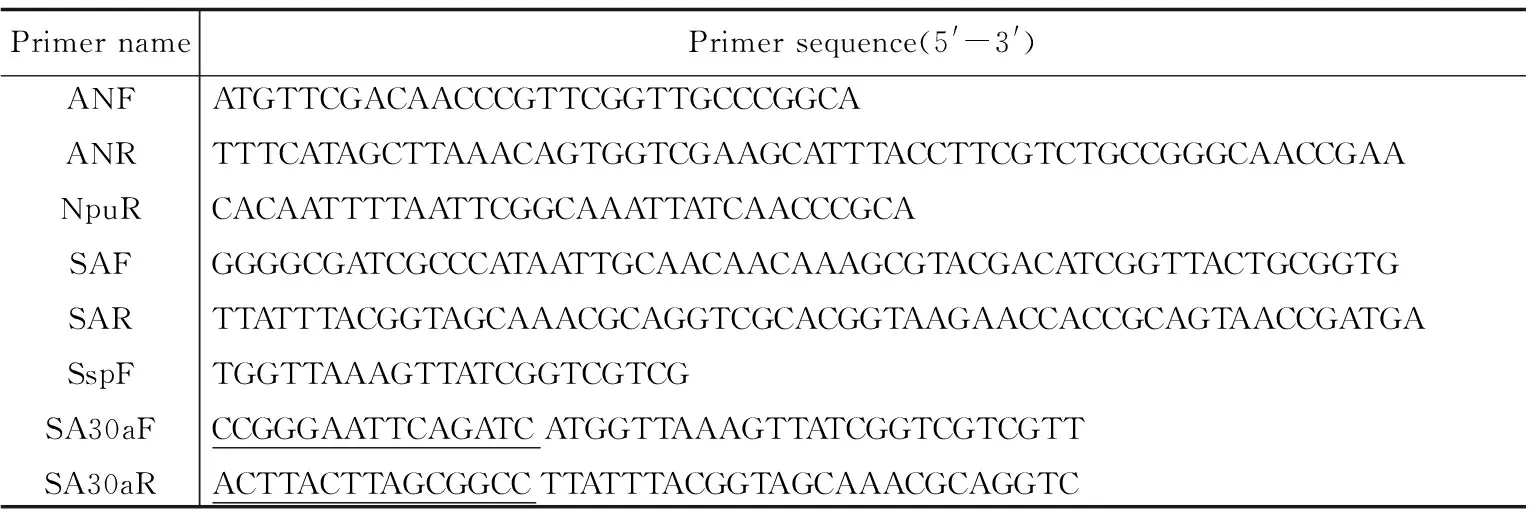
表1 引物序列
1.2 主要试剂 培养基LB按常规方法配制,各种限制性核酸内切酶、Prime-STARTM HS DNA聚合酶、Solution I购自TaKaRa公司,DNA纯化试剂盒购自Vitagene公司,引物(表1) 均在上海桑尼生物科技有限公司合成,其他化学试剂均为分析纯.1.3 方法
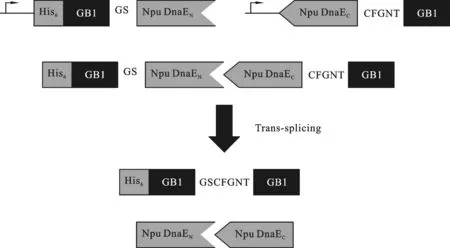
图1 Npu DnaE发生反式剪接原理
1.3.1 抗菌肽基因的获取 根据Hideo Iwai等[11]的研究,分离型内含肽Npu DnaE的N端与C端、Ssp DnaE的N端与C端,在发生反式剪接反应时,会严格识别其C端相邻的识别位点.但是当Npu DnaE的N端和Ssp DnaE的C端形成杂合内含肽时,严谨性会降低,针对特异氨基酸位点“CαNβ”有反式剪接活性,由此结合融合表达可行性设计融合表达抗菌肽(原理见图1).根据NCBI数据库查询,选择目的氨基酸序列,根据设计的氨基酸序列按照大肠杆菌的密码子偏爱性转换成碱基序列,利用Genetool软件设计引物,合成抗菌肽两端的肽的基因序列.阳性质粒经初步鉴定后送上海英俊生物公司进行序列测序.1.3.2 重组表达载体的构建 首先,用BfuⅠ酶切实验室已构建的pET23a-GFP(T载),琼脂糖凝胶回收酶切完全的载体片段,低温冻存备用.
利用已合成的引物和LATaqDNA聚合酶扩增抗菌肽C端和N端的目的基因,琼脂糖凝胶回收扩增的目的片段.载体pET23a-GFP片段与扩增的抗菌肽片段按摩尔比1∶3的比例,在SolutionⅠ连接酶介导下进行连接反应,共转化大肠杆菌感受态细胞XL-GOLD,涂布于氨苄抗性平板后,37 ℃培养箱中避光培养12 h后经蓝白斑筛选(挑取蓝色菌落),抽提质粒,经0.7%琼脂糖凝胶电泳检测,初步鉴定正确的质粒送上海英俊生物公司进行序列测序.
1.3.3 蛋白质表达和SDS-PAGE检测 测序正确的阳性克隆转化大肠杆菌BL21(DE3)感受态细胞,使用IPTG作诱导物,37 ℃诱导8 h.收集菌体,超声波破菌,收集样品后,进行SDS-PAGE检测.
1.3.4 重组表达载体的共转化 选取重组抗菌肽C/N端与分离性内含肽C/N的表达载体,共转化表达菌株后涂布于双抗性的平板,诱导表达后利用过柱纯化的方式检测融合肽的表达.
1.3.5 结合肽抑菌活性检测 取10 mL 7%琼脂糖的LB固体培养基,融化后冷却至40 ℃左右,加入DH5α(或藤黄八叠球菌)制备平板,待培养基冷却凝固后,使用打孔器打孔,孔径为4 mm.将过柱纯化的融合抗菌肽加入孔中,置37 ℃培养7 h后观察抑菌圈的大小.
2 结果
2.1 抗菌肽基因的拆分及基因 由于Npu DnaE的N端和Ssp DnaE的C端形成杂合内含肽时较低的严谨性及特殊氨基酸位点“CαNβ”的反式剪接活性,在结合融合表达可行性的基础上,选取了“CNNK”为剪接位点,再通过检索抗菌肽数据库The antimicrobial peptide database(APD, http://aps.unmc.edu/AP/main.php)选定的抗菌素花蝉属防御素ADP-1(Amblyommadefensin peptide 1,APD ID:AP01375)为目标肽,该AMPs的肽序列FDNPFGCPADEGKCFDNPFGCPADEGKCFDHCNNKAYDIGYCGGSYRATCVCYRK.选取“CNNK”为拆分位点,其N端序列为:FDNPFGCPADEGKCFDH,命名为ADP-1-N,C端序列为:CNNKAYDIGYCGGSYRATCV CYRK,命名为ADP-1-C,再根据大肠杆菌的密码子偏爱性,分别将拆分的N、C端氨基酸序列转换成碱基序列,并在N端加上6×His的基因序列,合成的引物如表1所示.
2.2 重组表达载体pET-23a-ADP-1-N-Npu的构建 重组表达载体pET-23a-ADP-1-N-Npu的构建过程如图2,首先,以引物ANF与引物ANR为正反向引物,使用LA Taq DNA聚合酶进行PCR反应,1.5%琼脂糖凝胶回收扩增的ADP-1-N片段.然后以实验室已构建的含有断裂性内含肽Npu DnaE的N端序列的载体为模板,以ANF、NpuR为正反向引物进行PCR扩增.琼脂糖凝胶电泳检测扩增产物大小约为250 bp,与预期的片段ADP-1-N-Npu大小相符.将回收的ADP-1-N-Npu片段与酶切载体pET23a-GFP按摩尔比3∶1的比例混合后用SolutionⅠ连接酶进行连接反应,连接产物转化大肠杆菌感受态细胞XL-GOLD,挑取蓝色转化菌落,扩大培养抽提质粒,以引物ANF、NpuR进行PCR检测.结果如图3所示,在约250 bp处有与预期相合的明显条带,并且泳道6(以实验室已构建的pET23a-GFP质粒为PCR模板)和泳道7(未添加PCR模板)作为负对照,没有检测到目的条带,序列测定结果表明该重组子与预期完全一致,命名为pET-23a-ADP-1-N-Npu.
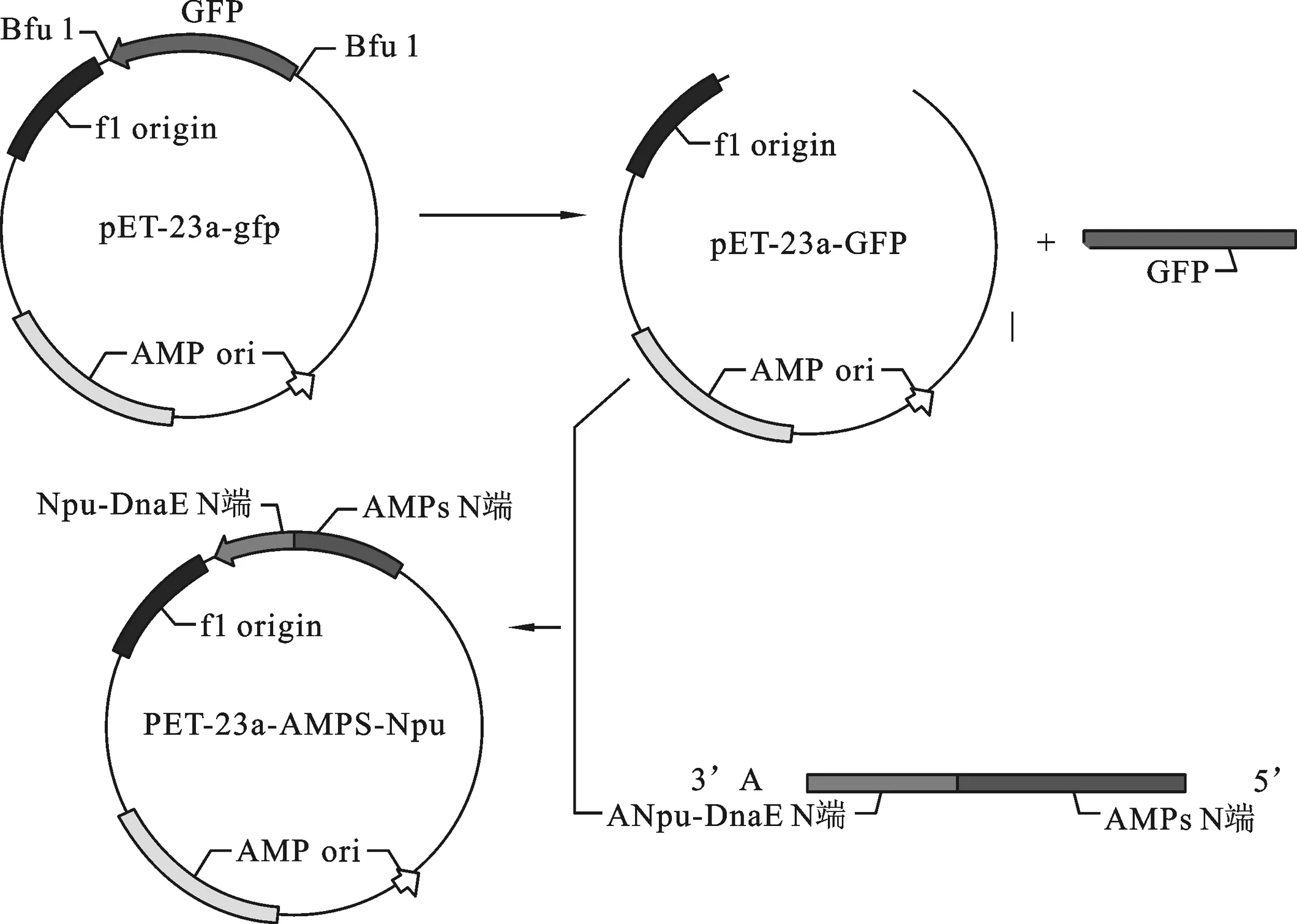
图2 重组载体pET-23a-ADP-1-N-Npu构建图示
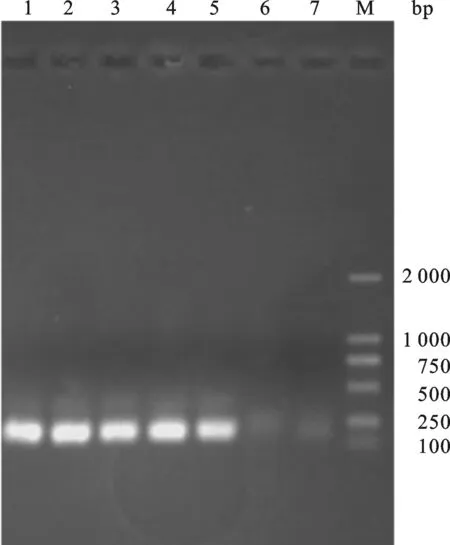
图3 重组质粒pET-23a-ADP-1-N-NpuPCR鉴定M: DL2000 DNA marker;1~5:The PCR products from recombinant plasmid pET-23a-ADP-1-N-Npu;6~7:Negative control.
2.3 重组表达载体pET-30a-Ssp- ADP-1- C的构建 重组表达载体pET-30a-Ssp- ADP-1- C的构建过程如图4.以SAF、SAR为正反向引物,进行PCR扩增,获得ADP-1-C片段.以实验室已构建的含有断裂性内含肽Ssp DnaE的C端序列的载体为模板,以引物Ssp-F与片段ADP-1-C为正反向引物,进行PCR反应,回收该PCR产物为模板,用SA-30a-F与SA-30a-R为正反向引物,进行PCR反应,琼脂糖凝胶电泳检测扩增产物大小约为250 bp,将获得PCR产物与经NotⅠ和BglⅡ双酶切的pET30a-GFP按摩尔比3∶1的比例混合,共转化大肠杆菌感受态细胞XL-GOLD,用定点同源重组的方法重组.转化的菌株抽提质粒以引物SA-30a-F与SA-30a-R进行PCR检测,在约250 bp处有与预期相合的明显条带,并且泳道1(pET30a-GFP质粒为PCR模板)作为负对照没有与目标冲突的条带,获得与预期大小一致的目的片段,如图5所示.进一步基因测序证实,已获得预期的克隆表达载体,命名为pET30a-Ssp -ADP-1-C.
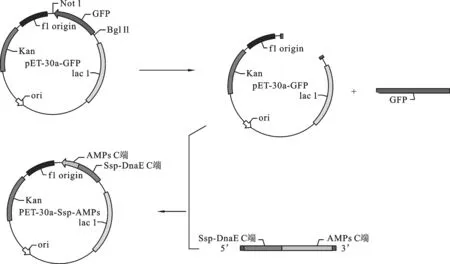
图4 重组载体pET30a-Ssp -ADP-1-C构建图
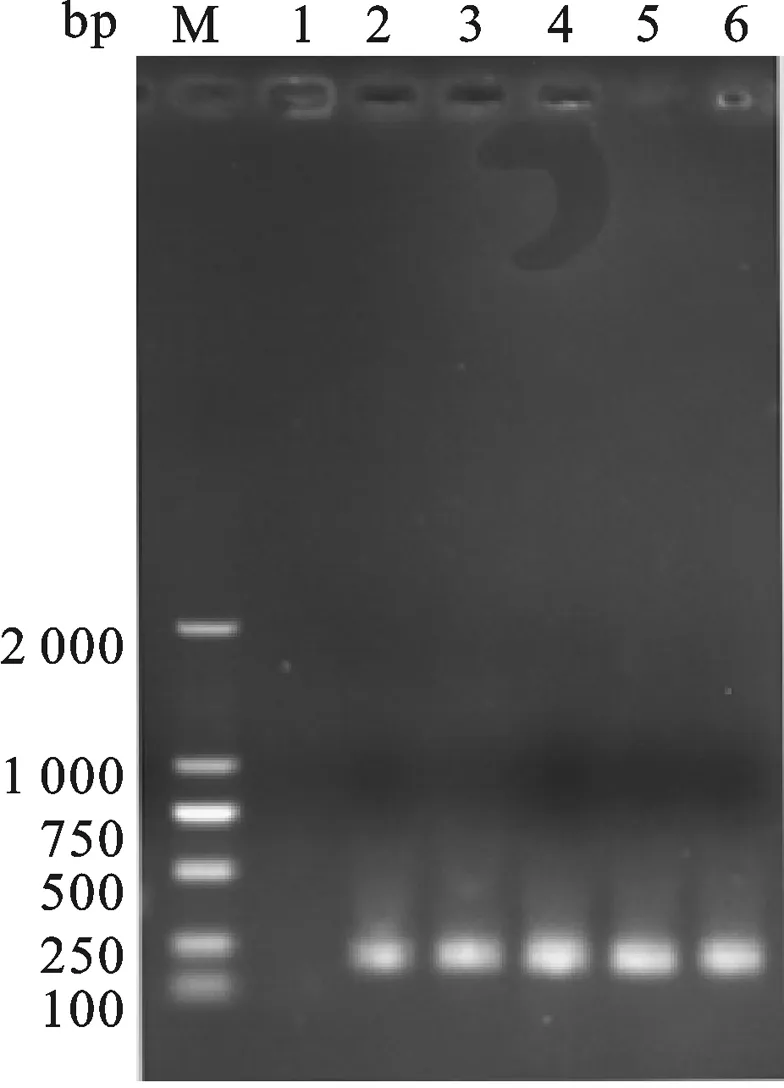
图5 重组质粒pET30a-Ssp -ADP-1-C PCR鉴定M: DL2000 DNA marker; 1:Negative control;26:The PCR products from recombinant plasmid pET30a-Ssp -ADP-1-C.
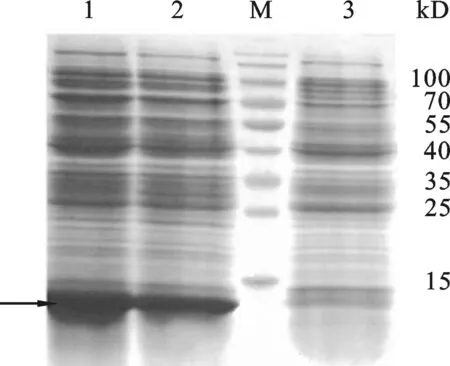
图6 重组质粒pET-23a-ADP-1-N-Npu表达鉴定3:Expressed product of control plasmid pET-23a in E.coli BL21(DE3).12: Expressed product of recombinant plasmid pET-23a-ADP-1-N-Npu in E.coli BL21(DE3) .M: Protein Marker.
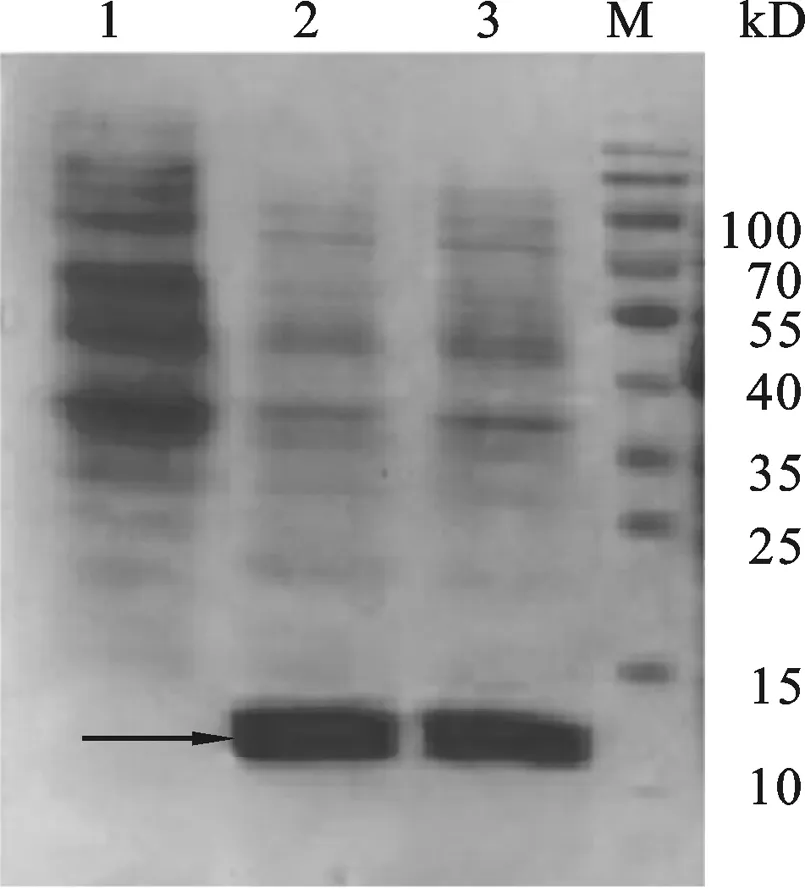
图7 重组质粒pET-30a-Ssp-ADP-1-C表达鉴定1:Expressed product of control plasmid pET-30a in E.coli BL21(DE3).23: Expressed product of recombinant plasmid pET-30a-Ssp-ADP-1-C in E.coli BL21(DE3) .M: Protein Marker.
2.4 重组表达载体pET-23a-ADP-1-N-Npu的表达验证 将阳性质粒pET-23a-ADP-1-N-Npu转化BL21(DE3)菌株,在37 ℃经IPTG诱导8 h后收集菌体,超声波处理菌体后收集上清和沉淀, SDS-PAGE检测重组蛋白表达情况.结果如图6所示,与对照载体相比,转化重组质粒pET-23a-ADP-1-N-Npu的菌株在约14.0 kD处有明显特异性蛋白表达条带,该条带的大小与预期相符,初步说明重组蛋白获得表达.2.5 重组表达载体pET-30a-Ssp- ADP-1-C的表达验证 参照结果2.4的方法按照常规方法转化大肠杆菌感受态、诱导表达,收集表达产物后SDS-PAGE检测重组蛋白的表达情况,结果如图7所示,与对照载体相比,重组表达载 pET-30a-Ssp-ADP-1-C转化的菌株在12 kD处有明显的特异表达蛋白条带(箭头所示),该蛋白大小与预期的相符,初步显示重组表达载体构建成功.融合蛋白ADP-1-N-Npu和Ssp- ADP-1-C的表达为进一步验证二者剪切后是否有抑菌活性奠定了基础.

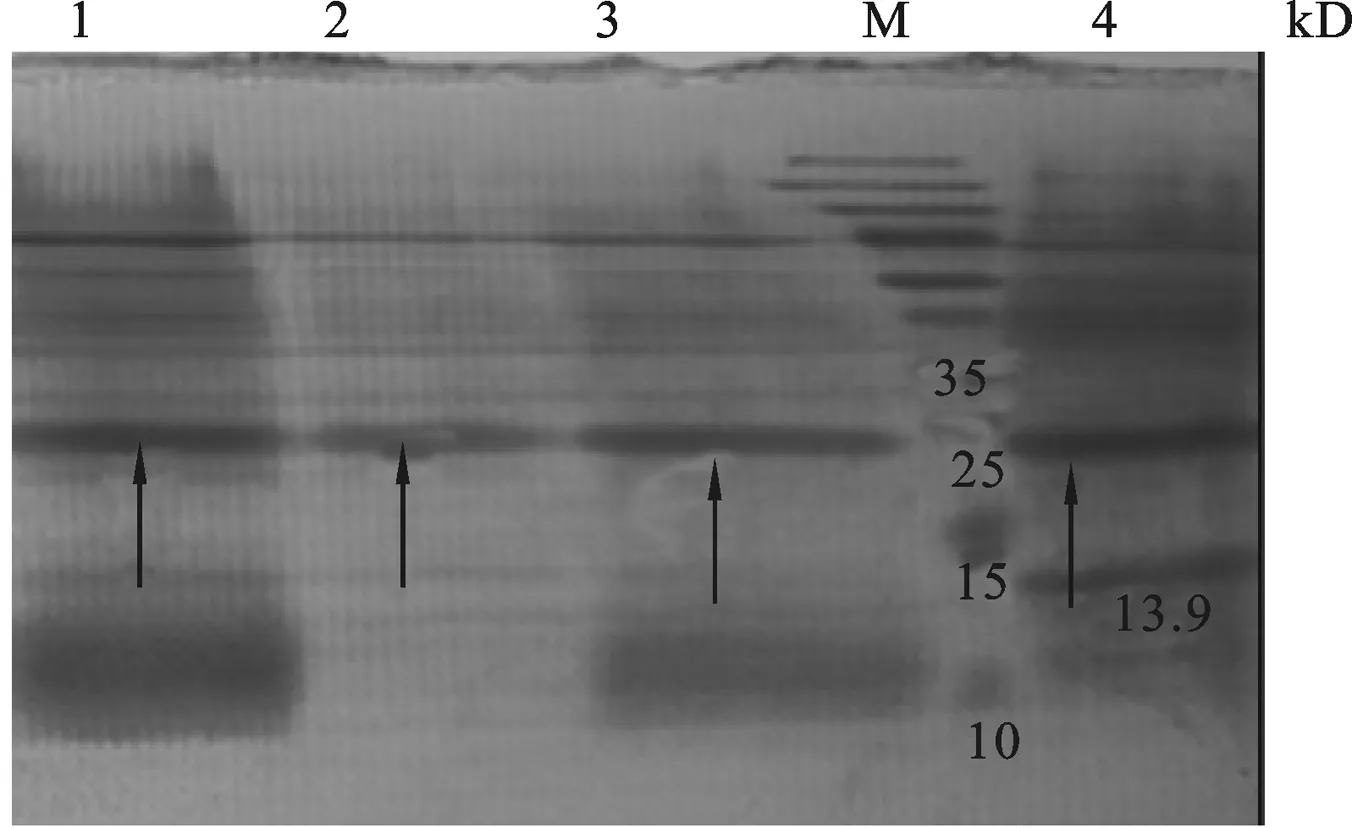
图8 重组质粒pET-23a-ADP-1-N-Npu和pET-30a-Ssp-ADP-1-C共表达产物检测M: Protein Marker;1: Elution product with 50 mmol/L iminazole;2: Elution product with 100 mmol/L iminazole;3:Elution product with 150 mmol/L iminazole;4: Elution product with 250 mmol/L iminazole.

图9 反式剪切产物的抑菌活性检测9-50: Elution product with 50 mmol/L iminazole;50: Elution buffer of 100 mmol/L Iminazole;9-100:Elution product with 100 mmol/L iminazole;100: Elution buffer of 100 mmol/L iminazole.
2.7 结合肽抑菌活性检测 取10 mL 7%琼脂糖的LB固体培养基,融化后冷却至40 ℃左右,加入DH5α(或藤黄八叠球菌)制备平板,待培养基冷却凝固后,使用打孔器打孔,将过柱纯化的融合抗菌肽加入孔中,置37 ℃培养7 h后观察抑菌圈的大小.用结果2.6实验中的梯度洗脱样品进行抑菌活性实验,结果如图9.从图中可以看出破菌上清经His镍柱纯化浓缩后,作用于混合有大肠杆菌的琼脂平板时可见明显的抑菌圈(箭头所示),其中“8-50”孔为在孔中添加氨苄抗生素的用50 mmol/L咪唑洗脱的样品的阳性对照,“8-100”孔为在孔中添加氨苄抗生素的用100 mmol/L咪唑洗脱的样品的阳性对照,阳性对照也存在明显的抑菌圈,“50”孔为用50 mmol/L咪唑洗脱的样品的阴性对照,“100”孔为用100 mmol/L咪唑洗脱的样品的阴性对照,阴性对照没有抑菌圈,其他未标注的孔为未添加任何其他试剂的空白对照,空白对照没有抑菌圈,这表明自动反式剪切的产物中有抗菌肽的形成.
3 讨论
抗菌肽是生物界广泛存在的一类生物活性肽,它具有抗细菌、真菌、病毒和原虫作用,甚至对癌细胞也有杀伤作用[12].抗菌肽可能作为一种由独立的基因编码以及非核糖体合成的方式广泛存在于各类生物体内[13].抗菌肽主要作用于微生物细胞膜,使细胞膜穿孔,破坏细胞膜的完整性,导致细胞质外溢而达到杀菌的目的,这与抗生素的作用机制不同,因此微生物不易产生耐药性[14].长期滥用抗生素导致了耐药菌株“超级细菌”的出现,增加了动物、人类健康和环境污染风险,寻找抗生素替代品正成为全球研究热点,抗菌肽因其高效抗菌效果和不同于抗生素的独特作用机制引起了各国研究者的关注,并进行相关研究[15].本研究利用分离型内含肽Npu DnaE的N端部分与Ssp DnaE的C端部分组成杂合内含肽,将抗菌肽蛋白ADP-1拆分成两段,分别与两者融合后,进行表达.该研究中主要是将天然抗菌肽一分为二,分别表达后通过自剪切的作用再获得具有抗菌活性的抗菌肽的过程,且分子中间区域常形成铰链区,充当连接体功能,规避了抗菌肽对表达宿主(大肠杆菌)的毒害作用,探讨了利用内含肽介导表达抗菌肽的可行性,同时也验证杂合内含肽的反式剪接能力.结果表明融合蛋白ADP-1-N-Npu与Ssp- ADP-1-C在进行共表达时,具有反式剪接活性,根据蛋白质SDS-PAGE凝胶灰度定量,发现反式剪接效率在40%至50%之间,且共表达产物具有一定的抑菌活性.该研究可进一步通过内含肽的连接作用,将抗菌肽与特定识别病原菌的特异性肽连接与使得该类肽可特异性杀灭有害微生物,而不杀灭有益微生物,即所谓的特异性靶向抗菌肽[16],为抗菌肽的大规模生产奠定基础.
[1] Joseph A, Kimberly A, Patrick M. Novel antimicrobial peptides that inhibit gram positive bacterial exotoxin synthesis[J]. PLoS One, 2014, 9(4): e95661.
[2] Pasupuleyi M, Schmidtchen A, Malmsten M. Antimicrobial peptides: key components of the innate immune system[J]. Crit Rev Biotechnol, 2011, 32, 143-171.
[3] Lapis K.Physiologic and pathophysiologic significance of antimicrobial(host defensive) small peptides[J]. Orv Hetil, 2008,149(51):2419-2424.
[4] De Figueiredo I, Freire J, Flores L, et al. Cell-penetrating peptides: a tool for effective delivery in gene-targeted therapies[J]. IUBMB Life, 2014, 66:182-194.
[5] Nuno V, Luísa A, D Paula G. Antimicrobial peptides: a new class of antimalarial drugs? [J]. Front in Pharm, 2014, 19:1-13.
[6] Ulvatne H, Samuelsen, Haukland H, et al. Lacto ferricin B inhibits bacterial macromolecular synthesys inEscherichiacoliandBacillussubtilis[J].FEMS Micro Lett, 2004, 237:377-384.
[7] 刘倚帆,徐良,朱海燕,等.抗菌肽与抗生素对革兰氏阴性菌和革兰氏阳性菌的体外协同抗菌效果研究[J].动物营养学报, 2010, 22(5): 1457-1463.
[8] Gonzalez N, Moody T, Igarashi H, et al. Bombesin-related peptides and their receptors: recent advances in their role in physiology and disease states[J]. Curr Opin in Endo, Diab and Obes, 2008, 15(1):58-64.
[9] Ertan E, Neel H, Tom W, et al. Structural and dynamical features of inteins and implications on protein splicing[J]. J Biol Chem, 2014, 289(21):14506-14511.
[10] Caspi J, Amitai Q, Belenkiy O, et al. Distribution of split DnaE inteins in cyanobacteria[J]. Mol Micro, 2003, 50(5):1569-1577.
[11] Iwai H, Züger S, Jin J, et al. Highly efficient protein trans-splicing by a naturally split DnaE intein from Nostoc punctiforme[J]. FEBS Lett, 2006, 580(7):1853-1858.
[12] 柴晓杰,王丕武,徐雅维,等. 抗菌肽的研究进展及应用前景[J]. 中国饲料, 2005, 40:15-17.
[13] Chen L, Zhu Y, Yang D, et al. Synthesis and antibacterial activities of antibacterial peptides with a spiropyran fluorescence probe[J]. Sci Rep, 2014, 4:6860.
[14] Hee K, Chang H, Yoonkyung P. Marine peptides and their anti-infective activities[J]. Mar Drugs, 2015, 13(1): 618-654.
[15] Pelegrini P, Sarto R, Silva O, et al. Antibacterial peptides from plants: what they are and how they probably work[J]. Biochem Res Int, 2011, 250349: 1-9.
[16] Sato H, Feix J B. Peptide-membrane interactions and mechanisms of membrane destruction by amphipathic helical antimicrobial peptides[J]. BBA-Biom, 2006, 1758(9):1245-1256.
[17] Jonathan G., Rodriguez P, Rosmarbel M, et al. Cell penetrating peptides and cationic antibacterial peptides: two sides of the same coin [J]. J Biol Chem, 2014, 289(21): 14448-14457.
[18] Bowdish D, Davidson D, Hancock R. A re-evaluation of the role of host defence peptides in mammalian immunity[J]. Curr Protein Pept Sci, 2005, 6(1): 35-51.
[19] 朱鑫,马清泉,董娜,等.改良型抗菌肽研究进展[J].生物化学与生物化学进展,2012,29(9):853-860.
[20] Joseph A, Kimberly A, Patrick M. Novel antimicrobial peptides that inhibit gram positive bacterial exotoxin synthesis[J]. PLoS One, 2014, 9(4): e95661.
[21] Jason S, Laura C, Jamie E, et al. Proteolytically activated anti-bacterial hydrogel microspheres[J]. J Control Release, 2013, 171(3): 288-295.
[22] Chu M, Ding R, Chu Z, et al. Role of berberine in anti-bacterial as a high-affinity LPS antagonist binding to TLR4/MD-2 receptor[J]. BMC Comp Altern Med, 2014, 14: 89.
[23] Sun P, Ye S, Ferrandon S, et al. Crystal structures of an intein from the split dnaE gene of Synechocystis sp. PCC6803 reveal the catalytic model without the penultimate histidine and the mechanism of zinc ion inhibition of protein splicing[J]. Mole Biol, 2005, 353(5):1093-1105.
[24] Joachim Z, Simone E, Alena B, et al. SPLICEFINDER- a fast and easy screening method for active protein trans-splicing positions[J]. PLoS One, 2013, 8(9): e72925.
[25] He J, Anderson M, Shi W, et al. Design and activity of a dual-targeted antimicrobial peptide[J]. Int J Antimicrob Ag, 2009, 33(6):532-537.
[26] Aranko A, Wlodawe A, Iwa H. Nature’s recipe for splitting inteins[J]. Protein Eng Des Sel, 2014, 27(8): 263-271.
(责任编辑 游俊)
The expression of antimicrobial peptides mediated by the separation intein DnaE
ZHANG Chenyao, LIU Min, WANG Fei, SUN Bin, MA Lixin, YU Xiaolan
(Hubei Collaborative Innovation Center for Green Transformation of Bio-resources, College of Life Science, Hubei University, Wuhan 430062, China)
In order to investigate the feasibility of producing antimicrobial peptide by the two natural fracture type inteins Ssp DnaE and Npu DnaE which can circumvent toxic effects to the host caused by the expression of antimicrobial peptides directly. The DNA sequence of antimicrobial peptide ADP-1 was split into two parts at special sites. The N-terminal of ADP-1 peptide was fused to the N-terminal of Npu DnaE, and the C-terminal peptide was fused to the C-terminal of Ssp DnaE.Then they were cloned into the prokaryotic expression vector pET-23a(Amp+) and pET-30a(Kan+) respectively, resulting the recombinant expression plasminds pET-23a-ADP-1-N-Npu and pET-30a-Ssp-ADP-1-C. Then they were transformed into BL21(DE3) alone or together, induced by IPTG, and detected by SDS-PAGE. We found they were transformed into BL21(DE3) strain, and both were expressed after inducing. But the expression products did not have antibacterial activity in strain which was transformed by only one recombinant plasmid pET-23a-ADP-1-N-Npu or pET-30a-Ssp-ADP-1-C. However, the antibacterial activity was detected in the concentration and purification supernatant of the strain which was co-transformed with pET-23a-ADP-1-N-Npu and pET-30a-Ssp-ADP-1-C plasmid.The two natural fracture type inteins Ssp DnaE and Npu DnaE are used to express the defensin ADP-1 C terminal and N terminal respectively, and the two fused protein can form the trans-splicing reaction in BL21(DE) and promote the spliced ADP-1 to obtain the antibacterial activity.
antimicrobial peptides; Npu DnaE; Ssp DnaE; the trans-splicing reaction; fusion protein
2016-11-11
国家自然科学基金(31672561)资助
张晨瑶(1990-),男,硕士生;余晓岚,通信作者,副教授, E-mail: yxiaolan@163.com
1000-2375(2017)04-0354-07
Q939.92
A
10.3969/j.issn.1000-2375.2017.04.005
