芘番化学合成研究进展
2017-07-06杨轶浠郭晓强
杨轶浠, 张 珏, 邱 露, 郭晓强
(1.成都大学 海外教育学院, 四川 成都 610106; 2.成都大学 药学与生物工程学院, 四川 成都 610106)
芘番化学合成研究进展
杨轶浠1, 张 珏2, 邱 露2, 郭晓强2
(1.成都大学 海外教育学院, 四川 成都 610106; 2.成都大学 药学与生物工程学院, 四川 成都 610106)
芘番是环番的一种类型,其不仅具有芘的理化性质,同时也具有环番的理化性质.对于芘番的合成,国内鲜有报道.就芘番的定义、结构、合成和应用进行了介绍,通过对已知芘番合成路线的描述,对具有光物理、光化学活性的,能应用于荧光探针、分子识别等功能的芘番合成提供借鉴.
环番;芘番;合成
0 引 言
芘具有非常有效的光化学和光物理性质,当环番的芳香部分特定为芘的时候,此类型的化合物被称为芘番.芘番是环番类化合物的一种类型,它同时具有芘和环番的化学、物理性质.本研究综述了目前已知芘番的合成方法,对芘番的概念、物理性质和化学性质作了详细的介绍,并对芘番类化合物光物理、光化学活性,荧光探针和分子识别功能的相关研究进行了探讨,可进一步拓展人们对芘番类化合物新的合成方法的认识.
1 芘的结构与性质
1.1 芘的结构及其化学性质
1871年,科研人员在煤焦油中首次分离出了芘[1],其结构如图1所示.芘作为最小的迫位稠合的多环芳香烃化合物开始进入了人们的视野.同苯相比,芘的化学反应相对局限.然而芘富含p电子,所以它在进行芳香烃的亲电取代反应有相对活性.从最高被占用分子轨道来看,芘的1,3,6和8位具有非常高的轨道系数,此说明芘类化合物对于芳香烃的亲电取代反应在这些位置上具有很高的选择性[2].例外的是,当芘发生付—克异丁基化反应时,反应只会发生在芘的2位和7位上(见图2).这主要是因为芘只有2位和7位是不受空间位阻效应影响的迫位[3].另外,芘还可以发生氧化反应,氧化后生成4,5-二酮化合物5或4,5,9,10-四酮化合物6(见图3)[4].
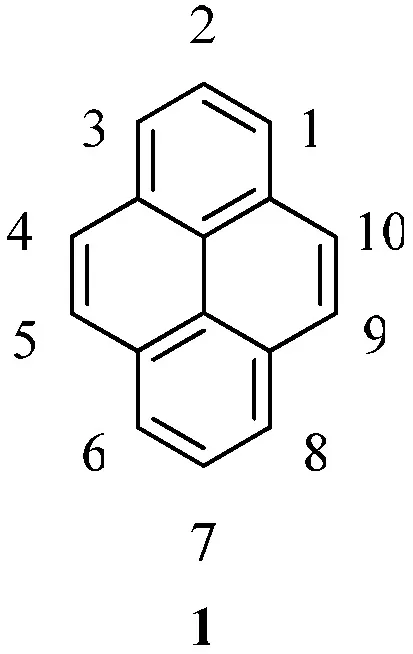
图1 芘的结构及其编号
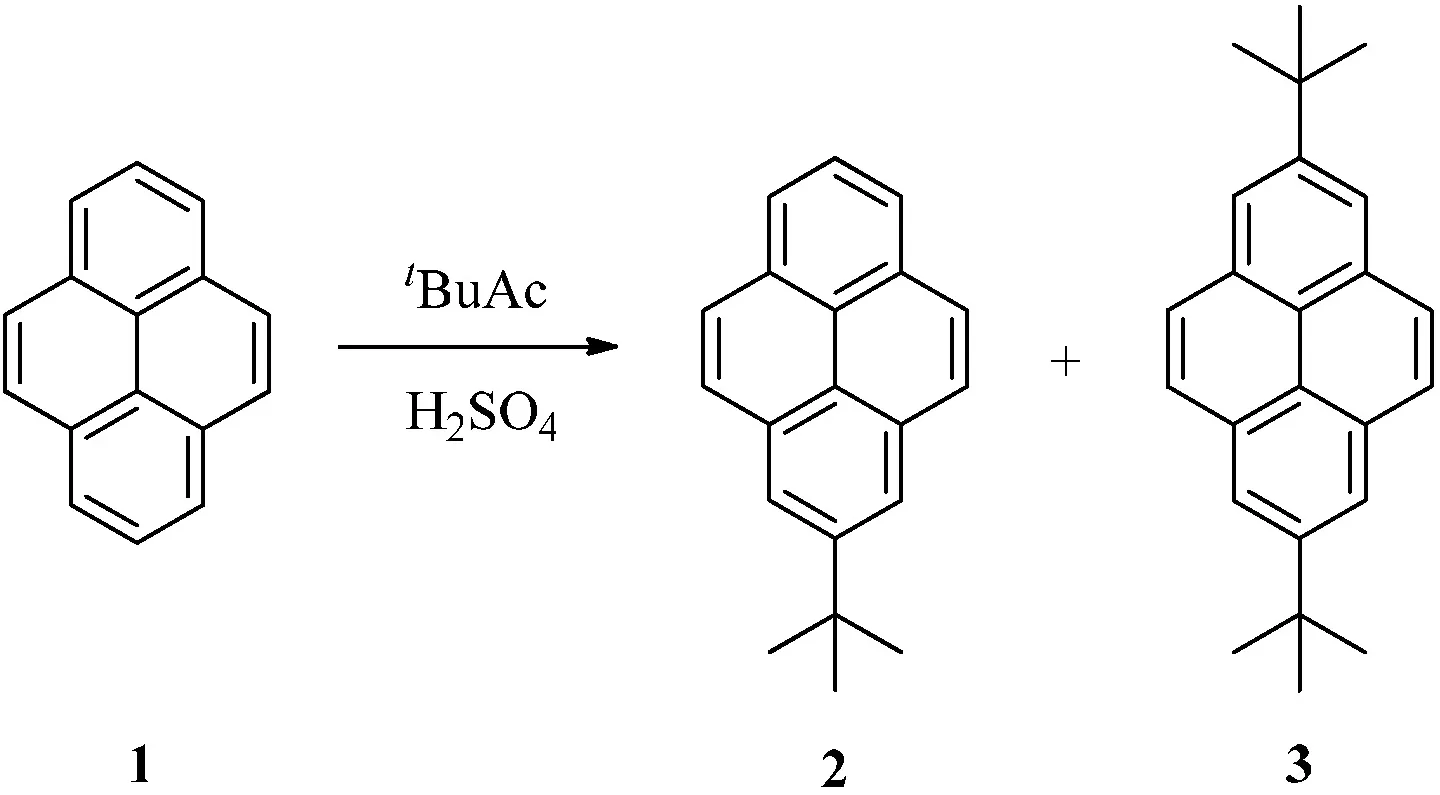
图2 芘的付—克异丁基化反应
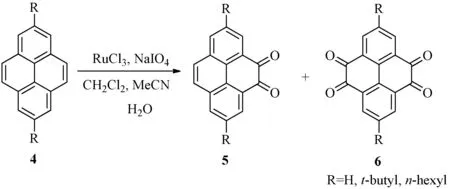
图3 芘的氧化反应
1.2 芘的光物理与光化学性质
实验证明,芘具有非常有效的光物理与光化学活性.芘的第一单重激发态(S1)有相当长的寿命,与基态(S0)相比,其第一单重激发态(S1)具有不同的结构[5].同时,芘有很高的荧光量子产率(Fem=0.65),非常容易形成激发态聚合物.另外,不论是荧光量子产率还是激发态聚合物对所处环境都非常敏感.
基于芘的光物理和光化学特性,一些相关的荧光探针可根据它的激发二聚体/单体的发射光谱和长荧光寿命来进行设计[6].一些分子聚合体当其含有芘结构时会有一定的识别功能,比如三氮唑连接二茂铁芘二分体7可以选择性的识别磷酸阴离子(见图4)[7].
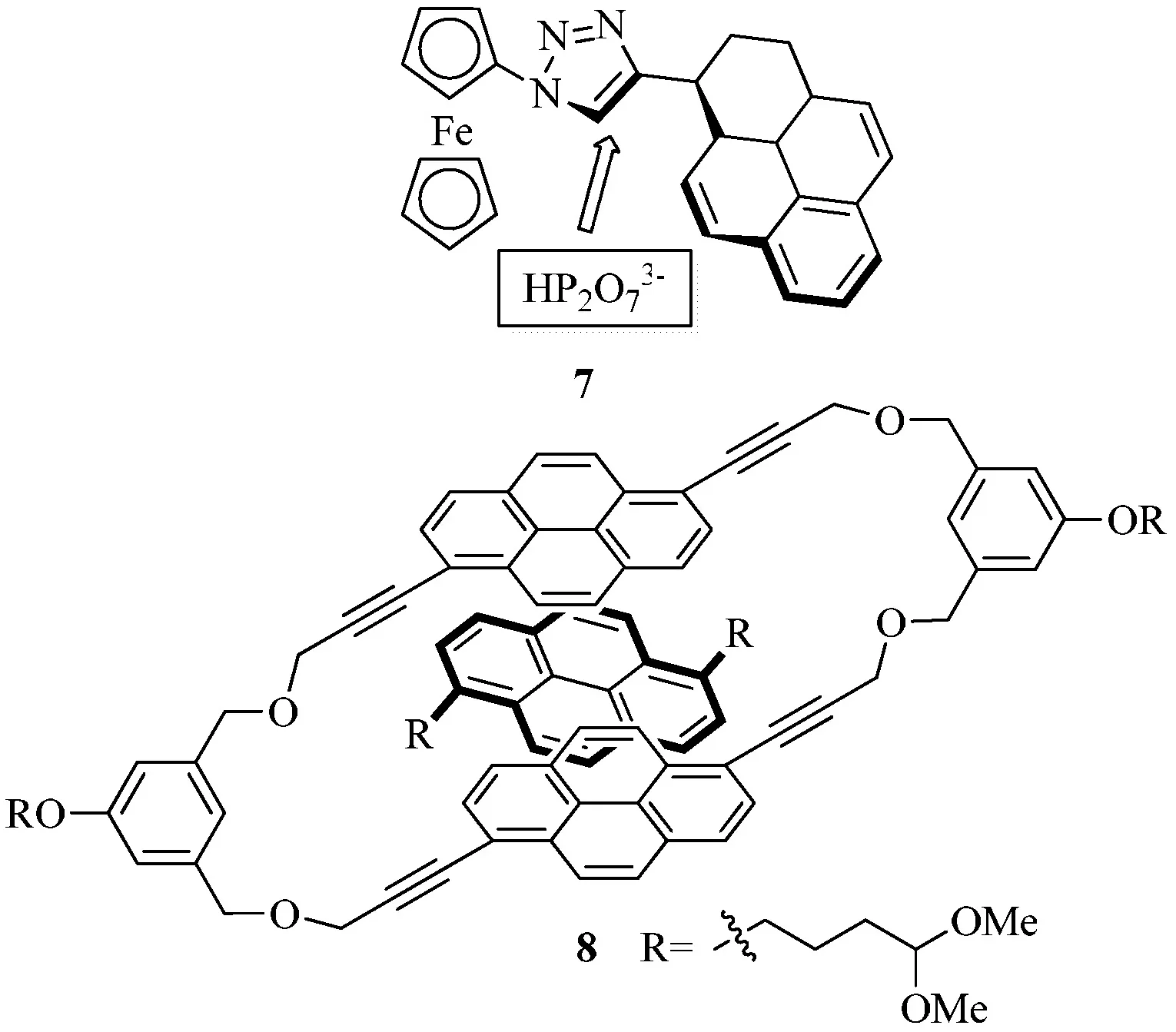
图4 7和8的识别系统
目前,已知的芘衍生物应用于多个领域,如染料、农药、医药和电致发光器等,并且芘衍生物作为一类较特殊结构的化合物,其开发与利用将有很大的空间及前景,如水溶性芘类衍生物8展现了分子识别的能力,由于其空腔大小为0.46×0.95×1.31 ?,这种大小的空腔可以用于识别阴性芳香烃化合物或者核酸[8].
2 芘番及其合成
2.1 芘 番
芘番是环番(Cyclophane)的一种类型,当环番的芳香烃部分特定为芘时,则称之为芘番(见图5).芘番是通过由线型的且各种不同数目原子所形成的桥链将芘上两个不相邻的原子连接起来的化合物.芘番所含的线型桥链或芘的数目可以为一个也可以为多个[9].芘番不仅具有芘的化学性质,同时也具有环番的化学性质.
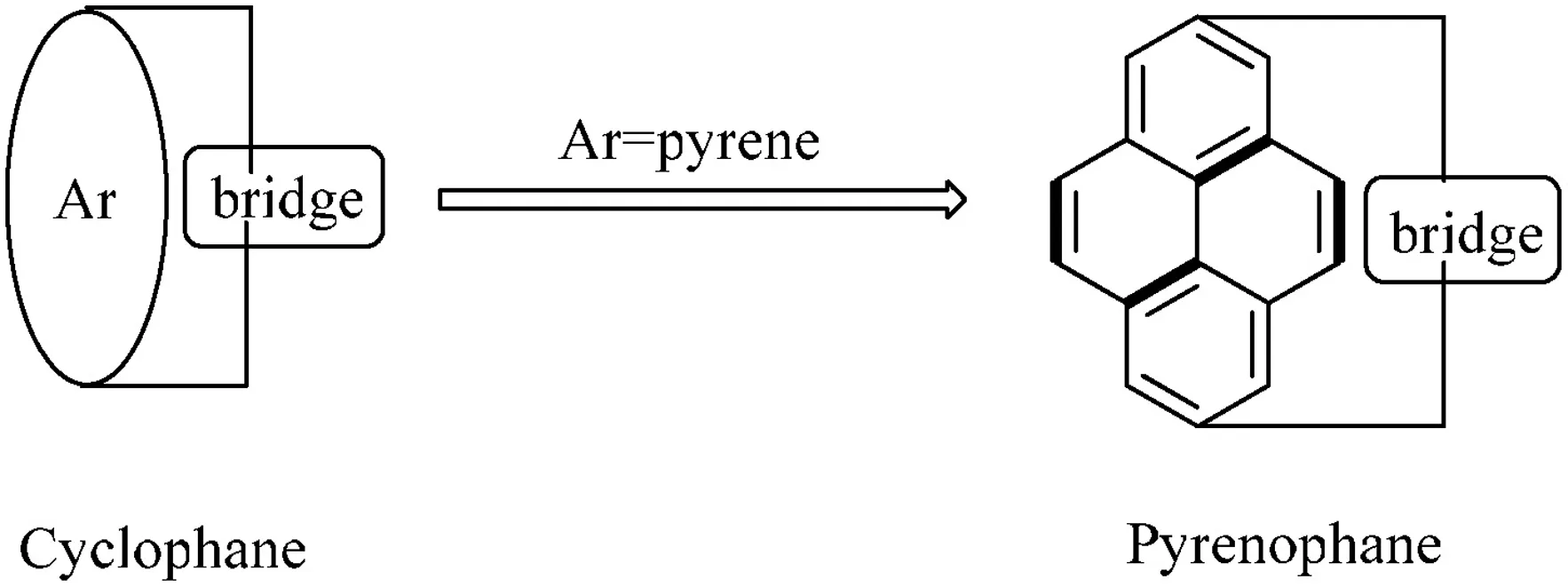
图5 环番和芘番的关系
另外,从芘的结构上来看,其具有13种不相邻碳原子两两配对的形式,这些是潜在的芘番桥链连接方式,如,(1,3)、(1,4)、(1,5)、(1,6)、(1,7)、(1,8)、(1,9)、(2,4)、(2,5)、(2,6)、(2,7)、(4,9)和(4,10)(见图1).而目前仅有(1,3)、(1,6)、(1,8)、(2,4)、(2,7)和(4,9)相连接的方式被发现,其主要原因是合成具有对应取代基团的芘较为困难.
2.2 芘番的合成
2.2.1 (1,3)芘番的合成.
1993年,Yamato等[3]报道了(1,3)芘番的合成(见图6).当芘的7位被叔丁基取代时,1,3-双取代的芘9较为容易被合成,这主要是因为叔丁基处于芘的7位时可以阻碍6位和8位的取代反应.二溴化合物9和二巯基化合物10a在极稀释浓度的条件下可以发生偶联反应生成(1,3)芘番11.而当二溴化合物9和二巯基化合物10b发生偶联反应时,由于10b化合物在二巯基之间有一个甲基取代,以至于只能生成反式构型的化合物12.另外,硫化物11和12发生氧化反应后生成砜类化合物,其构型保持不变.然而,经过高压高温分解,顺式构型的硫化物11和反式构型的硫化物12都将生成反式构型的氧化产物(1,3)芘番13和(1,3)芘番14.其(1,3)芘番13和(1,3)芘番14的反式构型可通过对芘的2位氢的化学位移的测定(d顺式11=6.85,d反式12=5.85,d反式13=5.09,d反式14=4.53)来进行证明[10-12].
2.2.2 (1,6)芘番的合成.
2004年,Inouye等[8]对一系列的具有聚阳离子和两亲性功能的大环(1,6)芘番的合成进行了报道,这些(1,6)芘番的合成主要利用的是交叉偶联化学反应(见图7).丁二炔15与1,6-二碘芘发生Sonogashira交叉偶联反应后生成二碘化合物17,中间化合物17可以通过Stille交叉偶联反应与二锡烷16(二锡烷16从化合物15反应制得)反应生成(1,6)芘番18.各式R基团,比如ω-乙缩醛,被引入来增加大环化合物的溶解度,以便进一步增强大环化合物的功能性.同时,Misumi等[13]在1978年也合成了[2.2](1,6)芘番并伴随着[2.2](2,7)芘番的生成.
2.2.3 (1,8)芘番的合成.
化合物21是现在所知的惟一的(1,8)芘番(见图8),二硫环番20是从化合物19通过4步化学反应而生成,硫化基团可以通过P(OEt)3来除去,通过使用DDQ的脱氢化反应可以生成反式化合物21.其中反式构型可以通过对Ha和Hb向高场移动的化学位移数值所证明(dHa=6.55,dHb=8.03)[13].
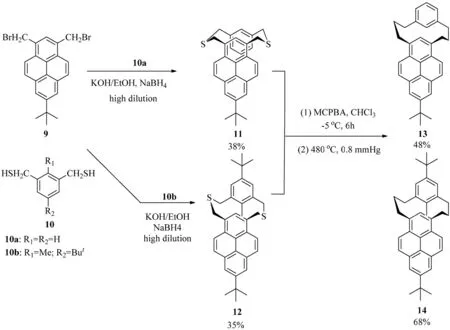
图6 (1,3)芘番13和14的合成
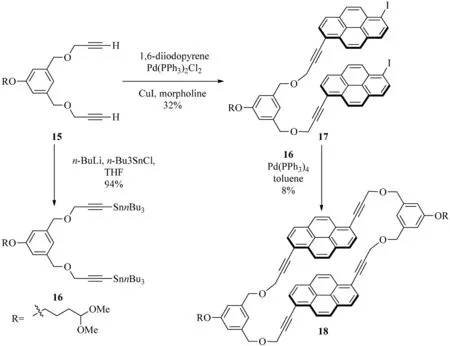
图7 (1,6)芘番18的合成
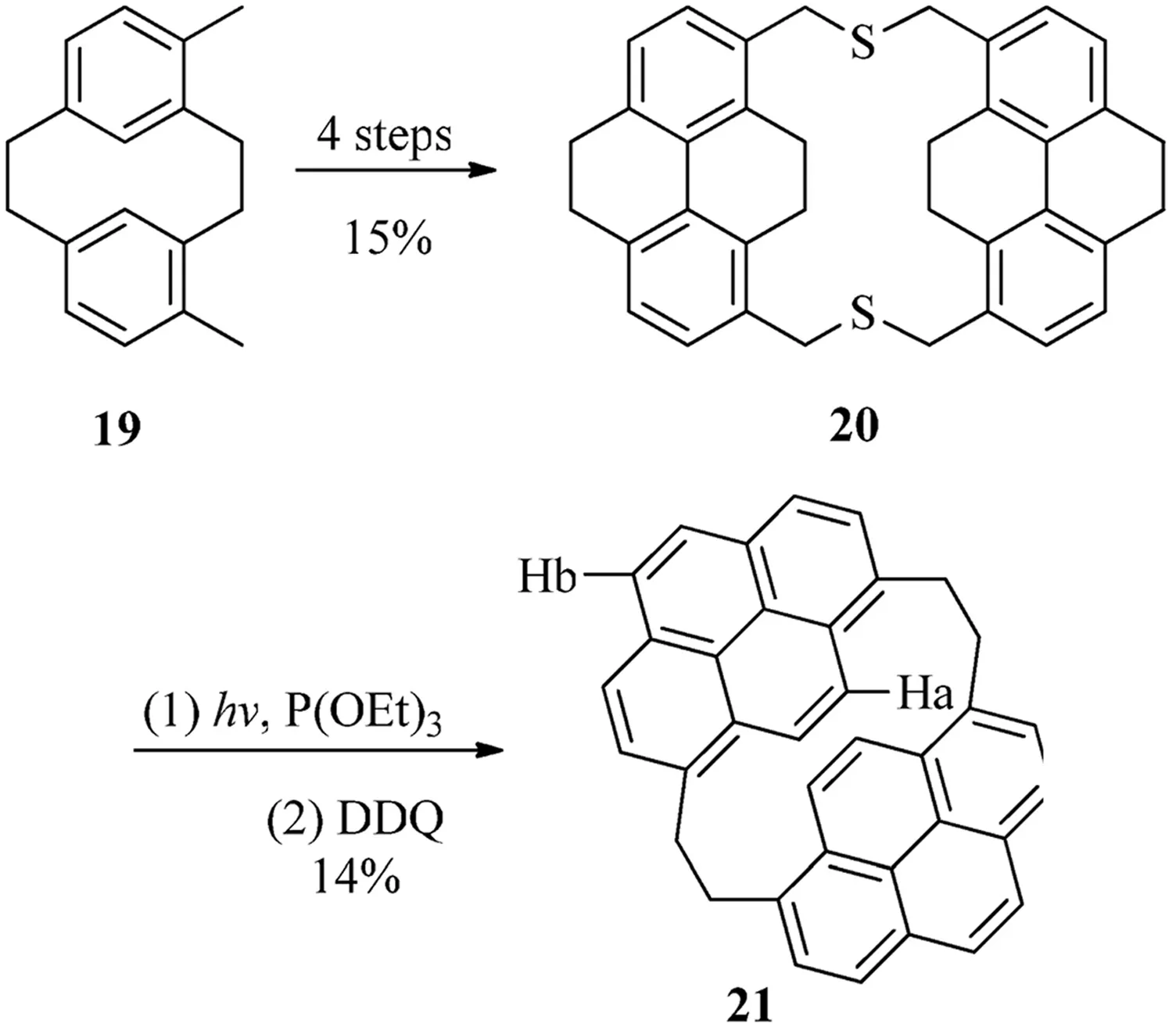
图8 (1,8)芘番21的合成
2.2.4 (2,4)芘番的合成.
2000年,Meier等[5]合成了三芘[2,3,4-abc:2,3,4-ghi:2,3,4-mno][18]环轮烯32,实际上它也可以被看作为(2,4)芘番的一种(见图9)[5].该合成没有直接以芘作为起始原料,而是采用了2个起始模块结构24和25,这2个模块结构分别是从化合物22和23合成得到的,并且2个起始模块可以通过Horner-Wadsworth-Emmons反应生成(E/Z)26.接着,光化学的环化脱氢反应可以生成菲的衍生物27.这时通过甲酰化Witting反应乙烯基被引入到化合物结构29中.第二次的环化脱氢反应生成具有完整芘结构的化合物30.其中它的溴化基团通过两步化学反应被转化为N-苯胺,同时通过三重高度(E)-选择性的Siegrist反应最终生成(2,4)芘番32.从结构上来看,[18]环轮烯很容易在化合物32上识别出来,但是化合物32确实也是由3个芘通过桥链连接而成,因此属于芘番的范畴.目前,Meier等合成的(2,4)芘番化合物是惟一已知合成的(2,4)芘番.
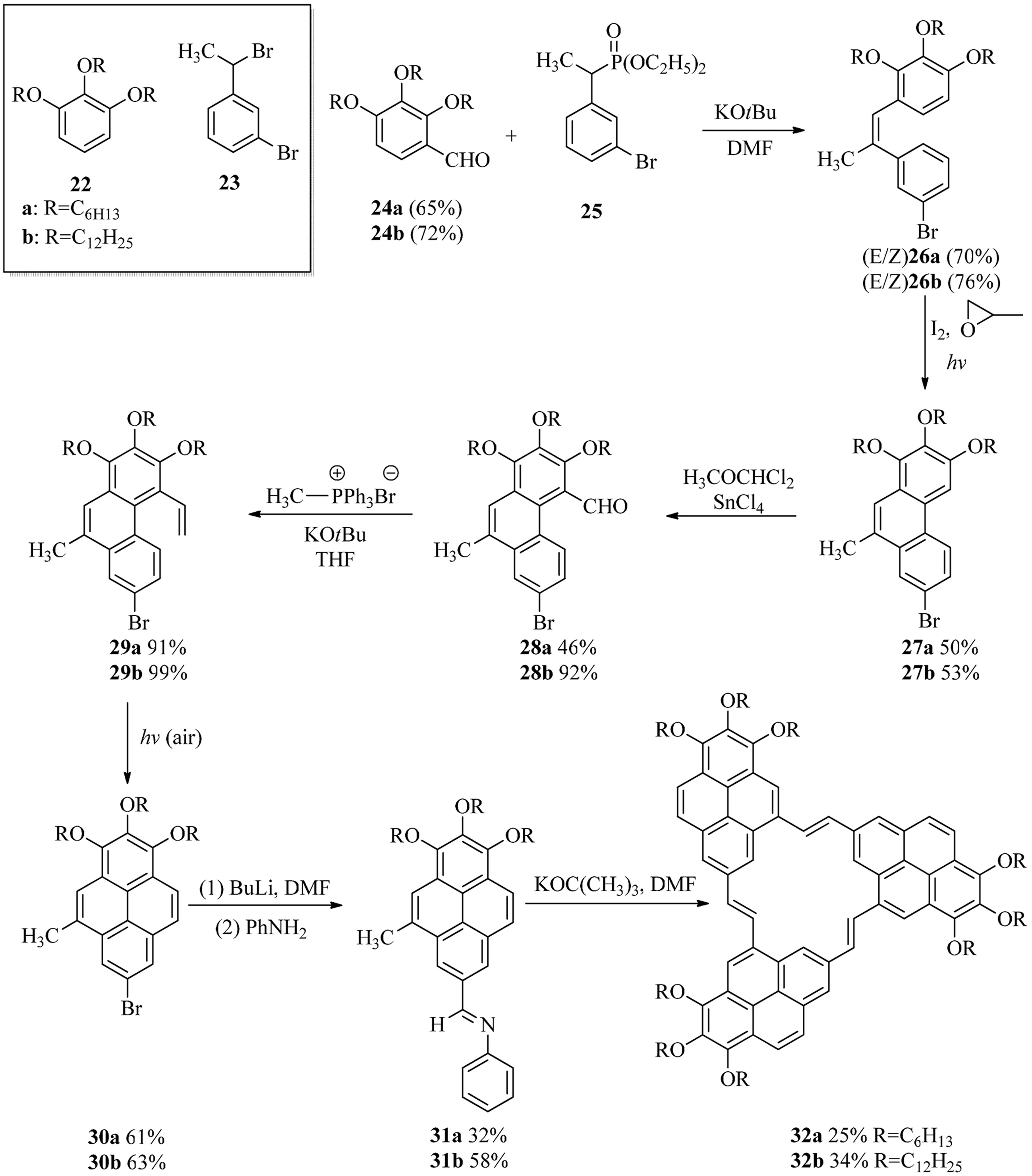
图9 (2,4)芘番32a和32b的合成
2.2.5 (2,7)芘番的合成.
Bodwell研究团队合成了一些列的[n](2,7)芘番,这些芘番一般都采用较为固定的合成策略(见图10).在这个合成路线中,异构化反应/脱氢反应(VID)是最为关键的反应步骤,可将桥链[2.2]间环番-1,9-二烯生成完整的芘结构.当桥链的长度足够短时,芘的结构可以被弯曲,并且当桥链的长度越短,芘结构的弯曲度越大[14].这种非平面性的芘可以对其弯曲度进行量化,并用弯曲度θ来表示.弯曲度θ为芘结构上C1-C2-C3 3个碳原子构成的平面与C6-C7-C8 3个碳原子构成的平面间所形成的最小夹角.现所测得芘番中最大的弯曲度θ是1,7-二氧[7](2,7)芘番34(X=1)的弯曲度,其数值为109.2 °.根据DFT计算,化合物36和37中芘结构的弯曲度分别为,93.6 °和95.8 °[15].
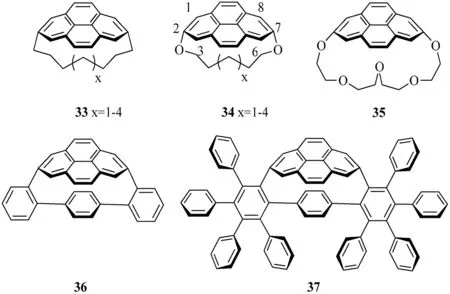
图10 部分合成的[n](2,7)芘番
2003年,Bodwell等[16]报道了合成(2,7)芘番的方法.以1,10-二氧[10](2,7)芘番43为例(见图11),该方法首先通过Williamson醚合成法,二酯38同1,8-二溴辛烷反应生成四酯化合物39.四酯基团与LiAlH4的还原反应所得到粗产物直接再跟HBr/H2SO4作用生成四溴化合物40,2步反应的收率为55%.此时,2个苯基除了桥链外,可以通过41与Na2S/Al2O3反应将1,3位侧链连接起来进一步生成二噻环番41化合物.通过使用(MeO)2CHBF4(Borch试剂)对二噻环番41S-甲基化后再进行Stevens重排生成一系列不易分离的缩环异构混合物.第二次的S-甲基化反应和Hofmann消除反应最终生成了关键中间体顺式-[2.2]间环番二烯42,4步反应的总产率为65%.通过氢核磁共振波谱法测定分析后发现,约一半数量的顺式-[2.2]间环番二烯42可以直接转化为终产物43.然而化合物41和42并不容易能够分离,它们的混合物通过与DDQ反应过后,最终生成芘番43.同时,VID反应也被证明了是对于合成非平面性的芘非常有用的反应.
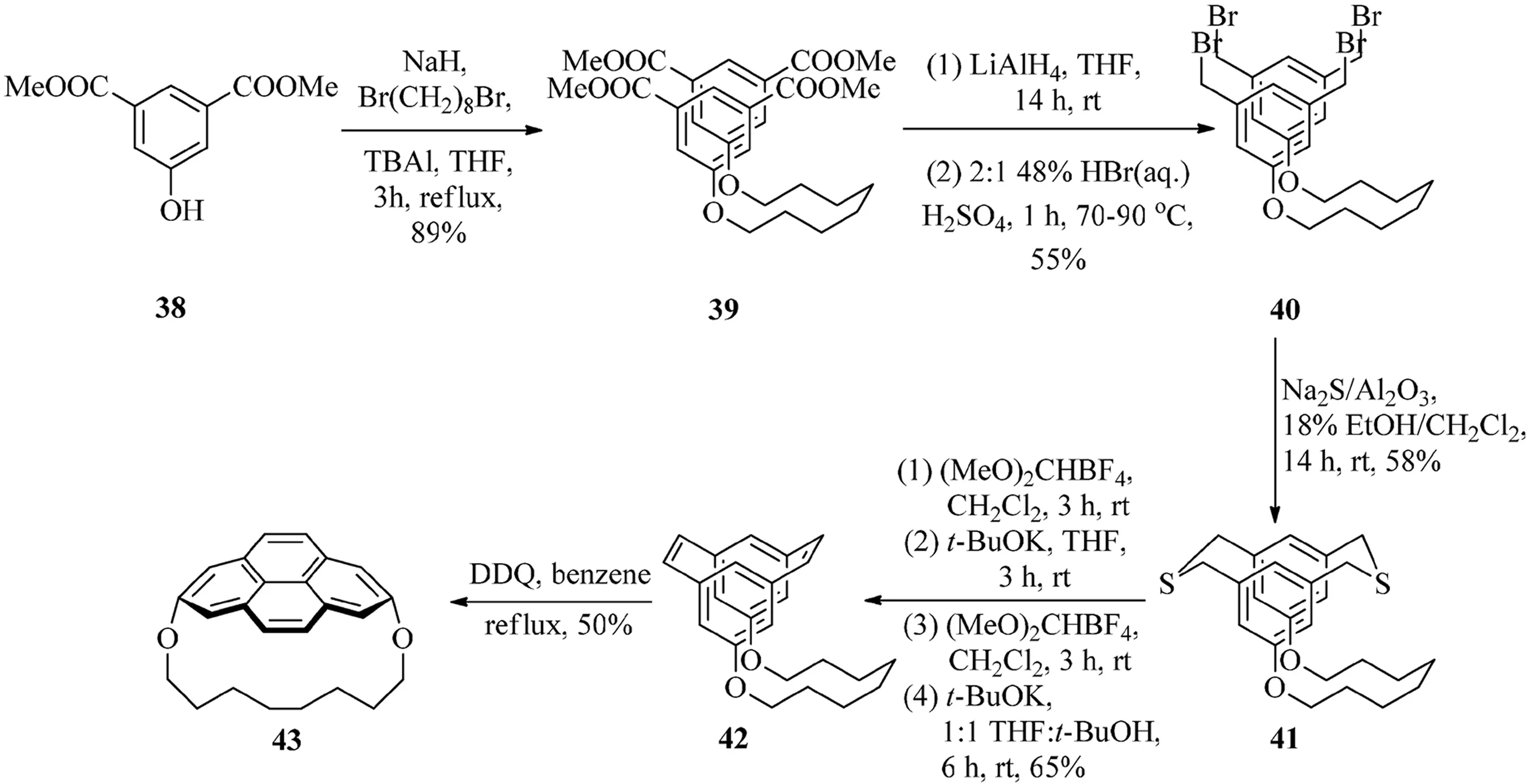
图11 1,10-二氧[10](2,7)芘番43的合成
2.2.6 (4,9)芘番的合成.
2005年,Tsuge等[17]通过传统的环番合成方法成功的合成了(4,9)芘番(见图12),并且这个化合物是惟一的现今所知的(4,9)芘番.其方法是,双氯甲基芘44同双氢硫甲基苯45在Cs2CO3作用下在极稀浓度的溶液中可以制得二噻芘番46,如果将苯环上的硝基取代还原为氨基,这样还可以用于研究氨基和芘的NH-π相互作用.
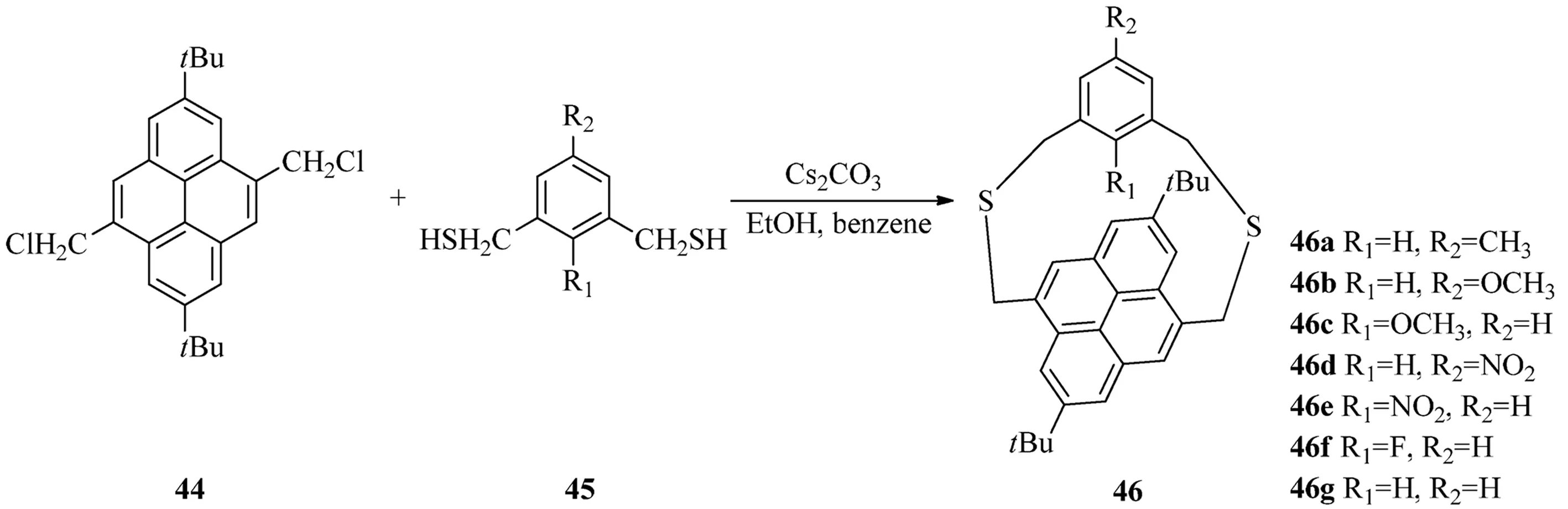
图12 (4,9)芘番46的合成
3 结 语
本研究综述了芘番的光化学和光物理特性及其合成方法.目前,仅(1,3)、(1,6)、(1,8)、(2,4)、(2,7)与(4,9)类型的芘番被科研人员合成出来.通过对已知芘番合成路线的研究,亲核取代反应生成硫化物后再进行脱巯基氧化反应生成芘番是常采用的合成方法.另外,利用交叉偶联反应或Siegrist反应也是合成芘番强有力的工具之一.在芘番结构的设计中,引入一些侧链的R基团亦可增加芘番的溶解性,有利于芘番的合成.这些合成策略对于新类型芘番的合成和设计将有很强的指导意义.同时,随着新类型芘番的合成,更多的芘番或芘番衍生物的应用将被人们开发出来.
[1]Graebe C.Ueberpyren[J].Eur J Org Chem,2010,158(3):285-299.
[2]Streitwieser A,Lawler R G,Schwaab D.Onthebromopyrenes[J].J Org Chem,1965,30(5):1470-1473.
[3]Yamato T,Miyazawa A,Tashiro M.Medium-sizedcyclophanes.part31.Synthesisiandelectrophilicsubstitutionof8-substituted[2]metacyclo[2](1,3)pyrenophanes[J].J Chem Soc,Perkin Trans 1,1993,25(12):3127-3137.
[4]Hu J,Zhang D,Harris F W.Ruthenium(III)chloridecatalyzedoxidationofpyreneand2,7-disubstituedprenes:anefficient,one-stepsynthesisofpyrene-4,5-dionesandpyrene-4,5,9,10-tetraones[J].J Org Chem,2005,70(2):707-708.
[5]Meier H,Schnorpfeil C,Fetten M.Synthesisoftripyreno[2,3,4-abc:2,3,4-ghi:2,3,4-mno] [18]annulenes[J].J Prakt Chem,2000,342(8):785-790.
[6]Ji S,Yang J,Yang Q,et al.Tuningtheintramolecularchargetransferofalkynylpyrenes:effectonphotophysicalpropertiesanditsapplicationindesignofoff-onfluoresentthiolprobes[J].J Org Chem,2009,74(13):4855-4865.
[7]Inouye M,Fujimoto K,Furusyo M,et al.Molecularrecognitionabilitiesofanewclassofwater-solublecyclophanescapabeofencompassinganeutralcavity[J].JACS,1999,121(7):1452-1458.
[8]Inouye M,Abe H,Mawatari Y,et al.Synthesisandmolecularrecognitionofpyrenophaneswithpolycationicoramphiphilicfunctionalities:artificialplate-shapedcavitantincorporationgarenesandnucleotidesinwater[J].J Org Chem,2004,69(2):495-504.
[9]Gleiter R,Rausch B J,Schaller R J.Moderncyclophanechemistry[M].Weinheim,Berlin,Germany:Wiler-VCH,2004.
[10]Sato T,Wakabayashi M,Okamura Y,et al.Medium-Sizedcyclophanes.IV.thehalogenationreactionsof[2.2]metacyclophane[J].BCSJ,1967,40(10):2363-2365.
[11]Mitchell R H,Mahadevan R.Synthesisofdiatropichighlybenzannelatedannulenes[J].Tetr Lett,1981,22(51):5131-5134.
[12]Vøgtle F,Ostrowicki A,Begemann B,et al.Chiraledreilagigeundkondensierte[2.2]cyclophanesynthese,struktur,chiroptik[J].Chem Ber,1990,123(1):169-176.
[13]Misumi S,Kawashima T,Sakata O Y.Synthesesofthree[2.2]pyrenophanesasanexcimermodeloriginalresearcharticle[J].Tetr Lett,1978,19(51):5115-5121.
[14]Yao T,Yu H,Vermeij R,et al.Nonplanararomaticcompounds.Part10:astrategyforthesynthesisofaromaticbelts-allwrappedupordownthetubes?[J].Pure Appl Chem,2008,80(3):533-536.
[15]Zhang B,Manning G P,Dobrowolski M A,et al.Nonplanararomaticcompounds.9.synthesis,structure,andaromaticityof1:2,13:14-dibenzo[2]paracyclo[2] (2,7)-pyrenophane-1,13-diene[J].Org Lett,2008,10(2):273-276.
[17]Tsuge A,Otsuka M,Moriguch T,et al.Syntheses,structuralproperties,andcharge-transfercomplexesofpyrenophanes[J].Org Biomol Chem,2005,3(19):3590-3593.
Research Advances on Synthesis of Pyrenophanes
YANGYixi1,ZHANGJue2,QIULu2,GUOXiaoqiang2
(1.School of Oversea Education, Chengdu University, Chengdu 610106, China;2.School of Pharmacy and Bioengineering, Chengdu University, Chengdu 610106, China)
Pyrenophane is referred as one type of cyclophane,which obtains not only the physical and chemical properties of pyrene,but also the physical and chemical properties of cyclophane.However,the synthesis of this compound is rarely reported in China.In this paper,the definition,structures,synthesis and applications are briefly reviewed.Based on the description of the synthetic routes for the already known pyrenophanes,the paper provides reference for the pyrenophanes synthesis with photophysical and photochemical properties that will be applied in fluorescent probes and molecule recognition.
cyclophane;pyrenophane;synthesis
1004-5422(2017)02-0125-06
2017-03-02.
成都大学校科技发展基金(2014XJZ03)资助项目.
杨轶浠(1984 — ), 女, 硕士, 助理研究员, 从事有机合成研究.
O625.8
A
