IUGR对成年期CG-IUGR雄性大鼠糖尿病易感性的影响
2017-07-06张宽琳侯拉梅李丽娟
张宽琳,侯拉梅,李丽娟
(1. 遵义医学院附属医院 病理科,贵州 遵义 563099;2. 遵义医学院 病理生理学教研室,贵州 遵义 563099)
基础医学研究
IUGR对成年期CG-IUGR雄性大鼠糖尿病易感性的影响
张宽琳1,侯拉梅2,李丽娟2
(1. 遵义医学院附属医院 病理科,贵州 遵义 563099;2. 遵义医学院 病理生理学教研室,贵州 遵义 563099)
目的 分析生长追赶的宫内发育迟缓(CG-IUGR)雄性大鼠成年期糖尿病(DM)的易感性。方法 ①测量CG-IUGR组(为采用低热量饮食法复制的胚胎期营养不良、出生后正常饲养至12周龄的生长追赶雄性SD大鼠)和正常对照组(为正常饲养孕鼠所产、出生后正常饲养至12周龄的雄性大鼠)大鼠0~12周龄的体重(BM)和身长(BL),计算体重指数(BMI);分离并称量两组12周龄雄性大鼠双侧肾周脂肪组织。②检测12周龄的两组大鼠空腹血糖(FBG)及空腹血清胰岛素(FINS)水平,计算胰岛素抵抗指数(IRI);进行糖耐量实验(GTT)和胰岛素耐量实验(ITT),并计算GTT实验曲线下面积(AUC);测定两组大鼠葡萄糖负荷后15 min时的血清胰岛素(INS)水平。结果 CG-IUGR组雄性大鼠BM、BMI的增长以及12周龄时肾周脂肪组织重量明显高于对照组(P均<0.05);与对照组比较,12周龄CG-IUGR组雄性大鼠血清FINS水平及IRI轻度降低(P<0.05),葡萄糖及INS负荷后的血糖水平均明显升高(P<0.05),葡萄糖负荷后的血清INS水平明显增加(P<0.05)。结论 IUGR可能通过增加肥胖的倾向,降低葡萄糖和INS的耐受性及葡萄糖负荷后的INS效应导致成年CG-IUGR大鼠DM的易感性增加。
糖尿病;易感性;CG-IUGR;IUGR;大鼠
宫内发育迟缓(intrauterine growth restriction,IUGR)是指在胚胎发育的过程中,由于各种原因引起胎儿发育不良,导致其出生体重低于正常新生儿平均体重2个标准差的现象[1]。流行病学调查发现,部分IUGR个体出生后会出现生长速度加快的现象,即生长追赶(catch-up growth,CG)[2]现象。CG现象促使IUGR个体在出生后的生长发育过程中逐渐达到甚至超过胚胎期正常发育个体的生长速度,在一定程度上弥补了胚胎期营养不良的不足,缩小了其与胚胎期正常发育个体在生长发育上的差距;但CG现象导致的代谢失衡却可能成为IUGR个体在成年后罹患某些代谢性疾病的基础。糖尿病(diabetes mellitus,DM)是一种慢性代谢性疾病,是由于胰岛素分泌减少和(或)胰岛素抵抗(insulin resistance,IR)而造成的糖代谢紊乱性疾病。DM的发病机制非常复杂,迄今为止,尚有诸多环节不清楚。现有研究表明,IUGR可导致IUGR个体成年期DM的易感性和发病率增加,特别是具有生长追赶的宫内发育迟缓(catch-up growth intrauterine growth restriction,CG-IUGR)个体尤为明显[3-7],但二者之间的关系并不清楚,其中的发病机制亦不确定。
本文拟通过低热量饮食法建立CG-IUGR大鼠模型,并且通过检测其DM的相关指标来探索IUGR对成年期CG-IUGR雄性大鼠DM易感性的影响机制。
1 材料与方法
1.1 材料
1.1.1 动物饲料 由第三军医大学大坪医院野战外科研究所实验动物中心提供,每100 g饲料的总热量为1 031.9千焦(kilojoule,kJ)。各营养成分及热量见表1。
表1 实验动物饲料配方表(100 g)

成分玉米大豆饼大豆小麦麸面粉骨粉芝麻饼奶粉植物油总计热量(kJ)172.6173.688216.2221.231.850.540.537.51031.9
1.1.2 实验试剂 40 U/mL胰岛素(insulin,INS)溶液(江苏万邦生化医药股份有限公司),50%葡萄糖(glucose solution,GS)溶液(重庆迪康长江制药有限公司),强生稳豪型血糖试纸(葡萄糖氧化酶法)、强生稳豪倍易型血糖仪(强生中国医疗器材有限公司),碘[125I]胰岛素放射免疫试剂盒(北京北方生物技术研究所有限公司)。
1.2 实验方法
1.2.1 实验分组及处理 以Sprague Dawley(SD)大鼠作为实验动物[北京维通利华实验动物技术有限公司,批号:SCXK(京)2012-0001]。实验分为正常对照组(control组)和CG-IUGR组。取8周龄SD同窝雌性大鼠16只(每窝4只,共4窝),体重180~200 g,适应性饲养1周后,按雌雄4∶1的比例合笼至雌鼠受孕。采用低热量法建立CG-IUGR大鼠模型[8-9],即孕期全程给予control组饲料总量的40%进行饲养(12 g/d,热量总计412.8 kJ),直至分娩,其子鼠出生后进行常规饲养至12周龄,选择具有生长追赶的雄性大鼠作为CG-IUGR组大鼠。control组孕期全程给予常规饲养(30 g/d,热量总计约1 031.9 kJ),直至子鼠出生,出生后正常饲养至12周龄,选择雄性大鼠作为control组大鼠。
1.2.2 检测指标
1.2.2.1 检测两组大鼠的生长发育情况 两组大鼠出生时及出生后,每周测量大鼠的体重(body mass,BM)和身长(body length,BL)(自鼻尖至尾根部的长度),计算体重指数(body mass index,BMI)(BMI=BM/BL2)并绘制BMI增长图;分离并称量两组12周龄雄性大鼠肾周脂肪组织。
1.2.2.2 检测空腹血糖和空腹血清胰岛素水平并计算胰岛素抵抗指数 取两组12周龄雄性大鼠,空腹12 h后经颈动脉取血,分离血清后按照试剂盒说明分别采用葡萄糖氧化酶法测量空腹血糖(fasting blood-glucose,FBG)水平和采用放射免疫法测定空腹血清胰岛素(fasting insulin,FINS)水平,计算胰岛素抵抗指数(insulin resistance index,IRI)(IRI=FPG×FINS/22.5,取自然对数)。
1.2.2.3 糖耐量实验(glucose tolerance test,GTT) 取两组12周龄雄性大鼠进行GTT实验。两组雄性大鼠空腹12 h后,在尾静脉采血,按照试剂盒说明采用葡萄糖氧化酶法测定FBG水平后,经腹腔注射GS(葡萄糖2 g/kg),并在GS注射后15、30、60、90和120 min经尾静脉采血,采用葡萄糖氧化酶法测定血糖水平,绘制糖耐量曲线图,并计算GTT实验的曲线下面积(area under curve,AUC)。
1.2.2.4 胰岛素耐量实验(insulin tolerance test,ITT) 取两组12周龄雄性大鼠进行ITT实验。两组雄性大鼠空腹12 h后,在尾静脉采血,按照试剂盒说明采用葡萄糖氧化酶法测定FBG水平后,经腹腔注射INS(0.1 U/kg),并在INS注射后15、30、60、90和120 min经尾静脉采血,采用葡萄糖氧化酶法测定血糖水平,绘制胰岛素耐量曲线图。
1.2.2.5 葡萄糖负荷后的血清胰岛素水平 取两组12周龄雄性大鼠,空腹12 h后经腹腔注射GS(葡萄糖2 g/kg),并于GS注射后15 min时经颈动脉取血,分离血清并按照试剂盒说明采用放射免疫法测定血清INS水平。
2 结果
2.1 两组大鼠的生长发育变化 随着两组大鼠周龄的增加,与control组相比较,各周龄CG-IUGR组雄性大鼠的BL无明显增加,但其BM、BMI增长值以及12周龄时的肾周脂肪重量均明显增加(P<0.05,见图1~2)。结果显示,CG-IUGR组雄性大鼠出现明显的生长追赶,并呈现出肥胖趋势。
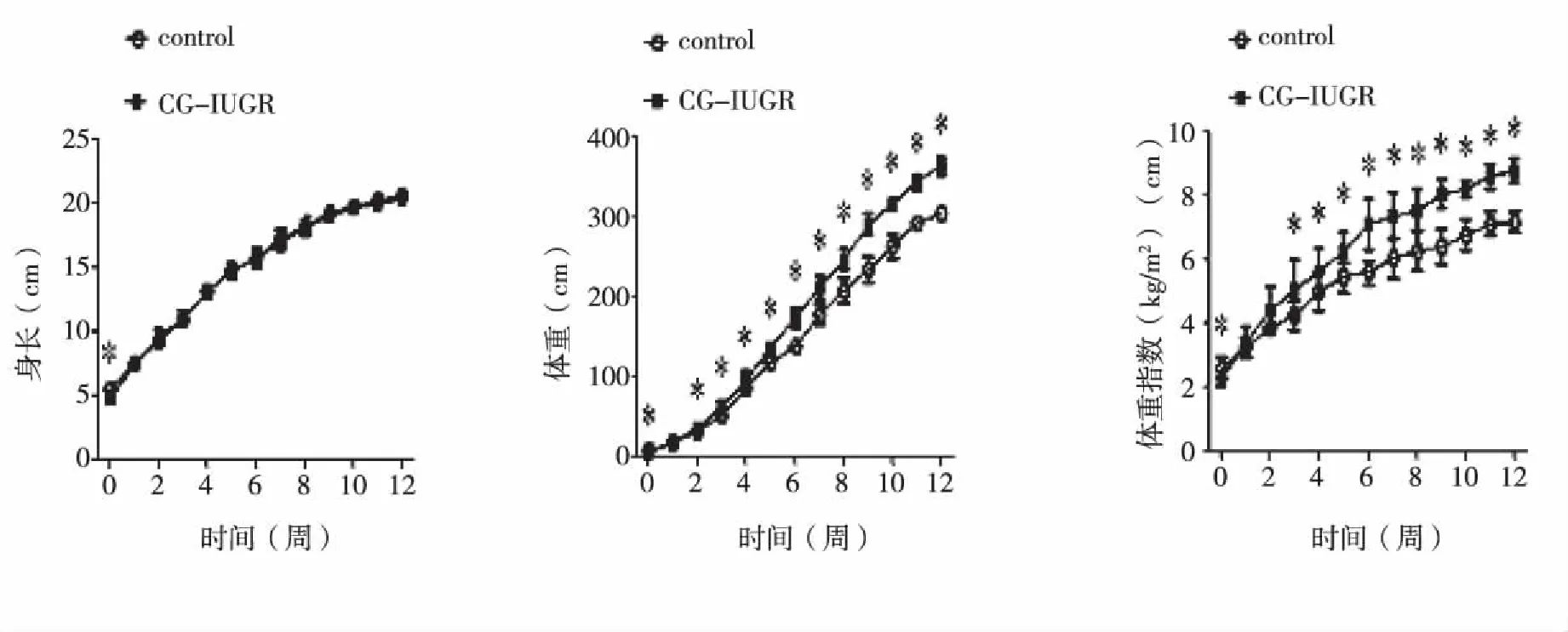
与control组相比较,*P<0.05。图1 两组大鼠0~12周龄身长、体重、体重指数增长变化
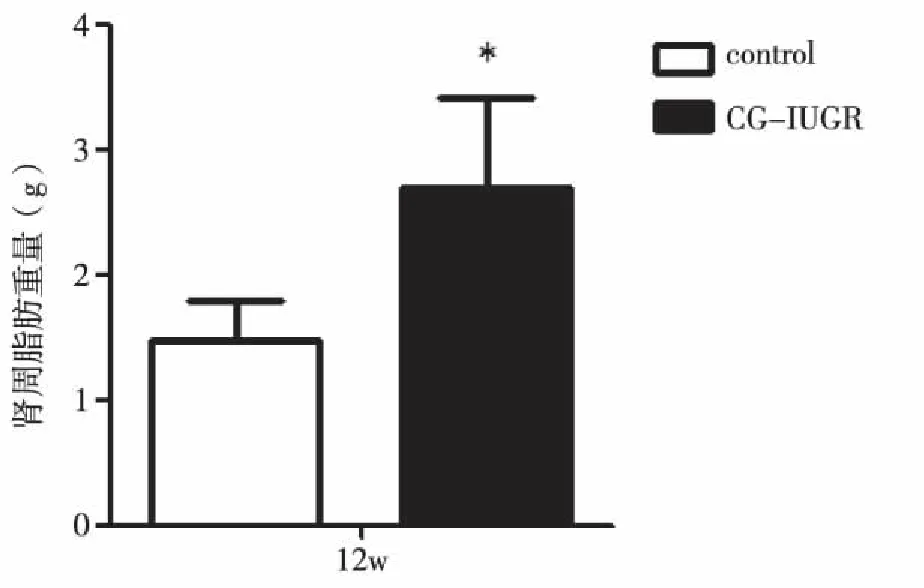
与control组相比较,*P<0.05。图2 两组大鼠12周龄肾周脂肪组织的重量
2.2 两组12周龄雄性大鼠的空腹血糖、空腹血清胰岛素水平及胰岛素抵抗指数 CG-IUGR组雄性大鼠FBG的平均水平轻度升高,但与control组相比较,差异无统计学意义;CG-IUGR组雄性大鼠血清FINS水平降低(P<0.05),其相应的IRI也轻度降低(P<0.05,见表2)。上述结果提示,IUGR可造成12周龄的CG-IUGR雄性大鼠INS分泌异常。


组别空腹血糖(mmol/L)空腹胰岛素(μIU/L)胰岛素抵抗指数control4.43±0.2837.51±4.381.99±0.10CG-IU-GR4.89±0.3616.63±3.44*1.26±0.20*
与control组相比较,*P<0.05。
2.3 两组大鼠葡萄糖负荷后的血糖水平 在葡萄糖负荷后,两组雄性大鼠的血糖水平均明显升高,并且于葡萄糖负荷后的15 min达最高峰值。与control组相比较,CG-IUGR雄性大鼠的血糖水平在葡萄糖负荷后的各个时间点均明显升高(P<0.05);其相应的AUC也增大(P<0.05,见图3)。结果提示,IUGR可导致12周龄CG-IUGR雄性大鼠糖耐量降低。
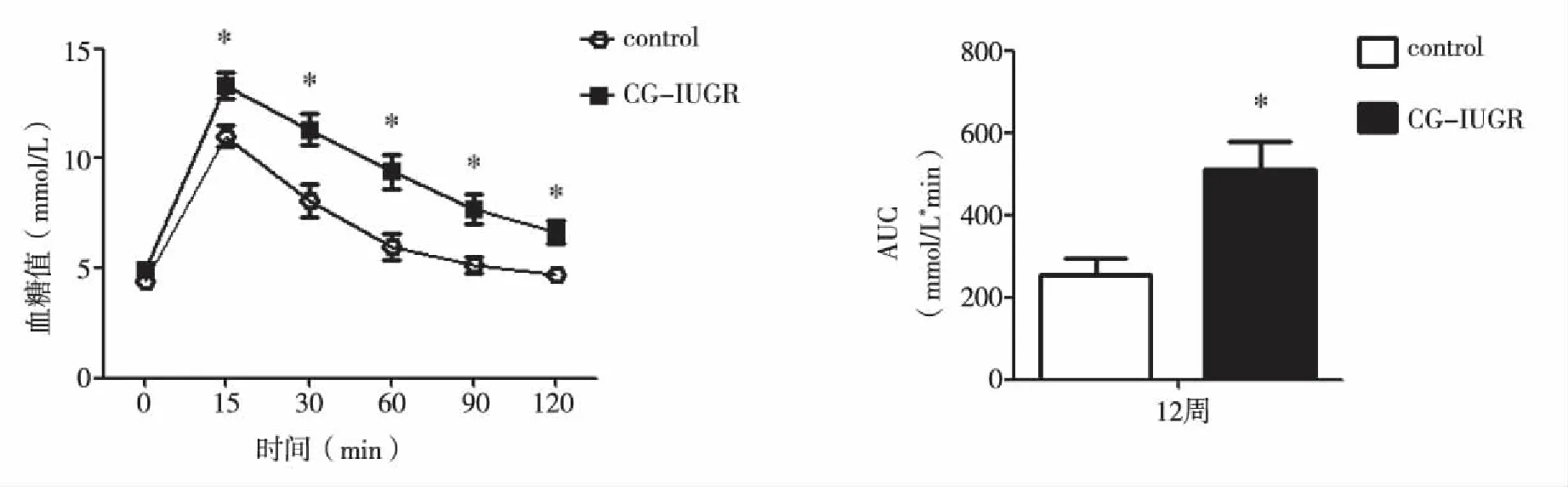
与control组相比较,*P<0.05。图3 两组大鼠葡萄糖负荷后的血糖水平及糖耐量实验(GTT)曲线下面积(AUC)
2.4 两组大鼠INS负荷后的血糖水平 CG-IUGR组雄性大鼠的血糖水平在INS负荷后的各个时间点均明显增高,与control组相比较,差异具有统计学意义(P<0.05,见图4)。上述结果提示,IUGR可导致12周龄的CG-IUGR雄性大鼠INS耐量降低。
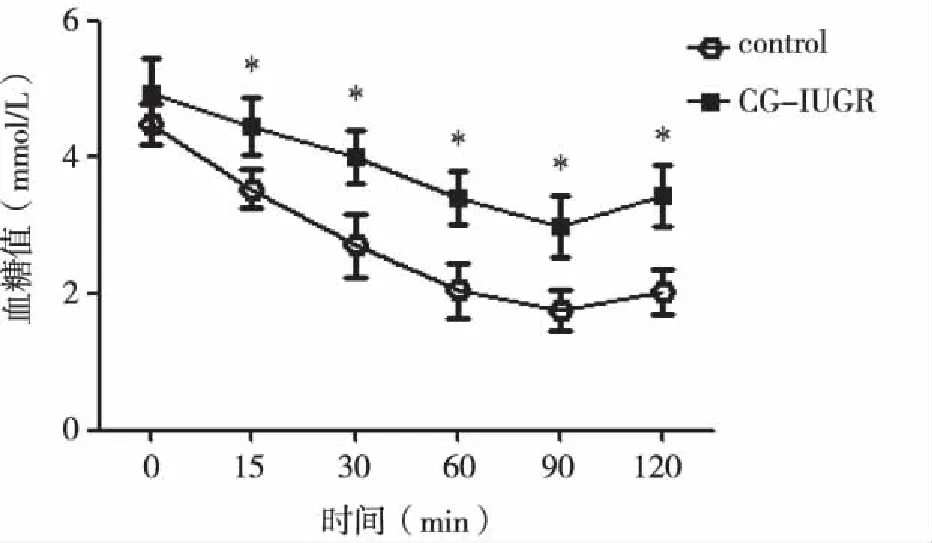
与control组相比较,*P<0.05。图4 两组大鼠胰岛素(INS)负荷后的血糖水平
2.5 葡萄糖负荷后的血清INS水平 CG-IUGR组雄性大鼠在葡萄糖负荷后15 min的血清INS水平显著升高,与control组相比较,差异具有统计学意义(P<0.05)。上述结果提示,12周龄CG-IUGR雄性大鼠存在IR的潜在可能(见表3)。
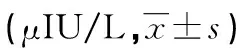

组别空腹胰岛素葡萄糖负荷后胰岛素control37.51±4.3840.64±3.61CG-IUGR16.63±3.44*67.47±2.91*
与control组相比较,*P<0.05。
3 讨论
本研究结果中,与control组相比较,CG-IUGR组雄性大鼠BM及BMI增加明显;12周龄的CG-IUGR雄性大鼠的肾周脂肪组织也明显增加。刘晓梅等[10]通过低蛋白饮食法建立IUGR大鼠模型,发现IUGR雄性大鼠的BM自哺乳期出现明显增加,并于4周龄时达control组水平;田景琰等[11]采用孕期50%低热量饮食联合断乳后高脂饮食法复制CG-IUGR大鼠模型,发现CG-IUGR大鼠BM增长值自出生起就开始增加,并于15周龄时明显超过control组,同时15周龄时的附睾脂肪重量也明显高于control组。这些研究结果均表明CG-IUGR大鼠出生后即开始出现明显的生长追赶,并且存在潜在肥胖的可能。Osmand等[12-14]的研究解释了这一现象,IUGR个体为适应宫内的营养不良环境,通过改建自身的代谢方式来保证生存,这种改建过的代谢方式将会延续至成年,导致其在出生后至成年期的生长过程中,面临富足的营养环境时,出现体重明显增加甚至是肥胖。这可能为包括DM等代谢紊乱性疾病的发生埋下了隐患。
本实验结果发现,与control组相比较,12周龄的CG-IUGR组雄性大鼠血清FINS水平降低,其相应的IRI也有所下降,这似乎提示成年期CG-IUGR雄性大鼠组织对INS的敏感性增加,该结果与目前的部分研究似乎存在矛盾,如关育红等[15-16]的研究就提示低蛋白饮食复制的IUGR大鼠,其INS的敏感性在出生后进行性下降。但Inoue等[17]通过限制热量摄入法建立IUGR小鼠模型,发现IUGR小鼠出生时已经存在显著的胰岛β细胞数量减少及胰岛密度降低的现象,证实IUGR小鼠存在胰岛发育不良的问题;王艳芳等[18]采用低蛋白饮食法建立IUGR大鼠模型,发现IUGR新生大鼠胰腺组织重量显著降低,且胰腺组织松散及胰岛数量减少;Emmanuel等[19]采用低热量饮食法复制的IUGR大鼠模型,也证实了IUGR大鼠胰腺组织中的胰岛数量显著减少,综上所述,血清FINS水平的降低可能与CG-IUGR大鼠宫内营养不良环境导致其胰腺发育缺陷、INS分泌减少有关;也可能与模型复制方法及实验条件的不同,所造成的DM易感性改变的进展程度不同有关。
为进一步证实成年期CG-IUGR雄性大鼠的糖代谢情况,本课题对12周龄的CG-IUGR雄性大鼠进行了GTT和ITT实验,结果发现成年期CG-IUGR雄性大鼠对葡萄糖和INS的耐受性均降低;同时本研究也发现,成年期CG-IUGR雄性大鼠在葡萄糖负荷15 min后的血清INS水平也明显增高。Dolinsky等[20]利用缺氧复制IUGR大鼠模型,大鼠在出生后给予高脂饮食,发现其成年后出现葡萄糖耐受性降低和IR的现象;丘小汕等[21]通过被动吸烟建立IUGR大鼠模型,亦发现IUGR大鼠在成年后有糖耐量降低及葡萄糖负荷后INS对血糖升高反应延迟的现象;众所周知的荷兰饥荒事件也印证了这一观点[22],妊娠期暴露于饥饿环境的母体所产的胎儿与正常胎儿相比较,其成年后糖耐量发生异常,罹患DM、肥胖症及心血管等代谢性疾病的风险明显增加。由此本研究认为,尽管12周龄的CG-IUGR雄性大鼠血清FINS是减少的,但是其葡萄糖负荷后的INS效应降低,即12周龄的CG-IUGR雄性大鼠亦存在IR的潜在可能。
本研究表明:IUGR可能通过增加肥胖的倾向,降低葡萄糖和INS的耐受性及葡萄糖负荷后的INS效应导致成年CG-IUGR大鼠DM的易感性增加。
[1] 曾玉,黄培林.宫内发育迟缓与成年期代谢综合症的表观遗传调控机制[J].医学综述,2010,16(11):1629-1631.
[2] 孙秀静,万伟琳,董梅,等.极低或超低出生体重儿41例追赶生长的临床研究[J].中国新生儿科杂志,2008,23(2):56-58.
[3] 易波,文重远.追赶生长大鼠性激素与胰岛素抵抗的相关性研究[J].中华临床医师杂志,2012,6(9):2511-2513.
[4] Morrison J L,Duffield J A,Muhlhausler B S,et al.Fetal growth restriction,catch-up growth and the early origins of insulin resistance and visceral obesity[J].Pediatric Nephrology,2010,25(4):669-677.
[5] Thorn S R,Rozance P J,Brown L D,et al.The intrauterine growth restriction 763 phenotype:Fetal adaptations and potential implications for later life insulin resistance and 764 diabetes[J].Seminars in Reproductive Medicine,2011,29(3):225-236.
[6] Takaya J,Kaneko K.Small for gestational age and magnesium in cord blood platelets:Intrauterine magnesium deficiency may induce metabolic syndrome in later life[J].Journal of Pregnancy,2011,doi:10.1155/2011/270474..
[7] Leach L,Mann G E.Consequences of fetal programming for cardiovascular disease in adulthood[J].Microcirculation,2011,18(4):253-255.
[8] Carmen Minana-Solis M,Escobar C.Post-weaning protein malnutrition in the rat produces short and long term metabolic impairment,in contrast to earlier and later periods[J].International Journal of Biological Sciences,2008,4(6):422-432.
[9] 于萍,文重远,李凝旭.追赶肥胖大鼠血清瘦素及游离瘦素受体水平的变化[J].武汉大学学报:医学版,2011,32(6):761-763.
[10] 刘晓梅,潘莉莉,李书琴,等.宫内蛋白营养不良对大鼠胰岛素抵抗的影响[J].中国现代医学杂志,2008,18(12):1692-1695.
[11] 田景琰,王卫庆,李凤英,等.低出生体质量追赶生长大鼠到功能的变化[J].上海交通大学学报:医学版,2010,30(12):1505-1508.
[12] Osmand C,Barker D.Infant and childhood growth are predicator of coronary heart disease,diabetes and hypertension in adult man and women[J].Environment Health Perspectives,2000,108(S3):545-550.
[13] Luo K J,Chen P Y,Xie Z D,et al.Effects of L-Argon expression of PI3K and PKB of liver in low birth weight rats[J].Chinese Journal of Contemporary Pediatrics,2013,15(8):682-685.
[14] Fukuoka H,Mukai S,Taniguchi T.Nutritional environment in utero and development of obesity[J].Nihon Rinsho,Japanese Journal of Clinical Medicine,2013,71(2):237-243.
[15] 关育红,邢燕,王新利,等.胎儿生长受限大鼠胰岛素敏感性的动态变化[J].中华围产医学杂志,2011,14(4):221-226.
[16] 张金,邢燕,王新利,等.宫内发育迟缓致大鼠肝细胞胰岛素敏感性降低及体外胰岛素抵抗模型的建立[J].北京大学学报:医学版,2014,46(3):464-468.
[17] Inoue T,Kido Y,Asahara S,et al.Effect of intrauterine under-nutrition during late gestation on pancreatic beta cell mass[J].Biomedical Research,2009,30(6):325-330.
[18] 王艳芳,刘颖,付大军,等.宫内发育迟缓新生大鼠胰腺中MafA的表达[J].中国儿童保健杂志,2013,21(5):487-493.
[19] Emmanuel S,Delphine M,Guerardel A,et al.Early metabolic defects in dexamethasone-exposed and undernourished intrauterine growth restricted rats[J].Plos One,2012,7(11):e50131.
[20] Dolinsky V W,Rueda-Clausen C F,Morton J S,et al.Continued postnatal administration of resveratrol prevents diet-induced metabolic syndrome in rat offspring born growth restricted[J].Diabetes,2011,60(9):2274-2284.
[21] 丘小汕,刘军,张怡坚,等.早期营养对IUGR大鼠糖耐量和胰岛素敏感性的远期影响[J].中山大学学报:医学版,2003,24(3):238-242.
[22] Heijmans B T,Tobi E W,Stein A D,et al.Persistent epigenetic differences associated with prenatal exposure to famine in humans[J].Proceedings of the National Academy of Sciences,2008,105(44):17046-17049.
[收稿2016-10-13;修回2016-11-14]
(编辑:王静)
The effect of IUGR on susceptibility to diabetes mellitus of male CG-IUGR rats in adulthood
ZhangKuanlin1,HouLamei2,LiLijuan2
(1.Department of Pathology, Affiliated Hospital of Zunyi Medical University, Zunyi Guizhou 563099, China;2.Department of Pathophysiology, Zunyi Medical University, Zunyi Guizhou 563099, China)
Objective To analyze the susceptibility to diabetes mellitus of male catch-up growth intrauterine growth restriction(CG-IUGR)rats in adulthood.Methods (1)The body mass(BM)and the body length(BL)of the male rats in CG-IUGR groups that delivered by low calorie diet feeding pregnant rats and fed by normal feeding for 12 weeks after birth and the male rats in control groups that delivered by the normal feeding pregnant rats and fed by normal feeding for 12 weeks after birth were measured weekly after birth,and their body mass index(BMI)were calculated.(2)At 12 weeks after birth,the perirenal fat,the levels of fasting blood-glucose(FBG)and fasting serum insulin(FINS)of all male rats in the two groups were detected and their corresponding insulin resistance index(IRI)were calculated,glucose tolerance test(GTT)and insulin tolerance test(ITT)were carried out after fasting for 12 hours and then calculated the corresponding area under curve(AUC)of GTT,and the levels of serum insulin(INS)were detected at the 15 minutes after glucose loading.Results 1)The growth changes of BM and BMI of male rats at each week after birth and the weight of perirenal fat of male rats at 12 weeks after birth in CG-IUGR groups were increased significantly(P<0.05).2)At 12 weeks after birth,the levels of FINS and IRI were decreased moderately(P<0.05) and their blood-glucose levels were increased significantly at 15,30,60,90,and 120 minutes after intraperitoneal injection glucose solution(GS)and INS(P<0.05). The levels of serum INS of male rats in CG-IUGR groups were increased significantly at 15 minutes after glucose loading(P<0.05).Conclusion IUGR can increase the susceptibility to diabetes mellitus of CG-IUGR male rats in adulthood by increased their obesity risk and decreased the tolerance of glucose and INS and the effects of INS after glucose loading.
Diabetes mellitus;susceptibility;CG-IUGR;IUGR;rats
国家自然科学基金资助项目(NO:81260131);贵州省优秀科技人才省长专项资金项目(NO:黔省专合字2011 58)。
李丽娟,女,博士,教授,硕士生导师,研究方向:表观遗传学与疾病的关系,E-mail:fdhllj@sohu.com。
R363.1
A
1000-2715(2017)03-0259-05
