基于多重荧光PCR检测的肉及其制品中鸭DNA成分的鉴别方法
2017-07-05林霖
林 霖
陈国培
何永盛
杨国武
赖心田
(深圳市计量质量检测研究院,广东 深圳 518131)
基于多重荧光PCR检测的肉及其制品中鸭DNA成分的鉴别方法
林 霖
陈国培
何永盛
杨国武
赖心田
(深圳市计量质量检测研究院,广东 深圳 518131)
针对现有肉制品中鸭DNA成分检测方法不能检测番鸭DNA成分的问题,通过下载番鸭、家鸭及其相近物种的12S rDNA序列,使用CLUSTAL X2进行序列比对,筛选特异性序列,设计了一对通用引物及两条番鸭、家鸭特异性探针,构建了可同时检测番鸭、家鸭DNA成分的实时荧光PCR方法。结果表明:最终构建的检测方法可在掺伪量为0.1%的情况下,检测出样品中的家鸭或番鸭DNA成分。该方法相比普通PCR或单重荧光PCR检测方法节省了劳动力,提高了检测效率,补充了现有检测方法的不足,为更有效地识别掺伪肉类提供技术支持。
番鸭;家鸭;肉制品;实时荧光PCR;DNA
自2013年爆发“马肉风波”以及“假羊肉事件”以来,肉类食品掺伪问题显然已成为全球性的食品安全问题[1]。鸭肉由于其廉价且颜色等性质与红肉接近,因此使用鸭肉掺假更加具有隐蔽性,多被发现用于相对价格较高的羊肉中进行掺伪[2]。肉类掺假不仅涉及经济利益,若使用未经检验检疫的病死肉掺伪,还可能严重威胁消费者的身体健康。
据调查[3-5],中国饲养的肉鸭品种主要有两种,一个是起源于鸭科(Anatinae)鸭属(Anas)中绿头野鸭(AnasPlatyrhynchos)和斑嘴鸭(A.poecilorhyncha),即家鸭;另一个是起源于鸭科(Anatinae)栖鸭属(Cairina)中疣鼻栖鸭(Cairinamoschata)的番鸭。番鸭原产于南美洲和中美洲热带地区,17世纪番鸭由东南亚引入中国,已成为中国的主要饲养品种之一。现有文献[3-5]对番鸭的研究多集中在饲养上。
食品中肉类成分的鉴别技术不断发展,已逐步形成了基于蛋白质和基于DNA的两种检测方法。其中,由于肉类食品中蛋白质的稳定性差、含量变化范围广,干扰因素多等原因,均导致了该类方法灵敏度较低、假阳性率较高的现象[6]。虽然可基于热稳定蛋白[7-8],免疫小鼠,筛选单克隆抗体,建立ELISA检测方法,但由于肉类耐热蛋白物种间序列差异太小,导致特征单克隆抗体的筛选极困难[9]。在食品加工过程中,DNA的耐热稳定性、耐酸碱稳定性均高于蛋白质。因此目前在肉类食品属性鉴别方面,基于DNA的检测方法为主要检测方法。中国已颁布关于鸭的PCR检测方法有SN/T 3731.5—2013 《食品及饲料中常见禽类品种的鉴定方法 第5部分:鸭成分检测PCR法》、SN/T 2727—2010 《饲料中禽源性成分检测方法 实时荧光PCR方法》。同时,也有一些已发表文献[2,6,10-11]中公布了鸭DNA成分检测方法,但是这些方法均不可以检测番鸭DNA成分,考虑到番鸭已是中国养鸭业中极为重要的品种[4],而使用现有标准方法检测容易导致漏检。本试验拟通过在国际公认NCBI Gen-bank数据库下载获取的核酸序列,通过CLUSTAL序列比对软件比对获取特异性序列,并在该序列基础上设计了一套一次反应即可同时测试家鸭和番鸭DNA的特异性引物探针,并对所构建的检测方法检测限、特异性测试,所构建的方法能够达到有效防止漏检问题的目的,更好地为食品安全执法提供技术支撑。
1 材料与方法
1.1 材料与仪器
肉及肉制品:市售;
实时荧光PCR反应预混液[Premix ExTaq(2×)]:分子生物学级,宝生物工程(大连)有限公司;
引物、探针:HPLC级,上海生工生物工程有限公司;
核酸提取试剂盒[DNeasy mericon Food Kit(69514)]:分子生物学级,凯杰生物技术(上海)有限公司;
实时荧光PCR仪:7500型,美国ABI life technologies公司。
1.2 试验方法
1.2.1 DNA提取 按照QIAGEN DNeasy mericon Food Kit(69514)说明书操作。
1.2.2 引物探针设计 从NCBI Genbank数据库下载家鸭(EU755253、HM010684、EU755252)、番鸭(EU755254、HM063542)、斑嘴鸭(AY164517)、家鹅(EU932689)、鸿雁(AY164524)、鸡(GU261719)、家鸽(NC013978)、鹌鹑(X572245)、北美火鸡(EF153719)的线粒体12S rDNA全基因序列,使用CLUSTAL X2进行序列比对。
1.2.3 实时荧光PCR反应体系及程序
(1) 反应体系(20 μL):正向引物(20 μmol/L)0.4 μL,反向引物(20 μmol/L)0.4 μL,番鸭及家鸭探针mix(各20 μmol/L)0.2 μL,Premix ExTaq(2×)10 μL,灭菌超纯水4 μL,DNA模板5 μL。
(2) 反应程序: 95 ℃ 3 min;95 ℃ 15 s;60 ℃ 34 s;40个循环。
(3) 结果判断: Ct值≤35时,可判定检测结果为阳性;Ct值≥35时,可判定检测结果为阴性。
1.2.4 特异性试验 提取各种肉类(家牛、水牛、猪、绵羊、山羊、马、兔、鼠、鸡、家鸭、番鸭、鹅、鹌鹑、鸽子、火鸡)DNA作为扩增模板,使用DNA条形码检测方法(BOLD System)对肉类鉴定,以确保样品的真实性。使用番鸭、家鸭引物探针验证方法的特异性。
1.2.5 灵敏度试验 取下瘦肉部分,使用粉碎机粉碎,然后互相掺比混合成0.1%~50.0%的人工掺假肉,使用番鸭、家鸭引物探针检测其灵敏度。
1.2.6 样品检测 对143批次牛羊肉制品及96份牛羊肉切片进行检测。
2 结果与分析
2.1 引物探针的设计
引物设计时,共分析了家鸭、番鸭、斑嘴鸭、家鹅、鸿雁、鸡、家鸽、北美火鸡、鹌鹑的线粒体12S rDNA全基因序列。找到了一段127 bp的特征片段,在该序列上,通过设计鸭DNA检测通用引物,以及分别设计家鸭、番鸭探针,实现了在同一管反应中检测家鸭、番鸭DNA成分,见图1。
已有的DNA检测方法中,肉类鉴别的靶基因主要集中于两种DNA序列:线粒体DNA序列和染色体DNA序列。其中,线粒体DNA在肉类细胞中拷贝数多,且为环状DNA,在食品的加工过程中不易被破坏,以此寻找特异性序列开发检测方法,其灵敏度高,且在深加工食品中也能够稳定检测,是肉类食品属性鉴别的首选[1,10]。本研究选取了线粒体DNA中12S rDNA片段,找到了家鸭、番鸭的特征序列,12S rDNA为目前实时荧光PCR常用的靶基因位点[12-13],NCBI数据库中各物种12S rDNA基因序列较为齐全,这有助于提高引物探针设计的特异性。
2.2 特异性试验结果
2.2.1 DNA条形码检测结果 用于特异性实验验证的肉类经DNA条形码技术鉴定,与相关物种序列匹配度达99%,可确认其真实属性,见表1。
基于DNA的实时荧光PCR法目前在肉类食品检测中为公认的核心检测方法,现有检测标准大多基于该方法[6,14-15]。而另外一种在物种属性鉴别领域发展迅速的方法为DNA条形码技术,其使用一段公认的标准DNA片段,对物种进行鉴定,通常采用680 bp左右长的COI序列[16-17],将测序获得的序列与生物信息学数据库比对,获得匹配信息,得以鉴定物种属性。但是对于深加工的肉类食品,常混合有多种物种的DNA,而检测用引物是通用引物,现有测序方法无法完成混合样品的直接测序,对其进行鉴定需挑选多个PCR产物转化后单克隆菌落,过程繁琐且存在极大的漏检可能性[16]。因此该技术在深加工肉类食品中使用时的便捷性及准确性不及实时荧光PCR法。本研究使用该方法对特异性试验肉类样品属性进行鉴别,以保证方法验证的准确性。
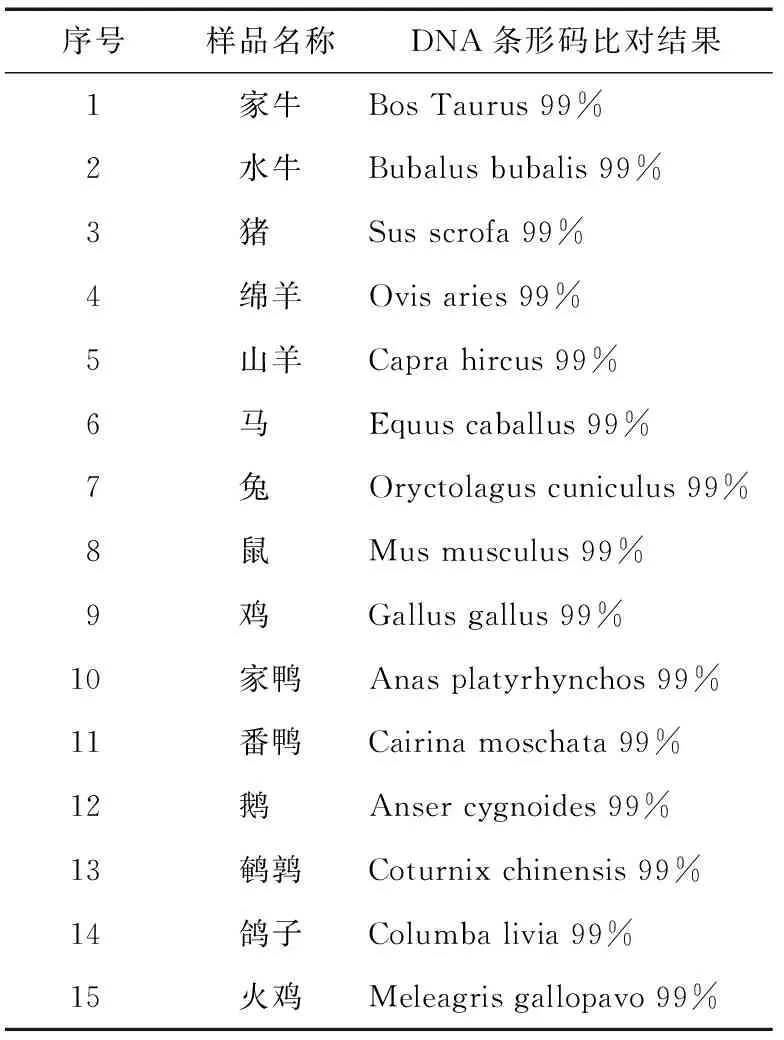
表1 DNA条形码检测结果Table 1 Detective Result Based on DNA Barcoding Technology
2.2.2 特异性检测结果 提取各种肉类DNA作为扩增模板,包括家牛、水牛、猪、绵羊、山羊、马、兔、鼠、鸡、家鸭、番鸭、鹅等DNA,进行荧光PCR反应,以验证方法的特异性,见表2。验证结果表明该方法具有很高的特异性,番鸭和家鸭引物探针可特异扩增鸭DNA成分。
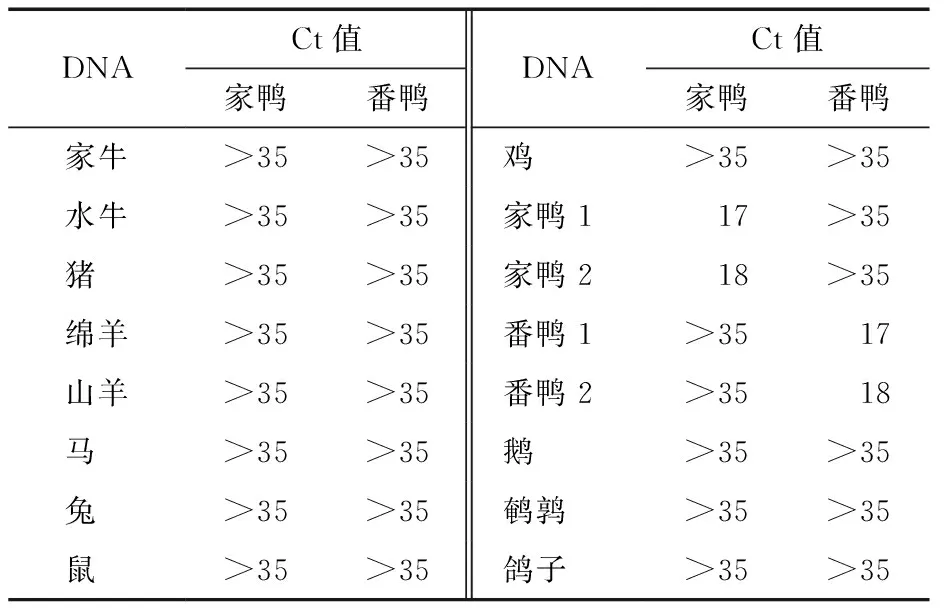
表2 特异性试验结果Table 2 Results of Specificity Detected by Real-time Fluorescence PCR Assays
2.3 灵敏度试验结果
使用粉碎机粉碎,然后互相掺比混合成0.1%~50.0%的人工掺假肉,检测其灵敏度。检测结果显示0.1%的番鸭肉和家鸭肉可以被检出,见表3及图2。依据SN/T 2051—2008 《食品、化妆品和饲料中牛羊猪源性成分检测方法 实时 PCR 法》和SN/T2727—2010 《饲料中禽源性成分检测方法 实时荧光PCR方法》 等标准实时荧光PCR检测方法对动物属性DNA成分的检测限为0.1%。通过灵敏度试验测试,本研究建立的多重PCR方法可达到该检测限。
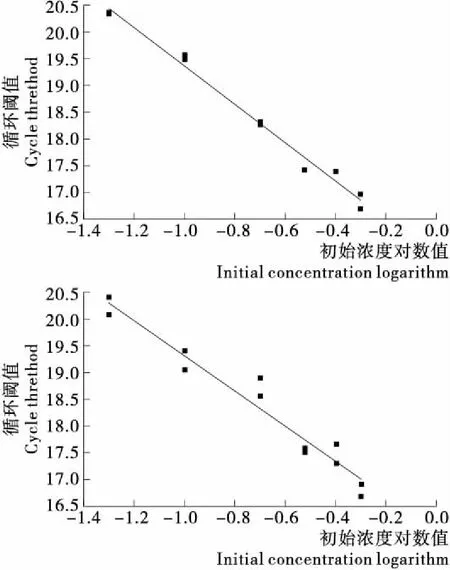
图2 灵敏度试验结果图Figure 2 Result of Sensibility Experiment Detected by Real-time Fluorescence PCR Assays表3 鸭引物探针灵敏度试验结果列表Table 3 Result of Sensibility Experiment Detected by Real-time Fluorescence PCR Assays
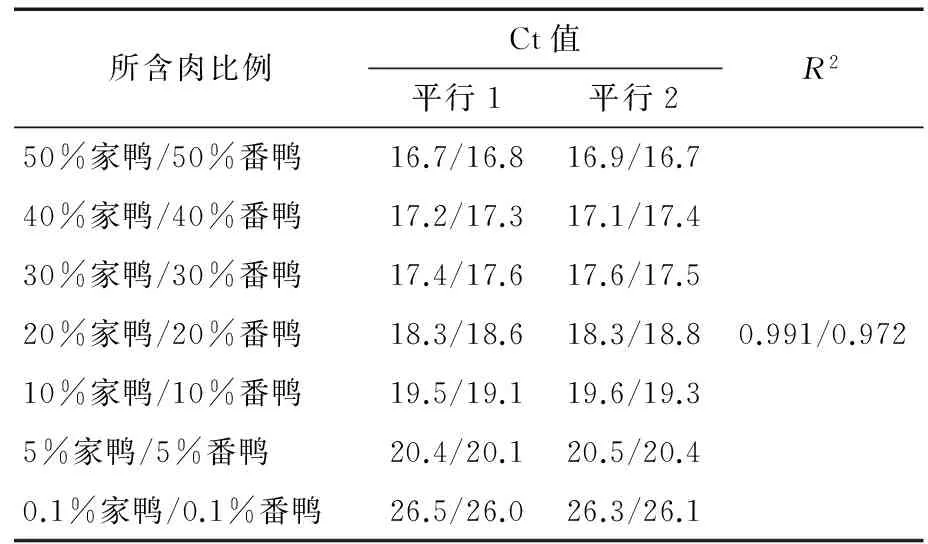
所含肉比例Ct值平行1平行2R250%家鸭/50%番鸭16.7/16.816.9/16.740%家鸭/40%番鸭17.2/17.317.1/17.430%家鸭/30%番鸭17.4/17.617.6/17.520%家鸭/20%番鸭18.3/18.618.3/18.80.991/0.97210%家鸭/10%番鸭19.5/19.119.6/19.35%家鸭/5%番鸭20.4/20.120.5/20.40.1%家鸭/0.1%番鸭26.5/26.026.3/26.1
2.4 样品检测试验结果
对143批次牛羊肉制品及96份牛羊肉切片进行检测,在9批次中检测出家鸭或番鸭DNA成分,其中检出家鸭DNA成分,检测结果与SN/T 2727—2010 《饲料中禽源性成分检测方法 实时荧光PCR方法》 中鸭DNA成分检测结果一致,见表4。本试验证明了使用本研究建立的多重检测体系可在实际检测中应用。
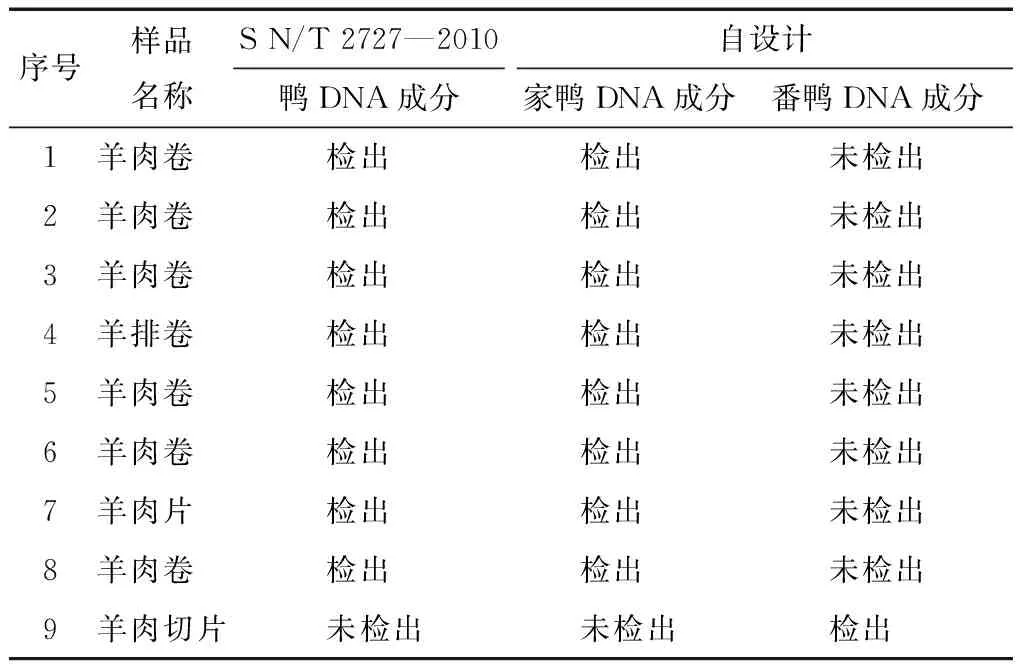
表4 样品检测结果Table 4 Samples Detected Result
3 结论
本研究根据特征序列,对家鸭、番鸭设计了一对通用引物,减少了PCR体系中引物对的数量,减少扩增体系的负担,也减少了操作步骤;对家鸭和番鸭分别设计了一条特异性探针,可特异性检测家鸭和番鸭DNA成分,通过探针预混液形式加入扩增体系中并标记不同的荧光基团,使得同一反应体系可同时检测家鸭和番鸭DNA成分,节省了劳动力,提高了检测效率。最终构建的检测体系可检测低至0.1%的掺伪量。该方法的建立,补充了标准检测方法的不足,为更有效地识别掺伪肉类提供了技术支持。但由于荧光PCR方法定量需依赖标准曲线,且不同部位或者不同个体的线粒体数量会有所差异等各方面因素,导致该方法不可用于准确定量具体掺伪的含量,后续通过数字PCR技术可能解决该方面的问题。
[1] 李宗梦, 赵良娟, 王永芳, 等. 肉及肉制品分子生物学鉴别技术研究进展[J]. 食品安全质量检测学报, 2015(2): 405-409.
[2] 刘岑杰, 刘彦泓, 杨滴, 等. 肉制品中鸭源性成分的实时荧光PCR检测[J]. 肉类工业, 2015(1): 51-53.
[3] 高鑫凤, 许继国, 叶峭, 等. 影响番鸭羽色性状的候选基因研究现状[J]. 中国家禽, 2015, 37(10): 43-47.
[4] 何大乾, 杜鹃, 刘益平, 等. 番鸭mtDNA D-loop部分序列分析[J]. 上海农业学报, 2008, 24(4): 1-4.
[5] 张建华, 戴求仲, 林谦. 番鸭特性及其代谢能和蛋白质营养需要的研究进展[J]. 饲料博览, 2011(7): 23-25.
[6] 杨冬燕, 杨小柯, 李浩, 等. 用多重荧光PCR技术鉴别牛肉中掺入的猪马鸭成分的研究[J]. 中国预防医学杂志, 2015(7): 528-533.
[7] SHIBATA M, MATSUMOTO K, OE M, et al. Differential expression of the skeletal muscle proteome in grazed cattle[J]. Journal of Animal Science, 2009, 87(8): 2 700-2 708.
[8] MORZEL M, CHAMBON C, HAMELIN M, et al. Proteome changes during pork meat ageing following use of two different pre-slaughter handling procedures[J]. Meat Science, 2004, 67(4): 689-696.
[9] ZVEREVA E A, KOVALEV L I, IVANOV A V, et al. Enz-yme immunoassay and proteomic characterization of troponin I as a marker of mammalian muscle compounds in raw meat and some meat products[J]. Meat Science, 2015, 105: 46-52.
[10] 张驰, 邱皓璞, 张筠. 荧光定量PCR检测肉制品中鸭源性成分[J]. 食品科学, 2013, 34(18): 154-157.
[11] 张娟, 宗卉, 张利平. PCR-mtDNA技术鉴别检测不同动物肌肉组织和饲料中鸭源性成分[J]. 生物工程学报, 2008, 24(10): 1 832-1 836.
[12] MARTIN I, GARCIA T, FAJARDO V, et al. Technical note: detection of chicken, turkey, duck, and goose tissues in feedstuffs using species-specific polymerase chain reaction [J]. J Anim Sci, 2007, 85: 452-458.
[13] RODRIGUEZ M A, GARCA T, GONZLEZ I, et al. TaqMan realtime PCR for the detection and quantitation of pork in meat mixtures[J]. Meat Sci, 2007, 70: 113-120.
[14] 何海宁, 洪霞, 冯玉升, 等. 加工食品中动物源DNA的提取和多重PCR检测方法的建立[J]. 食品与机械, 2015, 31(6): 79-83.
[15] 冯永巍, 王琴. 肉类掺假检验技术研究进展[J]. 食品与机械, 2013, 29(4): 237-240.
[16] 李新光, 王璐, 赵峰, 等. DNA条形码技术在鱼肉及其制品鉴别中的应用[J]. 食品科学, 2013, 34(18): 337-342.
[17] ZHANG Jun-bin, HANNER R. DNA barcoding is a useful tool for the identification of marine fishes from Japan[J]. Biochemical Systematicsand Ecology, 2011, 39(1): 31-42.
A method for dark DNA components detection in meat and productions by multiplex-real-time fluorescence PCR
LINLin
CHENGuo-pei
HEYong-sheng
YANGGuo-wu
LAIXin-tian
(ShenzhenAcademyofMetrology&Qualityinspection,Shenzhen,Guangdong518131,China)
TheCairinamoschataDNA component can not be detected by the current duck DNA component detection methods. By downloadingCairinamoschata,andAnasplatyrhynchosdomesticaand similar species 12S rDNA sequences and compareing them by using Clustal X2 software to find a specific sequence, a pair of universal primers and two individual specific probes were designed based on the sequence, which construct specific detectCairinamoschataandAnasplatyrhynchosdomesticaDNA components real-time PCR system. This detection system can detect as low as 0.1% adulteration. Results: Using this detection system can detectCairinamoschataandAnasplatyrhynchosdomesticaDNA components from the adulteration samples. This method, compares with normal PCR method or single real-time PCR method, requires lesser labor force, and has higher detection efficiency. This method also complements the deficiency of standard detection methods, and provides technical support for more effective identification of adulterated meat.
Cairinamoschata;Anasplatyrhynchosdomestica; Meat; Real-time Fluorescence PCR; DNA ingredient
广东省质量技术监督局科技项目(编号:2013CZ05)
林霖(1987—),女,深圳市计量质量检测研究院中级工程师,硕士。E-mail:softbluefeather@qq.com
2017—03—21
10.13652/j.issn.1003-5788.2017.05.019
