电化学法测量黑曲霉孢子萌发过程中葡萄糖氧化酶的活性
2017-07-05刘洋汝
刘洋汝
李忠海1,2
任佳丽1, 2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产品深加工国家工程实验室,湖南 长沙 410004)
电化学法测量黑曲霉孢子萌发过程中葡萄糖氧化酶的活性
刘洋汝1
李忠海1,2
任佳丽1, 2
(1. 中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2. 稻谷及副产品深加工国家工程实验室,湖南 长沙 410004)
建立了电化学循环伏安法测定葡萄糖氧化酶活性的方法。该方法引入二茂铁甲醇作为氧化还原探针,以玻碳电极作为工作电极、饱和甘汞电极作为参比电极、铂丝电极作为辅助电极,采用循环伏安法,得到不同酶活的峰电流值,在酶浓度为0.128~2.377 U/mL,酶浓度与峰电流之间存在线性关系,相关系数为0.998,检测下限为0.128 U/mL。运用该法测定了孢子萌发过程中酶活的变化,随着孢子的萌发,酶活先增加,达到最大值(2.130 U/mL)后再次下降,同时采用传统滴定法进行对照。结果表明,相较于传统方法,电化学方法具有准确、快速和简便的特点。
孢子;萌发;葡萄糖氧化酶;循环伏安法
葡萄糖氧化酶(Glucose oxidase,GOD)是一种需氧脱氢酶,能高度专一地氧化β-D-葡萄糖生成葡萄糖酸和过氧化氢,在食品、畜牧以及生物医药等领域有着广泛的应用[1-2]。目前工业中生产葡萄糖氧化酶常采用黑曲酶整菌发酵法[3],该方法生产的游离GOD存在稳定性差、易变性失活、酶与底物难以分离等缺陷,不利于产物的回收与连续生产[4-5]。S. Ramachandran等[6-7]研究发现黑曲霉孢子是一个葡萄糖氧化酶的贮存库,并通过柠檬醛透化孢子膜,抑制孢子萌发,使孢子催化活力增长到1.500~4.350 g/(L·h)。Moksia等[8]证明黑曲霉孢子具有一个充满活力的酶催化体系,孢子本身也可以起到良好的酶固定作用,可作为GOD生物催化剂进行开发。目前,对于黑曲霉孢子的研究主要集中在发酵葡萄糖产酸能力[6-10],然而黑曲霉孢子在哪个阶段的葡萄糖氧化酶酶活力最强,尚未进行系统研究。
目前,国内外检测葡萄糖氧化酶酶活力主要采用滴定法和分光光度法,但是这两种方法测量精度低,操作繁琐,耗时较长。电化学方法具有灵敏度高、响应速度快、操作简便等优势,是研究生物化学和生物活动的一种新方法。由于酶在电极表面的取向往往不利于其电活性基团与电极之间的电子交换,与电极间的直接电子转移受到阻碍,通过电化学检测酶活力历来是一个令人困扰的问题。本试验拟以二茂铁甲醇(Ferrocene methanol,Fc)为氧化还原介质,介导酶与电极间的电子传递,玻碳电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为辅助电极,扫描得到循环伏安曲线,然后将获得的阳极峰电流与酶浓度进行线性回归,以期实现对葡萄糖氧化酶活力的检测。
1 材料与方法
1.1 菌种
黑曲霉 (Aspergillusniger) NRRL3:美国ATCC公司。
1.2 试剂与仪器
1.2.1 材料与试剂
葡萄糖:分析纯,国药集团化学试剂有限公司;
吐温-80:化学纯,国药集团化学试剂有限公司;
二茂铁甲醇:216.060 g/mol, 西格玛奥德里奇公司;
葡萄糖氧化酶:228 253 U/g,西格玛奥德里奇公司;
柠檬醛:95%,美国西格玛奥德里奇公司;
斜面培养基:马铃薯培养基,称取 200 g马铃薯,加水煮烂,纱布过滤,加入15 g琼脂、20 g葡萄糖,补足水分至 1 000 mL,分装试管,加塞、包扎,121 ℃灭菌20 min;
固态发酵培养基:荞麦种子培养基,称量300 g 市售荞麦种子,蒸馏水洗两次,加等量的蒸馏水沸水浴15 min,过滤,分装锥形瓶,加塞、包扎,高压蒸气灭菌处理,得到50 g水/100 g的荞麦种子培养基[4]。
1.2.2 主要仪器设备
电化学工作站:660D型,上海辰华仪器有限公司;
双面净化工作台:SW-CJ-2F型,苏州净化设备有限公司;
霉菌培养箱:MJX-150BⅢ型,北京中兴伟业仪器有限公司;
冷冻离心机:TK25KG型,长沙东旺仪器有限公司;
生物显微镜:BM-1000型,致微仪器有限公司;
高压灭菌锅:GI54DWS型,致微仪器有限公司;
电热恒温水浴锅:DK-98型,天津市泰斯特仪器有限公司;
超纯水机:LS1-10型,湖南中沃水务环保科技有限公司。
1.3 试验方法
1.3.1 黑曲霉孢子种子液的制备 从冰箱取出冻存黑曲霉孢子液,室温融化后转接斜面培养基,置于恒温箱 28 ℃培养7 d。用含有0.1 mL/100 mL 吐温-80 的灭菌蒸馏水冲洗斜面,收集孢子悬液至离心管,4 ℃ 10 000×g 离心10 min,弃上清液,收集孢子沉淀。稀释沉淀,在显微镜下用血球计数板计数,调整孢子悬液浓度108spores/mL。
取1 mL 108spores/mL的孢子悬液于100 g荞麦种子培养基中,28 ℃培养200 h,然后加入0.1 mL/100 mL 吐温-80 的灭菌蒸馏水,180 r/min 振摇1 h后,过滤,收集滤液,4 ℃ 10 000×g 离心10 min,弃掉上清液,收集沉淀,确定109spores/mL 浓度的孢子种子液备用。以上操作均在无菌条件下进行。
1.3.2 标准曲线的绘制
(1) 电极预处理:以玻碳电极( GC,Φ= 2 mm) 为工作电极,用 0. 050 μm氧化铝兑水打磨抛光至镜面,依次用无水乙醇、蒸馏水超声清洗1 min 后,晾干备用。饱和甘汞电极(SCE)作为参比电极, 铂丝电极作为辅助电极。
(2) 酶浓度的测量:往电解池中加入100 μL 4 g/L 葡萄糖溶液,800 μL 1 mmol/L二茂铁甲醇的0.1 mol/L的磷酸钾缓冲液(pH=7.0),30 ℃水浴5 min,然后依次加入100 μL浓度为0.000,1.282,5.128,10.256,15.384,23.770 U/mL的葡萄糖氧化酶,设定电压范围0.0~0.5 V,扫速0.1 V/s,作循环伏安扫描。记录每一个酶浓度所对应的峰电流值,并绘制成标准曲线,计算得到相应的线性回归方程。
1.3.3 黑曲霉孢子萌发观察 接种1 mL 109spores/mL孢子种子液至含25 mL基本培养基[11]的锥形瓶中,在96孔板上每孔定时加入200 μL 孢子培养液,置于30 ℃恒温培养箱中。定时取孢子培养液涂布于载玻片,观察[12-13]并计数100~200个孢子,以长出的芽管长度达到2倍原孢子长度为萌发标准[14],计算孢子萌发率,之后每隔2 h 观察,持续24 h,观察黑曲霉孢子萌发状况。
1.3.4 黑曲霉孢子生长过程中的酶活测定 用移液枪吸取1 mL 109spores/mL 孢子种子液于含25 mL 基本培养基的锥形瓶中,在96孔板上每孔分别在0,2,4,6,8,10,12,14,16,18,20,22,24 h加入200 μL 孢子培养液,30 ℃恒温培养,每组3个平行。取对应时间的黑曲霉孢子培养液100 μL,按照标准曲线检测方法进行测试,将得到的峰电流值代入到标准曲线对应的线性回归方程中,计算得到黑曲霉孢子在休眠、萌发、菌丝生长阶段的酶活信息。取适量孢子培养液80 ℃灭活30 min,循环伏安扫描,作为空白组。
1.3.5 对比试验 选用滴定法:取1 mL梯度稀释酶液加入到已经30 ℃恒温5 min,25 mL含4 g/L葡萄糖的60 mmol/L (pH=5.6)的乙酸钠缓冲液中。加入20 mL 0.1 mol/L的NaOH中停止反应。将所得混合物通过使用0.1 mol/L标准HCl溶液滴定,酚酞作为指示剂至暗粉色为终点。所加盐酸的体积为V。空白测定(孢子溶液不存在)在相同的试验条件下进行。添加的标准HCl的体积为V0。葡萄糖酸的浓度可由式(1)计算,酶活由式(2)计算,一个酶活单位为在1 min内能转化1 μmol底物的酶量。

(1)
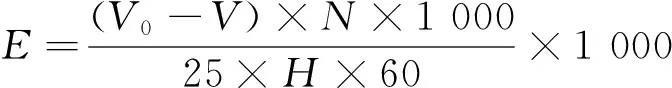
(2)
式中:
C——葡萄糖酸的浓度,μmol/mL;
E——酶活,μmol/(mL·min);
N——标准 HCl 溶液的摩尔浓度,mol/L;
V0——空白滴定的标准HCl的体积,mL;
V——最终滴定盐酸的体积,mL;
H——样品反应时间,min。
2 结果与分析
2.1 葡萄糖氧化酶活性电化学测定方法的建立
2.1.1 检测原理 采用电化学循环伏安法检测葡萄糖氧化酶的反应原理[15-16]见式(3)~(6),在一定的电压下,二茂铁甲醇(Fc) 发生氧化反应失去一个电子形成Fc+,在有氧化态葡萄糖氧化酶(GODox)和葡萄糖存在时,GODox氧化葡萄糖产生还原态葡萄糖氧化酶(GODred)和葡萄糖酸,生成的GODred还原Fc+产生GODox和Fc,重新生成的Fc补充扩散到电极表面发生氧化,从而增加电子传递的速度,峰电流增加。
工作电极表面:
FcCH2OH-e-=FcCH2OH+。
自然教育理念提倡让幼儿在大自然中自然成长,幼儿美术是最接近自然的教学内容,对提升幼儿成长品质具有重要的促进作用。美术教学中,教师坚持自然教育,让幼儿在自然氛围、自然材料、自然互动中,充分的感受美、表现美。幼儿对美术活动始终保持浓厚的兴趣,才能全身心投入到美术创作中,才能获得更多的欢乐和笑声,才能极大实现课堂教学目标。
(3)
葡萄糖氧化酶:
GOxox+glucose→[GOxox+glucose],
(4)
[GOxox+glucose]→GOxred+gluconic acid,
(5)
GOxred+ FcCH2OH+→ GOxox+FcCH2OH。
(6)
2.1.2 标准曲线的绘制 不同浓度GOD的循环伏安曲线见图1。由图1可知,随着GOD浓度的上升,阳极峰电流值在增高。峰电流值与酶浓度呈正比,介质浓度增加,电流值上升[17]。以峰电流值对酶浓度作图(见图2),得到线性回归方程:y=0.435x+1.414,相关系数为0.998。
2.1.3 精密度试验 连续10次对100 μL 10 U/mL的葡萄糖氧化酶样品进行测定,结果见表1。由表1可知,精密度试验相对标准偏差(RSD)为0.031%,表明该检测葡萄糖氧化酶活力的方法有较好的精确性。
2.1.4 回收率试验 准备50 μL 1.282 U/mL的葡萄糖氧化酶溶液,再分别加入50 μL不同活力单位的葡萄糖氧化酶溶液,作回收率试验,对每份样品重复测量3次,结果取平均值。由表2可知,回收率在97.208%~104.538%,标准偏差在3.383%,表明此方法检测葡萄糖氧化酶活力具有良好的准确性。
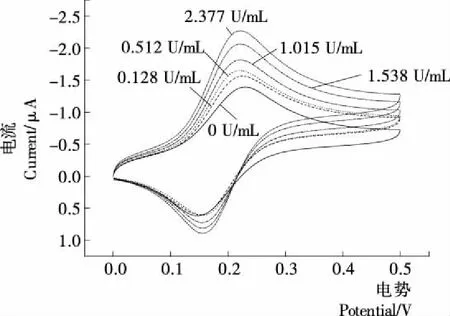
图1 不同葡萄糖氧化酶酶浓度下的循环伏安扫描曲线Figure 1 The CV curves with different GOD enzyme concentration

图2 峰电流与葡萄糖氧化酶活性的关系Figure 2 The relationship between the peak current and the GOD enzyme activity
2.2 电化学方法检测黑曲霉孢子萌发中GOD的活性
2.2.1 黑曲霉孢子的萌发观察 定时取接种于96孔板上中的孢子培养液10 μL涂布于载玻片[18],采用显微镜观察不同时间的孢子萌发情况(以萌发率表示),结果见表3。由表3可知,在0~4 h时未见孢子萌发,但孢子体积略有增大;6 h

表1 精密度试验Table 1 Test for precision
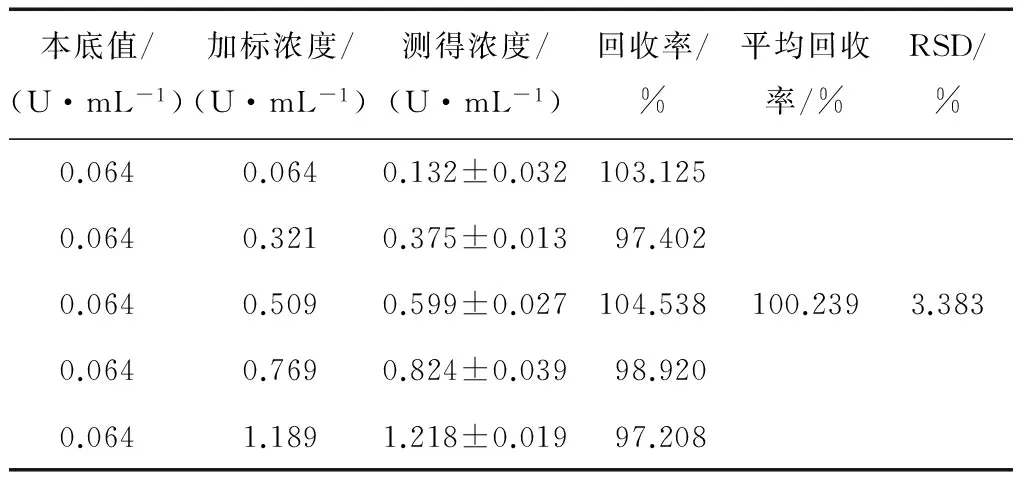
表2 回收率试验结果Table 2 Test for recovery
2.2.2 黑曲霉孢子萌发过程中的酶活变化 定时扫描黑曲霉孢子培养液的循环伏安曲线,将得到的响应峰电流值代入到线性回归方程中,计算得出其葡萄糖氧化酶浓度。将所得到的酶浓度对时间作图,结果见图3。在孢子萌发早期,即可以检测到葡萄糖氧化酶的存在,Rosenberg等[19]提出了黑曲霉氧化葡萄糖生成葡萄糖酸的能力并不依赖于完整发育的细胞。Moksia等[8]的研究证明在黑曲霉孢子持有一个活跃的酶系统来氧化葡萄糖,正如工业发酵中常用的黑曲霉菌丝一样。随着孢子对营养条件产生反应,孢子吸水膨胀并萌发,合成新壁物质,相较于刚强的孢子膜结构通透性增强,便于自身与外界交换营养物质,酶体系活跃地氧化葡萄糖合成ATP为生长供给能量,培养8~10 h时GOD酶活力达到高峰。随后,酶活力下降,可能是随着菌丝生长,真菌为了更加复杂的生命活动发展其他的功能[20]。

表3 孢子随时间的萌发率Table 3 Spores germination rate over time
2.3 对比试验
在采用电化学循环伏安法测定孢子萌发过程中酶活性的同时,采用传统的滴定法进行了佐证测定,结果见表4。整体而言,使用滴定法测出的结果都略低于电化学方法,可能是滴定法是通过肉眼判断滴定终点的颜色变化。初始孢子的酶活力为 (1.355 ± 0.057) U/mL,随着孢子开始萌发酶活力增强,趋势与使用电化学方法测量结果一致,对比两种测量GOD酶活力的方法,循环伏安法测定时间更短,操作更简便,可将该法用于葡萄糖氧化酶的监测。

表4 滴定法测定葡萄糖氧化酶酶活的结果Table 4 The results of titration methods for determination of the activity of GOD U/mL
3 结论
本试验通过研究二茂铁甲醇、葡萄糖和葡萄糖氧化酶三者之间的循环伏安特性,建立了电化学测定GOD活性的方法,并使用方该法测定了黑曲霉孢子萌发过程中的GOD活性。研究结果表明:随着酶浓度的上升,峰电流值呈现逐渐升高的趋势,且在酶浓度为0.128~2.377 U/mL的范围内线性良好(R2=0.998)。通过显微镜对黑曲霉孢子萌发过程的观测发现,在30 ℃条件下培养10 h后,孢子的萌发率可达到86.534%,此时的葡萄糖氧化酶活力最强。本研究建立的电化学测定GOD活性的方法,能够实现准确、快速和客观地检测标准酶以及葡萄糖酶酶活力。将其应用到黑曲霉孢子的酶活性检测,为开发黑曲霉孢子作为GOD生物催化剂提供了新思路。
[1] 袁永利, 邹奇波, 黄卫宁. 食品酶制剂改善冷冻面团贮藏稳定性的研究[J]. 食品与机械, 2007, 23(3): 41-44.
[2] 张志国, 王硕, 生庆海. HPLC-ELSD法检测液态奶中的低聚半乳糖[J]. 食品与机械, 2011, 27(3): 68-70.
[3] BANKAR S B, BULE M V, SINGHAL R S, et al. Optimization ofAspergillusnigerfermentation for the production of glucose oxidase[J]. Food and Bioprocess Technology, 2009, 2(4): 344.
[4] 李晔. 酶的固定化及其应用[J]. 分子催化, 2008, 22(1): 86-95.
[5] 韩志, 叶剑芝, 罗荣琼. 固定化酶的方法及其在食品中的应用研究进展[J]. 保鲜与加工, 2012, 12(5): 48-53.
[6] RAMACHANDRAN S, FONTANILLE P, PANDEY A, et al. Spores ofAspergillusnigeras reservoir of glucose oxidase synthesized during solid-state fermentation and their use as catalyst in gluconic acid production[J]. Letters in Applied Microbiology, 2007, 44(2): 155-160.
[7] RAMACHANDRAN S, FONTANILLE P, PANDEY A, et al. Permeabilization and inhibition of the germination of spores ofAspergillusnigerfor gluconic acid production from glucose[J]. Bioresource Technology, 2008, 99(11): 4 559-4 565.
[8] MOKSIA J, LARROCHE C, GROS J B. Gluconate production by spores ofAspergillusniger[J]. Biotechnology Letters, 1996, 18(9): 1 025-1 030.
[9] 周玉庭. 黑曲霉孢子作为葡萄糖氧化酶生物催化剂的制备和活性测定方法研究[D]. 长沙: 中南林业科技大学, 2016: 52-59.
[10] 莫随青, 杨建雄, 王子浩. 用固定化黑曲霉C-435孢子生产柠檬酸的初步研究[J]. 陕西师大学报: 自然科学版, 1990(3):93-94.
[11] 翟彤宇, 单金缓. 葡萄糖氧化酶催化反应动力学特征及其抑制剂[J]. 河北大学学报: 自然科学版, 1998, 18(2): 203-205.
[12] HELLMUTH K, PLUSCHKELL S, JUNG J K, et al. Optimization of glucose oxidase production byAspergillusnigerusing genetic-and process-engineering techniques[J]. Applied Microbiology and Biotechnology, 1995, 43(6): 978-984.
[13] 徐俊光. 壳寡糖对植物病原真菌的抑菌活性及其机理的初步研究[D]. 大连: 中国科学院大连物理研究所, 2007: 53-54.
[14] 李丽, 罗莉斯, 王艳萍, 等. 刺糖多孢菌生长特性及培养条件的优化[J]. 中国粮油学报, 2010(11): 89-93.
[15] GERIN P, BELLON-FONTAINE M N, ASTHER M, et al. Immobilization of fungal spores by adhesion[J]. Biotechnology and Bioengineering, 1995, 47(6): 677-687.
[16] 王志新. 黑曲霉 A9 葡萄糖氧化酶的提取纯化及其酶学性质研究[D]. 保定: 河北农业大学, 2006:18-21.
[17] PIERCE D T, UNWIN P R, BARD A J. Scanning electrochemical microscopy. 17. Studies of enzyme-mediator kinetics for membrane-and surface-immobilized glucose oxidase[J]. Anal. Chem, 1992, 64(1 795): 1 804.
[18] 蒋雪薇, 李浩, 杨琛, 等. 丝状真菌液体深层发酵菌丝体形态控制研究进展[J]. 食品与机械, 2016, 32(9): 209-212.
[19] ROSENBERG M, SVITEL J, STURDK E, et al. Gluconic acid production byAspergillusnigerwith oxygen supply by hydrogen peroxide[J]. Bioprocess Engineering, 1992, 7(7): 309-313.
[20] MOIR A. How do spores germinate?[J]. Journal of Applied Microbiology, 2006, 101(3): 526-530.
Detection of GOD activity during the germination ofAspergillusnigerspores by electrochemical method
LIUYang-ru1
LIZhong-hai1,2
RENJia-li1, 2
(1.CollegeofFoodScienceandEngineering,CentralSouthUniversityofForestryandTechnology,Changsha,Hunan410004,China; 2.NationalEngineeringLaboratoryforRiceandBy-productDeepProcessing,Changsha,Hunan410004,China)
In this study, the electrochemical cyclic voltammetry method was developed for the determination of activity of glucose oxidase. The ferrocene methanol was introducing as the redox probes on cyclic voltammetry, using glassy carbon electrode as working electrode, saturated calomel electrode as reference electrode, platinum wire electrode as the counter electrode and the peak current value of different enzyme activity was required . There was a linear relationship between the peak current in enzyme concentration of 1.282~2.377 U/mL with the correlation coefficient as 0.998, the detection limit as 1.282 U/mL. The enzyme activity of spores from dormancy to germination was detected by this new method, as the enzyme activity of spores decreased after increasing first, reaching the maximum (2.130 U/mL). The traditional methods were tested at the same time. Compared with the traditional method, the proposed electrochemical method has the characteristics of accurate, fast and convenient.
Aspergillusnigerspores; germination; glucose oxidase; cyclic voltammetry
国家自然科学基金(编号:31340059);湖南省自然科学基金(编号:2017JJ3523);粮油深加工与品质控制湖南省2011协同创新项目(编号:湘教通[2013]448号)
刘洋汝,女,中南林业科技大学在读硕士研究生。
任佳丽(1977—),女,中南林业科技大学教授,博士。 E-mail:rjl_cl@163.com
2017—03—20
10.13652/j.issn.1003-5788.2017.05.017
