飞行时间质谱技术及其在植物多酚鉴定中的应用
2017-07-05李苇舟肖星凝
李苇舟 - 明 建,2 ,2 肖星凝 - 石 芳 李 谣
(1. 西南大学食品科学学院,重庆 400715;2. 重庆市特色食品工程技术研究中心,重庆 400715)
飞行时间质谱技术及其在植物多酚鉴定中的应用
李苇舟1LIWei-zhou1明 建1,2MINGJian1,2肖星凝1XIAOXing-ning1石 芳1SHIFang1李 谣1LIYao1
(1. 西南大学食品科学学院,重庆 400715;2. 重庆市特色食品工程技术研究中心,重庆 400715)
飞行时间质谱技术因具有检测精度高、使用范围广、分析速度快等优点,被广泛应用于食品、生物医药、环境检测等领域,飞行时间质谱与多种技术串联使用在多酚结构鉴定中发挥着重要作用。文章综述了飞行时间质谱技术在植物多酚结构鉴定中的应用,以期为植物多酚研究提供一定参考。
飞行时间质谱;多酚;结构鉴定
植物多酚是一类广泛存在于植物中,具有一个或多个酚羟基结构的次生代谢产物[1-3]。多酚由于能有效地清除体内过多自由基,从而表现出较强抗氧化活性[2-4]。但各植物多酚结构组成不同,导致其抗氧化能力不同,因此,研究植物多酚成分及结构对于研究其生理功能和作用机制具有重要意义。
常用鉴定多酚组分及结构的方法有高效液相色谱、核磁共振、质谱等,高效液相色谱(High performance liquid chromatography,HPLC)因灵敏度和检测限的限制而只能用于分析低分子量的多酚,对高分子量、结构复杂的多酚分析效果不理想;核磁共振(Nuclear magnetic resonance,NMR)虽具有鉴定分离出单宁聚合物的强大结构解析能力,但由于成本高、样品处理复杂、测定结果会被糖配体干扰,且灵敏度低,导致其使用受到限制[5]。质谱(Mass spectrum,MS)技术作为一种主要分析分子化学结构的技术,具有分辨率高、分析速度快、检测范围广等优点,被认为是分析植物多酚的理想工具和手段,飞行时间质谱(Time of flight mass spectrometry,TOF-MS)作为其中重要的一类,在多酚研究中有不可替代的作用。
本文概述了飞行时间质谱工作原理及其串联技术应用的必要性,从酚酸、黄酮、原花色素3个方面综述了飞行时间质谱及其串联技术在植物多酚结构鉴定中的应用。
1 飞行时间质谱及其串联技术
1.1 飞行时间质谱工作原理
飞行时间质谱(Time of flight mass spectrometry,TOF-MS)是利用动能相同而质荷比不同的离子在恒定电场中运动,经过恒定距离所需时间不同,对物质成分或结构进行解析的一种分析方法。其在理论上对分析对象没有质量范围限制,有较高分辨能力(55 000 FWHM)和微秒级采集速度(4 GHz/s)[6],能够获得样品的全扫描质谱图和精确质量数(精度达5~10 mg/kg)[7],并能通过精确质量数推测获得化合物分子式[5]。
常见的飞行时间质谱仪有线性式和反射式两种[8]。线性式飞行时间质谱的工作原理[见图1(a)]:被测样品离子化后经过电场加速,不同质量的离子获得相同的动能E[式(1)],然后凭惯性穿越长为L的无场区到达检测器,根据式(2),质荷比m/q大的飞行时间比m/q小飞行时间长,从而将不同质量数的离子分离并检测[9]15-16。

图1 飞行时间质谱工作原理图Figure 1 Working principle of TOF-MS

(1)
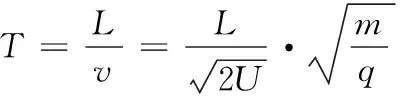
(2)
式中:
E——离子在加速电场中获得的动能,J;
m——离子质量,g;
v——进入无场区时离子速度,m/s;
q——离子电荷量,C;
U——加速电场电压,V;
T——离子在无场区中的飞行时间,s;
L——离子在无场区中的飞行距离,m。
然而,由于线性式飞行时间质谱分辨率不高,不易得到精确分子量,为了改善线性式的不足,人们运用反射式飞行时间质谱对样品进行检测,提高了分辨率和分子量测定的精度。其原理[见图1(b)]:高动能离子比低动能离子穿入反射器更深一些,适当的反射器电压,可使相同质量数动能不同的离子经反射后同时到达检测器,从而使其分辨率和分子量测定的精度都得到了提高。许多仪器同时具备线性式和反射式两种工作方式。
1.2 飞行时间质谱串联技术
飞行时间质谱技术首先需要离子源使样品离子化再进入电场中加速。早期飞行时间质谱由于分辨率较低,离子化时如何使粒子分流与雾化、如何尽可能去除溶剂等问题未得到解决,导致其发展受到限制[9]16-18。20世纪90年代以来,新型软电离技术电喷雾离子化电离(Electrospray ionization ionization,ESI)、大气压下碰撞电离或大气压化学电离(Atmospheric pressure chmical iosziaa-lion,APCI)和基质(体)辅助激光解吸电离(Matrix assisted laser desorption ionization,MALDI)技术的产生促进了飞行时间质谱仪的发展[10]。其中,电喷雾离子源(ESI)在快速无损分析方面具有独特的优势[11],不仅可以产生多电荷离子,而且可以产生多电荷母离子的子离子,从而获得更多结构信息。
飞行时间质谱与离子源结合后,再与气相色谱(Gas chromatography,GC)、超高效液相色谱(Ultra performance liquid chromatography,UPLC)、四极杆(Quadrupole,Q)等仪器技术串联,提高了检测的准确性,从而更全面地鉴定样品成分,飞行时间质谱的多级联用技术已成为基因及基因组学、蛋白质及蛋白质组学、病毒学等研究领域中的重要分析手段[12]。其串联方式及相关应用见表1。

表1 飞行时间质谱与其他检测仪器串联方式及应用Table 1 Modes and applications of TOF-MS with other testing instruments in tandem
2 飞行时间质谱技术在植物多酚类化合物鉴定中的应用
目前,各种分离技术(高效液相色谱法、气相色谱法、毛细管电泳法)同飞行时间质谱技术串联作为一种有效的识别方法,被越来越广泛地应用于多酚结构鉴定中[26]。研究[27-28]表明,液相色谱与飞行时间质谱联用(LC—TOF-MS)技术已成为多酚成分分析的强大解析工具,通过液相初步得出多酚的成分组成,然后对于出现的特殊峰利用飞行时间质谱进行检测,根据得到的离子碎片信息鉴定多酚的结构。如利用液相色谱电喷雾电离飞行时间质谱(HPLC—ESI—TOF-MS)技术在杏仁皮的提取物中共检测到23种多酚类化合物[29];利用超高效液相色谱—四级杆—飞行时间质谱(UPLC—Q—TOF-MS/MS)技术在印度绿叶蔬菜Merremiaemarginata中检测到29种已知和19种未知的多酚类化合物[30];通过液相色谱混合动力飞行时间质谱(HPLC—IT—TOF-MS)技术在桑白皮叶中检测到22种酚类化合物,其中11种酚类化合物在桑白皮叶中为首次报道[31]。
2.1 酚酸类化合物的鉴定
植物中富含酚酸类物质,在对其成分进行分析鉴定时,最常用到的方法是HPLC(UPLC)—TOF—MS,通过与标准品保留时间比较及分析质谱图给出的一级结构和二级结构等,最终得到成分具体类别。
在全谷物中,酚酸是最具代表性的多酚类物质,尤其是阿魏酸,在小麦中约占总酚酸含量的70%~90%[32-35]。利用HPLC—ESI—TOF-MS技术在意大利22种小麦中共鉴定出34类(共104种异构体)多酚类物质,其中阿魏酸的同分异构体共有9种,二氢阿魏酸的同分异构体8种,丁香酸的同分异构体有2种且大部分存在于结合酚的部分[26]。在Carosello小麦中发现了分子质量为224.061 2(C11H12O5)的物质,并初步鉴定为芥子酸[26]。
通过Q—TOF-MS提供的质荷比和离子碎片信息并结合相应的文献资料,在西瓜果肉里发现30种酚酸类物质,并含有间苯三酚-葡萄糖醛酸[36]。同样,利用该技术从朝鲜淫羊藿中共鉴定出18种酚酸类物质,其中有7种酚酸是首次发现,均为咖啡酰己酸的同分异构体[37]。
松萝具有清热解毒、止咳化痰等功效,多酚类物质是其中的主要药效成分。通过超高效液相色谱串联三重四极杆飞行时间质谱法(UPLC—Triple-TOF-MS)在松萝中鉴定出17种酚酸类物质,主要为二苯并呋喃类化合物、多取代单苯环类化合物、缩酚酸类及其衍生物等[38]。
2.2 黄酮类化合物的鉴定
黄酮类化合物是通过两个苯环和一个吡喃环相互连接而形成的一系列化合物。串联质谱技术能给出图谱中记录的物质精确的分子质量,甚至能够给出黄酮类物质裂解途径的信息,大多数记录的A型和B型离子碎片为这些化合物的取代模式提供了极为重要的信息[27,39-40],因此,对研究未知黄酮类化合物的结构提供了依据。
利用反向高效液相色谱电喷雾电离飞行时间质谱(RP-HPLC-ESI-TOF-MS)技术在苦荞中检测到28种黄酮类物质,其中2-羟基-3-O-β-D-吡喃葡糖基-苯甲酸、1-O-咖啡酰-6-α-吡喃鼠李糖基-β-葡萄糖苷、表儿茶素-3-(3''-O-甲基)是首次在苦荞中被发现[41]。在南美亚马逊雨林棕榈树叶中利用UPLC—ESI-MS/MS串联技术鉴定出的黄酮类化合物主要有槲皮素、柚皮素、儿茶素和表儿茶素、芦丁、矢车菊素-3-芸香糖苷和矢车菊素-3-葡萄糖苷[42]。
通过ESI-IT-TOF/MSn多级质谱联用技术对21种黄酮类化合物的裂解规律进行研究时发现,异黄酮和黄酮丢失C2H2O2碎片的先决条件是5,7-二羟基或5-羟基-7-甲氧基取代,异黄酮、黄酮和黄酮醇失去C3O2的结构特点是A环具有5,7-二羟基取代,若A环含有其他取代基,则不会失去C3O2[43]。葛根素-4’-O-β-D-葡萄糖苷在质谱中给出的离子峰的测定值为577.156 2,可推断其分子式为C27H30O14,以m/z577.15 62为母离子,进行二级质谱分析,其可能的裂解途径见图2,与2-苯基色原酮8号碳位链接的官能团(C6H11O5)中,环上相间的C—O键、C—O键断裂脱落C4H8O4部分(Mv=120),留下的C2H3O形成一个新C—C双键,并以该离子形式(m/z457)保持稳定[44]。

图2 葛根素-4’-O-β-D-葡萄糖苷可能的裂解途径Figure 2 Possible fragmentation mechanism of puerain- 4’-O-β-D-glucoside
2.3 原花色素类化合物的鉴定
原花色素,又称缩合单宁,是一类结构与花青素相似,味涩而无色的高聚物,其基本结构单元是黄烷-3-醇,因结构中起始单元或延伸单元黄烷-3-醇组成单元的连接位置、羟化部分以及聚合度的不同使原花色素结构具有多样性和复杂性,导致对其进行定性和定量分析比较困难[45],运用亲核试剂(如间苯三酚或甲苯α-硫醇)催化的酸降解原花色素,其延伸和末端结构单元可被检测,从而测定其聚合度[46]。
辅助激光电离飞行时间质谱(MALDI-TOF-MS)技术是一种灵敏且有效的不挥发性物质检测技术,能对同一样品进行重复分析且具有最佳兼容性[47],被认为是对多酚聚合物和原花青素分析的有效方法[48-52]。Mané等[53]分别在MALDI-TOF-MS中使用[M+Na]+和[M+K]+两种阳离子模式,测得苹果中原花色素的聚合度分别为DP15和DP13;Takahata等[54]利用[M+K]+在线模式检测出棕色大豆种皮中的原花色素最高聚合度为DP30。
陈小鑫[55]运用MALDI-TOF-MS检测发现构成黄葛树叶、树皮和果实原花色素,鱼尾葵果皮原花色素和印度塔树叶原花色素的黄烷-3-醇结构单元(U288)的质量数与原花青素结构单元C/EC(儿茶素/表儿茶素)的相对分子质量恰好相等,并能分别检测到黄葛树叶、树皮和果实原花色素,鱼尾葵果皮和果肉原花色素,印度塔树叶原花色素存在从三聚体到六聚体、十五聚体、十二聚体和十四聚体的聚物。相似的,在木榄花萼原花色素的MALDI-TOF质谱图中,主要离子峰系列的相邻离子峰间距均为m/z288,显示了构成花萼原花色素的黄烷-3-醇结构单元(U288)的质量数,通过计算结构单元U288个数得知其中从三聚体到十六聚体的均聚物都存在[56]。
3 结语
植物多酚因成分与结构的不同而具有多种生理功能,在疾病控制和保健方面发挥着重要作用。因此,分析植物多酚的结构对研究植物多酚生理功能具有重要的意义,飞行时间质谱技术在分析多酚成分及结构鉴定方面发挥着巨大作用。但由于飞行时间质谱是通过质谱图提供的离子碎片信息对多酚类物质做初步的鉴定,所以单一使用具有一定的局限性。将多种电离技术与多级质谱连用,能使飞行时间质谱在全面鉴定和分析多酚类化合物成分中发挥重要作用。
[1] 付真烈, 刘胜利, 王敏. 氧自由基造成肝细胞损害的机理[J]. 临床肝胆病杂志, 1996(4): 181-183.
[2] OKARTER N, LIU Rui-hai. Health benefits of whole grain phytochemicals[J]. Critical Reviews in Food Science and Nutrition, 2010, 50(3): 193-208.
[3] LIU Rui-hai. Whole grain phytochemicals and health[J]. Journal of Cereal Science, 2007, 46(3): 207-219.
[4] PÉREZ-JIMÉNEZ J, TORRES J L. Analysis of non-extractable phenolic compounds in foods: the corrent state of the art[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 12 713-12 724.
[5] MEZUCA M, MALATO O, GARCA-REYES J F, et al. Accurate-mass databases for comprehensive screening of pesticide residues in food by fast liquid chromatography time-of-flight mass spectrometry[J]. Analytical Chemistry, 2009, 81(3): 913-929.
[6] 李晓颍, 张红医, 范春林, 等. 气相色谱-飞行时间质谱在化合物鉴定方面的应用进展[J]. 化学通报, 2014, 77(2): 123-130.
[7] 汪聪慧. 有机质谱技术与方法[M]. 北京: 中国轻工业出版社, 2011: 56-58.
[8] 韩瑶. 寡糖的基质辅助激光解吸电离飞行时间质谱分析方法研究[D]. 青岛: 中国海洋大学, 2006: 10-12.
[9] 徐国宾. 飞行时间质谱及串联质谱关键技术的系统研究[D]. 上海: 复旦大学, 2010.
[10] PASCH H, ALPHEUS MAUTJANA N. Matrix-assisted laser desorption/ionization mass spectrometry of polymers[M]// ROBERT A M. Encyclopedia of Analytical Chemistry. New Jersey: Wiley-Blackwell, 2011: 3 126-3 131.
[11] 侯可勇, 董璨, 王俊德, 等. 飞行时间质谱仪新技术的进展及应用[J]. 化学进展, 2007, 19(1): 385-392.
[12] BEHRENS A, MAIE N, KNICKER H, et al. MALDI-TOF mass spectrometry and PSD fragmentation as means for the analysis of condensed tannins in plant leaves and needles[J]. Phytochemistry, 2003, 62(7): 1 159-1 170.
[13] VELOO A C M, ERHARD M, WELKER M, et al. Identification of gram-positive anaerobic cocci by MALDI-TOF mass spectrometry[J]. Systematic and Applied Microbiology, 2011, 34(1): 58-62.
[14] 陈秀金, 尹红红, 匡华, 等. 沙门氏菌MALDI-TOF-MS蛋白质指纹图谱分析方法的研究[J]. 食品与生物技术学报, 2012, 31(11): 1 189-1 197.
[15] GRIMM B, KRÜGER R P, SCHRADER S, et al. Molecular structure investigations on fluorine containing polyazomethines by means of the MALDI-TOF-MS technique[J]. Journal of Fluorine Chemistry, 2002, 113(1): 85-91.
[16] BOZZINI C, CAMPOSTRINI N, TROMBINI P, et al. Measurement of urinary hepcidin levels by SELDI-TOF-MS in HFE-hemochromatosis[J]. Blood Cells Molecules and Diseases, 2008, 40(3): 347-352.
[17] MOON Y S, PARK E S, KIM T O, et al. SELDI-TOF-MS based discovery of a biomarker in cucumis sativus seeds exposed to CuO nanoparticles[J]. Environmental Toxicology and Pharmacology, 2014, 38(3): 922-931.
[18] SCHIPPER R, LOOF A, GROOT J D, et al. Salivary Protein/Peptide Profiling with SELDI-TOF-MS[J]. Annals of the New York Academy of Sciences, 2007, 1 098(1): 498-503.
[19] 李晓颖, 张红医, 常巧英, 等. 气相色谱—四极杆飞行时间质谱准确鉴定常见水果蔬菜中的农药残留[J]. 色谱, 2014, 32(3): 268-277.
[20] DALSGAARD P W, RASMUSSEN B S, MÜLLER I B, et al. Toxicological screening of basic drugs in whole blood using UPLC-TOF-MS[J]. Drug Testing and Analysis, 2012, 4(5): 313-319.
[21] GRATA E, BOCCARD J, GUILLARME D, et al. UPLC-TOF-MS for plant metabolomics: a sequential approach for wound marker analysis in Arabidopsis thaliana[J]. Journal of Chromatography B, 2008, 871(2): 261-270.
[22] 钱疆, 陈方, 陈驰, 等. 超高效液相色谱飞行时间质谱测定食品中36种合成色素[J]. 食品科学, 2013, 34(6): 215-218.
[23] 杜志峰, 冼燕萍, 刘付健, 等. 液相色谱-高分辨率飞行时间质谱法测定食品接触纸包装材料中的7种荧光增白剂[J]. 分析化学, 2014, 42(5): 636-642.
[24] SHI Qi-yuan, JIALIE C, ZHOU Qin-fen, et al. Indirect identification of antioxidants in polygalae radix through their reaction with 2,2-diphenyl-1-picrylhydrazyl and subsequent HPLC-ESI-Q-TOF-MS/MS[J]. Talanta, 2015, 144: 830-835.
[25] 杨英, 饶春明, 王威, 等. HPLC-ESI-Q-TOF-MS鉴定重组人白细胞介素II的一级结构[J]. 质谱学报, 2006, 27(2): 117-121.
[26] DINELLI G, SEGURA-CARRETERO A, DI SILVESTRO R, et al. Profiles of phenolic compounds in modern and old common wheat varieties determined by liquid chromatography coupled with time-of-flight mass spectrometry[J]. Journal of Chromatography A, 2011, 1 218(42): 7 670-7 681.
[27] 范金波, 蔡茜彤, 郑立红, 等. 果蔬中多酚成分及其分析方法的研究进展[J]. 食品工业科技, 2014, 35(4): 374-379.
[28] WOLFENDER J L, WARIDEL P, NDJOKO K, et al. Evaluation of Q-TOF-MS/MS and multiple stage IT-MSnfor the dereplication of flavonoids and related compounds in crude plant extracts[J]. Analysis, 2000, 28(10): 895-906.
[30] RAMESHKUMAR A, SIVASUDHA T, JEYADEVI R, et al. Profiling of phenolic compounds using UPLC-Q-TOF-MS/MS and nephroprotective activity of Indian green leafy vegetableMerremiaemarginata(Burm. f.)[J]. Food Research International, 2013, 50(1): 94-101.
[31] DUGO P, DONATO P, CACCIOLA F, et al. Characterization of the polyphenolic fraction ofMorusalbaleaves extracts by HPLC coupled to a hybrid IT-TOF MS system[J]. Journal of Separation Science, 2009, 32(21): 3 627-3 634.
[32] 李富华, 郭晓晖, 夏春燕, 等. 全谷物酚类化合物抗氧化活性研究进展[J]. 食品科学, 2012, 33(13): 299-304.
[33] MATTILA P, PIHLAVA J, HELLSTRÖM J. Contents of phenolic acids, alkyl- and alkenylresorcinols, and avenanthramides in commercial grain products[J]. Journal of Agricultural and Food Chemistry, 2005, 53(21): 8 290-8 295.
[34] MOORE J, LIU Jian-guo, ZHOU Ke-quan, et al. Effects of genotype and environment on the antioxidant properties of hard winter wheat bran[J]. Journal of Agricultural and Food Chemistry, 2006, 54(15): 5 313-5 322.
[35] OKARTER N, LIU Chang-shu, SORRELLS M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat[J]. Food Chemistry, 2010, 119(1): 249-257.
[36] ABU-REIDAH I M, ARREZ-ROMN D, SEGURA-CARRETERO A, et al. Profiling of phenolic and other polar constituents from hydromethanolic extract of watermelon (Citrulluslanatus) by means of accurate-mass spectrometry (HPLC-ESI-QTOF-MS)[J]. Food Research International, 2013, 51(1): 354-362.
[37] WANG Ya-qin, GUO Zhi-mou, JIN Yu, et al. Identification of prenyl flavonoid glycosides and phenolic acids in Epimedium koreanum Nakai by Q-TOF-MS combined with selective enrichment on “click oligo (ethylene glycol)” column[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(3): 606-616.
[38] 马英华, 田婷婷, 解伟伟, 等. 采用UHPLC-TRIPLE-TOF-MS法鉴定松萝主要酚酸类化学成分[J]. 中草药, 2016, 47(3): 392-400.
[39] ES-SAFI N E, GUYOT S, DUCROT P H. NMR, ESI/MS, and MALDI-TOF/MS analysis of pear juice polymeric proanthocyanidins with potent free radical scavenging activity[J]. Journal of Agricultural and Food Chemistry, 2006, 54(19): 6 969-6 977.
[40] CUYCKENS F, CLAEYS M. Mass spectrometry in the structural analysis of flavonoids[J]. Journal of Mass Spectrometry, 2004, 39(1): 1-15.
[41] VERARDO V, ARREZ-ROMN D, SEGURA-CARRETERO A, et al. Identification of buckwheat phenolic compounds by reverse phase high performance liquid chromatography-electrospray ionization- time-of-flight-mass spectrometry (RP-HPLC-ESI-TOF-MS)[J]. Journal of Cereal Science, 2010, 52(2): 170-176.
[42] KOOLEN H H F, DA SILVA F, GOZZO F C, et al. Antioxidant, antimicrobial activities and characterization of phenolic compounds from buriti (Mauritiaflexuosa, L. f.) by UPLC-ESI-MS/ MS[J]. Food Research International, 2013, 51(2): 467-473.
[43] 尹亮亮, 董静, 徐英, 等. 应用负的ESI-IT-TOF/MSn研究黄酮类化合物的裂解规律[C]// 第九届全国中药和天然药物学术研讨会大会报告及论文集. 北京: 中国药学会, 2007: 5.
[44] 孙冬梅, 董玉娟, 胥爱丽, 等. 葛根枳椇软胶囊中黄酮类化合物的UPLC/Q-TOF-MS快速分析[J]. 中草药, 2015, 46(7): 970-976.
[55] 温鹏飞. 葡萄多酚[M]. 北京: 中国农业科学技术出版社, 2012: 2-8.
[46] 傅瑜. 杨梅叶原花色素的结构鉴定以及对黑色素生成和细胞凋亡的作用研究[D]. 杭州: 浙江大学, 2015: 1-3.
[47] MONAGAS M, QUINTANILLA-LPEZ J E, GMEZ-CORDOVÉS C, et al. MALDI-TOF-MS analysis of plant proanthocyanidins[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 51(2): 358-372.
[48] Hanton S D. Mass spectrometry of polymers and polymer surfaces[J]. Chemical Reviews, 2001, 101(2): 527-570.
[49] 王晓青, 陈栓虎. 基质辅助激光解吸电离飞行时间质谱在聚合物表征中的应用[J]. 质谱学报, 2008, 29(1): 51-59.
[50] 范铁男, 邹继宏, 卢行安, 等. MALDI—TOF质谱在细菌检测及鉴定中的研究进展[J]. 中国微生态学杂志, 2010, 22(3): 282-284.
[51] FULCRAND H, MANÉ C, PREYS S, et al. Direct mass spectrometry approaches to characterize polyphenol composition of complex samples[J]. Phytochemistry, 2008, 69(18): 3 131-3 138.
[52] MUELLER-HARVEY I. Analysis of hydrolysable tannins[J]. Animal Food Science and Technology, 2001, 91(1): 3-20.
[53] MANÉ C, SOMMERER N, YALCIN T, et al. Assessment of the molecular weight distribution of tannin fractions through MALDI-TOF-MS analysis of protein-tannin complexes[J]. Analytical Chemistry, 2007, 79(6): 2 239-2 248.
[54] TAKAHATA Y, OHNISHI-KAMEYAMA M, FURUTA S, et al. Highly polymerized procyanidins in brown soybean seed coat with a high radical-scavenging activity[J]. Journal of Agricultural and Food Chemistry, 2001, 49(12): 5 843-5 847.
[55] 陈小鑫. 抗氧化剂原花色素对蘑菇酪氨酸酶活性的影响及机理研究[D]. 厦门: 厦门大学, 2014: 34-37.
[56] 张亮亮. MALDI—TOF质谱联合NMR及HPLC分析植物单宁结构及抗氧化能力的研究[D]. 厦门: 厦门大学, 2009: 39-40.
The time of flight mass spectrometry technology and its application in plant polyphenols identification
(1.CollegeofFoodScience,SouthwestUniversity,Chongqing400715,China;2.ChongqingEngineeringResearchCenterforSpecialFoods,Chongqing400715,China)
Time of flight mass spectrometry (TOF-MS) has been widely applied in food, biological medicine, environmental monitoring for its great precision, wide range of detection and high speed of analysis. TOF-MS with various techniques in tandem plays an important role in the structure identification of polyphenols. In this review, it was outlined the application of time of flight mass spectrometry in the structure identification of plant polyphenols to provide some references for the study of plant polyphenol.
time of flight mass spectrometry; polyphenols; structure identification
10.13652/j.issn.1003-5788.2017.04.039
国家自然科学基金项目(编号:41601573);安徽省公益性技术应用研究联动计划项目(编号:1604f0704050);滁州学院实验室开放课题(编号:SWSP201507KF)
张磊(1983—),男,滁州学院讲师,博士。 E-mail:leizhang2014@163.com
2017—01—20
