Osborne分级法提取藜麦糠清蛋白及功能性质研究
2017-07-05,,,,,*
,,,,,*
(1.山西大学生命科学学院,山西太原 030006; 2.山西林业职业技术学院,山西太原 030009)
Osborne分级法提取藜麦糠清蛋白及功能性质研究
田旭静1,段鹏慧2,陈文超1,张婧婷1,范三红1,*
(1.山西大学生命科学学院,山西太原 030006; 2.山西林业职业技术学院,山西太原 030009)
以藜麦糠为研究对象,采取超声辅助Osborne分级法对藜麦糠中清蛋白进行提取。在单因素实验基础上,应用Box-Behnken方法选取料液比、提取温度、提取时间3个因素,以清蛋白提取率为响应值进行优化,确定藜麦糠清蛋白的最优提取条件为:料液比1∶37 (g/mL)、提取温度46 ℃、提取时间25 min,在此条件下藜麦糠清蛋白提取率为43.21%,与理论预测值43.76%相比,其相对误差约为1.25%。说明通过响应面分析优化后得到的回归方程在实践指导方面具有一定的意义。对藜麦糠清蛋白功能(溶解性、持水力、乳化性、起泡性)特性进行了测定,结果表明pH为2.5即等电点时,清蛋白的溶解度最低,持水力最小达到1.33 g/g,乳化性最低,乳化稳定性反而最好,而起泡性和起泡稳定性在等电点附近均最差。
藜麦糠,清蛋白,Osborne 分级法,响应面分析法,功能特性
藜麦(Chenopodiumquinoa)是一种藜科假谷物,原产地在南美洲安第斯山脉地区,栽植历史已有5000~7000年。古代印加人称之为“mother of all grains”[1-2]。藜麦具有抗寒、抗旱、耐贫瘠和高盐碱土壤等特征[3-4]。藜麦有增强机体功能、均衡营养、抗癌和减肥等功效,适于一系列慢性病的辅助治疗[5]。因此被推荐为最适宜人类的完美“全营养食品”[6]。自1987年以来,我国在西藏地区试种藜麦[7],目前在山西、湖南和吉林等实现规模化种植[5]。藜麦优质蛋白含量高[8],容易被人体吸收[9]。Lamacchia[10]等的研究认为,藜麦中可利用的蛋白质含量比其他普通谷物要高。藜麦主要贮藏蛋白是清蛋白和球蛋白,谷蛋白和醇溶蛋白含量较低。由于二硫键的作用藜麦清蛋白具有较好的稳定性[11]。
目前国内对于藜麦产品的开发仍然处在初级阶段,藜麦糠作为副产品经常被视为工业生产的废料被遗弃,没有得到综合利用导致严重的资源浪费,因此对藜麦糠的开发仍有很大的研究空间。本研究以藜麦糠为原料,通过响应面分析对超声辅助Osborne分级法提取藜麦糠清蛋白的最佳工艺条件进行优化,并对蛋白功能特性进行了研究,为进一步开发藜麦糠提供理论依据。
1 材料与方法
1.1材料与仪器
藜麦糠 山西华青藜麦产品开发有限公司提供;大豆色拉油 由市场购得;所用其他试剂 均为分析纯。
AL204电子分析天平 梅特勒-托利仪器上海有限公司;101-2AB型电热鼓风干燥箱 天津市泰斯特仪器有限公司;SP-200OUV型紫外可见分光光度计 上海光谱仪器有限公司;TDL-5离心机 上海安亭科学仪器制造;868型pH测试仪 美国奥立龙公司;其他仪器 均为常规。
1.2实验方法
1.2.1 藜麦糠预处理 筛选藜麦糠,粉碎过0.35 mm筛,置35 ℃鼓风干燥箱烘4 h,使其水分含量在5%以下,冷却后密封干燥备用。
1.2.2 蛋白质含量测定 采用考马斯亮蓝法[12]测定蛋白质含量。以牛血清白蛋白浓度为横坐标,吸光值为纵坐标,得到标准曲线方程Y=0.0073X+0.0109(R2=0.9981)。依据所测吸光度值可计算蛋白的含量。此方程具有良好的线性相关性[12]。
1.2.3 原料成分含量测定 水分含量测定:105 ℃烘箱恒重法(GB/T 20264-2006);脂肪含量测定:索氏抽提法(GB/T 5009.6-2003);蛋白质含量测定:微量凯氏定氮法(GB 5009.5-2010),考马斯亮蓝比色法;灰分含量测定:600 ℃灰化法(GB 5009.4-2010)。
1.2.4 藜麦糠分级蛋白提取工艺 藜麦糠中加入一定比例的蒸馏水,搅拌均匀,在40 ℃超声辅助提取15 min,4000 r/min 离心20 min得到上清液A和残渣A;上清液A经过沉淀、洗涤、干燥等处理步骤得到清蛋白。残渣A继续做下一步处理[13]。

表2 藜麦糠基本成分分析Table 2 Quinoa chaff basic composition analysis
向上一步操作所得的残渣A中加入同比例2% NaCl溶液,提取过程同清蛋白,离心后得到上清液B和残渣B;上清液B经过同上处理得到球蛋白。
向上一步操作所得残渣B中加入同比例70%乙醇溶液,提取过程同清蛋白,离心后得到上清液C和残渣C;上清液C经过同上处理得到醇溶蛋白。
向上一步操作所得残渣C中加入同比例0.05 mol/L NaOH溶液,提取过程同清蛋白,离心后得到上清液D和残渣D。上清液D经过同上处理得到谷蛋白。
测定上清液中各蛋白含量,分别求得藜麦糠中各蛋白质质量分数。
1.2.5 清蛋白等电点的测定 取藜麦糠清蛋白提取液7份,用磷酸盐缓冲溶液调节pH分别为1.9、2.2、2.5、2.8、3.1、3.4、3.7,静置后,蛋白质发生沉淀,离心后取上清液测定吸光度值,吸光度值最小的点对应的为蛋白质的等电点[14]。
1.2.6 单因素实验 采用控制变量法[15]对藜麦糠中提取清蛋白的工艺进行单因素实验设计。称取藜麦糠粉2.0 g,以蒸馏水为提取溶剂,分别考查提取时间、料液比、提取温度对清蛋白提取率的影响。固定料液比为1∶35,提取时间为25 min,在提取温度为20、30、40、50、60 ℃条件下测定清蛋白提取率。固定料液比为1∶35,提取温度40 ℃,在提取时间为15、20、25、30、35 min条件下测定清蛋白提取率。固定提取时间25 min,提取温度40 ℃,在料液比1∶25、1∶30、1∶35、1∶40、1∶45 (g/mL)条件下测定清蛋白提取率。
1.2.7 响应面实验 根据单因素实验结果,设计Box-Behnken中心组合实验[16],其因素水平列于表1。

表1 Box-Behnken实验设计因素水平表Table 1 Factors and levels of Box-Behnken design
1.2.8 提取率计算 用考马斯亮蓝法[17]测定上清液中蛋白质的浓度。
蛋白质提取率(%)

1.2.9 藜麦糠清蛋白功能特性测定 对实验室自制的藜麦糠清蛋白进行溶解性的测定[18],乳化性和起泡性[19]的测定,以及持水力的测定[18]。
1.3 数据处理
以Origin 7.0软件绘制单因素实验图表,采用Design Expert 8.0.6软件进行Box-Behnken设计及分析。
2 结果与分析
2.1原料成分分析
根据表2显示的测定结果,该藜麦糠中蛋白质含量最多,其次是水分和脂肪,灰分含量相对较少。此测定结果为研究藜麦糠蛋白的理化性质打下了良好的基础。
2.2藜麦糠中4种蛋白的含量
采用考马斯亮蓝法测定藜麦糠中4种蛋白质组分质量分数如图1所示。
Osborne分级提取法将藜麦糠蛋白分为清蛋白、球蛋白、醇溶蛋白、谷蛋白。结果如图1显示,藜麦糠中清蛋白占蛋白总量的40.86%,4种蛋白中含量最多。藜麦糠球蛋白次之,占28.15%,藜麦糠谷蛋白和醇溶蛋白含量较少,分别占6.23%和4.45%。

图1 藜麦糠4种蛋白的百分含量Fig.1 The percentage of quinoa chaff 4 kinds of protein
2.3清蛋白等电点的测定
由图2可知,当pH在2.5左右时,藜麦糠清蛋白提取的上清液吸光度最小,蛋白沉淀最多,所以确定了藜麦糠清蛋白的等电点为pH=2.5。

图2 吸光度值随pH的变化曲线Fig.2 The absorbance value along with the change of pH curve
2.4单因素实验
2.4.1 提取温度对清蛋白提取率的影响 如图3结果表明,清蛋白提取率随提取温度的增加呈现先上升后下降的趋势,温度在40 ℃达到最大值,可能是因为开始随着提取温度的升高,使分子扩散速率增加,有利于蛋白质溶出,提取率上升。温度继续升高提取率开始有所下降,原因可能是清蛋白是热敏性较强的蛋白质,温度继续上升,部分蛋白质的结构可能被破坏而无法溶出,使得溶出量下降,导致提取率降低[20]。因此根据实验结果,确定最佳提取温度为40 ℃。

图3 提取温度对清蛋白提取率的影响Fig.3 The influence of temperature on albumin extraction yield
2.4.2 超声提取时间对清蛋白提取率的影响 通过图4可知,藜麦糠清蛋白提取率随提取时间增加先增大后减小,且当提取时间是25 min时达到最大值34.09%。这可能是因为提取时间较短时,超声波的作用强度不够,而清蛋白的溶出需要一定的时间,清蛋白随时间的增加能被充分提取,但当时间过长,清蛋白可能会被超声波产生的巨大机械能所破坏[21],而发生蛋白质部分分解和变性,从而使得提取率降低,因此确定最适提取时间是25 min。

图4 提取时间对清蛋白提取率的影响Fig.4 The influence of time on the albumin extraction yield

图5 料液比对清蛋白提取率的影响Fig.5 The influence of solid-liquid ratio on the albumin extraction yield
2.4.3 料液比对清蛋白提取率的影响 通过图5可知,藜麦糠清蛋白提取率随料液比的减小先增大后减小。这可能是由于溶剂和样品比例越大,浓度差则越大,增加了藜麦糠分子与溶液的接触面积,进而加快了传质的过程,但当料液比在1∶35~1∶45 g/mL之间时,清蛋白提取率不增加甚至降低[22],这是因为加水量继续增加,蛋白的溶解已经达到饱和,加水过多导致酸沉时上清液中清蛋白的溶解量增加,造成蛋白损失量的增高,提取率反而下降[23]。因此确定料液比1∶35 g/mL为宜。
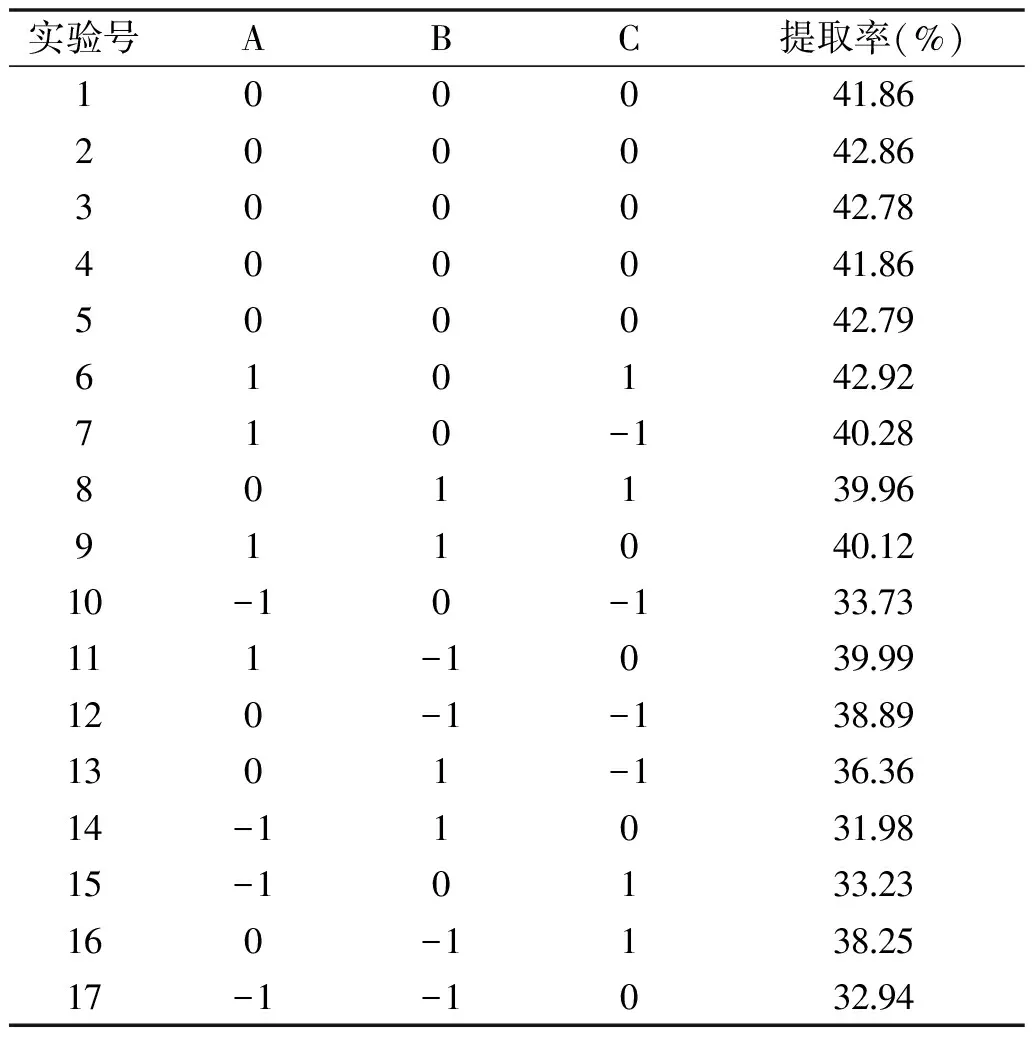
表3 响应面实验设计及结果Table 3 The response surface design of experimental results

表4 回归方程方差分析Table 4 The variance analysis of regression equation
注:*差异显著,p<0.05;**差异极显著,p<0.01。2.5响应面实验
在单因素实验的基础上,设计响应面实验,响应面实验方案及结果见表3。
2.5.1 回归方程的建立与方差分析 利用Design Expert 8.0.6软件对表3数据进行多元回归拟合,建立提取工艺参数回归模型。回归方程为:Y=42.43+3.93A-0.21B+0.64C+0.27AB+0.79AC+1.06BC-3.50A2-2.67B2-1.39C2。该方程中各项系数绝对值的大小可以反映各因素对响应值的影响程度,系数的正、负反映了影响的方向[24]。由方程的一次项系数可以得出影响藜麦糠清蛋白提取率的因素的主次顺序为A提取温度>C料液比>B提取时间。对该模型进行方差分析,结果见表4。
2.5.2 响应面分析 根据表4结果,利用Design Expert 8.0.6绘制响应面三维图形,固定其中一个因素在0水平不变,考虑其他2个因素的交互作用对藜麦糠清蛋白提取率的影响,分析AB、AC、BC这3组交互作用对清蛋白提取率的影响[26]。其响应面图如图6。由3组图可知,提取温度(A)曲线最陡,说明该因素对清蛋白提取率影响最大;料液比(C)和提取时间(B)曲线相对较平缓,响应值变化随其数值的变化不大,说明这两个因素对清蛋白提取率的影响程度相对于提取温度(A)较弱,这与方差分析的结果一致。等高线的形状也可以反映交互效应的强弱,越接近椭圆形交互作用越显著,越接近圆形交互作用不显著。分析可知,提取时间(B)和料液比(C)交互作用最显著,其后是提取温度(A)和料液比(C)交互作用较显著,而提取温度(A)和提取时间(B)的交互作用最不显著。

图6 各因素交互作用对清蛋白提取率的等高线和响应面图Fig.6 The contour and response surface figure of various factors interaction albumin extraction yield
图6(a)响应面图显示,提取温度30~45 ℃,提取时间20~26 min范围内时,藜麦糠清蛋白提取率随着温度和时间的增加而升高;而当提取温度在45~50 ℃范围内,提取时间26~30 min,藜麦糠清蛋白提取率随着两者的增加开始降低。由图6(a)还可知,在提取温度的42~46 ℃水平和提取时间的24~26 min水平之间有最大值。图6(b)显示,提取温度30~45 ℃,料液比1∶30~1∶35范围内时,两者存在较显著的增效作用,藜麦糠清蛋白提取率随着温度和料液比水平的增加而升高;而当提取温度在45~50 ℃,料液比1∶35~1∶40范围内时,藜麦糠清蛋白提取率反而开始降低。图6(c)可知,提取时间20~26 min,料液比1∶30~1∶35范围内时,两者的增效作用最显著,藜麦糠清蛋白提取率随着时间和料液比水平的增加而升高,而当在提取时间26~30 min,料液比1∶35~1∶40范围内时,藜麦糠清蛋白提取率随着两因素的增加开始降低,并且在提取时间的25~27 min和料液比的1∶35~1∶40之间有最大值。
由Design Expert 8.0.6软件得出的清蛋白的最佳提取条件为:提取温度46.13 ℃、提取时间25.39 min、料液比1∶37。此条件下模型预测的最大提取率为43.7636%。考虑到实际操作的局限性,将理论值修正为提取温度46 ℃、提取时间25 min、料液比1∶37。此条件下做验证实验,所得的清蛋白提取率为43.21%,与理论值43.7636%接近,说明该模型能较好地预测实际提取量。
2.6藜麦糠清蛋白功能特性测定
2.6.1 溶解性的测定 由图7可以看出,藜麦糠清蛋白的溶解度呈现先下降后上升的趋势。当pH为2.5时,清蛋白的溶解度最低,是因为在等电点处,蛋白质表面所带的总电荷为零,蛋白质分子之间的静电排斥力较小,由于疏水相互作用使导致蛋白质分子之间聚集沉淀。pH离清蛋白的等电点越远,其水化作用越弱,水分子对清蛋白的分散作用提升明显,表现为清蛋白的溶解度增加。
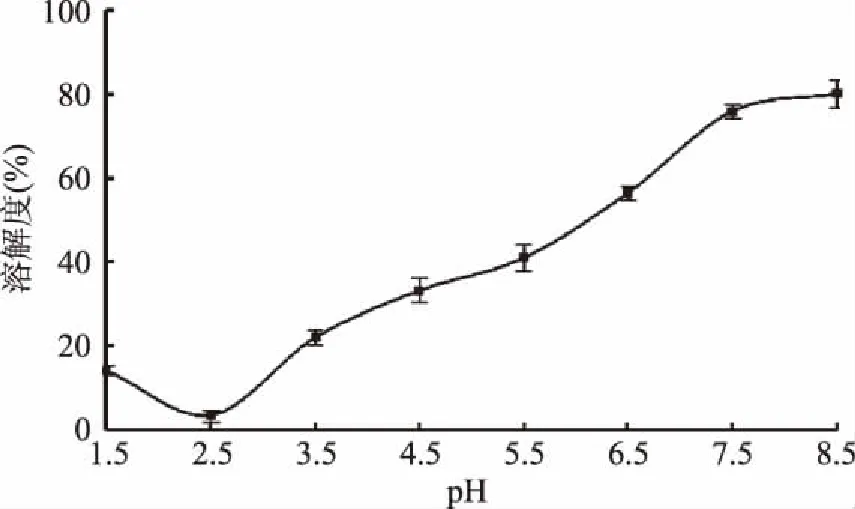
图7 pH对清蛋白溶解度的影响Fig.7 The influence of pH value on albumin solubility
2.6.2 持水力的测定 图8可知,藜麦糠清蛋白的持水力随pH的变化大致呈V型曲线,当pH逐渐靠近等电点时,清蛋白的持水力逐渐降低,当pH偏离等电点时,清蛋白的持水力显著提升。很明显可以发现,pH对清蛋白持水能力的影响与pH对其溶解度的影响基本一致。当pH在等电点(pH2.5)附近时,清蛋白质分子本身呈现电中性,蛋白质分子之间的相互作用达到最强,相互缔合收缩,蛋白质呈现最低的水合作用,所以持水力最小达到1.33 g/g。高于或低于等电点,由于净电荷和排斥力的增加使蛋白质持水力增强。

图8 pH对清蛋白持水力的影响Fig.8 The influence of pH value on albumin hold water
2.6.3 乳化性的测定 如图9所示,藜麦糠清蛋白的乳化性在等电点附近最低,乳化稳定性反而最好。当pH偏离等电点时,清蛋白的溶解度增大,从而乳化性增大,pH对藜麦糠清蛋白乳化性的影响与pH对其溶解度的影响基本一致,这表明蛋白质乳化性与溶解度有密切关系。

图9 pH对清蛋白乳化性的影响Fig.9 The influence of pH value on albumin emulsification
2.6.4 起泡性的测定 由图10可知,pH对藜麦糠清蛋白起泡性的影响与pH对其溶解度的影响趋势都呈“V”字型,在等电点处蛋白质聚集沉淀从而导致起泡性降低。所以清蛋白的起泡性和起泡稳定性在等电点附近均最差,且泡沫大小不均匀,消失很快。而在远离等电点时,清蛋白溶解度和表面活性增加,从而使清蛋白的起泡性和起泡稳定性均得到改善[18]。

图10 pH对清蛋白起泡性的影响Fig.10 The influence of pH value on albumin foaming
3 结论
通过超声辅助Osborne分级法对藜麦糠进行蛋白提取,得到的4种蛋白,其中清蛋白含量最多,占蛋白总量的40.86%。藜麦糠球蛋白次之,占28.15%,藜麦糠谷蛋白和醇溶蛋白含量较少,分别占6.23%和4.45%。进而对藜麦糠中清蛋白采用超声辅助水提的方法进行优化,在单因素实验的基础上,将Box-Behnken实验设计原理和响应面分析法相结合,拟合了料液比、提取温度、提取时间这3个因素对清蛋白提取率的回归模型,经检验证明该模型合理可靠,最优工艺条件为提取温度46 ℃、提取时间25 min、料液比1∶37。在此条件下,得到藜麦糠清蛋白提取率为43.21%。通过模型系数显著性检验,得到因素的主效应关系为:提取温度>料液比>提取时间。通过对藜麦糠清蛋白功能(溶解性、持水力、乳化性、起泡性)特性的测定发现,在等电点附近时,清蛋白的溶解度最低,持水力最小达到1.33 g/g,乳化性最低,乳化稳定性反而最好,而起泡性和起泡稳定性在等电点附近均最差。偏离等电点,清蛋白功能性质得到改善。它可以作为一种颇具开发前景的功能性食品配料应用于食品工业中。
[1]Koziol M J.Chemical composition and nutritional evalua-tion of quinoa(ChenopodiumquinoaWilld.)[J].Journal of Food Composition and Analysis,1992,5(1):35-37.
[2]Repo Carrasco R,Espinoza C,Jacobsen S E.Nutritional value and use of the andean crops quinoa(Chenopodiumquinoa)and kaniwa(Chenopodiumpallidicaule)[J].Food Reviews International,2003,19(1):179-180.
[3]Jacobsen S E,Mujica A,Jensen C R. The resistance of quinoa(ChenopodiumquinoaWilld.)to adverse abiotic factors[J]. Food Reviews International,2003,19(1/2):99-109.
[4]Escuredo O,Martín M I G,Moncada G W,et al. Amino acid profile of the quinoa(ChenopodiumquinoaWilld.)using near infrared spectroscopy and chemometric techniques[J]. Journal of Cereal Science,2014,60(3):67-74.
[5]肖正春,张广伦.藜麦及其资源开发利用[J].中国野生植物资源,2014,33(2):62-66.
[6]丁云双,曾亚文,闵康,等.藜麦功能成分综合研究与利用[J]. 生物技术进展,2015,5(5):341-342.
[7]贡布扎西,旺姆,张崇玺,等.南美藜在西藏的生物学特性表现[J].西南农业学报,1994,7(3):54-62.
[8]Abugoch L,Romero N,Tapia C,et al.Study of some physicochemical and functional properties of quinoa(ChenopodiumquinoaWilld.)protein isolates[J].Agriculture Food Chemistry,2008,56(2):4745-4750.
[9]王黎明,马宁,李颂,等.藜麦的营养价值及其应用前景[J].食品工业科技,2014,35(1):381-384.
[10]Lamacchia S,Chillo S,Lamparelli N,et al. Amaranth,quinoa and oat doughs-mechanical and rheological behaviour,polymeric protein size distribution and extractability[J].J Food Eng,2010,96(1):97-106.
[11]Brinegar C,Sine B,Nwokocha L. Highcysteine 2S seed storage proteins from quinoa(Chenopodiumquinoa)[J]. Journal of Agricultural and Food Chemistry,1996,44(7):1621-1623.
[12]柳荫,吴凤智,陈龙,等. 考马斯亮蓝法测定核桃水溶性蛋白含量的研究[J].中国酿造,2013,32(12):131-132.
[13]全越,王长远. Osborne分级法提取燕麦麸球蛋白的响应面分析[J]. 粮食加工,2015,40(5):34-35.
[14]訾艳,王常青,陈晓萌,等. 白芸豆清蛋白提取工艺及分子组成研究[J]. 食品工业科技,2014,35(15):121-122.
[15]郜海燕,李兴飞,陈杭君,等. 山核桃多酚物质提取及抗氧化研究进展[J]. 食品科学,2011,32(5):336-341.
[16]张瑶,李啸,潘冬瑞,等. Box-Benhnken设计优化植物乳杆菌培养基[J]. 天津农业科学,2013,19(7):1-5.
[17]赵英永,戴云,崔秀明,等. 考马斯亮蓝 G-250染色法测定草乌中可溶性蛋白质含量[J]. 云南民族大学学报:自然科学版,2006,15(3):235-237.
[18]邓芝串,张超,张晖,等.黑籽瓜种子蛋白质的功能特性[J].食品工业科技,2014,35(10):115-119.
[19]张维农,刘大川,胡小泓. 花生蛋白产品功能特性的研究[J]. 中国油脂,2002,27(5):60-65.
[20]陈建旭,黄生权.赤灵芝中水溶性蛋白响应面法优化提取[J].现代食品科技,2009,25(6):661-663.
[21]褚福红,陆宁,于新,等. 响应面法优化微波提取野菊花抗氧化物质[J].食品科学,2010,31(24):90-94.
[22]Eskilsson C S,Bjorklund E. Analytical-scale microwaveassisted extraction[J].Journal of Chromatography A,2000,902(1):227-250.
[23]钟俊桢,顿儒艳,黄宗兰,等. 腰果蛋白的提取工艺条件优化[J]. 食品科学,2014,35(16):20-21.
[24]肖卫华,韩鲁佳,杨增玲,等. 响应面法优化黄芪黄酮提取工艺的研究[J]. 中国农业大学学报,2007,12(5):52-56.
[25]陈红梅,谢翎.响应面法优化半枝莲黄酮提取工艺及体外抗氧化性分析[J]. 食品科学,2016,37(2):48-49.
[26]陈仕学,郁建平,杨俊,等.响应面法优化阳荷水溶性膳食纤维的微波提取工艺研究[J]. 食品科学,2014,35(18):57-62.
ExtractofalbuminfromquinoachaffbyOsborneclassificationmethodandfunctionalproperties
TIANXu-jing1,DUANPeng-hui2,CHENWen-chao1,ZHANGJing-ting1,FANSan-hong1,*
(1.College of Life Science,Shanxi University,Taiyuan 030006,China; 2.Shanxi Forestry Vocational and Technical College,Taiyuan 030009,China)
Quinoa chaff is the research object,albumin from quinoa chaff was extracted by using ultrasonic auxiliary Osborne classification method. Three extraction parameters including solid-liquid ratio,extraction temperature and extraction time were optimized using Box-Behnken method and response surface methodology with protein extraction ratio as the response value. The research was based on single factor experiments for achieving maximum the protein extraction ratio. The optimal extraction conditions were determined as a solid/liquid ratio of 1∶37 (g/mL),an extraction temperature of 46 ℃,and an extraction time of 25 min. Under these optimized conditions,quinoa chaff albumin extraction yield was 43.21%,compared to the theoretical value 43.76%,the relative error of 1.25%. Optimized by response surface regression equation derived some practical significance. Experiment of quinoa chaff albumin functional properties(solubility and hold water,emulsification,foaming)were determined. The results showed that pH2.5 isoelectric point,namely the solubility of albumin was the lowest,a hold water minimum was 1.33 g/g,emulsification was lowest,but emulsifying stability was best,and the foaming ability and foam stability in isoelectric point nearby were worst.
quinoa chaff;albumin;Osborne classification method;response surface analysis;functional properties
2016-11-28
田旭静(1992-),女,硕士研究生,研究方向:农产品综合利用开发,E-mail:497792954@qq.com。
*通讯作者:范三红(1963-),男,大学本科,教授,研究方向:食品科学,E-mail:fsh729@sxu.edu.cn。
山西省自然科学基金项目(2012011031-4);2016年山西省高等学校教学改革创新项目 (J2016003);2016年山西省研究生教育改革研究课题(2016JG26);山西省重点研发计划(一般项目)(201603D221004-4)。
TS201.1
:B
:1002-0306(2017)12-0264-07
10.13386/j.issn1002-0306.2017.12.048
