响应面法优化海湾扇贝壳赖氨酸螯合钙的制备工艺
2017-07-05,,,,,
,,, ,,
(河北农业大学食品科技学院,河北保定 071000)
响应面法优化海湾扇贝壳赖氨酸螯合钙的制备工艺
李云姣,陈杨扬,侯宝岩,霍超,杜佳峰,桑亚新*
(河北农业大学食品科技学院,河北保定 071000)
为提高废弃扇贝壳的利用率,对扇贝壳制备赖氨酸螯合钙的工艺进行研究。以海湾扇贝壳和L-赖氨酸为原料,在一定条件下制备赖氨酸螯合钙,考察了反应温度、时间、L-赖氨酸与Ca2+摩尔比例和pH对螯合产率的影响。在单因素的基础上进行响应面实验,确定螯合工艺为:反应温度63.4 ℃,反应时间34.0 min,L-赖氨酸与Ca2+摩尔比例2.1∶1,pH为8.4。在此最优条件下,获得的产品螯合产率为82.16%,螯合物中的钙含量为9.58%。傅里叶红外光谱显示钙离子与L-赖氨酸发生了螯合反应,形成了Ca-N键和Ca-O键,有赖氨酸螯合钙的生成。
海湾扇贝壳,L-赖氨酸螯合钙,工艺优化,响应面法
海湾扇贝营养丰富、肉质鲜美,壳、肉、珍珠层具有极高的利用价值,是我国重要的经济海产品之一。河北省已成长为我国海湾扇贝的第二大主产区,2012年海湾扇贝产量高达29.6万吨[1]。而扇贝壳作为扇贝加工的副产物经常会被废弃,在浪费资源的同时还污染了环境,贝壳污染成为沿海地区不容忽视的环境问题。扇贝壳中矿物质含量丰富,其中碳酸钙含量在90%以上,是一种良好的天然钙来源[2]。
钙是人体维持健康必不可少的元素之一,在维持骨骼矿物化和硬度以及正常生理活动方面起着重要作用[3]。缺钙可能会导致骨质疏松症等,摄入适量的钙元素则可以增加儿童骨密度,预防中老年的骨质疏松症[4-6]。目前钙的缺乏已经成为十分普遍的现象,因此选择合理有效的补钙制剂对预防钙缺乏有着重要意义。国内补钙制剂种类繁多,碳酸钙等无机钙仍占据主导地位,但其存在着溶解度低、生物活性差的缺陷[7],以可溶性有机钙为主的氨基酸螯合钙,如谷氨酸螯合钙、复合氨基酸螯合钙等已成为学者们研究的热点之一。L-赖氨酸又称第一必需氨基酸,在生物机体代谢过程中扮演着重要的角色,具有促进食欲、参与疾病的治疗等作用,现今已被广泛应用于食品、医药等行业[8-9]。氨基酸螯合钙作为新一代补钙试剂,具有稳定性好、吸收率高、生物效价高等优点,对机体补充钙元素的同时还起到补充氨基酸的作用[10-12]。
因此,本实验利用生物钙源——海湾扇贝壳和L-赖氨酸为原料,以螯合率为指标,研究、优化赖氨酸螯合钙的制备工艺,并通过红外光谱法对赖氨酸螯合钙进行表征。旨在探寻一种合理的工艺使扇贝壳中的钙源与L-赖氨酸进行配位螯合,为废弃贝壳污染资源的再利用提供新的思路。
1 材料与方法
1.1材料与仪器
海湾扇贝壳 购自河北省秦皇岛市当地水产市场;L-赖氨酸盐酸盐 张家港华昌药业有限公司;钙元素标准溶液 国家有色金属电子材料测试分析中心;其余试剂 均为国产分析纯。
Spectrum 65傅里叶红外光谱仪 美国PerkinElmer公司;FA2004电子天平 北京赛多利仪器有限公司;QE-100中药材粉碎机 浙江屹立工贸有限公司;RE-52B温控旋转蒸发仪 上海亚荣仪器厂;101-A电热恒温鼓风干燥箱 天津泰斯仪器有限公司;JS-XL-1马弗炉 鹤壁山金仪器设备有限公司;ROTANTA 460 R高速离心机 德国海蒂诗科技有限公司;DF-102S磁力搅拌器 上海长青仪器厂;TAS-990型原子吸收分光光度计 北京普析通用有限责任公司;电热炉 北京中伟兴业仪器有限公司。
1.2实验方法
1.2.1 钙源溶液的制备 将清洗后的扇贝壳烘干、粉碎,在马弗炉中1000 ℃灰化3 h,在干燥器中保存备用。灰分用浓度为3%的HCl溶液处理得到CaCl2溶液。
1.2.2 含水量的测定 扇贝壳灰分中水分含量的测定参照《GB 5009.3-2010食品中水分的测定》中固体试样水分含量的测定方法,采用直接干燥法进行测定[13]。
1.2.3 扇贝壳灰分和赖氨酸螯合钙中含钙量的测定 扇贝壳灰分和赖氨酸螯合钙中含钙量的测定分别参照《GB/T 6436-2002饲料中钙的测定》以及《GB/T 5009.92-2003 食品中钙的测定》中相关规定,通过原子吸收分光光度法进行测定[14-15]。
1.2.4 赖氨酸螯合钙螯合产率的计算 使用原子吸收分光光度法对螯合钙产品中的含钙量进行测定。赖氨酸螯合钙产品的螯合产率计算公式如下所示:

式中:X-赖氨酸螯合钙产品的螯合产率(%);m1-螯合态钙元素的质量,(mg);m0-灰分中可螯合钙元素的总质量,(mg)。
1.2.5 工艺流程

1.2.6 单因素实验 根据相关文献资料报道[16],在水体系中利用水相合成法制备氨基酸螯合物时,影响反应进行以及产物稳定性和纯净度的主要因素有反应温度、反应时间、物料摩尔比和体系pH。本实验围绕以上4个主要影响螯合反应进行的因素进行单因素实验。
1.2.6.1 反应温度对螯合产率的影响 本实验选择30、40、50、60、70 ℃五种反应温度,反应时间定为30 min,体系pH保持为8,L-lys与Ca2+的摩尔比设定为2∶1。在以上条件下进行螯合反应,最后分别计算每种反应温度下的螯合产率,从而确定最佳反应温度。
1.2.6.2 反应时间对螯合产率的影响 本实验选择20、30、40、50、60 min五种反应时间,反应温度设定为60 ℃,体系pH保持为8,L-lys与Ca2+的摩尔比设定为2∶1。在以上条件下进行螯合反应,最后分别计算每种反应时间下的螯合产率,从而确定最佳反应时间。
1.2.6.3 摩尔比对螯合产率的影响 本实验选择1∶1、3∶2、2∶1、5∶2、3∶1五种物料摩尔比,反应温度设定为60 ℃,反应时间控制在30 min,体系pH调到8。在以上条件下进行螯合反应,最后分别计算每种物料摩尔比下的螯合产率,从而确定最佳的物料摩尔比。
1.2.6.4 pH对螯合产率的影响 本实验选择5、6、7、8、9五种体系pH,反应温度设定为60 ℃,反应时间控制在30 min,L-lys与Ca2+的摩尔比设定为2∶1。在以上条件下进行螯合反应,最后分别计算每种体系pH下的螯合产率,从而确定最佳体系pH。
1.2.6.5 响应面优化实验 本实验根据单因素实验结果,依据Box-Behnken中心组合的原理进行设计,选取反应温度、反应时间、物料摩尔比和体系pH4个因素为自变量,以螯合产率为响应值,共设计出4因素3水平29组实验。目的是研究所选因素对赖氨酸螯合钙产品螯合产率的综合影响,因素设计编码及各自变量水平见表1。

表1 响应曲面实验设计水平及因素编码Table1 Factors,codes and levels of response surface design
1.2.7 红外光谱分析 取赖氨酸螯合钙以及L-赖氨酸用KBr压片法测定两者在400~4000 cm-1的红外光谱,比较其中差异。
1.3数据处理

2 结果与分析
2.1单一因素对赖氨酸钙螯合产率的影响
2.1.1 反应温度对赖氨酸钙螯合产率的影响 如图1所示,赖氨酸螯合钙的螯合产率随着反应温度的升高,呈先升高后降低的趋势。在反应温度接近60 ℃时,产品的螯合产率比较理想。从图中可以得知,当反应温度比较低时,螯合反应的速率较低,反应程度也较小,产品的螯合产率也随之降低;当温度逐渐升高的时候,增加了分子间的碰撞,加快了反应速率,产品的螯合产率自然会随之升高[17]。但当温度过高时,会加剧氢氧化钙沉淀的速率,导致螯合反应中的配位过程不能有效完成,产品的螯合产率较60 ℃时稍有降低。所以,当反应温度保持在50~70 ℃时,比较有利于螯合反应的顺利进行。

图1 反应温度对赖氨酸钙螯合产率的影响Fig.1 Effect of reaction temperature on the yield of calcium-lysine chelate
2.1.2 反应时间对赖氨酸钙螯合产率的影响 如图2所示,赖氨酸螯合钙的螯合产率随着温度的升高,呈现着先升高后趋于平缓的趋势。在反应时间接近30 min时,产品的螯合产率最高。从图中可以得知,在反应时间较短时,螯合反应因无法彻底完成而致使产品的螯合产率处于较低水平;随着时间的推移,螯合反应完成得越来越充分,产品的螯合产率也会越来越高;但如果反应时间过长,产品的螯合产率不但没有升高,反而略有下降,这可能是由于当螯合反应彻底完成时,继续加热搅拌会造成部分螯合物的降解,使得产品的螯合产率略有下降[18]。所以,当反应20~40 min时,不仅节约资源,而且更有利于螯合反应充分进行。

图2 反应时间对赖氨酸钙螯合产率的影响Fig.2 Effect of reaction time on the yield of calcium-lysine chelate
2.1.3 物料摩尔比对赖氨酸钙螯合产率的影响 如图3所示,赖氨酸螯合钙的螯合产率随着L-赖氨酸与Ca2+摩尔比的升高,呈现着先升高后下降的趋势。在L-赖氨酸与Ca2+摩尔比为2∶1左右时,产品的螯合产率存在着最大值。由图可知,1∶1的物料摩尔比使得产品的螯合产率很低,只有20%左右,这是由于此时L-赖氨酸含量过少,无法与Ca2+完全配位,导致部分Ca2+无法被充分利用,过量的Ca2+容易加速氢氧化物沉淀的生成,螯合产率处于较低的水平;当L-赖氨酸与Ca2+摩尔比超过2∶1时,产品的螯合产率略有下降,可能由于过量的L-赖氨酸不利于配位反应的发生,而且L-赖氨酸与Ca2+摩尔比过高还会造成资源的浪费[19]。所以,当L-赖氨酸与Ca2+摩尔比为3∶2~5∶2时较为合理,可以获得理想的螯合产率。
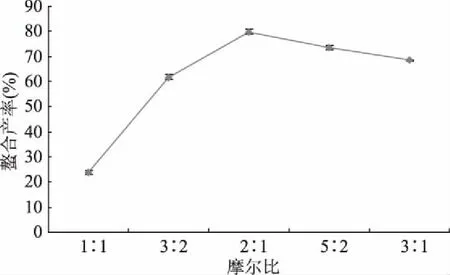
图3 摩尔比例对赖氨酸钙螯合产率的影响Fig.3 Effect of molar ratio on the yield of calcium-lysine chelate

图4 pH对赖氨酸钙螯合产率的影响Fig.4 Effect of pH value on the yield of calcium-lysine chelate


表2 响应面实验设计及结果Table 2 Design and results of response surface experiments

表3 响应面实验结果方差分析Table 3 Variance analysis of response surface experiments
注:**表示差异极显著(p<0.01),*表示差异显著(p<0.05)。
2.2工艺参数的确定
2.2.1 响应面优化实验结果 利用Design-Expert 8.0.5.1软件,将表2中的实验数据进行多元回归拟合,得到的二次多项回归方程为:
Y=79.46+2.34A+3.29B+5.92C+4.07D+0.12AB-0.81AC-0.082AD-1.54BC+0.60BD-1.06CD-3.16A2-4.03B2-10.14C2-5.41D2
p值的高低表明了各个考察因素及模型的显著水平。如果p值小于0.05,表明了模型或各因素存在着显著性影响;如果p值小于0.01,表明了模型或各因素存在着极显著性差异[22]。由表3可知,以赖氨酸螯合钙的螯合产率为响应值时,模型p<0.0001,说明本研究的模型极显著。同时,失拟项=0.1262>0.1000,表明本实验结果与所建立的数学模型拟合度较好。多元拟合系数为R2=99.28%,预测R2=96.15%,调整R2=98.55%,说明该模型能解释98.55%的响应值的变化。CV值为1.30%,表明模型方程能够很好地确保实验值的真实性,具有比较高的置信度。综上所述,本实验模型建立较为理想,可用于赖氨酸螯合钙最佳螯合产率的探索和最优制备工艺的模拟估算。
另由表3得出,C(摩尔比)>D(pH)>B(反应时间)>A(反应温度),一次项中A、B、C、D、二次项中A2、B2、C2、D2及交互作用BC对赖氨酸螯合钙的螯合产率具有极显著(p<0.01)的影响;交互作用CD对赖氨酸螯合钙的螯合产率具有显著(p<0.05)影响;其他交互项对赖氨酸螯合钙的螯合产率的影响不显著。
2.2.2 多因素交互作用响应曲面图分析 从图5中可得结论,当反应温度与pH保持恒定时,随着反应时间的进行,螯合钙的螯合产率先升高后降低,随着L-赖氨酸与Ca2+摩尔比的增大,螯合钙的螯合产率先增大后减小。从等高线图中可以看出,反应时间与摩尔比的交互作用对螯合钙的螯合产率的影响为极显著。

图5 反应时间与摩尔比例对螯合产率影响的等高线和响应曲面图Fig.5 Response surface and contour diagram for the effect of reaction time and molar ratio on the yield of calcium-lysine chelate
从图6中可以看出,当反应温度和反应时间一定时,随着L-赖氨酸与Ca2+摩尔比的增大,螯合钙的螯合产率表现出先升高后降低的趋势,随着体系pH的升高,螯合钙的螯合产率先增加后减小。从等高线图中可以看出,摩尔比与pH的交互作用对螯合钙的螯合产率的影响较为显著。

图6 摩尔比例与pH对螯合产率影响的等高线和响应曲面图Fig.6 Response surface and contour diagram for the effect of molar ratio and pH value on the yield of calcium-lysine chelate
2.2.3 响应面结果及检验 通过对响应面的曲面图以及等高线图的分析,Design-Expert软件预测出的赖氨酸螯合钙理论的最佳制备工艺条件为:反应温度63.4 ℃、反应时间34.0 min、L-赖氨酸与Ca2+摩尔比2.1∶1、体系pH为8.4,其赖氨酸螯合钙的螯合产率预测值为81.95%。进行验证实验,做3次重复,测的赖氨酸螯合钙的螯合产率为82.16%,与预测值基本相符,表明该模型方程与实际情况的拟合度较好,说明赖氨酸螯合钙制备的工艺条件优化通过响应面法是可行的。
2.3赖氨酸螯合钙成品含钙量的检测
根据实验方法中所列出的赖氨酸螯合钙中含钙量的测定方法,进行检测实验,结果表明赖氨酸螯合钙中含钙量为9.58(g/100 g),按百分比计即为9.58%。
2.4红外光谱分析
用溴化钾作为分散剂,分别对L-赖氨酸和赖氨酸螯合钙样品进行红外光谱分析,结果如图7和图8所示。
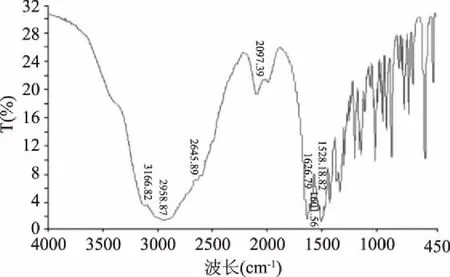
图7 L-赖氨酸的红外扫描图谱Fig.7 Infrared spectral analysis of L-lysine

图8 赖氨酸螯合钙的红外扫描图谱Fig.8 Infrared spectral analysis of calcium-lysine chelate
由L-赖氨酸的红外光谱可见,在特征区,3166.82 nm-1处存在着的伸缩振动单峰为-NH2振动峰;在指纹区,C=O的吸收峰在1626.79 nm-1处,-COO-的吸收峰在1528.18 nm-1处。以上结果证明了在L-赖氨酸中-NH2和-COOH的存在。通过比较赖氨酸螯合钙的红外光谱可见,在特征区,-NH2的吸收峰在形成螯合物之后发生了明显的位移,移动到了3415.46 nm-1,可以说明在L-赖氨酸中的-NH2键发生了明显的化学反应,其中的N原子参与了配位;在指纹区,C=O的吸收峰红移至1582.44 nm-1处,-COO-的吸收峰红移至1453.28 nm-1处,可以表明-COOH也参与到了反应之中[23]。发现-NH2和-COOH的吸收峰都发生了明显的位移,可以得出L-赖氨酸中氨基上的N原子和羧基上的O原子均参与了反应,所得反应产物确实为赖氨酸螯合钙的结论。在赖氨酸螯合钙的红外图谱中,3003.04 nm-1处的吸收峰是-OH的吸收峰,出现在506.02 nm-1和421.35 nm-1处出现了新的振动吸收峰,说明L-赖氨酸与Ca2+形成了Ca-N键和Ca-O键,进一步证明了赖氨酸螯合钙的生成[24]。有较宽的吸收峰出现在了3400 nm-1左右,表明螯合物中或许有水分子的存在。以上结果进一步证明了反应产物确实为赖氨酸螯合钙。
3 结论
以废弃的海湾扇贝壳和赖氨酸盐酸盐为原料制备赖氨酸螯合钙,根据单因素实验结果利用响应面分析其最优制备工艺:反应温度63.4 ℃、反应时间34.0 min、物料摩尔比2.1∶1、pH为8.4。在此条件下,螯合产率可达到82.16%,此时含钙量为9.58%。通过对L-赖氨酸和赖氨酸螯合钙进行红外扫描,结果表明:经过螯合反应之后,赖氨酸螯合钙的氨基和羧基的特征峰都发生了明显位移,表明L-赖氨酸中氨基和羧基都参与了化学反应,另外在指纹区出现的新的振动吸收峰说明有Ca-N键和Ca-O键的形成。红外光谱分析结果证明了赖氨酸螯合钙的生成,课题组接下来将研究赖氨酸螯合钙对大鼠骨密度的影响。
[1]孙桂清,赵振良,穆珂馨,等. 龙须菜与海湾扇贝多营养层次综合养殖技术研究[J]. 河北渔业,2015(12):27-30.
[2]桑亚新,王昌禄,王苏,等. 利用扇贝壳制备胶原螯合钙的研究[J]. 中国食品学报,2012,12(5):49-55.
[3]De A D,Dias M R,Mb D A B,et al. Calcium intake by
adolescents-a population-based health survey[J]. Jornal De Pediatria,2016,92(3):251-259.
[4]Osborne C G,Mctyre R B,Dudek J,et al. Evidence for the Relationship of Calcium to Blood Pressure[J]. Nutrition Reviews,1996,54(12):365-381.
[5]Cilla A,Lagarda M J,Alegría A,et al. Effect of processing and food matrix on calcium and phosphorous bioavailability from milk-based fruit beverages in Caco-2 cells[J]. Food Research International,2011,44(9):3030-3038.
[6]Zhao L,Huang S,Cai X,et al. A specific peptide with calcium chelating capacity isolated from whey protein hydrolysate[J]. Journal of Functional Foods,2014,10(3):46-53.
[7]丛琳,路国红. 钙制剂正确选择及合理应用[J]. 中国现代药物应用,2010,4(2):128.
[8]马同江,杨冠丰. 新编食品添加剂手册[M]. 第一版. 北京:农村读物出版社,1989:15.
[9]麦加保. 国产L-赖氨酸寻求新用途[J]. 精细与专用化学品,2001(18):3-5.
[10]薛荣涛,李翠芹,何腊平. 复合氨基酸螯合钙的研究进展[J]. 食品工业科技,2014,35(21):390-394.
[11]胡荣,马宇熙,陈铮,等. 鸡蛋壳制备的谷氨酸螯合钙片剂配方及工艺研究[J]. 食品工业科技,2016,37(7):258-262.
[12]Ashmead H D. The absorption and metabolism of iron amino acid chelate.[J]. Archivos Latinoamericanos De Nutrición,2001,51(Suppl 1):13-21.
[13]中华人民共和国卫生部.GB5009.3-2010食品中水分的测定[S]. 北京:中国标准出版社,2010.
[14]中华人民共和国国家质量监督检验检疫总局.GB/T6436-2002饲料中钙的测定[S]. 北京:中国标准出版社,2002.
[15]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.92-2003食品中钙的测定[S]. 北京:中国标准出版社,2003.
[16]李健,徐忠. 复合氨基酸微量元素络合盐的制备工艺研究[J]. 中国粮油学报,2001,16(3):38-41.
[17]管海跃. 甘氨酸微量元素螯合物的合成与表征研究[D]. 浙江:浙江大学,2007.
[18]杜冰,蔡巽楷,谢伊澄,等. 蛋壳粉制备氨基酸螯合钙工艺优化[J]. 食品工业科技,2011(4):287-289.
[19]张祥麟. 络合物化学[M]. 北京:冶金工业,1979:53.
[20]魏凌云,钱建强,魏鹏,等. 谷氨酸螯合钙的合成条件研究[J]. 氨基酸和生物资源,2009,31(3):43-46.
[21]朱迎春,黄素珍. 复合氨基酸螯合钙的开发研制[J]. 山西农业大学学报:自然科学版,2009,29(2):173-177.
[22]林建原,季丽红. 响应面优化银杏叶中黄酮的提取工艺[J]. 中国食品学报,2013,13(2):83-90.
[23]胡振珠. 复合氨基酸螯合钙的制备工艺及其抗氧化特性研究[D]. 上海:上海海洋大学,2011.
[24]郭艳. 水解米渣蛋白及制备氨基酸螯合钙的工艺研究[D]. 成都:四川大学,2006.
Optimizationofpreparationofcalcium-lysinechelatefrombayscallopshellbyresponsesurfacemethod
LIYun-jiao,CHENYang-yang,HOUBao-yan,HUOChao,DUJia-feng,SANGYa-xin*
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,China)
In order to increase utilization of waste bay scallop shell,the preparation technology of calcium-lysine chelate from scallop shell was studied. Calcium chelating calcium was prepared from scallop shell and L-lysine under certain conditions. The effects of reaction temperature,time,L-lysine and Ca2+molar ratio and pH value on chelate yield were investigated to determine reasonable preparation process. Response surface test was carried out on the basis of single factor experiment,and the chelating process was determined as follows-reaction temperature was 63.4 ℃,reaction time was 34.0 min,the molar ratio of L-lysine and Ca2+was 2.1∶1,pH value was 8.4. Under the optimum conditions,the chelate yield of product was 82.16%,and the calcium content in chelate was about 9.58%. Fourier transform infrared spectroscopy showed that calcium ions and L-lysine chelate reaction occured,formed Ca-N bond and Ca-O bond,and produced calcium-lysine chelate.
bay scallop shell;calcium-L-lysine chelate;process optimization;response surface method
2017-01-03
李云姣(1989-),女,硕士研究生,研究方向:食品生物技术,E-mail:liyunjiao0221@163.com。
*通讯作者:桑亚新(1972-),男,博士,教授,研究方向:农产品加工和食品微生物,E-mail:sangyaxin@sina.com。
河北省科技支撑计划科研专项(16227109D);国家公益性行业科研专项(201205031)。
TS255.4
:B
:1002-0306(2017)12-0248-06
10.13386/j.issn1002-0306.2017.12.045
