植物乳杆菌发酵对金枪鱼碎肉酶解液挥发性物质的影响
2017-07-05,,
,,
(宁波大学海洋学院,浙江宁波 315211)
植物乳杆菌发酵对金枪鱼碎肉酶解液挥发性物质的影响
汤玉洁,吕佳昀,李晔*
(宁波大学海洋学院,浙江宁波 315211)
金枪鱼主要用于生鱼片、鱼柳、鱼排和各类鱼罐头等产品的加工,加工过程中会产生下脚料,这些下脚料腥味较重,风味不佳,多被加工成饲料处理,经济价值较低。鉴于此,本实验研究植物乳杆菌发酵对金枪鱼碎肉风味的改善作用,利用电子鼻和气质联用(GC-MS)分别检测了金枪鱼碎肉酶解液未发酵以及发酵不同时间的风味变化情况。结果发现,植物乳杆菌发酵金枪鱼碎肉酶解液中呈腥味的乙醛未发酵时含量为11.51%,发酵72 h后含量低至检测限下;呋喃类低阈值且具有良好风味的化合物未发酵时含量为0.68%,发酵48 h达到最大含量5.31%。研究结果为金枪鱼下脚料的综合利用以及高值化利用提供了理论基础。
金枪鱼,酶解液,植物乳杆菌,电子鼻,GC-MS
金枪鱼类(tuna)是硬骨鱼纲(Osteichthyes)鲈形目(Pereiformes)鲭(Scombridae)鱼类中具有胸甲(指胸区和侧线前部明显扩大的鳞片)的几个属的鱼类的统称[1-2]。它们生活在海洋中上层水域,主要分布于太平洋、大西洋和印度洋的热带、亚热带和温带水域,我国东海、南海也有分布,属于大洋暖水性洄游鱼类[3],其肉质鲜红,营养丰富,具有低脂肪、低能量、高蛋白的特点[4-5]。
金枪鱼在加工生产过程中会产生大量的碎肉,约占原料鱼的11%[6]。尽管这些碎肉富含蛋白质和不饱和脂肪酸,但由于具有较大腥味,口感不佳,所以难以被高值化利用。目前有将金枪鱼碎肉通过凝胶化形成凝胶体,生产鱼丸、鱼香肠、鱼松等鱼糜制品[7]。还有将金枪鱼碎肉组织重组化,粘结成型后制成新型鱼肉加工制品[8]。另外还有通过水解产生活性肽[9],但由于其不良的风味阻碍了进一步的产品开发和利用。为了高值化地利用这部分优质蛋白质资源,对其风味的改良是非常重要的研究内容。
植物乳杆菌(Lactobacillusplantarum)是一种乳酸杆菌,革兰氏阳性菌,最适生长温度为30~35 ℃,兼性厌氧,最适生长pH为6.5左右[10]。植物乳杆菌是人体胃肠道的益生菌群,属于同型发酵乳酸菌,能代谢产生有机酸、过氧化氢、双乙酰和细菌素等物质,这些物质能够抑制病原菌和腐败菌。同时植物乳杆菌在食品中,尤其在酸性发酵食品中的应用也很广泛[11]。
植物乳杆菌发酵可促进鱼肉中的蛋白质水解提高水溶蛋白、水溶性固形物和总酸含量,产生大量氨基酸,改善整体感官品质[12]。已有研究表明,接种植物乳杆菌的风干香肠具有浓郁的芳香味[13]。金枪鱼生肉中含有较多的腥味成分:乙醛、辛醛、壬醛、1-辛烯-3-醇、1,5-辛二烯-3-醇[14],利用植物乳杆菌发酵后可形成多种呈味物质,有助于去除腥味[15]。
本实验利用电子鼻和GC-MS研究经过不同时间发酵的金枪鱼碎肉酶解液的挥发性物质种类及含量的变化情况,旨在为金枪鱼碎肉的开发利用提供理论基础。
1 材料与方法
1.1材料与仪器
金枪鱼碎肉 取自宁波今日食品有限公司;植物乳杆菌 由本实验从泡菜中分离鉴定获得,其鉴定号为JX025073.1;动物蛋白酶(酶活力100 U/mg)、风味水解酶(酶活力20 U/mg)及其他化学试剂 购自宁波镇海百川生物科技有限公司,均为试剂纯。
立式高压灭菌锅 上海申安医疗器械厂;QHZ-12A组合式恒温振荡培养箱 江苏省太仓市华美生化仪器厂;PEN3 便携式电子鼻 德国Airsense公司;65 μm PDMS萃取头 美国Agilent公司;7890/M7-80EI型GC-MS 北京普析通用仪器有限责任公司。
1.2实验方法
1.2.1 碎肉酶解 金枪鱼肉用绞肉机进行碎化处理,称取250 g置于1000 mL烧杯中,再加入2.5 g动物蛋白酶,2.5 g风味水解酶以及375 g蒸馏水,用玻璃棒搅拌均匀后置于恒温水浴锅在55 ℃条件下水浴加热6 h,之后水浴锅升温到100 ℃灭酶处理15 min,得到金枪鱼碎肉酶解液。
1.2.2 植物乳杆菌菌液制备 植物乳杆菌接种于MRS培养基(96%的MRS肉汤培养基加2%的吐温),37 ℃,100 r/min,摇床培养20 h获得植物乳杆菌菌液。
1.2.3 样品制备 在金枪鱼酶解液中加入3%的植物乳杆菌菌液,于37 ℃进行发酵处理,分别于发酵0、12、24、36、48、60和72 h,取酶解液样品。未加菌液的酶解液作为对照,取0.2 g样品置于15 mL螺纹口样品瓶中,每组5个重复,用于电子鼻和GC-MS检测。
1.2.4 电子鼻测定 利用电子鼻对数据进行测量和分析。电子鼻与计算机连接,打开电源,启动WinMuster软件,检测条件:测试时间180 s,传感器清洗时间150 s[16-17]。通过LDA方法对电子鼻数据进行分析。
1.2.5 GC-MS测定 固相微萃取条件:将萃取头置于气相色谱的进样口在250 ℃温度下老化30 min。GC-MS参数设置完成后,将萃取头插入样品瓶于60 ℃水浴吸附30 min,接着移进气质联用仪,进样口220 ℃解吸2 min,然后启动气质联用仪采集数据。色谱条件:He作为载气,1 mL/min流速;采用不分流模式进样,进样口温度以及传输线温度均为220 ℃。程序升温:起始柱温50 ℃,以5 ℃/min升至200 ℃后保留5 min,然后以10 ℃/min升至250 ℃后保持2 min。质谱条件:电子轰击源(EI)是离子源,电离电压为70 eV,离子源温度为230 ℃,扫描范围45~400 u[18-19]。
2 结果与分析
2.1植物乳杆菌的发酵时间对金枪鱼酶解液气味的影响
图1为金枪鱼酶解液在不同发酵时间下气味的LDA分析图,第一主成分贡献率为83.897%,第二主成分贡献率为5.966%,总贡献率为89.863%。不同发酵时间的样品之间没有重叠,表明所有样品之间的气味存在较大差异。由此可知,随着植物乳杆菌发酵时间的变化,金枪鱼酶解液的气味发生相应的改变。

图1 不同发酵时间条件下金枪鱼酶解液气味的LDA分析Fig.1 LDA of flavor in enzymatic hydrolysate of tuna meat at different fermentation time
2.2发酵时间对金枪鱼酶解液挥发性物质组成的影响
不同发酵时间的金枪鱼酶解液挥发性物质组成的GC-MS鉴定结果见表1。
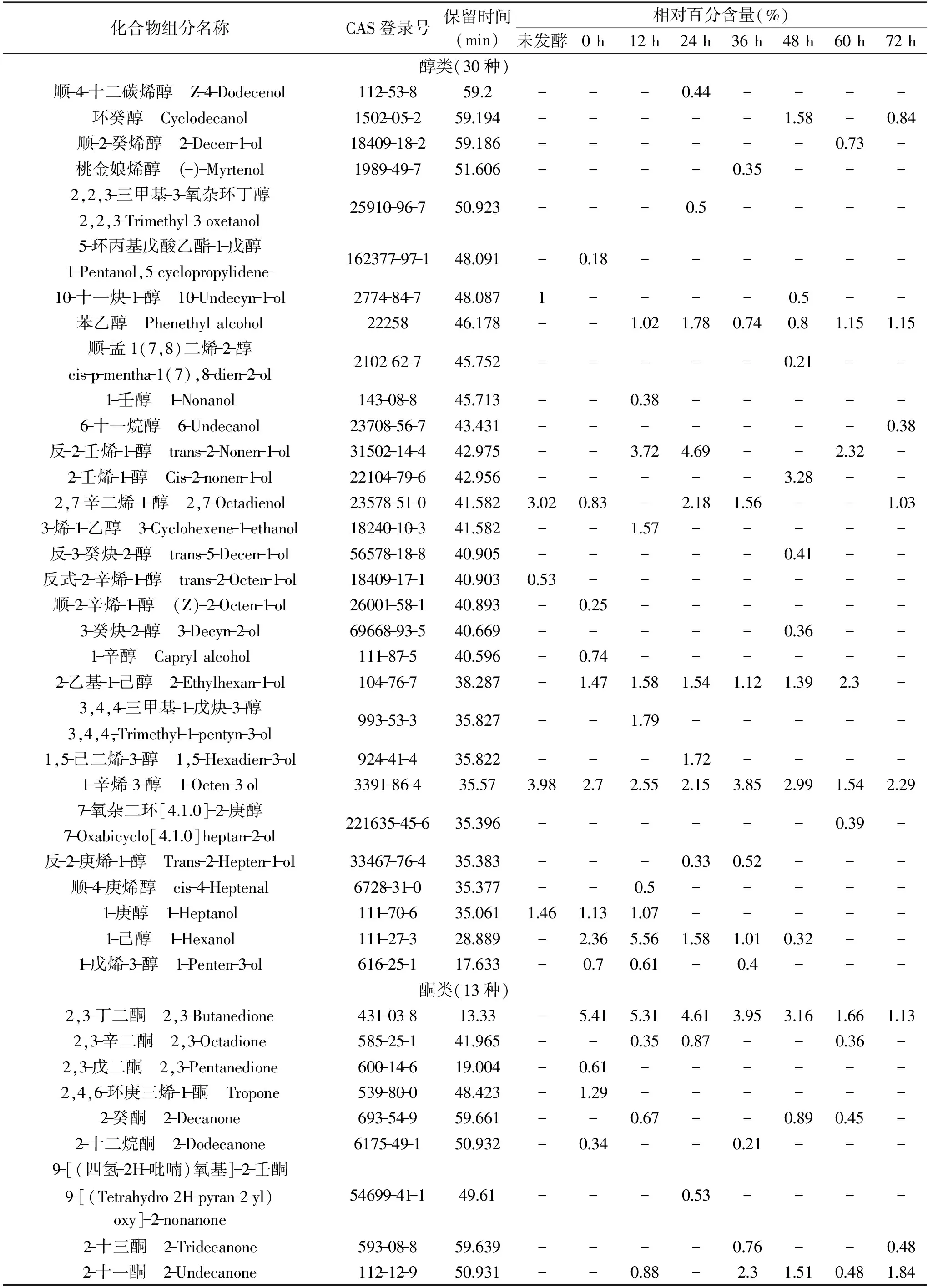
表1 不同发酵时间下的酶解液挥发性成分组成Table 1 Volatiles components in enzymatic hydrolysate of tuna meat at different fermentation time
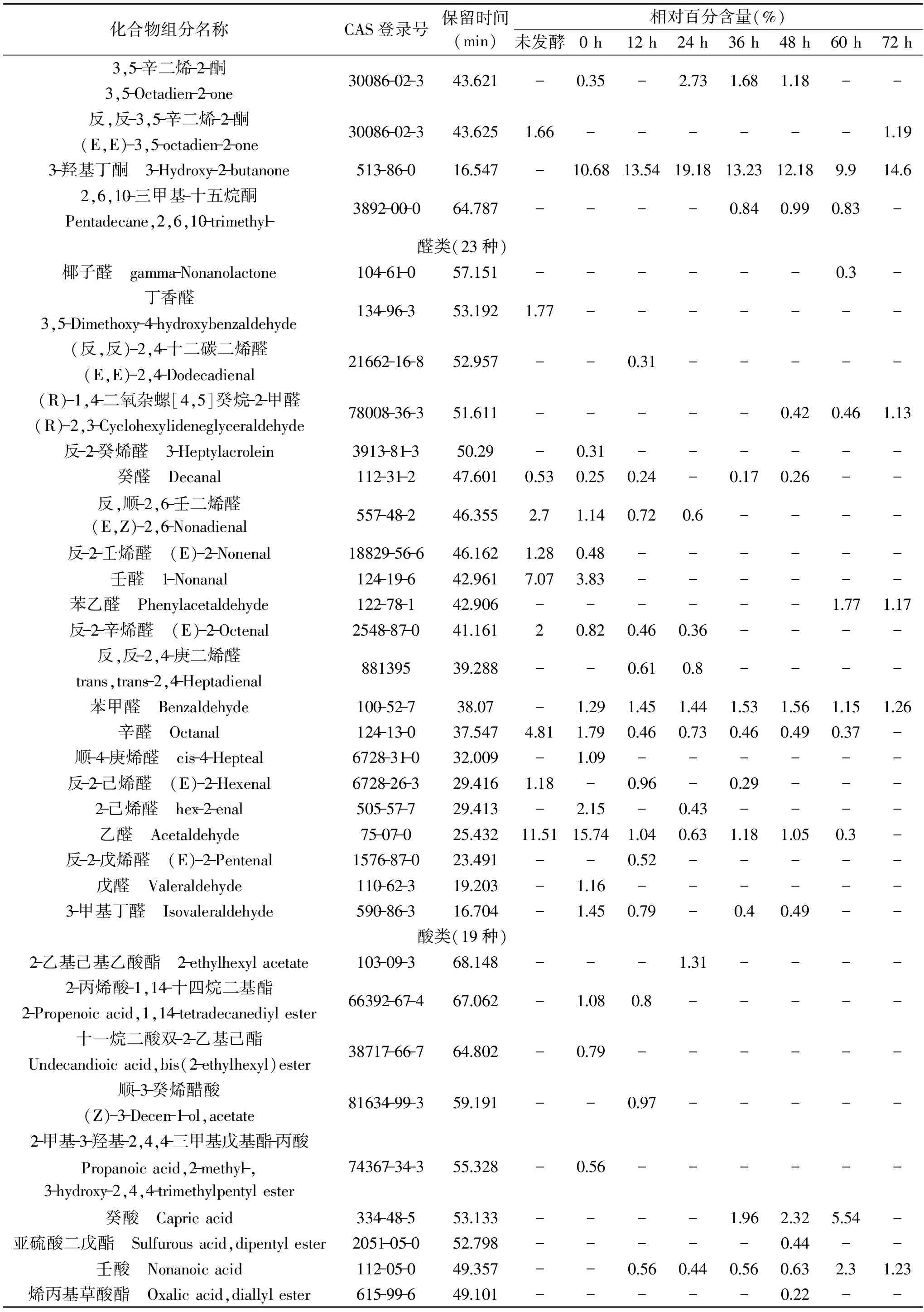
续表

续表

续表
共鉴定出142种化合物:醇类30种,酮类13种,醛类23种,酸类19种,酯类6种,碳氢类43种,其它8种。其中不同发酵时间检测出的化合物分别为:未发酵24种,发酵0 h 51种,12 h 52种,24 h 45种,36 h 48种,48 h 51种,60 h 46种,72 h 48种。
2.2.1 醛类化合物 发酵初期,金枪鱼酶解液中醛类物质占据较大比重,在未发酵和发酵0 h的挥发性物质中均达30%以上,并且,醛类物质阈值较低,多由脂类自动氧化而成,对发酵初期的酶解液风味具有重要作用。发酵初期的醛类物质主要由乙醛、壬醛、辛醛、反,顺-2,6-壬二烯醛等构成,其中的饱和直链醛乙醛、壬醛、辛醛通常呈现令人不愉快的草味和刺激性气味,是金枪鱼碎肉腥臭味的重要来源。顺-4-庚烯醛、反,顺-2,6-壬二烯醛可在鱼肉中呈现出瓜果类香气[14]。随着发酵时间的延长,乙醛、壬醛、辛醛、反,顺-2,6-壬二烯醛等物质的量呈逐渐减少趋势,同时发酵金枪鱼酶解液中产生了苯甲醛等物质。苯甲醛具有令人愉快的杏仁香、坚果香和水果香,对其他风味也具有重要作用[20]。发酵末期,呈不良风味的醛类物质均减少至微量或未检出。
2.2.2 酮类化合物 酮类化合物在未发酵的金枪鱼酶解液挥发性物质中只占1.66%,发酵后酮类化合物含量大量增加,在发酵24 h时达到最大含量27.92%。这些化合物中主要由特定的脂肪氧化酶作用于脂质中的多不饱和脂肪酸衍生而来[21]。酮类化合物阈值远高于醛类化合物,因此对金枪鱼肉风味贡献不大。发酵中后期,产生了2-十一酮等物质,其具有柑橘类、油脂和芸香似香气[20]。
2.2.3 醇类 醇类化合物在发酵12 h时含量达到最高,之后呈逐渐减少的趋势。己醇、庚醇等可能是由于脂肪氧化生成,或者是由一些羰基化合物还原生成的。醇类化合物的阈值较高,但占比较多的非饱和烯醇如1-辛烯-3-醇、2,7-辛二烯-1-醇等对金枪鱼风味影响较大[14]。1-辛烯-3-醇阈值仅为1 μL/μg,且具有蘑菇香、青香、蔬菜香以及油腻的气息[22]。
2.2.4 酸类化合物 酸类物质是变化最明显的一类物质,刚加菌发酵时含量(15.43%)高于原始酶解液酸类物质含量(3.24%),随着发酵时间的变化,酸类物质含量增加显著,最高时达到50%左右,说明发酵过程中生成了大量的酸类物质。酸类物质主要由碳水化合物分解产生,也有可能由氨基酸代谢生成[23]。乙酸等短链脂肪酸具有强烈的酸味和奶酪味且阈值很低,发酵金枪鱼碎肉酶解液中的酸味和奶酪味主要是来自这些短链脂肪酸[24]。
2.2.5 其他化合物 其他化合物主要由碳氢类、酯类、呋喃类化合物构成。碳氢类化合物共检测出43种,在金枪鱼发酵酶解液中占比重较大,但碳氢类化合物阈值较高,因此对金枪鱼酶解液整体风味贡献不大;呋喃类化合物含量很少,其中的2-乙基呋喃和反式-(戊烯-2-基)呋喃经发酵后含量增加,2-乙基呋喃具有强烈的焦香气味和极低的阈值,可能对金枪鱼酶解液的整体风味具有较大影响。发酵72 h大量甲氧基苯基肟被检出,甲氧基苯基肟具有霉味和肉香[25]。
2.3主体挥发性物质
由图2可知,不同发酵时间(包括未加菌酶解液)金枪鱼酶解液的挥发性物质发生较大变化:醇类含量呈波动变化;酮类初始含量为1.66%,加菌发酵后含量增加,24 h后达到最大值36.63%;醛类未加菌时含量为34.06%,随着发酵时间变化在36 h时减少至0.25%;酸类加菌后含量增加显著,由3.24%增加至56.01%;酯类物质随发酵时间变化含量减少甚至消失;碳氢类随着发酵时间不同而呈现波动变化;其它物质总体加菌后60 h内呈减少趋势,72 h时甲氧基苯基肟大量检出导致其它类物质含量升高。经过植物乳杆菌发酵的金枪鱼碎肉酶解液中主体挥发性物质为酸类、醇类、呋喃类化合物。

图2 不同发酵时间金枪鱼酶解液挥发性物质的组成Fig.2 Comparison of volatiles components in enzymatic hydrolysate of tuna meat at different fermentation time
3 结论
采用电子鼻和顶空固相微萃取-气质联用两种技术,对未经植物乳杆菌发酵以及不同发酵时间条件下,金枪鱼碎肉酶解液的挥发性风味成分进行了检测。电子鼻结果显示,加入植物乳杆菌与未加菌发酵的酶解液气味差异明显且不同发酵时间酶解液气味具有较大差异。采用气质联用方法对不同发酵条件的酶解液的挥发性成分进行鉴定,通过分析可知加入植物乳杆菌发酵的酶解液风味优于未加菌的原始酶解液。
[1]罗殷,王锡昌,刘源.金枪鱼加工及其综合利用现状与展望[J].安徽农业科学,2008,36(27):11997-11998.
[2]张青,王锡昌,刘源.中国金枪鱼渔业现状及发展趋势[J].南方水产,2009,5(1):68-74.
[3]方健民,黄富雄,郑钟新,等.金枪鱼的营养价值和加工利用[J].水产科技,2006,3(2):8-13.
[4]奚春蕊.金枪鱼生鱼片品质变化及快速评价方法建立[D].上海:上海海洋大学,2013.
[5]李桂芬,乐建盛.金枪鱼的营养功效与开发加工[J].食品科技,2003,28(09):41-44.
[6]杜帅.金枪鱼下脚料制备高F值寡肽的工艺及活性研究[D].浙江:浙江海洋学院,2014.
[7]李萌立.杨梦昕,李忠海,等. 加工方式对鱼糜凝胶性质影响研究进展[J].食品工业科技,2015,36(8):370-373.
[8]王新萍.金枪鱼碎肉的酶解与产物改性利用研究[D].浙江:浙江工业大学,2013.
[9]辛建美.酶解金枪鱼碎肉制备活性肽及其分离的研究[D].浙江:浙江海洋学院,2011.
[10]肖仔君,钟瑞敏,陈惠音,等.植物乳杆菌的生理功能与应用[J].中国食品添加剂,2005(2):87-89.
[11]杨永亮.泡菜中植物乳杆菌的分离鉴定及其应用[D].广州:华南理工大学,2013.
[12]谭汝成,欧阳加敏,卢晓莉,等.接种植物乳杆菌和戊糖片球菌发酵对鱼鲊品质的影响[J].食品科学,2007,28(12):268-272.
[13]张兰威,郭清泉,王静,等.植物乳杆菌对成熟过程风干香肠特性的影响[J].食品与机械,2001,31(4):21-22.
[14]王霞,黄健,侯云丹,等.电子鼻结合气相色谱-质谱联用技术术分析黄鳍金枪鱼肉的挥发性成分[J].食品科学,2012,33(12):268-272.
[15]韩姣姣,裘迪红,宋绍华.电子鼻检测植物乳杆菌发酵草鱼中的风味物质[J].食品科学,2012,27(10):208-211.
[16]殷勇,于慧春,孙香丽.无封装条件下牛奶存放质量电子鼻分析[J].农业机械学报,2010,41(3):149-152.
[17]张拥军,何杰民,蒋家新,等.不同处理工艺杨梅果汁风味成分的电子鼻检测[J].农业机械学报,2010,41(12):134-137.
[18]Bianchin J N,Nardini G,Merib J,et al. Screening of volatile compounds in honey using a new sampling strategy combining multiple extraction temperatures in a single assay by HS-SPME-GC-MS[J]. Food Chemistry,2014,145:1061-1065.
[19]Riu-Aumatell M,Miró P,Serra-Cayuela A,et al. Assessment of the aroma profiles of low-alcohol beers using HS-SPME-GC-MS[J]. Food Research International,2014,57:196-202.
[20]焦慧.海鱼及其制品挥发性风味的研究[D].浙江:浙江工商大学,2012.
[21]Refsgaard H H F,Annemette Haahr A,Jensen B. Isolation and Quantification of Volatiles in Fish by Dynamic Headspace Sampling and Mass Spectrometry[J]. Journal of Agricultural & Food Chemistry,1999,47(3):1114-8.
[22]王怡娟,娄永江,陈梨柯.养殖美国红鱼鱼肉中挥发性成分的研究[J].水产科学,2009,28(6):303-307.
[23]Herranz B,Ldela H,Hierro E,et al. Improvement of the sensory properties of dry-fermented sausages by the addition of free amino acids.[J]. Food Chemistry,2005,91(4):673-682.
[24]陈俊卿,王锡昌.固相微萃取与气质联用法分析鱼肉中气味成分[J].广州食品工业科技,2004,20(3):117-118.
[25]孙玉亮,王颉. HS-SPME/GC-MS分析发酵前后扇贝豆酱中的香气成分[C].中国水产学会学术年会,2011:156-159.
EffectofLactobacillusplantarumfermentationonvolatilesubstancesoftunameathydrolysate
TANGYu-jie,LVJia-yun,LIYe*
(School of Marine Sciences,Ningbo University,Ningbo 315211,China)
The tuna is mainly used for processing of raw fish,fish fillets,steaks and a variety of canned fish and other products. A lot of by-product with poor flavor have been produced in this process. Most of them were made into animal feed and have low economic value though they were rich in protein and unsaturated fatty acid. In this study,the effects of lactobacillus fermentation on improvement the flavor of tuna meat were researched. The electronic nose and GC-MS were used to detect the flavor of tuna meat enzyme hydrolysate unfermented and fermented in different time. The results indicated that the content of acetaldehyde in the enzymatic hydrolysate of tuna meat was 11.51%,when the enzyme hydrolysate was fermented by lactobacillus for 72 h,it was under the detection limit,and the content of furan which has low threshold and good flavor was low at 0.68% when the enzyme hydrolysate was unfermented and reached a peak 5.31% of after 48 h fermentation. Our research provided a theoretical basis about how to use of tuna scraps and improve its economic value.
tuna;enzymatic hydrolysate;Lactobacillusplantarum;electronic nose;GC-MS
2016-11-08
汤玉洁(1993-),女,硕士研究生,研究方向:食品科学,E-mail:tangyujie1565@126.com。
*通讯作者:李晔(1980-),女,博士,副教授,研究方向:食品安全/生物与分子生物学,E-mail-liye@nbu.edu.cn。
国家海洋经济创新发展区域示范项目(2013710);浙江省重中之重学科开放基金项目(F01728144200)。
TS254
:A
:1002-0306(2017)12-0200-08
10.13386/j.issn1002-0306.2017.12.037
