红曲霉菌胞外多糖的分离纯化、结构鉴定及抗氧化活性测定
2017-07-05苟小
, , ,, , ,苟小,
(药食同源植物资源开发高校重点实验室,四川抗菌素工业研究所,成都大学,四川成都 610052)
红曲霉菌胞外多糖的分离纯化、结构鉴定及抗氧化活性测定
贾红倩,刘嵬,梁立,郑瑞凤,冉琳,颜军,苟小军,何钢*
(药食同源植物资源开发高校重点实验室,四川抗菌素工业研究所,成都大学,四川成都 610052)
目的:分离纯化红曲霉菌胞外多糖(Exopolysaccharide,EPS),测定各组分的抗氧化活性并对其结构进行初步表征。方法:红曲霉菌发酵液经乙醇沉淀获得胞外多糖,经精制除杂和DEAE-纤维素柱层析法分离纯化获得多糖组分,再分别用高效凝胶过滤色谱法(HPGFC)、柱前衍生PMP-HPLC法测定相对分子质量(Mw)和单糖组成,测定多糖组分清除DPPH和羟自由基的能力,评价其体外抗氧化活性。结果:EPS经分离得到三个组分EPS-1、EPS-2和EPS-3,相对分子质量分别为8673、143537、238742 Da。EPS-1、EPS-2均由甘露糖、鼠李糖、葡萄糖、半乳糖组成,摩尔比为1∶0.301∶2.052∶3.614和1∶2.475∶1.950∶1.532,EPS-3由甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖组成,摩尔比为1∶0.401∶0.066∶0.307∶2.974。三个多糖组分对DPPH·和羟自由基均有清除能力,并与多糖浓度呈现正相关。当多糖浓度为1 mg/mL时,三个组分对DPPH清除率分别为16.4%、15.9%和14.8%;对清除羟自由基的清除率分别为40.4%、39.6%、63.8%。结论:红曲霉菌胞外多糖各组分的相对分子质量和单糖组成比例均有差异;对羟自由基、DPPH·的清除作用也存在差异,这种活性差异可能与各组分Mw及结构差异相关。
红曲霉菌,胞外多糖,分离纯化,单糖组成,抗氧化活性
真菌胞外多糖是真菌的次级代谢产物,是真菌在液态培养过程中分泌到细胞外的易与菌体分离的水溶性胶质多糖,因其独特的物理学特性,广泛应用于各种食品的增稠、稳定、乳化等。由于真菌胞外多糖的提取无需进行细胞破碎处理,提取工艺简单,目前对其提取和活性的研究日益受到研究者的重视[1]。红曲霉菌(Monascuspurpureus)为散囊菌目子囊菌属曲霉菌科真菌,主要用途为生产降脂药物洛伐他丁以及红曲米等降脂食品,是一种珍贵的药食两用真菌,具有杀菌、防腐、解毒、消食、活血、健脾等功效[2]。
近年来,已有学者对红曲霉菌多糖进行研究,但研究内容集中在多糖的提取工艺优化,以及多糖的抑菌、抗肿瘤、抗氧化等活性的报道[3-8],但缺乏红曲霉菌胞外多糖的组成以及各组分的结构、活性的报道。在前人的研究基础上,通过液体深层发酵获得红曲霉菌胞外多糖,经精制、分离纯化、结构表征、抗氧化活性的初步研究,为红曲霉菌胞外多糖的精细结构解析、构效关系研究和资源合理利用做铺垫。
1 材料与方法
1.1材料与仪器
菌种:红曲霉菌(编号:CGMCC-3.5834) 购自中国微生物菌种保藏委员会普通微生物中心;红曲霉菌液体培养基 葡萄糖50 g,蛋白胨15 g,磷酸氢二钾5 g,硫酸镁2.5 g,水1000 mL,pH自然,121 ℃灭菌20 min;1-苯基-3-甲基-5-吡唑啉酮(PMP)、磷酸二氢钾、氯化钠、氢氧化钠、D-葡萄糖(Glc)、D-阿拉伯糖(Ara)、D-鼠李糖(Rha)、D-半乳糖(Gal)、D-甘露糖(Man)、D-葡萄糖醛酸(GlcUA)、D-(+)-半乳糖醛酸(GalUA)、三氯甲烷、甲醇、浓硫酸、苯酚 分析纯,成都科龙化学试剂公司;标准葡聚糖(DextranT-10,40,70,500,2000) 购自北京索莱宝科技有限公司;乙腈 色谱纯,购自默克公司。
L-1260高效液相色谱仪、DAD-二极管阵列检测器 安捷伦科技有限公司;L-2000液相色谱仪、L-2490示差折光检测器 上海天美科技有限公司;旋转蒸发仪 上海亚荣仪器有限公司;GL-21M 型高速冷冻离心机 湖南湘仪离心机仪器有限公司;FD-1C-55型冻干机 北京博医康实验仪器有限公司;BS-100A自动部分收集器 上海青浦沪西仪器厂;UV-5100B型可见光分光光度仪 上海元析仪器有限公司
1.2实验方法
1.2.1 红曲霉菌胞外多糖的制备 红曲霉菌种子液接种到液体培养基中,25 ℃,180 r/min条件下恒温培养6 d。胞外多糖的制备参考文献方法进行[9-10],发酵液10000 r/min离心10 min,取上清液进行浓缩,加入4倍体积无水乙醇过夜沉淀多糖。10000 r/min离心10 min收集多糖沉淀,沉淀加入适量蒸馏水复溶,10000 r/min离心10 min,除去不溶物质,上清液再用Sevage试剂除蛋白质等杂质直到溶液在280 nm和254 nm处无吸收为止。精制多糖溶液进行真空冷冻干燥备用。
1.2.2 多糖的含量测定 采用徐光域等人改进的苯酚-硫酸法[11]测定多糖含量。以系列标准葡萄糖浓度为横坐标,以490 nm处吸光值为纵坐标制作出标准曲线,将多糖样品吸光值代入回归方程得到红曲霉菌胞外多糖中的单糖浓度,即可测得多糖含量。
1.2.3 红曲霉菌胞外多糖的分离纯化 利用多糖带电荷差异采用阴离子交换方法进行分离。称取精制红曲霉菌胞外多糖冻干样品2.0 g复溶于蒸馏水中,10000 r/min离心10 min,取上清过DEAE-纤维素柱层析,先用蒸馏水洗脱,再用0.1、0.15、0.2 mol/L NaCl溶液各洗脱200 mL,流速2 mL/min,每管5 mL自动部分收集器收集组分,共160管。取每管收集液适量,用硫酸-苯酚法显色检测[11]。以洗脱管数为横坐标,吸光值为纵坐标,绘制洗脱曲线,并分别收集各峰组分,浓缩,冻干。
1.2.4 多糖的分子量测定 采用高效凝胶渗透色谱法(High Performance Gel Permeation Chromatography,HPGPC)测定。色谱条件:色谱柱为YMC PACK-Diol 200 Å(300 mm×8.0 mm ID,S-5 μm,20 nm),流动相为蒸馏水;流速0.8 mL/min,柱温室温;检测器为示差折光检测器;上样量为20 μL。
将系列葡聚糖标准品以及各多糖组分配制成2 mg/mL溶液分别进样分析,记录洗脱峰的保留时间。以葡聚糖标准品分子量的对数值为纵坐标,以保留时间为横坐标得线性回归方程。将各多糖组分的保留时间代入回归方程求得多糖分子量。
1.2.5 单糖组成分析
1.2.5.1 色谱条件 DAD-二极管阵列检测器;XB-C18色谱柱(4.6 mm×150 mm,5 μm);柱温:35.0 ℃;流动相:溶剂A:0.05 mol/L磷酸盐缓冲液(KH2PO4-NaOH,pH6.72);溶剂B:乙腈,时间梯度1~5~10~35~40 min分别为19%~21%~21%~19%;流速:1.0 mL/min;进样量20 μL;检测波长:250 nm。
1.2.5.2 标准单糖的衍生化 按文献方法[12]分别取对照品甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖0.010 g,精密称定,用蒸馏水溶解,转移至10 mL容量瓶定容至刻度,摇匀,即得。取各单糖标准品溶液1 mL于试管中,分别加入1 mL 0.25 mol/L NaOH和1 mL 0.25 mol/L PMP-甲醇溶液,涡旋混匀后70 ℃水浴90 min,冷却至室温。用0.3 mol/L的HCl溶液将pH调至5.6,涡旋混匀,加入2 mL氯仿萃取3次,静置备用。
1.2.5.3 多糖组分的水解及衍生化分析 将红曲霉菌胞外多糖各组分配制成2 mg/mL的多糖溶液,取2 mL于安瓿瓶中,加入0.3 mL 2 mol/L浓硫酸,充氮气密封,110 ℃水解2 h,0.3 mol/L的NaOH中和,离心得上清液,按照1.2.5.2方法衍生后,HPLC进样分析。
1.2.6 红外光谱分析 取红曲霉菌胞外多糖各组分适量,同KBr混合研磨均匀,压片后进行红外光谱分析,扫描范围为400~4000 cm-1。
1.2.7 抗氧化活性的测定
1.2.7.1 羟自由基的清除能力 取不同浓度红曲霉菌胞外多糖溶液1.0 mL,分别加入FeSO4溶液2.0 mL,水杨酸-乙醇1.5 mL,H2O20.1 mL振荡混匀,37 ℃水浴保温30 min,波长510 nm下测量吸光值。以1.0 mL蒸馏水代替多糖溶液测得空白对照吸光值[13]。
清除率(%)=[(A0-As)/A0]×100
式中,A0为空白管的吸光度,As为加入样品后的吸光度。
1.2.7.2 DPPH·的清除能力 取不同浓度红曲霉菌胞外多糖溶液0.1 mL,分别加入3.9 mL 0.1 mmol/L DPPH(95%乙醇配制),涡旋混匀,避光37 ℃反应30 min,高速离心10 min;取0.1 mL纯水,加入3.9 mL 0.1 mmol/L DPPH混匀作空白对照,0.1 mL纯水加3.9 mL 的95%乙醇作参比,混匀后暗处反应30 min,517 nm处测定吸光值[13]。
清除率(%)=(1-As/A0)×100
式中,A0为空白管的吸光度,As为加入样品后的吸光度。
2 结果与分析
2.1葡萄糖标准曲线及多糖含量
由图1可知,葡萄糖在0.2~1.0 mg/mL范围内,浓度与吸光度值线性良好,曲线方程Y=0.7344X-0.0127,r=0.9993(Y为吸光度值,X为葡萄糖浓度,mg/mL)。

图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
红曲霉菌胞外多糖溶液(稀释10倍)的吸光值为0.3692,代入回归方程中并乘以稀释倍数,得红曲霉菌胞外多糖浓度为5.23 mg/mL。
2.2红曲霉菌胞外多糖的分离纯化
DEAE-纤维素柱层析结果见图2。分别合并1~40管、42~80管、收集第80~100管作为红曲霉菌胞外多糖的三个组分(EPS-1,EPS-2,EPS-3)。
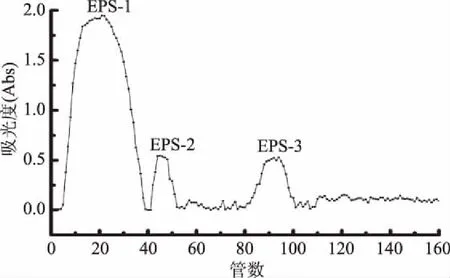
图2 红曲霉菌胞外多糖洗脱曲线Fig.2 The result of DEAE-cellulose column chromatography
2.3相对分子质量的测定
测定系列标准葡聚糖的保留时间,以保留时间对相对分子质量的对数作图,得线性回归方程Y=-0.5483X+8.8252,r=0.9539(X为保留时间,Y为分子量对数)。将红曲霉菌胞外多糖三个组分在相同色谱条件下进样分析,并记录各组分色谱峰的保留时间,代入线性回归方程,计算得EPS-1、EPS-2、EPS-3的相对分子质量(Mw)分别为8673、143537、238742 Da,结果见表1。

表1 分子量测定结果Table 1 The results of molecular weights of EPSs and standard samples
2.4单糖组成分析
2.4.1 单糖衍生物的分离 取各单糖衍生物(1 mg/mL)1 mL置于10 mL容量瓶中,加蒸馏水定容配成混合单糖标准溶液。取1 mL稀释100倍,按照1.2.5.1色谱条件,HPLC进样分析,得到混合单糖标准图谱。由图3可知,7种单糖衍生物得到了良好的分离。

图3 混合标准单糖的HPLC图谱Fig.3 HPLC chromatogram of mixed standard monosaccharides
2.4.2 线性关系 分别取1.2.5.2项下所得各单糖衍生物溶液1 mL,加入蒸馏水稀释成6个不同浓度,按照1.2.5.1色谱条件进样分析。根据单糖的浓度对相应峰面积进行线性回归(Y表示峰面积,X表示浓度),结果见表2。
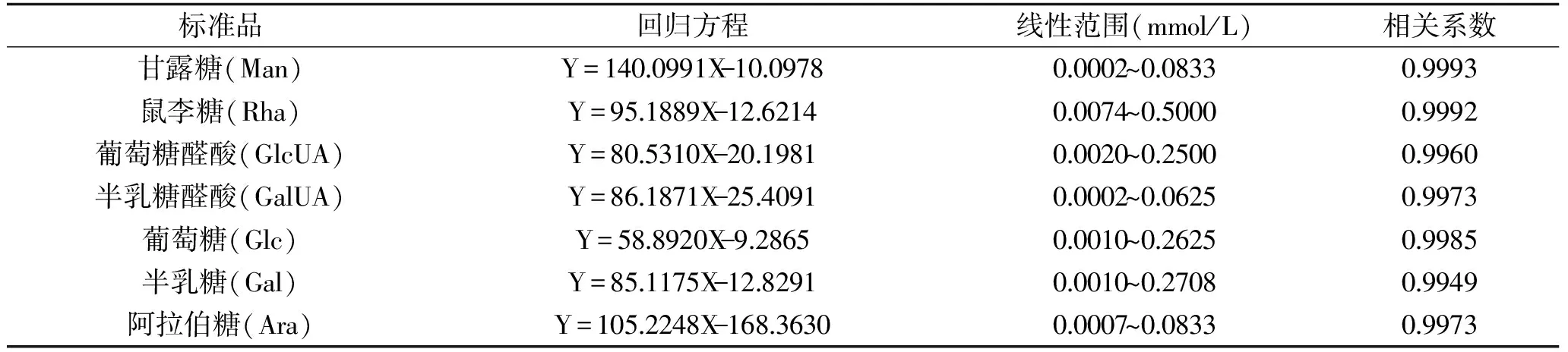
表2 单糖的标准曲线Table 2 Regression equations of monosaccharides

表3 单糖组成及摩尔比Table 3 Composition and molar ratio of monosaccharides of EPS
2.4.3 红曲霉菌胞外多糖衍生物分析 EPS-1、EPS-2、EPS-3的HPLC图谱见图4。由峰面积及标准曲线计算得EPS各单糖质量浓度,与摩尔质量之比得各单糖摩尔浓度,各单糖摩尔浓度之比即为摩尔比,结果见表3。

图4 红曲霉菌胞外多糖衍生物色谱图Fig.4 HPLC chromatogram of EPS注:a:EPS-1,b:EPS-2,c:EPS-3。
2.5红曲霉菌胞外多糖各组分的红外光谱分析
各胞外多糖组分红外光谱如图5所示。在3400 cm-1附近出现的吸收峰主要是由多糖的配糖体羟基伸缩振动引起的,羟基形成氢键缔合后,O-H键拉长,偶极矩增大,因此表现强而宽的峰;2900 cm-1附近的吸收峰为C-H的伸缩振动吸收峰;1670 cm-1附近出现的较强吸收峰是C-O伸缩振动引起的;1470 cm-1附近的吸收峰为C-H的变角振动吸收峰。由红外图谱可知EPS-1、EPS-2、EPS-3具有明显的糖类化合物的特征。此外,EPS-3和EPS-1及EPS-2相比,在1099、1072、920 cm-1附近出现吸收峰。1099 cm-1是C-O的伸缩振动吸收峰;1072 cm-1附近出现的峰是吡喃糖环内酯和羟基的吸收峰,是糖环上C-O-O醚键的不对称伸缩振动;920 cm-1是吡喃糖环的非对称伸缩振动吸收。这表明EPS-3的糖链组成与EPS-1和EPS-2存在差异。

图5 红曲霉菌胞外多糖组分的红外光谱图Fig.5 Infrared spectrum of EPS
2.6抗氧化活性
2.6.1 DPPH·的清除 不同浓度的三个多糖组分对DPPH的清除率结果见图6。在0.2~1 mg/mL范围内,三个多糖组分对DPPH的清除能力均与多糖浓度呈正相关,当多糖浓度为1 mg/mL时,三个组分对DPPH清除率分别为16.4%、15.9%和14.8%。

图6 多糖组分对DPPH的清除率Fig.6 DPPH radical scavenging activity of EPS
2.6.2 羟自由基的清除 不同浓度的三个多糖组分对羟自由基的清除率结果见图7。当多糖浓度为1 mg/mL时,EPS-3对清除羟自由基的清除率为63.8%,呈现出较高的清除羟自由基的能力,而EPS-1和EPS-2分别为40.4%和39.6%。

图7 多糖组分对羟自由基的清除率Fig.7 Hydroxyl radical scavenging activity of EPS
3 结论
红曲霉菌胞外多糖经DEAE-纤维素柱分离纯化获得三个组分EPS-1、EPS-2、EPS-3,通过高效凝胶色谱法分析其相对分子质量(Mw)分别为8673、143537、238742 Da。单糖组成分析和红外光谱数据表明EPS-1和EPS-3可能是以半乳糖为主链组成的杂多糖,具体结构有待进一步研究。三个组分对DPPH和羟自由基均有一定的清除能力,并在一定的浓度范围内红曲霉菌胞外多糖对羟自由基和DPPH·的清除作用与浓度呈现正相关。当多糖浓度为1 mg/mL时,三个组分对DPPH·清除率分别为16.4%、15.9%和14.8%,对羟自由基的清除率分别为40.4%、39.6%和63.8%。结果表明红曲霉菌胞外多糖各级组分之间的抗氧化活性、单糖组成比例均存在一定差异,这可能与Mw及其结构相关[14]。
[1]阿燕. 真菌多糖抗氧化活性的研究进展[J]. 微生物学杂志,2012,32(4):83-86.
[2]李秀岩,魏健,孙振雷. 红曲多糖的提取与发酵工艺的优化[J]. 安徽农业科学,2006,34(21):5653-5654.
[3]周芳美,朱晓松,潘佩蕾,等. 红曲霉菌胞外多糖的抗肿瘤活性研究[J]. 中华中医药学刊,2011(1):123-124.
[4伍健萍. 红曲霉发酵多糖条件及抗氧化活性的初步研究[D].天津:天津科技大学,2012.
[5]宋丹丹. 曲霉多糖的提取及其抑菌活性研究[D].长春:吉林农业大学,2013.
[6]Srianta I,Ristiarini S,Nugerahani I,et al. Recent research and development of Monascus fermentation products[J]. International Food Research Journal,2014,21(1):1-12.
[7]Wang P. Optimizing the Extraction Technology of Monascus Exopolysaccharide by Response Surface Methodology[J]. Journal of the Chinese Cereals & Oils Association,2011,26(12):83-1666.
[8]Xijun L. Current Study and Prospect on the Photostability of Monascus Pigment[J]. Meat Research,2003,2(64):33-34.
[9]汪鹏荣. 一株高产胞外多糖红曲霉发酵和提取工艺及抗氧化活性研究[D].杭州:浙江师范大学,2012.
[10]蔡琴,沈彬彬,张慧,等. 红曲霉菌胞外多糖提取及抗氧化活性测定[J]. 中华中医药学刊,2010(3):598-600.
[11]徐光域,颜军,郭晓强,等. 硫酸-苯酚定糖法的改进与初步应用[J]. 食品科学,2005,26(8):342-346.
[12]孙晓春,颜军,何钢,等. 川芎多糖的分离纯化及其单糖组成测定[J]. 四川农业大学学报,2011,29(1):56-60.
[13]罗懿洋,任道远,陈丽芳,等. 杏鲍菇多糖的单糖组成分析及其抗氧化活性研究[J]. 食品工业科技,2015(8):158-161.
[14]何钢,刘嵬,李会萍,等. 银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究[J]. 食品工业科技,2015,36(22):81-86.
Isolationandpurification,structureidentificationandantioxidantactivityofMonascuspurpureusexopolysaccharide
JIAHong-qian,LIUWei,LANGLi,ZHENGRui-feng,RANLin,YANJun,GOUXiao-jun,HEGang*
(The Key Laboratory of Medicinal and Edible Plants Resources Development of Sichuan Education Commission, Sichuan Industrial Institute of Antibiotics,Chengdu University,Chengdu 610052,China)
Objective:To isolate and purify the crudeMonascuspurpureusexopolysaccharide(EPS)and study the structure identification and antioxidant activity of the exopolysaccharide fractions. Method:The crude polysaccharide was extracted by liquid fermentation and purified by DEAE-cellulose. Molecular weights(Mw)of exopolysaccharide fractions were determined by high performance gel permeation chromatography(HPGPC)and the monosaccharide compositions were determined then by HPLC using precolumnderivatization with 3-methyl-1-phenyl-5-pyrazolone(PMP)separately. The ability of scavenging DPPH and hydroxyl free radical of polysaccharide fractions was tested to evaluate the antioxidant activity. The findings showed that three fractions(EPS-1,EPS-2,EPS-3)were obtained and molecular weights(Mw)were 8673,143537,238742 Da respectively. Both EPS-1,EPS-2 were composed of mannose,rhamnose,glucose and galactose with a molar ratio of 1∶0.301∶2.052∶3.614 and 1∶2.475∶1.950∶1.532,EPS-3 were composed of mannose,rhamnose,Glucuronic acid,glucose and galactose in a molar ratio of 1∶0.401∶0.066∶0.307∶2.974. The ability of removing DPPH and hydroxyl free radicals of polysaccharide fractions were positively related with concentrations. When it was up to 1 mg/mL,the DPPH clearance rate turned out to be 16.4%,15.9% and 14.8% respectively,hydroxyl free radical clearance rate of EPS-3 was 63.8%,and EPS-1,EPS-2 was 40.4% and 39.6% respectively. Conclusion:There existed some difference in monosaccharide composition and relative molecular mass and the ability of scavenging hydroxyl free radical and DPPH scavenging ability among EPSs,which could be associated with Mw and their structures.
Monascuspurpureus;exopolysaccharide;isolation and purification;monosaccharide composition;antioxidant activity
2016-11-04
贾红倩(1992-),女,硕士研究生,研究方向:多糖分析化学,E-mail:1550926634@qq.com。
*通讯作者:何钢(1982-),男,博士,副教授,研究方向:多糖生物化学,E-mail:hegang@cdu.edu.cn。
四川省科技厅应用基础计划项目(2015JY0117);四川省教育厅基础计划项目(14ZB0374);四川省高校重点实验室开发课题(10Y201501)。
TS201.2
:A
:1002-0306(2017)12-0092-05
10.13386/j.issn1002-0306.2017.12.017
