亚抑菌浓度头孢洛林对耐甲氧西林金黄色葡萄球菌生物膜形成的影响
2017-07-05朱科宋洁刘亚巍孙凤军徐巧玲
朱科,宋洁,刘亚巍,孙凤军,徐巧玲
(1.第三军医大学西南医院,a 预防保健科,b 药剂科,重庆 400038;2.中央军委联合参谋部警卫局卫生保健处;3.中国人民解放军第三○五医院药学部)
·论著·
亚抑菌浓度头孢洛林对耐甲氧西林金黄色葡萄球菌生物膜形成的影响
朱科1a,宋洁1a,刘亚巍2,孙凤军1b,徐巧玲3
(1.第三军医大学西南医院,a 预防保健科,b 药剂科,重庆 400038;2.中央军委联合参谋部警卫局卫生保健处;3.中国人民解放军第三○五医院药学部)
目的 探讨亚抑菌浓度头孢洛林对耐甲氧西林金黄色葡萄球菌生物膜形成能力的影响,为抗菌药物的临床使用提供理论依据。方法 金黄色葡萄球菌抑菌浓度(MIC)检测采用微量肉汤稀释法,亚-MIC头孢洛林对细菌生物膜形成能力的影响采用96孔板结晶紫染色法,胞外多糖的检测采用苯酚-硫酸法,icaA基因的表达采用荧光定量PCR扩增。结果 10株MRSA菌株对大部分抗菌药物具有较高耐药性,而对呋喃妥因、万古霉素和头孢洛林完全敏感。亚-MIC头孢洛林对7株MRSA菌株的生物膜形成具有显著诱导作用。此外,亚-MIC头孢洛林能增加MRSA菌株胞外多糖的产生和icaA基因的表达。结论 亚-MIC头孢洛林可能通过诱导icaA基因表达而增加胞外多糖的产生,从而导致细菌生物膜形成能力增强。
耐甲氧西林金黄色葡萄球菌;生物膜;微生物敏感性试验;头孢洛林
耐甲氧西林金黄色葡萄球菌(MRSA)是全球医院感染的重要革兰阳性菌,可引起皮肤和手术部位感染、菌血症、心内膜炎和肺炎等,具有较高的致死率[1]。近年来,随着导管和外科植入物等生物材料的应用,金黄色葡萄球菌生物膜引起的感染使临床治疗趋于复杂化[2]。头孢洛林是头孢洛林酯前药的活性代谢物,它是一种新型的头孢菌素,用于治疗成人社区获得性细菌性肺炎和急性细菌性皮肤和皮肤结构感染,对包括MRSA在内的金黄色葡萄球菌具有较高的体外抗菌活性[3-4]。有研究表明,亚抑菌浓度抗菌药物能显著诱导包括金黄色葡萄球菌在内的不同种类细菌的生物膜形成[5-7]。此外,亚抑菌浓度抗菌药物还能引起细菌基因转录的变化[8]。由于头孢洛林在体内治疗过程中大部分时间处于亚抑菌浓度水平,因此本研究以MRSA临床株为研究对象,研究亚抑菌浓度头孢洛林对MRSA生物膜形成能力的影响,为临床抗菌药物的使用提供理论依据。
1 材料与方法
1.1 菌株来源 10株MRSA临床株(S1501-S1510)分离自2015年7月至12月第三军医大学西南医院临床送检标本,剔除同一患者的重复菌株。金黄色葡萄球菌质控菌株ATCC29213由第三军医大学西南医院药学部保存。
1.2 试剂与仪器 头孢洛林(日本武田制药,批号:229016-73-3,纯度:99%),哥伦比亚血琼脂平板(重庆庞通公司),MH培养基(北京陆桥生物技术有限公司),胰蛋白胨大豆肉汤(TSB)培养基(英国Oxoid公司),RNA提取试剂盒和琼脂糖(北京天根生物科技有限公司),逆转录试剂盒和SYBR Green Realtime PCR Master Mix(东洋纺生物科技有限公司),引物由Invitrogen公司合成。酶标仪(美国MD公司),Real-Time PCR扩增仪(美国Bio-Rad公司)。
1.3 实验方法
1.3.1 最小抑菌浓度(MIC)的检测 采用微量肉汤稀释法检测MRSA菌株MIC。MRSA菌株划线接种于血琼脂平板,37 ℃恒温培养24 h。挑取单菌落于10 mL TSB肉汤中,37 ℃、180 r/min恒温振荡培养过夜。细菌过夜培养物用无菌0.9%氯化钠注射溶液稀释校正至0.5麦氏单位,然后再用TSB肉汤稀释100倍备用。头孢洛林用TSB肉汤倍比稀释至11个浓度梯度(0.25~256 μg/mL)。然后在96孔板中每孔加入100 μL稀释菌液和100 μL系列浓度头孢洛林,生长对照孔中加入100 μL稀释菌液和100 μL TSB肉汤。37 ℃孵育24 h后观察结果。MIC结果参照美国临床和实验室标准协会(CLSI)2014年标准进行判读。
1.3.2 亚-MIC头孢洛林对MRSA菌株生物膜形成能力的影响 采用96孔板结晶紫染色法检测MRSA菌株生物膜形成能力[9]。将MRSA过夜培养物用TSB肉汤稀释1000倍。空白对照组每孔加入100 μL菌液和100 μL TSB肉汤;头孢洛林组每孔加入100 μL菌液和100 μL头孢洛林,使药物终浓度为1/4 MIC。96孔板放入37℃孵箱培养24 h。培养完毕,轻轻吸除浮游菌,用PBS缓冲液轻柔冲洗2次,通风处倒置自然风干。然后在每孔中加入1%结晶紫溶液200 μL,染色10 min,自来水冲洗3次,再次通风阴凉处倒置自然晾干。最后每孔加入30%冰醋酸溶液100 μL,用酶标仪在590 nm处测定其吸光度值。每组设置3个复孔,实验重复3次。
1.3.3 亚-MIC头孢洛林对MRSA菌株胞外多糖的影响 采用苯酚-硫酸法检测MRSA菌株胞外多糖的产生[10]。按1%接种量将MRSA过夜培养物转种于100 mL TSB和含1/4 MIC头孢洛林的TSB肉汤中,37 ℃、180 r/min恒温振荡培养8 h。培养完毕将所有菌液在4 ℃、4000 r/min下离心15 min,去除上清。用蒸馏水重悬离心管底部的沉淀,然后加入37%甲醛溶液300 μL,4 ℃条件下放置3 h。然后加入20 mL 1M NaOH,4 ℃再放置3 h。4 ℃、12 000 r/min离心20 min,去除上清,留取沉淀待查。以标准葡萄糖溶液为底物制定标准曲线,上述待测沉淀稀释后按同样的方法进行显色,然后在490 nm处测定其吸光度值,并根据标准曲线计算出相应的多糖含量。
1.3.4 亚-MIC头孢洛林对MRSA菌株ica基因表达的影响 采用荧光定量PCR检测亚-MIC头孢洛林对MRSA菌株icaA基因表达的影响。采用Primer Premier 6.0软件针对icaA基因序列设计引物。icaA-F:CTTGGATGCAGATACTATCG;icaA-R:GCGTTGCTTCCAAAGACCTC。MRSA菌株划线接种于血琼脂平板,37 ℃培养24 h。分别挑取单菌落于10 mL TSB和含1/4 MIC头孢洛林的TSB肉汤中,37 ℃、180 r/min恒温振荡培养24 h。按照RNA抽提试剂盒说明书提取细菌总RNA,并用紫外分光光度计测定RNA浓度。cDNA合成按照逆转录试剂盒说明书进行。逆转录反应条件:42 ℃ 10 min,30 ℃ 20 min,99 ℃ 5 min,4 ℃ 5 min。反应完毕cDNA放入-20 ℃冰箱保存备用。RT-PCR反应体系(20 μL):2×SYBR Green 10 μL,上下游引物各0.3 μL,cDNA 2 μL,ddH2O 7.4 μL。扩增条件:94 ℃ 5 min,94 ℃ 30 s;57 ℃ 30 s;72 ℃ 30 s;40个循环。扩增反应完成后以16S rRNA作为内参进行分析。所有实验均重复3次。

2 结果
2.1 MRSA菌株MIC结果 常用抗菌药物对MRSA菌株的MIC结果见表1。10株MRSA菌株对苯唑西林和红霉素完全耐药,对克林霉素、庆大霉素、环丙沙星和四环素具有较高耐药性。而所有菌株均对呋喃妥因、万古霉素和头孢洛林敏感。
2.2 亚-MIC头孢洛林对MRSA菌株生物膜形成能力的影响 亚-MIC头孢洛林对MRSA菌株生物膜形成能力的影响如图1所示。1/4 MIC头孢洛林对MRSA菌株生物膜形成具有不同程度的诱导作用,其中对7株菌的生物膜形成具有显著诱导作用(P<0.05)。

表1 常用抗菌药物对MRSA菌株的MIC结果(mg/L)
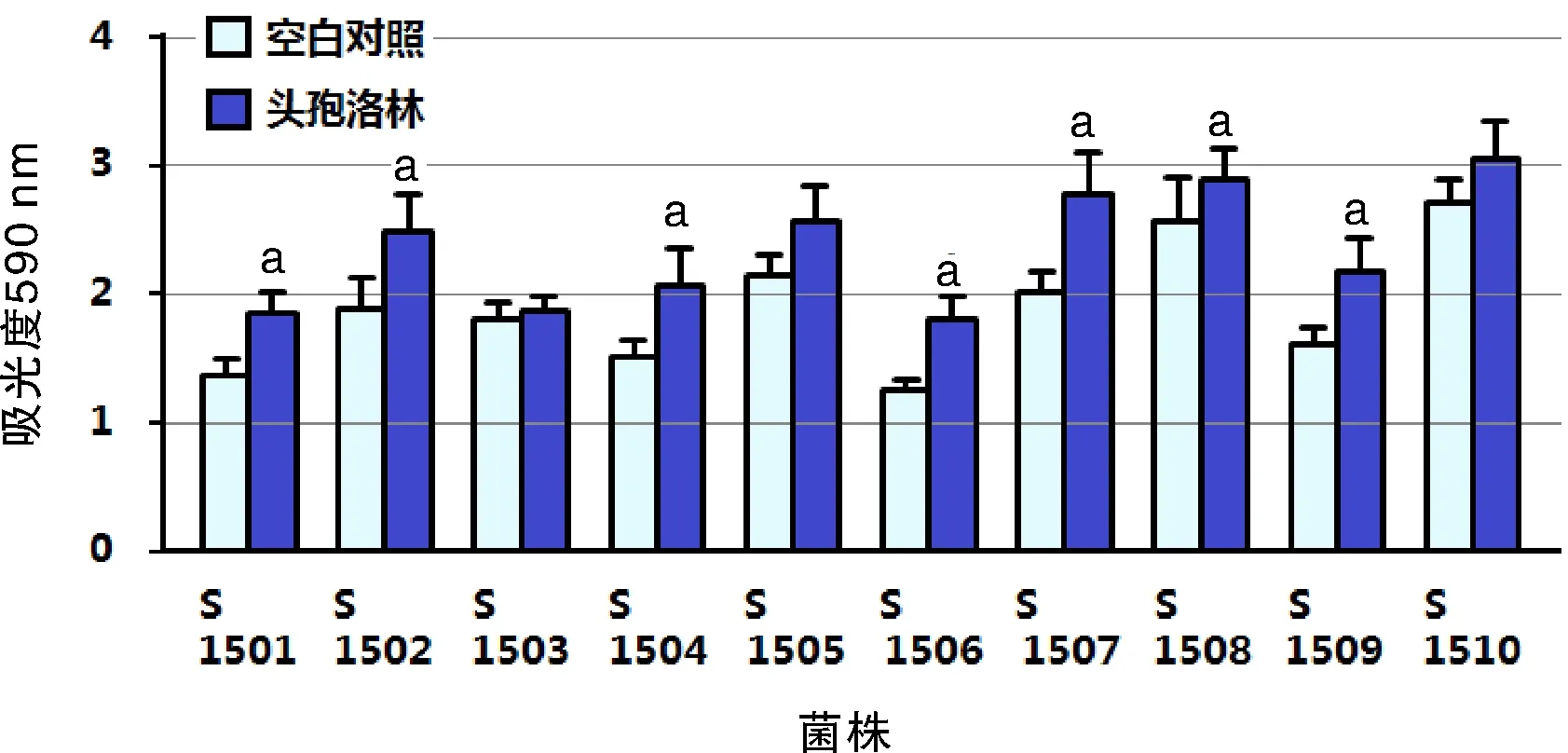
与空白对照组比较,aP<0.05
2.3 亚-MIC头孢洛林对MRSA菌株胞外多糖产生的影响 亚-MIC头孢洛林对MRSA菌株胞外多糖产生的影响见表2。除S1510菌株外,1/4 MIC头孢洛林可以显著诱导其他MRSA菌株胞外多糖的产生(P<0.05)。
2.4 亚-MIC头孢洛林对MRSA菌株ica基因表达的影响 亚-MIC头孢洛林对MRSA菌株icaA基因表达的影响如图2所示。与空白对照组相比,1/4 MIC头孢洛林能不同程度上调MRSA菌株的icaA基因表达。
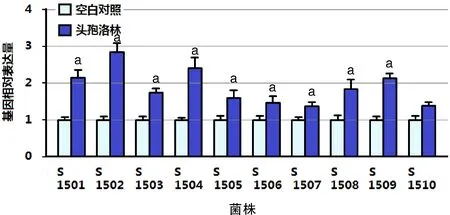
与空白对照比较,aP<0.05
3 讨论
头孢洛林对MRSA菌株的青霉素结合蛋白PBPs具有较强的亲和力,通过抑制细菌细胞壁的合成而使细菌死亡,但是头孢洛林对青霉素结合蛋白PBP2a有更高的亲合力[11-12],且有广谱抗菌活性。在本研究中,MRSA菌株对大多数抗菌药物均具有较高的耐药性,而对万古霉素、呋喃妥因和头孢洛林完全敏感。这与文献报道[13-14]基本一致。呋喃妥因虽然在体外具有稳定的抗菌活性,但肠道吸收量少,在血液和体内达不到有效治疗浓度,大部分药物以原形从尿中排出,主要用于预防和治疗下尿路感染疾病。万古霉素具有肾毒性等不良反应,在临床治疗MRSA感染时应慎重使用。本研究中所用金黄色葡萄球菌对头孢洛林全部敏感,且具有较低的MIC,说明头孢洛林为金黄色葡萄球菌耐药株的感染治疗提供了一个新的治疗选择。

表2 亚-MIC头孢洛林对MRSA菌株胞外多糖的影响
注:与空白对照组比较,aP<0.05,bP<0.01
金黄色葡萄球菌是生物膜感染的常见病原菌。形成生物膜的细菌具有高度的耐药性并能逃避免疫系统的攻击,给临床治疗带来了巨大挑战。由于在给药方案的开始和结束、剂量之间以及低剂量连续治疗中,细菌均处于亚-MIC抗菌药物环境下[15],因此研究亚-MIC抗菌药物对细菌的影响具有重要的临床研究意义。本研究显示亚-MIC头孢洛林对大部分MRSA菌株的生物膜形成能力具有诱导作用,这与亚-MIC β-内酰胺类、万古霉素和利奈唑胺等抗菌药物对金黄色葡萄球菌生物膜形成作用结果一致[6,16]。提示不同种类亚-MIC抗菌药物在体外均可诱导金黄色葡萄球菌生物膜的形成,影响细菌感染的病程。
葡萄球菌icaA属于糖基转移酶,是生物膜内主要成分多糖合成的关键酶[17]。本研究结果显示亚-MIC头孢洛林对MRSA菌株胞外多糖和icaA基因的表达均有诱导作用。提示头孢洛林可能通过诱导icaA基因的高表达导致胞外多糖产生的增多,进而使细菌生物膜的形成能力增加。然而,头孢洛林等小分子药物极少可直接调控icaA基因的表达,其具体的调控机制尚需进一步研究。头孢洛林虽对MRSA浮游菌具有较好的抗菌活性,但是在亚-MIC条件下可诱导细菌生物膜的形成,因此临床治疗过程中应根据药物的代谢特点,尽量避免或减少细菌处于亚-MIC的时间。该研究为临床抗菌药物的合理使用提供了理论依据,丰富了抗感染理论。
[2] ARCHER NK,MAZAITIS MJ,COSTERTON JW,et al.Staphylococcus aureus biofilms:properties,regulation,and roles in human disease[J].Virulence,2011,2(5):445-459.
[3] WERTH BJ,BARBER KE,IRELAND CE,et al.Evaluation of ceftaroline,vancomycin,daptomycin,or ceftaroline plus daptomycin against daptomycin-nonsusceptible methicillin-resistant staphylococcus aureus in an in vitro pharmacokinetic/pharmacodynamic model of simulated endocardial vegetations[J].Antimicrob Agents Chemother,2014,58(6):3177-3181.
[4] SARAVOLATZ L,PAWLAK J,JOHNSON L.In vitro activity of ceftaroline against community-associated methicillin-resistant,vancomycin-intermediate,vancomycin-resistant,and daptomycin-nonsusceptible Staphylococcus aureus isolates[J].Antimicrob Agents Chemother,2010,54(7):3027-3030.
[5] AKA ST,HAJI SH.Sub-MIC of antibiotics induced biofilm formation ofPseudomonasaeruginosain the presence of chlorhexidine[J].Braz J Microbiol,2015,46(1):149-154.
[6] KAPLAN JB,IZANO EA,GOPAL P,et al.Low levels of beta-lactam antibiotics induce extracellular DNA release and biofilm formation in Staphylococcus aureus[J].Mbio,2012,3(4):e00198.
[7] GOMES DL,PEIXOTO RS,BARBOSA EA,et al.SubMICs of penicillin and erythromycin enhance biofilm formation and hydrophobicity of corynebacterium diphtheriae strains[J].J Med Microbiol,2013,62(Pt 5):754-760.
[8] LAURETI L,MATIC I,GUTIERREZ A.Bacterial responses and genome instability induced by subinhibitory concentrations of antibiotics[J].Antibiotics (Basel),2013,2(1):100-114.
[9] HE HJ,SUN FJ,WANG Q,et al.Erythromycin resistance features and biofilm formation affected by subinhibitory erythromycin in clinical isolates of staphylococcus epidermidis[J].J Microbiol Immunol Infect,2016,49(1):33-40.
[10] 冯伟,夏培元,孙艺璇,等.hns基因对大肠埃希菌生物膜形成能力的影响[J].第三军医大学学报,2016,38(2):107-111.
[11] SARAVOLATZ LD,STEIN GE,JOHNSON LB.Ceftaroline:a novel cephalosporin with activity against methicillin-resistant Staphylococcus aureus[J].Clin Infect Dis,2011,52(9):1156-1163.
[12] POTTINGER PS.Methicillin-resistant Staphylococcus aureus infections[J].Med Clin North Am,2013,97(4):601-619.
[13] 许晶晶,张丽,邓丽华.319株金黄色葡萄球菌的耐药性分析[J].中外医学研究,2014,12(32):44-46.
[14] 朱玉龙,严燕燕,顾蓓青,等.653株金黄色葡萄球菌临床分布及耐药性分析[J].现代预防医学,2014,41(21):4026-4028.
[15] NG M,EPSTEIN SB,CALLAHAN MT,et al.Induction of MRSA biofilm by low-dose β-lactam antibiotics:specificity,prevalence and dose-response effects[J].Dose Response,2013,12(1):152-161.
[16] KAPLAN JB.Antibiotic-induced biofilm formation[J].Int J Artif Organs,2011,34(9):737-751.
[17] BÜTTNER H,MACK D,ROHDE H.Structural basis of Staphylococcus epidermidis biofilm formation:mechanisms and molecular interactions[J].Front Cell Infect Microbiol,2015,5(1):14.
Effect of sub-minimal inhibitory concentration ceftaroline on the biofilm formation of methicillin-resistant staphylococcus aureus isolates
ZhuKe*,SongJie,LiuYawei,SunFengjun,XuQiaoling
(*DepartmentofPreventionandHealthCare,SouthwestHospital,ThirdMilitaryMedicalUniversity,Chongqing400038,China)
Correspondingauthor:XuQiaoling,Email:fengwei.sky@163.com
Objective To investigate the effect of sub-minimal inhibitory concentration (sub-MIC) ceftaroline on the biofilm formation of methicillin-resistant Staphylococcus aureus (MRSA) isolates and provide the theory support for clinical treatment of antibiotics.Methods The MICs of anitibiotics to MRSA isolates were detected by broth microdilution method.The effect of sub-MIC ceftaroline on the biofilm formation of MRSA isolates was determined by using 96-crystal violet staining.The production of extracellular polymeric substances was detected by phenol-sulfuric acid method.The expression of icaA gene was analyzed by Real-Time PCR amplification.Results Ten MRSA strains were high resistant to most of the tested antibiotics,whereas they were all sensitive to nitrofurantoin,vancomycin and ceftaroline.Sub-MIC ceftaroline could significantly induce the biofilm formation of seven MRSA strains.In addition,sub-MIC ceftaroline could increase the production of extracellular polymeric substances and icaA gene expression of MRSA strains.Conclusions Sub-MIC ceftaroline might increase the production of extracellular polymeric substances by inducing the icaA gene expression,and then result in the enhancement of MRSA biofilm formation.
Methicillin-resistant staphylococcus aureus;Biofilms;Microbial sensitivity tests;Ceftaroline
国家自然科学基金面上项目(81373451)
朱科,医师,Email:21420019@qq.com
徐巧玲,副主任药师,Email:fengwei.sky@163.com
R378.11
A
10.3969/J.issn.1672-6790.2017.04.008
2017-02-18)
