高龄慢性病患者血浆白蛋白与前白蛋白水平和外周血细胞免疫功能的相关性研究
2017-07-05殷实殷华方向丁西平胡世莲
殷实,殷华,方向,丁西平,胡世莲
(1.安徽医科大学附属省立医院老年医学科,合肥 230001;2.安徽省老年医学研究所;3.肿瘤免疫与营养治疗安徽省重点实验室;4.海军南京半山园干休所门诊部)
·论著·
高龄慢性病患者血浆白蛋白与前白蛋白水平和外周血细胞免疫功能的相关性研究
殷实1,2,3,殷华4,方向1,2,3,丁西平1,2,3,胡世莲1,2,3
(1.安徽医科大学附属省立医院老年医学科,合肥 230001;2.安徽省老年医学研究所;3.肿瘤免疫与营养治疗安徽省重点实验室;4.海军南京半山园干休所门诊部)
目的 探讨高龄住院患者血浆前白蛋白(PAB)和白蛋白(ALB)水平与外周血细胞免疫功能之间的相关性。方法 选择住院高龄患者123例,按疾病类型分为感染性疾病和非感染性疾病,分为感染组64例、非感染组59例。免疫比浊法检测患者血浆PAB、ALB水平,细胞免疫芯片法检测外周血细胞T细胞亚群CD3、CD4、CD8细胞的数量以及CD4/CD8比值。比较两组差异,线性回归分析两组组内PAB/ALB水平与T淋巴细胞亚群之间的相关性。结果 感染组的PAB[(183.2±7.13)mg/L]明显低于非感染组[(228.9±6.93)mg/L]患者,而感染组和非感染组之间的ALB水平以及T细胞亚群均差异无统计学意义。感染组内PAB与CD3、CD4数量呈明显正相关(r=0.2551,P=0.0419;r=0.2585,P=0.0392),与CD8数量及CD4/CD8比值无明显相关性;而ALB与T细胞亚群也无显著相关。非感染组PAB、ALB水平与细胞免疫功能均无明显相关性。结论 PAB水平可作为预测老年感染性疾病患者细胞免疫功能的指标。
慢性病;血清白蛋白;前白蛋白;T淋巴细胞;老年人,80以上
中国已迈入老龄化社会,2015年人口调查显示,我国60岁及以上人口为2.22亿,占总人口16.15%[1];预计到2020年,60岁以上老年人口将达到2.5亿,其中80岁以上高龄老年人超过3000万[2]。老年人大多并存多种慢性疾病,且常常因为慢性疾病急性加重或合并感染而反复入院[3]。在高龄患者中,营养不良是一个很普遍的问题,血浆白蛋白水平下降,与功能状态差明显相关,并且预示着有不良的临床结局[4];此外营养状态与免疫功能密切相关,但其临床相关性仍不甚清楚[5]。本研究分析高龄感染性疾病及非感染性疾病住院患者血浆前白蛋白(PAB)和白蛋白(ALB)水平与外周血细胞免疫功能的差别,并分析蛋白营养状态PAB/ALB与细胞免疫功能之间的相关性,为临床医务工作者提供更便捷地反映老年患者的免疫功能指标。
1 对象与方法
1.1 研究对象 以2015年12月至2017年4月在安徽医科大学附属省立医院老年医学科住院的123例高龄患者(≥80岁)为研究对象,符合入院诊断标准。其中男98例,女25例,年龄80~99岁。入选标准:(1)高龄慢性病患者,符合WHO慢性病诊断标准;(2)预期生存期大于3个月;(3)近3个月未应用免疫抑制剂;(4)肿瘤患者带瘤生存其KPS评分大于50分。排除标准:(1)造血系统疾病;(2)血流动力学不稳定;(3)预期生存期小于3个月;(4)正在进行放疗、化疗及核素治疗的肿瘤患者;(5)长期应用激素的患者。
1.2 分组方法 根据患者入院及住院过程中是否存在感染性疾病,分为感染组和非感染组,感染组患者主要为:肺部感染、胃肠道感染、皮肤软组织感染及尿路感染;非感染组患者主要为各种慢性病急性发作的住院患者,如分组后3 d内患者发生感染,则考虑其分组时可能已存在感染性疾病,将其划为感染组。两组性别、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.3 仪器与试剂 清晨在患者空腹状态下同时抽取肘静脉血2管,每管5 mL,其中1管加入肝素抗凝,采用红细胞裂解液分离外周血单个核细胞(PBMC),以PBS 洗涤后重悬制成PBMC悬液进行T细胞亚群检测。T细胞亚群包括CD3、CD4、CD8的数量以及CD4/CD8比值,检测采用细胞免疫芯片法(上海汇中细胞生物科技有限公司产品)。严格按实验步骤进行。另外一管离心后,将血浆放置在-80 ℃冰箱中进行保存,采用免疫透射比浊法测定PAB和ALB水平。

2 结果
2.1 两组基线资料比较 如表1所示,符合纳入标准的住院高龄慢性病患者共123例,主要慢性病种为缺血性脑血管病、高血压病、冠心病、心律失常、心功能不全、慢性阻塞性肺疾病、2型糖尿病、恶性肿瘤等。两组性别和年龄比较差异无统计学意义(均P>0.05),说明两组基线资料均衡,具有可比性。
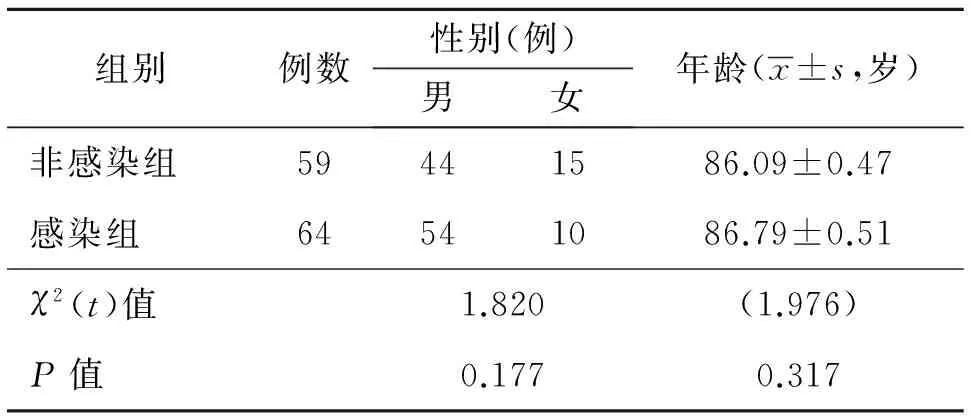
表1 两组研究对象一般临床特点
注:两组性别和年龄比较,均差异无统计学意义(均P>0.05)
2.2 两组血浆PAB、ALB水平以及外周血T细胞群CD3、CD4、CD8的数量以及CD4/CD8比值的差别 如表2所示,与非感染组相比,感染组PAB水平明显降低,差异有统计学意义(P<0.01)。
2.3 两组组内血浆PAB、ALB水平与CD3、CD4、CD8数量以及CD4/CD8比值的相关性分析 分别对感染组和非感染组组内血浆PAB、ALB水平与外周血CD3、CD4、CD8数量以及CD4/CD8比值进行相关性分析,结果如图1,2所示,感染组内PAB与CD3、CD4数量呈明显正相关(r值分别为0.2551、0.2585,P值为0.0419、0.0392),而与CD8数量和CD4/CD8比值无明显相关性;ALB与细胞免疫T细胞亚群均无显著相关。而非感染组PAB、ALB水平与细胞免疫功能均无明显相关性(见表3)。

表2 两组PAB、ALB、CD3、CD4、CD8和CD4/CD8指标比较
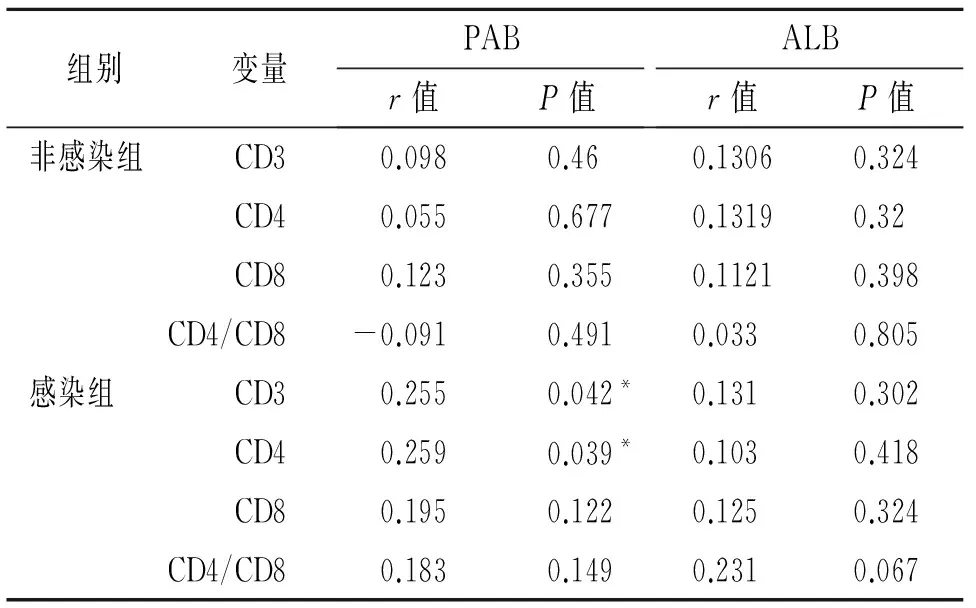
表3 两组中PAB、ALB与细胞免疫功能的相关分析
注:*感染组内PAB与CD3、CD4数量成正相关
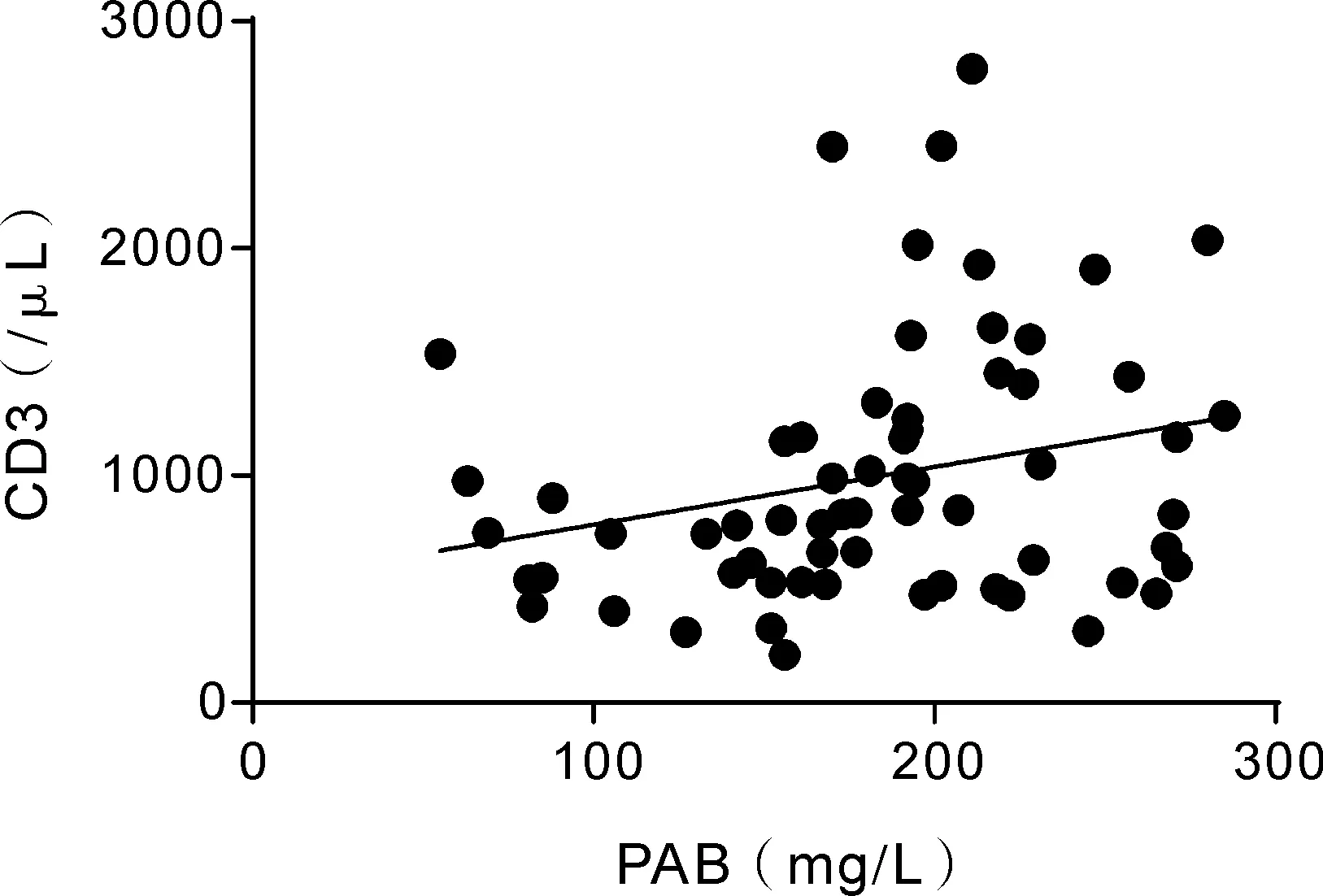
Y=1.408X+286.4; r=0.2551,P=0.0419
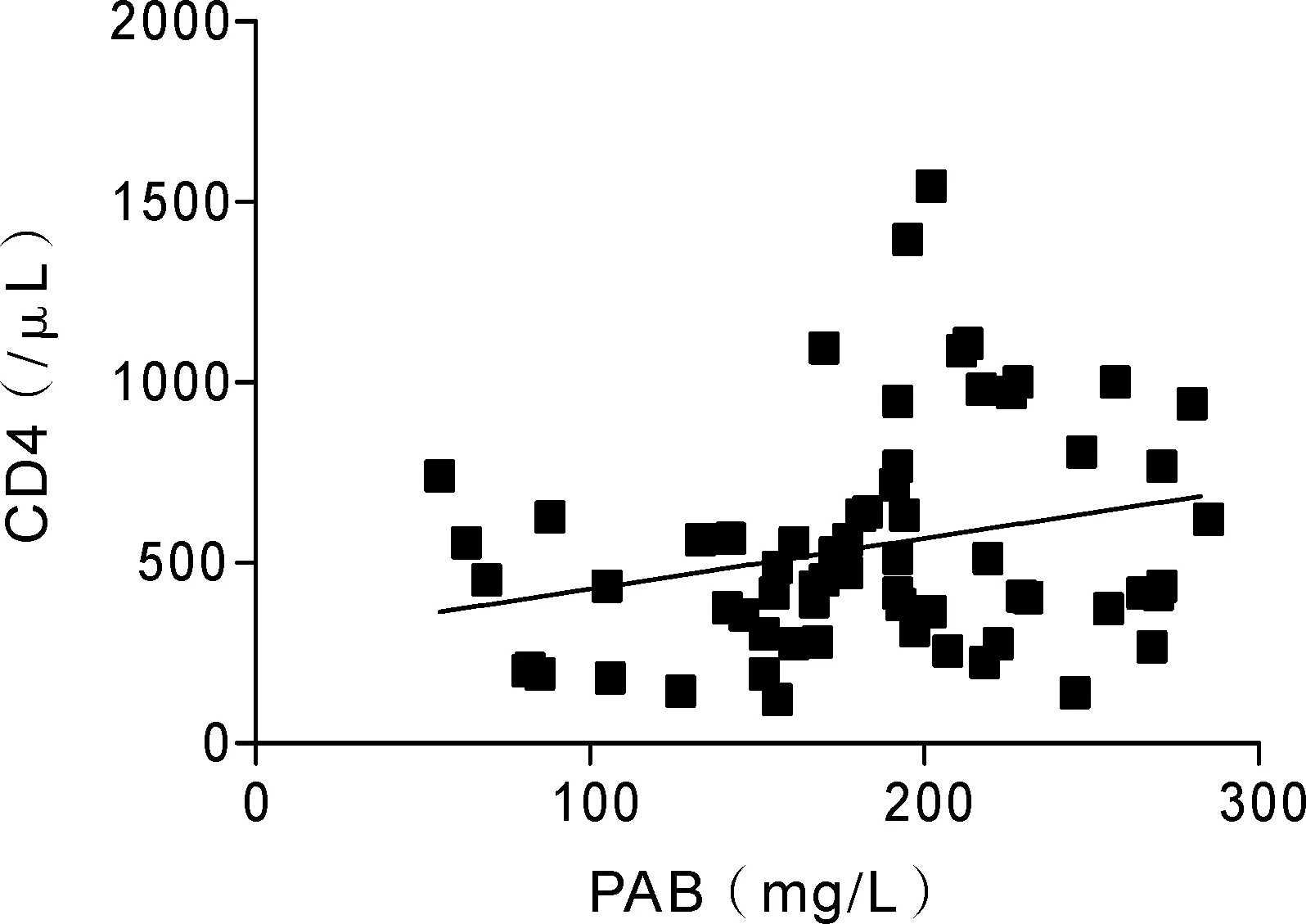
Y=2.543X+529.5;r=0.0419,P=0.0392
3 讨论
在自然衰老和外部环境因素的双重作用下老年人常常易患多种慢性病,最常见的如高血压,糖尿病和心脏病等,是导致老年患者反复入院的重要原因[6]。在这些慢性病的基础上,老年病患者更容易合并感染。在老年感染性疾病中,以肺部感染最为常见,是引起80岁以上的高龄老人致死的首要因素。除了临床的抗感染治疗以外,老年人自身的免疫功能特别是细胞免疫是抵抗外来感染的重要内部因素[6]。
研究表明老年人的机体免疫细胞不仅增殖能力下降,而且易发生凋亡,造成有活性免疫细胞数目减少,是引起感染的常见原因之一[7]。尤为重要的是机体的营养水平与免疫功能密切相关。本研究根据感染与否,对入院高龄患者进行分组,比较了血浆中PAB、ALB以及外周血细胞免疫功能水平差异,并对相关性进行了分析。结果发现感染组的PAB明显低于非感染组患者,而其他指标包括ALB水平以及T细胞亚群各参数差异无统计学意义。表明感染时PAB水平下降明显。进一步的相关性分析发现感染组内PAB与CD3、CD4数量呈明显正相关,与CD8数量和CD4/CD8比值无明显相关性;而ALB与细胞免疫T细胞亚群均无显著相关性。非感染组PAB、ALB水平与细胞免疫功能均无明显相关性。提示PAB可作为高龄老人免疫功能状况的预警指标,PAB数值下降表明老年人机体的细胞免疫功能受损,这对于临床上的病情监测具有一定价值。
老年人的营养状态对于维持机体内环境的稳定,抵抗感染等发挥着重要作用,ALB和PAB是目前被认为能反映机体营养状态的良好指标[8-9]。尤为重要的是PAB是由肝细胞合成的急性期反应蛋白,半衰期短,仅为1.9 d,临床上常常作为肝细胞早期受损的指标[10]。PAB不仅对反映了机体的营养状态,而且对于临床疾病的诊治和预后判断均具有重要参考价值[11]。本研究发现,在因感染高龄住院患者中PAB下降明显,而ALB有下降的趋势但差异无统计学意义,这提示感染自身可导致PAB消耗,但感染与PAB之间的因果关系尚需进一步研究证实。
衰老与免疫关系复杂,一方面导致免疫反应低下,另外一方面衰老本身可以导致炎症反应[12]。衰老过程伴随T淋巴细胞的组成和功能变化。高龄老人免疫功能衰退最突出的表现是T细胞数量和功能减退,是导致老年患者继发感染、肿瘤等多种疾病的重要原因[13-14]。从本研究的结果看,感染本身对于老年患者的外周细胞免疫T细胞CD3、CD4、CD8、CD4/CD8的数量无显著影响,但需进一步研究。由于外周血T细胞亚群的检测费时,成本较高,给临床普及这项检测造成困难。本研究发现在感染情况下,PAB水平与T细胞CD3、CD4数量呈明显正相关,这提示感染情况下,PAB可间接反映细胞免疫功能。
综上所述,本研究发现老年住院高龄感染性疾病患者的PAB明显低于非感染性疾病患者,且PAB与CD3、CD4数量呈正相关,提示检测PAB水平可预测老年患者细胞免疫CD4细胞数量。但由于本研究纳入的病例数较少且均为同一科室,高龄老人因为慢病、多病共存,入院前即应用多重药物,可能在一定程度上对本研究结果造成影响,本研究具有一定的局限性,仍需行多中心研究进一步证实。
[1] 国家统计局.2015年全国1%人口抽样调查主要数据公报[R/OL].(2016-04-20).http://www.stats.gov.cn/tjsj/zxfb/201604/t20160420_1346151.html
[2] 高超,王淑君,于普林.人口老龄化的现状及发展趋势[J].中华老年医学杂志,2014,33(8):924-926.
[3] 郜凯华,钱军程,张拓红.中国老年人医疗服务需要和利用——基于1998—2008 年的国家卫生服务调查数据[J].中国卫生政策研究,2014,7(6):47-52.
[4] HSU HY,HWANG LC,LIN CH,et al.Impact of serum albumin on functional status and hospital outcome in oldest-old inpatients[J].Int J Gerontol,2015,9(4):220-222.
[5] WU J,LI W,LIU Z,et al.Ageing-associated changes in cellular immunity based on the SENIEUR protocol[J].Scand J Immunol,2012,75(6):641-646.
[6] DOWD PS,KELLEHER J,WALKER BE,et al.Nutrition and cellular immunity in hospital patients[J].Br J Nutr,1986,55(3):515-527.
[7] GRUVER AL,HUDSON LL,SEMPOWSKI GD.Immunosenescence of ageing[J].J Pathol,2007,211(2):144-156.
[8] BECK FK,ROSENTHAL TC.Prealbumin:a marker for nutritional evaluation[J].Am Fam Physician,2002,65(8):1575-1578.
[9] SMITH SH.Using albumin and prealbumin to assess nutritional status[J].Nursing.2017,47(4):65-66.
[10] HUANG L,LI J,YAN JJ,et al.Prealbumin is predictive for postoperative liver insufficiency in patients undergoing liver resection[J].World J Gastroenterol,2012,18(47):7021-7025.
[11] 杨庆斌,李琼,王继灵,等.前白蛋白、C反应蛋白在高龄慢性阻塞性肺疾病急性发作患者中的动态变化[J].中国临床保健杂志,2015,18(1):93-94.
[12] FOUGèRE B,BOULANGER E,NOURHASHéMI F,et al.Chronic inflammation:accelerator of biological aging[J].J Gerontol A Biol Sci Med Sci,2016:1-8.
[13] LINTON PJ,THOMAN ML.Immunosenescence in monocytes,macrophages,and dendritic cells:lessons learned from the lung and heart[J].Immunol Lett,2014,162(100):290-297.
[14] FULOP T,LE PAGE A,FORTIN C,et al.Cellular signaling in the aging immune system[J].Curr Op in Immunol,2014,29(1):105-111.
Plasma albumin,prealbumin level and the correlation with the cellular immune function in peripheral blood cell from elderly inpatients with chronic diseases
YinShi*,YinHua,FangXiang,DingXiping,HuShilian
(*DepartmentofGeriatrics,AnhuiProvincialHospital,AnhuiMedicalUniversity,Hefei230001,China)
Correspondingauthor:HuShilian,Email:hushilian@126.com
Objective To compare the difference of plasma albumin,prealbumin level between elderly chronic disease inpatients with or without infection and analysize the correlation between plasma albumin/prealbumin and the cellular immune function in peripheral blood cell.Methods 123 elderly patients with chronic diseases during hospitalization in Geriatrics Department were enrolled in this study.The inpatients were assigned into 2 groups including non-infective group (n=59) and infective group (n=64).Plasma albumin and prealbumin level were measured by immunoturbidimetry assay.Cellular immune function including peripheral blood mononuclear cell surface T cell subsets CD3,CD4,CD8 and CD4/CD8 were examined by cell immuno-chip.Analysis of variance and Student’s t-test were used to compare the values from two groups.Linear-regression analysis was used to examine the correlation between plasma albumin/prealbumin level and the cellular immune function T cell subsets.Results Plasma prealbumin significantly decreased (183.2±7.13 VS.28.9±6.93) while the albumin level and T cell subsets had no change in the inpatients from the infective group when compared with that in non-infective group.In the infective group,the plasma prealbumin was significantly correlated with the number of CD3 and CD4 (r=0.2551,P=0.0419;r=0.2585,P=0.0392) but had no relationship with the number of CD8 and CD4/CD8.While the plasma albumin had no correlation with CD3,CD4,CD8 and CD4/8.In the non-infective group,both plasma prealbumin and albumin levels had no association with the number of CD3,CD4,CD8 and CD4/CD8.Conclusion The plasma prealbumin measurement maybe a good predictor for cellular immune function in elderly inpatients with chronic diseases.
Chronic disease;Serum albumin;Prealbumin;T-lymphocytes;Aged,80 and over
国家自然科学基金项目(81470879);安徽省科技计划项目(1501041142);肿瘤免疫与营养治疗安徽省重点实验室绩效项目(1606c08236)
殷实,主治医师, Email:yinshi11@163.com
胡世莲,主任医师,教授,Email:hushilian@126.com
R592
A
10.3969/J.issn.1672-6790.2017.04.001
2017-05-10)
