微小RNA-125b作用于SFRP5调节急性心肌梗死后心室重构的实验研究
2017-07-05别自东陈秀华王玉凤林晓静王竟靖
别自东,王 东,何 琳,陈秀华,王玉凤,林晓静,王竟靖,沙 勇
微小RNA-125b作用于SFRP5调节急性心肌梗死后心室重构的实验研究
别自东1,2,王 东3,何 琳4,陈秀华1,王玉凤1,林晓静1,王竟靖4,沙 勇4
目的 探讨微小RNA-125b(miR-125b)对小鼠急性心肌梗死后心室重构的影响及机制。方法 利用左前降支结扎法构建小鼠心肌梗死模型,以心电图及病理改变作为建模成功的观察指标。将急性心肌梗死组小鼠随机分3组:假手术组(6只)、急性心肌梗死组(12只)及急性心肌梗死+miR-125b抑制剂转染组(12只)。模型建立2周后,取各组小鼠制备病理切片,石蜡切片HE染色、石蜡切片免疫组化染色及石蜡切片胶原染色(Masson法染色)检测相关指标。结果 HE染色显示:假手术组可见心肌横纹清晰,排列整齐,细胞核明显,细胞无明显肿胀;而急性心肌梗死组则观察到多发散在的坏死灶,界限清晰,可见有明显的成纤维细胞增生,心肌肥大,同时可见较多的纤维化;急性心肌梗死+miR-125b抑制剂转染组,急性心肌梗死的典型生理现象较未加入miR-125b抑制剂转染组有明显改善。免疫组化染色显示:分泌型卷曲相关蛋白5(SFRP5)在假手术组小鼠组织中高表达;急性心肌梗死组,SFRP5表达显著下调;而在急性心肌梗死+miR-125b抑制剂转染组,SFRP5表达明显提高。Masson染色显示:假手术组心肌组织被染成均匀红色,可见前壁的厚度较一致,心肌组织胶原纤维少,无条索状及融合的胶原纤维;急性心肌梗死组小鼠左心室前壁心肌梗死区心肌组织被胶原纤维取代,且显著增多,呈条索状,分割包绕心肌束,部分胶原纤维融合,并可见前壁变薄;急性心肌梗死+miR-125b抑制剂转染组,急性心肌梗死后典型生理现象改善,计算胶原容积积分比较,差异有统计学意义(P<0.01)。结论 抑制miR-125b表达可改善急性心肌梗死后心室重构,其机制可能是通过抑制SFRP5来实现的。
急性心肌梗死;心室重构;微小RNA-125b;分泌型卷曲相关蛋白5
急性心肌梗死后心室重构是引起心力衰竭的主要病生机制,如何减缓疾病进程,一直是近年来基础和临床研究的热点[1]。随着心肌纤维化发生发展机制的研究的不断深入,较多研究表明微小RNA-125b(micro RNA-125b,miR-125b)在其中发挥重要作用[2-4]。在众多microRNAs中,miR-125b作用尤为重要。在人类心力衰竭的心肌组织和其他实验动物模型中均发现miR-125b表达上调,从而表明其可能是心室重构的特征性分子变化。因此,miR-125b在心血管疾病中可能具有重要意义[5]。但目前关于miR-125b在心肌纤维化中的具体机制还不甚清楚,值得进一步深入研究探讨。Duan等[6]研究显示,Wnt1/β-catenin信号通路激活可影响心肌成纤维细胞向肌成纤维细胞转化,从而促进心肌修复。但现有研究仍未阐明Wnt1/β-catenin信号通路在心肌纤维化进程中的确切作用及作用的具体机制,且缺乏与microRNAs相互调控等关系的研究。本研究前期相关研究证实:分泌型卷曲相关蛋白5(secreted frizzled related protein 5,SFRP5)是miR-125b的下游靶基因,而SFRP5是Wnt信号通路抑制剂,因此,本实验通过构建动物模型,进一步观察miR-125b对心肌梗死后心肌组织及组织中SFRP5表达的影响。
1 材料与方法
1.1 实验动物 SPF级,雄性,体质量相近的C57/BL6小鼠,体质量25 g±3 g,购自山东大学动物实验中心。
1.2 主要试剂和设备 miR-125b抑制物(广州锐博生物科技有限公司);石蜡(美国Sigma-Aldrich公司);苏木素(北京索莱宝科技有限公司);免疫组化试剂盒(广州锐博生物科技有限公司);Masson染液(南京建成生物工程研究所);慢病毒(广州赛哲生物科技有限公司);小动物呼吸机(北京中西远大科技有限公司);眼科及常规手术器材(乐仁堂医疗器械公司);AZ100多功能连续变焦显微镜(日本Nikon公司)。
1.3 方法
1.3.1 动物分组 按照随机数字表法分为假手术组(6只)、急性心肌梗死组(12只)及急性心肌梗死+miR-125b抑制剂转染组(12只)。假手术组开胸但不结扎左冠状动脉;急性心肌梗死组阻断前降支。当左心室前壁部分颜色转为苍白且出现心电示波为心肌梗死表现时才能确认本模型制作成功。
1.3.2 小鼠心梗模型建立 胸骨左缘第2肋~4肋开胸,以左冠脉主干为标志,在左心耳下方2 mm处进针,6-0号丝线结扎左前降支,当结扎区域变白,心电图2个以上肢体导联出现ST段上抬0.2 mV则判断为造模成功。
1.3.3 HE染色 处死小鼠,使用含有肝素的生理盐水冲洗以去除心脏组织的血液。取心脏,用10%福尔马林固定组织,脱水,石蜡包埋,切成3 μmol/L厚切片,进行HE染色,观察心肌梗死后心肌细胞存活及炎症细胞浸润情况。
1.3.4 免疫组化染色 免疫组化染色体步骤按试剂盒说明书操作,用Image pro plus 6.0图像分析系统进行图片处理。
1.3.5 Masson染色 将切片脱蜡;冲洗;分化;水洗;返蓝;水洗;浸入Masson复合染色液染色;快速冲洗切片;亮绿SF染色;快速冲洗;分化;脱水、透明、封片;染色完成后用普通光学显微镜观察染色效果并拍照,用Image pro plus(IPP)6.0图像分析系统进行图片处理。

2 结 果
2.1 HE染色(40×10)结果 假手术组可见心肌横纹清晰,排列整齐,细胞核明显,细胞无明显肿胀;急性心肌梗死组则观察到多发散在的坏死灶,界限清晰,可见有明显的成纤维细胞增生,心肌肥大,同时可见较多的纤维化;急性心肌梗死+miR-125b抑制剂后,急性心肌梗死的典型生理现象明显有所改善。详见图1。

假手术组
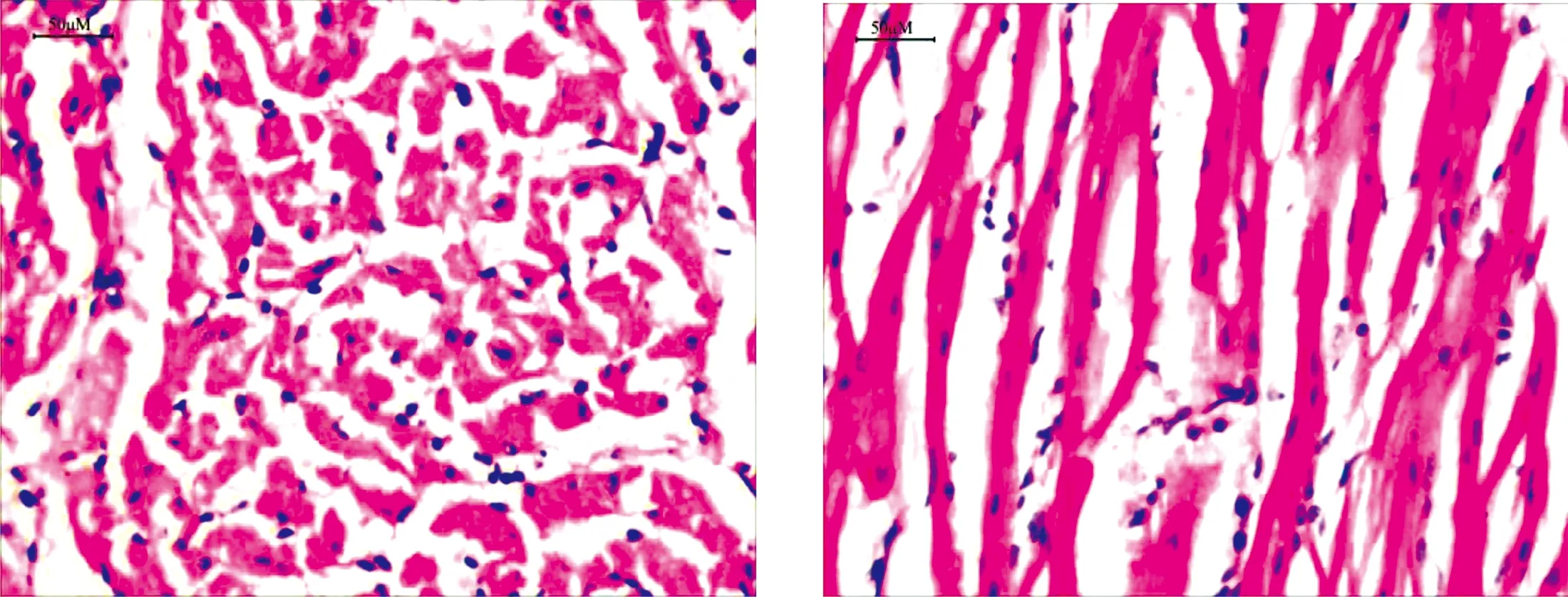
急性心肌梗死组
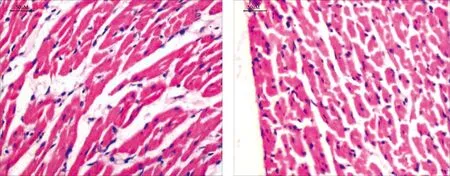
急性心肌梗死+miR-125b抑制物组
2.2 免疫组化染色结果 SFRP5在假手术组小鼠组织具有较高的表达;在急性心肌梗死组SFRP5表达显著下调;急性心肌梗死+miR-125b抑制剂转染组[0.24±0.05 vs 0.66±0.07,(P<0.01)]。详见图2。
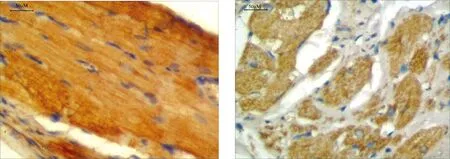
a为假手术组 b为急性心肌梗死组

C为急性心肌梗死+miR-125b抑制物组 各组胶原容积分数比较
2.3 Masson(10×10)染色结果 假手术组心肌组织被染成均匀红色,可见前壁的厚度较一致,心肌组织胶原纤维少,无条索状及融合的胶原纤维;急性心肌梗死组小鼠左心室前壁心肌梗死区心肌组织被胶原纤维取代,且显著增多,呈条索状,分割包绕心肌束,部分胶原纤维融合,并可见前壁变薄:急性心肌梗死组+miR-125b抑制剂转染组,急性心肌梗死后典型生理现象改善,IPP6.0分析Masson染色结果并计算胶原容积积分比较,6.75±1.15 vs 52.46±3.84 vs 17.48±1.74,P<0.01]。详见图3。

a为假手术组 b为急性心肌梗死组
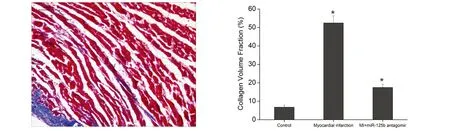
C为急性心肌梗死+ miR-125b抑制物组各组蛋白水平比较
图3 Masson(10×10)染色结果
3 讨 论
microRNAs参与生命活动的每一个生理过程,人类33.3%以上的基因直接受到microRNAs调控,且有证据提示microRNAs参与心室重构的许多功能尚不清楚[7-8]。较多研究显示,microRNAs可在转录后水平负调节目的基因表达,引起以心肌纤维化等心室重构路径中关键环节的变化而参与重构过程[9-10]。
参与心肌纤维化的microRNAs中,miR-21,miR-29等是研究较早的。miR-21在成纤维细胞丰富表达,且在心肌应激中上调,促进成纤维细胞增殖和细胞外基质沉积,参与纤维化进程。研究发现Spry1是miR-21的一个特异靶基因,miR-21会抑制Spry1在心肌成纤维细胞中的表达,进而上调丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外信号调节激酶(extracelluar regulated protein kinase,ERK)信号通路的活性,促进细胞增殖和分泌生长因子,从而影响心脏结构和功能,导致间质纤维化[11]。有研究发现,miR-21基因缺失的小鼠同样会出现心肌肥厚和心肌纤维化,因此miR-21影响心肌纤维化的具体机制仍需进一步研究探明。Luna等[12]研究发现,miR-29表达在心肌梗死后梗死区边缘及远处心肌中明显下调,细胞外基质如胶原等成分表达显著增强并出现间质沉积,出现明显心肌纤维化。Thum等[2]发现,心肌梗死后,miR-29b可以促进Ⅰ型胶原A1、A2和Ⅲ型胶原A1等几种胶原以及原纤蛋白1,从而导致细胞外基质沉积。
microRNAs参与肿瘤发生、转移及机体各组织的纤维化等许多生理及病理过程中,Wnt信号通路均起重要作用。Milosevic等[13]在特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)病人的肺成纤维细胞中观察到miR-154表达升高,肺成纤维细胞转染miR-154模拟物时,miR-154可下调Dkk、DIXDC1和PPP2CA等Wnt通路抑制因子的表达,上调FZD4/5/5、LRP和KREMEN1等Wnt受体激活因子的表达,从而激活Wnt信号通路活化,导致肺成纤维细胞增殖和迁移明显提高。肺成纤维细胞的表型转化受转化生长因子(TGF-β1)的调控,而miR-154可明显促进此作用,这说明miR-154通过Wnt信号通路发挥调控肺成纤维细胞活化的作用。SFRP1、Dkk2和Smad4等均是miR-1260b的靶基因,同时也是Wnt/β-catenin信号通路的关键因子,miR-1260b过表达可抑制上述靶基因在肾癌细胞中的表达,从而导致Wnt信号通路激活,进而显著增强肾癌细胞的增殖和转移能力[14]。
已有大量证据显示microRNAs在心肌纤维化中有重要作用,而SFRP5等Wnt信号通路成分在其中扮演的角色也日益受到关注,microRNAs与Wnt信号通路相互调控也得到许多研究支持[15-16]。
本研究设计实验以探讨miR-125b是否通过Wnt信号通路调节心肌纤维化。本研究前期实验结果显示,SFRP5这一Wnt通路的抑制信号受到miR-125b的靶向调控,miR-125b可通过抑制SFRP5表达,促进心肌纤维化进展。为进一步验证,构建急性心肌梗死动物模型,研究观察到急性心肌梗死后心肌形态及SFRP5表达的改变,转染miR-125b抑制剂至小鼠急性心肌梗死模型后,心肌纤维化明显减轻,心肌组织中SFRP5表达则有所上升,结果与之前体外实验一致,可以说明miR-125b可能有控制梗死后心肌纤维化的作用,SFRP5可能在其中扮演重要角色。
[1] 刘铭雅,魏盟.心肌梗死后心力衰竭发生机制及诊治进展[J].内科理论与实践,2014(1):21-25.
[2] Thum T,Lorenzen JM.Cardiac fibrosis revisited by micro RNA therapeutics[J].Circulation,2012,126(7):800-802.
[3] McMurray JJ,Packer M,Desai AS,et al.Angiotensin-neprilysin inhibition versus enalapril in heart failure[J].N Engl J Med,2014,371(11):993-1004.
[4] Olson EN.MicrorNAs as therapeutic targets and biomarkers of cardiovascular disease[J].Sci Transl Med,2014,6(239):239ps3.
[5] Jiang X,Ning Q,Wang J.Angiotensin Ⅱ induced differentially expressed microRNAs in adult rat cardiac fibroblasts[J].J Physiol Sci,2013,63(1):31-38.
[6] Duan J,Gherghe C,Liu D,et al.Wnt1/beta catenin injury response activates the epicardium and cardiac fibroblasts to promote cardiac repair[J].EMBO J,2012,31(2):429-442.
[7] Segura AM,Frazier OH,Buja LM.Fibrosis and heart failure[J].Heart Fail Rev,2014,19(2):173-185.
[8] Thannickal VJ,Zhou Y,Gaggar A,et al.Fibrosis:ultimate and proximate causes[J].J Clin Invest,2014,124(11):4673-4677.
[9] Orenes-Pinero E,Montoro-Garcia S,Patel JV,et al.Role of microRNAs in cardiac remodelling:new insights and future perspectives[J].Int J Cardiol,2013,167(5):1651-1659.
[10] Roderburg C,Urban G W,Bettermann K,et al.Micro-RNA profiling reveals a role for miR-29 in human and murine liver fibrosis[J].Hepatology,2011,53(1):209-218.
[11] Thum T,Gross C,Fiedler J,et al.MicroRNA-21 contributes to myocardial disease by stimulating MAP kinase signalling in fibroblasts[J].Nature,2008,456(7224):980-984.
[12] Luna C,Li G,Qiu J,et al.Cross-talk between miR-29 and transforming growth factor-betas in trabecular meshwork cells[J].Invest Ophthalmol Vis Sci,2011,52(6):3567-3572.
[13] Milosevic J,Pandit K,Magister M,et al.Profibrotic role of miR-154 in pulmonary fibrosis[J].Am J Respir Cell Mol Biol,2012,47(6):879-887.
[14] Hirata H,Ueno K,Nakajima K,et al.Genistein downregulates onco-miR-1260b and inhibits wnt-signalling in renal cancer cells[J].Br J Cancer,2013,108(10):2070-2078.
[15] Cai J,Guan H,Fang L,et al.MicroRNA-374a activates Wnt/beta-catenin signaling to promote breast cancer metastasis[J].J Clin Invest,2013,123(2):566-579.
[16] Brautigam C,Raggioli A,Winter J.The wnt/beta-catenin pathway regulates the expression of the miR-302 cluster in mouse ESCs and P19 cells[J].PLoS One,2013,8(9):e75315.
(本文编辑薛妮)
MicroRNA-125b Regulates Ventricular Remodeling after Acute Myocardial Infarction by SFRP5
Bie Zidong,Wang Dong,He Lin,Chen Xiuhua,Wang Yufeng,Lin Xiaojing,Wang Jingjing,Sha Yong
Weihai Central Hospital,Weifang Medical University,Weihai 264400,Shandong,China;Shandong University School of Medicine,Jinan 250012,Shandong,China
Wang Jingjing (General Hospital of Ningxia Medical University,Yinchuan 750004,Ningxia,China)
Objective To investigate the effect of microRNA-125b on ventricular remodeling after acute myocardial infarction (AMI) in mice and its mechanism.Methods The left anterior descending coronary artery ligation was used to construct the mouse myocardial infarction model.The electrocardiogram and pathological changes were used as the model of successful modeling.The AMI mice were randomly divided into 3 groups:sham operation group (n=6),AMI group (n=12) and AMI + miR-125b inhibitor transfection group (n=12).After two weeks,the pathological changes were observed by hematoxylin-eosin (HE) and Masson staining.Results HE staining showed that the striated segments of the myocardium were clear,neat,and clear in the nucleus and no obvious swelling in sham operation group.In the acute myocardial infarction group,there were multiple lesions in the necrotic foci,obvious fibroblast proliferation,cardiac hypertrophy,And more fibrosis was found.In the acute myocardial infarction + miR-125b inhibitor transfection group,the typical physiological phenomenon significantly improved.Immunohistochemical staining showed that secreted frizzled related protein 5 (SFRP5) was overexpressed in the sham-operated group.The expression of SFRP5 was significantly down-regulated in AMI group and the expression of SFRP5 was significantly increased in AMI + miR-125b inhibitor transfection group.Masson staining showed that the myocardial tissue in sham operated group was stained uniformly red,the thickness of the anterior wall of the left ventricle was more consistent,the collagen fibers of the myocardial tissue were less,and the collagen fibers were not linear or fused.In AMI group,the myocardium of the left anterior myocardial infarction area was replaced by collagen fiber,which was cord-like and divided around the myocardial bundle,and the anterior wall was thinned.The typical physiological symptoms after AMI improved in AMI + miR-125b inhibitor transfection group.There was a significant difference in collagen volume integrals among three groups (P<0.01).Conclusion The inhibition of miR-125b expression may improve ventricular remodeling after AMI.The mechanism may be through inhibition of SFRP5.
acute myocardial infarction; ventricular remodeling; microRNA-125b; secretory-type craniectin-associated protein 5
2015年宁夏自然基金(No.NZ15171);山东省威海市科技发展计划项目(No.2016GNS030-1)
1.潍坊医学院附属威海市中心医院(山东威海 264400);2.山东大学医学院;3.宁夏医科大学;4.宁夏医科大学总医院
王竟靖,E-mail:chenxiuhua126@163.com
信息:别自东,王东,何琳,等.微小RNA-125b作用于SFRP5调节急性心肌梗死后心室重构的实验研究[J].中西医结合心脑血管病杂志,2017,15(11):1315-1319.
R542.2 R256.2
A
10.3969/j.issn.1672-1349.2017.11.008
1672-1349(2017)11-1315-05
2016-09-06)
