脂蟾毒配基PLGA-TPGS纳米粒的体外细胞摄取及毒性研究Δ
2017-07-03褚秋辰徐荣谦张成鸿大连医科大学基础医学院辽宁大连6044大连医科大学药学院辽宁大连6044大连医科大学八年制06级临床医学专业辽宁大连6044
徐 红,高 萌,褚秋辰,董 浩,陈 雨,徐荣谦,张成鸿,田 燕#(.大连医科大学基础医学院,辽宁大连 6044;.大连医科大学药学院,辽宁大连 6044;.大连医科大学八年制06级临床医学专业,辽宁大连 6044)
脂蟾毒配基PLGA-TPGS纳米粒的体外细胞摄取及毒性研究Δ
徐 红1*,高 萌2,褚秋辰2,董 浩2,陈 雨3,徐荣谦3,张成鸿1,田 燕2#(1.大连医科大学基础医学院,辽宁大连 116044;2.大连医科大学药学院,辽宁大连 116044;3.大连医科大学八年制2016级临床医学专业,辽宁大连 116044)
目的:研究脂蟾毒配基(RBG)乳酸羟基乙酸共聚物-水溶性维生素E(PLGA-TPGS)纳米粒(RPTN)体外被人肝癌HepG2细胞、小鼠腹水型高淋巴道转移肿瘤HCa-F细胞的摄取情况和对HepG2细胞的毒性。方法:制备包载RBG和荧光标记物香豆素6的PLGA-TPGS纳米粒(RCPTN),荧光倒置显微镜观察HepG2、HCa-F细胞对RCPTN的体外摄取情况。将试验分为阴性对照组、空白PLGA-TPGS纳米粒(EPTN)组、5-氟尿嘧啶溶液(FS)组、RBG溶液(RS)组、RBG/PLGA纳米粒(RPN)组、RPTN组,采用水溶性四氮唑(WST-1)法考察不同终质量浓度(1.25、2.5、5、10、20µg/m L)的FS、RS、RPN和RPTN作用24、48、72 h后HepG2细胞在450 nm波长下的光密度,计算细胞存活率(CV)和半数抑制浓度(IC50)。结果:RCPTN分布在HepG2、HCa-F细胞的细胞核周围。RPN组和RPTN组细胞的CV随RBG浓度增加而减小,随作用时间延长而减小;与FS组比较,RPTN组细胞的CV均减小(P<0.05或P<0.01)。FS、RS、RPN和RPTN作用于HepG2细胞的IC50随时间的延长而减小,且IC50的大小依次为RS>FS>RPN>RPTN;RPN和RPTN作用48、72 h的IC50明显小于FS与RS(P<0.05或P<0.01)。结论:RPTN可将RBG带入HepG2、HCa-F细胞内部,其对HepG2细胞具有抑制作用,且作用强于RPN、RS和FS。
脂蟾毒配基;乳酸羟基乙酸共聚物-水溶性维生素E;纳米粒;肝癌HepG2细胞;腹水型高淋巴道转移肿瘤HCa-F细胞;细胞摄取;体外细胞毒性
脂蟾毒配基(Resibufogenin,RBG)是中药蟾酥的主要成分之一[1],具有广泛的生理、药理活性,如强心、增强心肌收缩、升血压、抗肿瘤等[2-5]。众多的细胞试验和动物试验均证明RBG是一种发展前景良好的天然抗癌药物[6-8],能作用于肿瘤发生的不同阶段,促使癌细胞凋亡。但因其本身难溶于水,并且具有较强的心脏毒性,口服生物利用度非常低,影响了其在临床上的应用。
纳米粒(Nanoparticles)是一种毒性相对较小、稳定性好的靶向制剂,iv后能将包载的药物靶向运送到肝、脾、骨髓等,降低药物在其他组织中的分布,从而提高疗效、减轻毒副作用[9]。纳米粒能否被肿瘤细胞直接摄取,对于纳米粒给药系统的研究与评价十分重要,较常用的方法是将纳米粒载体材料进行荧光标记或将荧光标记物包载到纳米粒内部后,在荧光显微镜下观察纳米粒被细胞摄取的过程。香豆素6(Coumarin-6,C6)是近年来常用于纳米粒给药系统体内示踪、体外细胞摄取等研究的脂溶性荧光标记物[10-11],具有性能稳定、荧光转化率高等优点。
本研究用自制材料乳酸羟基乙酸共聚物-水溶性维生素E(PLGA-TPGS)为载体,制备同时包载模型药物RBG和荧光标记物C6的RBG/C6-PLGA-TPGS纳米粒(RCPTN),利用C6的绿色荧光直观地研究人肝癌细胞HepG2和小鼠腹水型高淋巴道转移肿瘤细胞HCa-F对RCPTN的摄取情况。同时以PLGA-TPGS为载体,制备只包载RBG的RBG/PLGA-TPGS纳米粒(RPTN),并以市售材料PLGA为载体制备的RBG/PLGA纳米粒(RPN)为对照[12],采用水溶性四氮唑(WST-1)法考察RPTN和RPN对HepG2细胞的细胞毒性,以期为RPTN的体内靶向性评价、药效学研究等奠定基础。
1 材料
1.1 仪器
1200高效液相色谱仪(美国Agilent公司);354型酶标仪(美国Thermo公司);IX81倒置荧光显微镜(日本Olympus公司);Sorvall ST 16R台式离心机(美国Thermo Fisher公司,离心半径:13.5 cm)。
1.2 药品与试剂
RBG原料药(大连医科大学药物化学教研室提供,批号:20121120,纯度:98%);RCPTN[批号:20140110,规格:RBG 92 mg/g、C6 108 mg/g,粒径:(154.6±3.6)nm]、RPTN[批号:20140109,规格:RBG 183mg/g,粒径:(150.8±2.7)nm]、RPN[批号:20140109,规格:RBG 150 mg/g,粒径:(342.1±2.9)nm]、空白PLGA-TPGS纳米粒(EPTN,批号:20140110)均由大连医科大学药剂学教研室提供;5-氟尿嘧啶注射液(FS,上海旭东海普药业有限公司,批号:1402181,规格:25mg/m L);WST-1细胞增殖及细胞毒性检测试剂盒、优级胎牛血清(美国罗氏应用科学公司,批号:M 1680、20120906);4′,6-二脒基-2-苯基吲哚(DAPI,北京索莱宝科技有限公司,批号:20130110);碘化丙啶(PI,美国Sigma公司,批号:SLBC3518V,纯度:94.0%)。
1.3 细胞株与动物
人肝癌细胞HepG2购买于中国医学科学院基础医学研究所细胞中心;小鼠腹水型高淋巴道转移肿瘤细胞HCa-F由大连医科大学形态学教研室提供。健康昆明种小鼠,SPF级,8周龄,体质量20~25 g,♀♂不限,由大连医科大学实验动物中心提供,许可证号为SCXK(辽)2008-0002。
2 方法与结果
2.1 体外细胞摄取试验
2.1.1 细胞培养 (1)HepG2细胞在含10%胎牛血清的H-DMEM培养基中,于37、饱和湿度、含5%CO2的培养箱中培养,待细胞生长至80%~90%融合时,用磷酸盐缓冲液(PBS,pH 7.4)洗涤,0.25%胰酶消化液分散成单细胞悬液,取对数生长期的细胞进行试验。(2)常规方法复苏冻存的HCa-F细胞,调细胞密度为3×107个/m L,取200μL的细胞悬液接种在小鼠腹腔,培养腹水。
2.1.2 HepG2细胞摄取试验 参考文献[13]进行操作,取对数生长期HepG2细胞加至24孔板,细胞密度为1× 105个/孔,培养24 h。用含200μg/m L C6的RCPTN(RBG为170.4μg/m L,下同)在37下孵育4 h,冷PBS洗3次,75%乙醇固定10m in,吸走乙醇,冷PBS再洗3次,每次5m in。将200 ng/m L的DAPI加至样品孔中,染色15m in,冷PBS洗3次,每次5m in,用荧光倒置显微镜观察。结果显示,RCPTN分布在HepG2细胞核周围,显微镜图见图1。
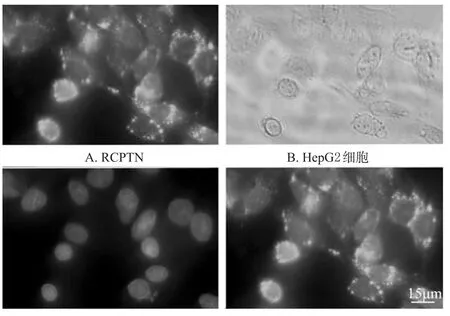
图1 HepG2细胞摄取RCPTN的显微镜图(×400)Fig 1 M icroscopy images of RCPTN by HepG2 cell up take(×400)
2.1.3 HCa-F细胞摄取试验 取活小鼠腹水2~3m L,置于10m L灭菌离心管中,加入适量PBS,离心(1 000 r/min,5min,下同),弃上清,再加入PBS重复操作至细胞沉淀内无血色。向沉淀中加3m LRCPTN[13],轻轻吹散,于37、5%CO2培养箱中孵育4 h,离心,沉淀用冷PBS洗3次,75%乙醇固定10m in后再离心,沉淀用冷PBS洗3次。每孔加PI(0.5μg/m L)300μL染色15min后离心,沉淀用冷PBS洗3次,取少量细胞悬液压片,用倒置荧光显微镜观察。结果显示,RCPTN分布在HCa-F细胞核周围,显微镜图见图2。
2.2 体外细胞毒性试验
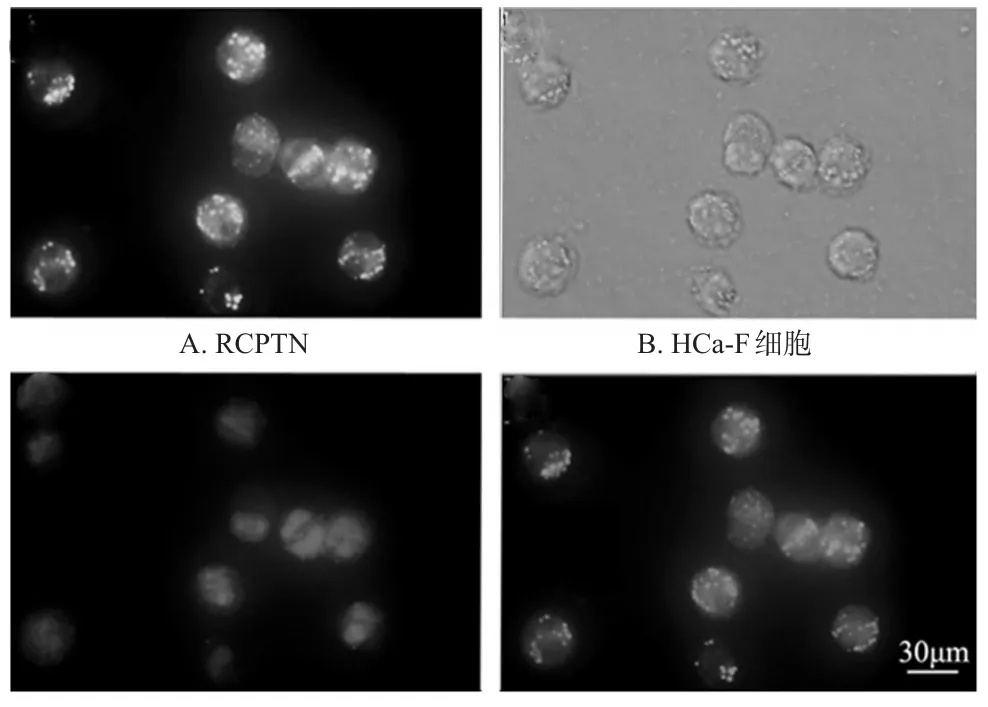
图2 HCa-F细胞摄取RCPTN的显微镜图(×400)Fig 2 M icroscopy images RCPTN by HCa-F cell uptake(×400)
2.2.1 分组与给药 为了消除96孔板和加入的培养液在测定样品时对光密度(OD)的影响,先用酶标仪测定450 nm波长下只加入50µL高糖DMEM培养液的空白96孔板的OD空白孔(n=6)。试验共分为6组,每个浓度6个复孔。(1)阴性对照组:接种细胞后不加任何药物,加入50µL高糖DMEM培养液;(2)EPTN组:接种细胞后加入50μLEPTN混悬液;(3)FS组:接种细胞后加入50 μL FS(5-氟尿嘧啶终质量浓度分别为1.25、2.5、5、10、20 μg/m L);(4)RBG溶液(RS)组:接种细胞后加入50μL RS(用含0.1%二甲基亚砜的无血清高糖DMEM培养液配制);(5)RPN组:接种细胞后加入50μLRPN混悬液;(6)RPTN组:接种细胞后加入50μL RPTN混悬液。其中,RPTN、RPN、RS组中RBG终质量浓度均分别为1.25、2.5、5、10、20μg/m L。试验中所有的纳米粒在给药前均需分散到适量无血清高糖DMEM培养液中,100W超声处理60 s,形成纳米粒的混悬液。
2.2.2 细胞存活率的测定 取对数生长期HepG2细胞,以1×104个/孔的细胞悬液接种于96孔板,每孔100μL。按“2.2.1”项下分组加入药物,分别作用24、48、72 h后,每孔加入WST-1溶液10μL,继续孵育4 h后终止培养。在酶标仪450 nm波长处测定各孔的OD,参比波长为600 nm,计算细胞存活率(CV)[CV(%)=(OD加药孔-OD空白孔)/(OD阴性对照孔-OD空白孔)×100%]。
2.2.3 数据处理与结果 用SPSS 13.0软件进行统计学分析。数据以±s表示,多组资料采用方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。各组细胞的CV测定结果见表1。
由表1可知,(1)HepG2细胞在EPTN组最大浓度下培养72 h的CV为(98.43±0.19)%,表明本研究制备纳米粒所用的材料PLGA-TPGS对HepG2细胞无明显的毒性;(2)随RBG质量浓度的增加、孵育时间的延长,RPN、RPTN组细胞的CV均降低(P<0.01),表明RPN和RPTN的体外抗肿瘤作用有RBG浓度依赖性和作用时间依赖性;(3)RS组细胞的CV与FS组比较均无明显差别,说明RS和FS加入细胞后能迅速达到最大药物释放量,从而发挥抗肿瘤作用,故不同时间点HepG2细胞的CV变化较小;(4)当纳米粒中RBG浓度为20μg/m L时,孵育时间为48 h、72 h时,RPN、RPTN组的CV较同浓度同孵育时间点FS组的CV均显著降低(P<0.01),表明RPN、RPTN具有很好的体外抗肿瘤活性和一定的缓释作用。⑤与RPN组比较,RPTN组细胞的CV均减低,表明RPTN体外抗肿瘤细胞作用优于RPN。
表1 各组细胞的CV测定结果(±s,n=6)Tab 1 Determ ination resultsof CV in each group(± s,n=6)

表1 各组细胞的CV测定结果(±s,n=6)Tab 1 Determ ination resultsof CV in each group(± s,n=6)
注:与FS组比较,*P<0.05,**P<0.01Note:vs.FSgroup,*P<0.05,**P<0.01
作用时间,h 24 CV,% 48 72 RPTN组75.12±0.21*72.31±0.24*68.46±0.22*61.32±0.15*45.17±0.13*58.23±0.11*52.67±0.15*45.25±0.23*38.54±0.22**18.71±0.26**50.87±0.19*45.93±0.12*41.09±0.23*31.52±0.24**14.65±0.17**质量浓度,μg/mL 1.25 2.5 5 10 20 1.25 2.5 5 10 20 1.25 2.5 5 10 20 EPTN组99.27±0.15 99.07±0.17 98.73±0.21 98.36±0.19 98.44±0.18 99.32±0.20 99.08±0.19 98.89±0.13 98.17±0.11 98.25±0.22 99.13±0.21 99.05±0.27 98.37±0.13 98.44±0.11 98.43±0.19 FS组88.25±0.22 86.91±0.25 84.47±0.26 79.43±0.19 68.73±0.13 86.62±0.17 85.03±0.21 81.94±0.25 75.58±0.23 62.73±0.17 75.33±0.13 68.06±0.11 60.65±0.22 57.16±0.19 48.82±0.11 RS组87.63±0.23 85.71±0.21 83.12±0.15 80.15±0.13 75.33±0.21 85.54±0.16 80.22±0.11 79.17±0.14 74.92±0.19 69.91±0.21 83.34±0.11 79.81±0.17 75.25±0.12 71.14±0.14 68.92±0.18 RPN组78.55±0.17 75.51±0.14 72.73±0.12 67.85±0.11 55.38±0.23 64.97±0.21*61.74±0.20*58.13±0.25*46.32±0.21*32.67±0.17*58.85±0.12*54.98±0.11 50.22±0.17 41.24±0.19 32.37±0.21*
2.2.4 半数抑制浓度(IC50)的测定 根据各组细胞抑制率[IR(%)=1-CV],将同一作用时间的5个药物浓度分别与对应的IR进行线性回归,得到不同作用时间的IR方程。将IR=50%代入该方程,计算IC50。各组细胞作用不同时间的IC50测定结果见表2。
表2 各组细胞作用不同时间的IC50测定结果(±s,n=6)Tab 2 Determ ination results of IC50after cell incubated for different time in each group(±s,n=6)

表2 各组细胞作用不同时间的IC50测定结果(±s,n=6)Tab 2 Determ ination results of IC50after cell incubated for different time in each group(±s,n=6)
注:与RS组比较,**P<0.01;与FS组比较,#P<0.05Note:vs.RSgroup,**P<0.01;vs.FSgroup,#P<0.05
RS组59.57±0.11 46.04±0.14 44.31±0.18作用时间,h 24 48 72 IC50,μg/mL RPTN组16.94±0.13**4.05±0.15**#0.66±0.17**#RPN组24.53±0.22**9.32±0.19**#5.92±0.21**#FS组38.10±0.27 30.01±0.29 17.44±0.17
由表2可知,在3个不同作用时间点,RPN组和RPTN组的IC50均比相应浓度、作用时间点RS组的IC50小(P<0.01);且在孵育24 h时,RPTN组、RPN组的细胞毒性是RS组的3.52倍和2.43倍。在孵育48、72 h时,RPN组和RPTN组的IC50均比相应浓度、作用时间点FS组的IC50小(P<0.05);且在孵育48 h时,RPTN组、RPN组的细胞毒性是FS组的7.41倍和3.22倍。这表明RBG纳米粒对HepG2的细胞毒性强于RS和FS。
3 讨论
由于RBG无荧光,故无法直观地观察RBG纳米粒被肿瘤细胞摄取的情况。本研究制备同时包载RBG和C6的RCPTN,用以考察HepG2细胞对纳米粒的摄取情况。结果可见,带荧光的RCPTN分布在细胞核周围,直观地证明了RCPTN可通过细胞摄取作用将RBG和C6同时带入肝癌细胞中,即RPTN也能通过细胞摄取作用进入细胞内部,进而发挥RBG对HepG2细胞的毒性作用。
本研究首次考察悬浮型细胞HCa-F对RCPTN的摄取情况,除HCa-F细胞形态与HepG2细胞不同外,细胞核周围也可见RCPTN发出的荧光,证明RCPTN也能被HCa-F细胞摄取,为后续其对荷HCa-F细胞小鼠的抗肿瘤作用研究奠定了基础。本课题组前期研究证实C6溶液无法被细胞摄取[13],同时由于细胞的容积是有限的,故纳米粒被细胞摄取量具有饱和性[14]。2种细胞与含C6的RCPTN在37下孵育4 h后,均需用PBS洗3次,以除去尚未被摄取进细胞内的纳米粒,从而证明了荧光显微镜下观察到的绿色荧光是细胞内的RCPTN所发出的。
体外细胞毒性试验中,不同浓度、不同作用时间下,RPTN、RPN的CV均小于RS,表明RPTN、RPN的体外抗肿瘤活性优于RS。与体外细胞毒性试验结合,RPTN比RS在作用24 h时具有对HepG2细胞更大的毒性是因为RBG分子跨膜吸收要经过被动扩散或主动转运过程,进入细胞后又可能在P糖蛋白的作用下而外排,降低了RBG的抑制作用。但RPTN不需要载体转运或浓度梯度扩散,可直接被HepG2细胞吞噬而进入细胞内,在细胞内溶酶体的作用下材料降解释放出RBG,既能将药物聚集在细胞内,又由于材料的缓释性而延长药物在细胞内的作用时间;同时载体材料PLGA-TPGS中所含的TPGS还可减少肿瘤细胞内P糖蛋白介导的多药耐药性(MDR)[15],故使RBG从纳米粒中释放出来后能更好地发挥其对HepG2细胞的抑制作用。此外,不同浓度、不同作用时间下,RPTN的CV小于RPN,表明RPTN的体外抗肿瘤活性优于RPN。这是因为RPTN的载体材料PLGA-TPGS中所含的TPGS可减少肿瘤细胞内P糖蛋白介导的MDR,改善细胞膜的渗透性,从而使纳米粒更易进入细胞从而发挥高效的抗肿瘤活性。其次,TPGS与PLGA合成的高分子材料PLGA-TPGS可改善PLGA的水溶性,其在细胞中释放更快、更完全,进一步增强了RBG的抗肿瘤活性。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:383-384.
[2] Zhang DM,Liu JS,Deng LJ,etal.Arenobufagin,a natural bufadienolide from toad venom,induces apoptosis and autophagy in human hepatocellular carcinoma cells through inhibition of PI3K/Akt/m TOR pathway[J].Carcinogenesis,2013,34(6):1331-1342.
[3]Qiu DZ,Zhang ZJ,WuWZ,etal.Bufalin,a component in chansu,inhibits proliferation and invasion of hepatocellular carcinoma cells[J].BMC Complement Altern Med,2013,doi:10.1186/1472-6882-13-185.
[4] 蒋洁君,周婧,马宏跃,等.蟾酥对豚鼠离体心脏的毒性作用和物质基础研究[J].中国实验方剂学杂志,2011,17(17):233-237.
[5] Qi F,LiA,InagakiY,etal.Antitumor activity of extracts and compounds from the skin of the toad bufo bufo gargarizans cantor[J].Int Immunopharmacol,2011,11(3):342-349.
[6] 张飞春,孙文革,高晓玲,等.蟾酥乙醇提取物抗肿瘤剂量效应关系实验研究[J].中国药业,2011,20(16):23-24.
[7] 刘丹,祝林,奉建芳.蟾酥中蟾毒配基类成分的分离纯化及其体外抗肿瘤活性的研究[J].中成药,2010,32(6):937-939.
[8] 唐信威,肖洁,宋健.酯蟾毒配基选择性杀伤肿瘤细胞的研究[J].中国癌症杂志,2012,22(3):196-199.
[9] Liong M,Lu J,Kovochich M,etal.Multifunctional inorganic nanoparticlesor imaging,targeting,and drug delivery[J].ACSNano,2008,2(5):889-896.
[10] Pamujula S,Hazari S,Bolden G,et al.Preparation and in-vitro/in-vivo evaluation of surface-modified poly(lactide-co-glycolide)fluorescent nanoparticles[J].J Pharm Pharmacol,2010,62(4):422-429.
[11] Win KY,Feng SS.Effects of particle size and surface coating on cellular uptake of polymeric nanoparticles for oral delivery of anticancer drugs[J].Biomaterials,2005,26(15):2713-2722.
[12] 徐红,褚秋辰,高萌,等.脂蟾毒配基-乳酸羟基乙酸共聚物纳米粒的制备与表征[J].中国药房,2014,25(31):2913-2915.
[13] 鲍旭,高萌,徐红,等.两种齐墩果酸纳米粒的体外细胞摄取研究[J].中国药房,2014,25(9):800-803.
[14] Bao X,Gao M,Xu H,etal.A noveloleanolic acid-loaded PLGA-TPGS nanoparticle for liver cancer treatment [J].Drug Dev Ind Pharm,2015,41(7):1193-1203.
[15] Guo Y,Luo J,Tan S,et al.The applications of vitam in E TPGS in drug delivery[J].Eur J Pharm Sci,2013,49(2):175-186.
(
Study on the in vitro Cell Uptake and Toxicity of Resibufogenin-loaded PLGA-TPGSNanoparticles
XU Hong1,GAO Meng2,CHU Qiuchen2,DONG Hao2,CHEN Yu3,XU Rongqian3,ZHANG Chenghong1,TIAN Yan2(1.College of Basic Medical Sciences,Dalian Medical University,Liaoning Dalian 116044,China;2.College of Pharmacy,Dalian Medical University,Liaoning Dalian 116044,China;3.Grade 2016 in Clinical Medical Eight Grade,Dalian Medical University,Liaoning Dalian 116044,China)
OBJECTIVE:To study the in vitro uptake of Resibufogenin(RBG)lactic acid glycolic acid copolymer-water soluble vitamin E(PLGA-TPGS)in human liver cancer HepG2 cells,mouse ascites-type lymphatic metastasis of tumor HCa-F cells,and the toxicity on HepG2 cells.METHODS:RCPTN loading RBG and coumarin-6(C6)were prepared.Fluorescent inverted microscope was used to observe the in vitro uptake by RCPTN HepG2,HCa-F cells.Itwas divided into negative control group,blank PLGA-TPGS nanoparticles(EPTN)group,5-fluorouracil solution(FS)group,RBG solution(RS)group,RBG/PLGA nanoparticles(RPN)group and RPTN group.WST-1 was conducted to investigate the optical density at 450 nm wavelength of HepG2 cells after 24,48,72 h incubated by FS,RS,RPN and RPTN w ith different final concentrations(1.25,2.5,5,10,20µg/m L);the cell viability(CV)and half inhibitory concentration(IC50)were calculated.RESULTS:RCPTN distributed around the nucleus of HepG2,HCa-F cells.CV was decreased by RBG concentration increased in RPN group and RPTN group,and decreased by time prolonged;compared w ith FS group,CV in RPTN group was decreased(P<0.05 or P<0.01).IC50of HepG2 cells incubated by FS,RS,RPN and RPTN was decreased by time prolonged,ordered by RS>FS>RPN>RPTN;IC50incubated by RPN and RPTN for 48,72 h was obviously less than that of FS and RS(P<0.05 or P<0.01).CONCLUSIONS:RPTN can deliver RBG into HepG2,HCa-F cells,show ing inhibition effect on HepG2 cellswhich is stronger than RPN,RS and FS.
Resibufogenin;Lactic acid glycolic acid copolymer-water soluble vitam in E;Nanoparticles;Liver cancer HepG2 cells;Ascites-type lymphaticmetastasis of tumor HCa-F cells;Cell uptake;in vitro cytotoxicity
R285
A
1001-0408(2017)16-2252-04
2016-09-18
2017-01-02)
(编辑:邹丽娟)
辽宁省科学技术计划项目(No.2015020308)
*实验师。研究方向:药物制剂、药理学、药效学。电话:0411-86110323。E-mail:859133790@qq.com
#通信作者:教授,硕士。研究方向:药物新制剂、新技术。电话:0411-86110420。E-mail:tiany2004@126.com
DOI10.6039/j.issn.1001-0408.2017.16.25
