移植物抗肿瘤效应抗大肠癌的实验研究
2017-07-01张晓川唐树尧李吉友陈志男侯利民叶振宇
张晓川 唐树尧 李吉友 陈志男 侯利民 叶振宇
移植物抗肿瘤效应抗大肠癌的实验研究
张晓川 唐树尧 李吉友 陈志男 侯利民 叶振宇
目的 通过移植物抗肿瘤效应和相关的细胞因子共同作用,建立一套综合的大肠癌辅助治疗方案。方法 对BALB/C小鼠的皮下注射CT26肿瘤细胞来建立结肠癌小鼠模型,将CT26肿瘤模型鼠随机分组治疗,记录它们的存活天数、肿瘤大小、肿瘤生长抑制率。结果 免疫细胞移植联合环磷酰胺(CP)治疗组的存活天数为(34.9±2.75)天,未治疗组存活天数(15.4±2.50)天(P<0.01)。联合治疗组肿瘤抑制率为94.3%。单独的CP治疗组和免疫细胞移植组肿瘤抑制率分别为99.4%和74.4%。结论 免疫细胞移植存在(GVT)效应,有益于肿瘤的治疗,是潜在的细胞免疫治疗实体瘤的新方法。
移植物抗肿瘤效应(GVT);大肠癌;同种异基因脾免疫细胞输注移植(DLI);环磷酰胺(CP)
(ThePracticalJournalofCancer,2017,32:875~878)
大肠癌是1种常见的严重威胁人类生命健康的恶性肿瘤,肿瘤免疫学各种学说的提出,使其成为新的研究热点[1]。近几年,利用激活免疫系统,打破原有的免疫耐受的机理来抗肿瘤的作用已经被广泛应用在临床中,例如乳腺癌[2]。现有的肿瘤靶向的免疫治疗被认为是较为安全和有效的手段,并且可以弥补长期放化疗对患者免疫系统的损伤[3]。利用自体淋巴细胞的移植,目前被认为可能对肿瘤治疗有效。然而,由于体外增殖,取材的困难,加之患者的免疫耐受和细胞传代中的污染等多方面问题可能导致肿瘤的复发,因此在临床中较少应用[4]。目前,关于免疫细胞移植(DLI)的异基因细胞免疫方面的研究正在迅速发展。异基因移植所引起的细胞免疫弥补了传统肿瘤免疫过程中副损伤大的缺点,并且提供了较强的的肿瘤杀伤力[5]。本实验中,我们用脾细胞作为供体免疫细胞。因为脾中含有大量淋巴细胞和少量造血干细胞,并且是天然的免疫器官。与其他移植相比,脾细胞移植有着操控性强,步骤简化,供者及受者并发症少的优点。因此,脾细胞诱导GVT有着较好的前景。
1 材料与方法
1.1 动物材料
受体小鼠32只(雌性),供体鼠10只(雄性),选自同种系BALB/C鼠,平均年龄8~10周,平均体重18~22克(哈尔滨医科大学动物实验中心提供)。 CT26结肠癌细胞(CRL-2638)由上海傅孟基因生物技术公司购买。CT26肿瘤细胞在含有10%牛胚血清的RPMI-1640培养液中,并在37°C温箱中培养使其达到指数增生期。牛胎血清补体灭活。
1.2 脾细胞悬液的制备和移植
1.2.1 制备悬液 供体近交系BALB/c(H2d)小鼠采用1%戊巴比妥钠溶液腹腔内注射麻醉,无菌条件切取脾脏置于10%肝素钠盐水溶液中,将脾脏组织反复剪切后经200目钢网滤过,滤过液加入5 ml淋巴细胞分离液,离心15 min,吸取中层液体加入1640培养液5 ml漂洗一次,再次加入1640培养液5 ml,即为脾细胞悬液。
1.2.2 细胞计数 吸取稀释后的细胞悬液,滴加在计数板上,让其自然流入计数池内,静止2 min,在显微镜下计数。细胞总数(个/ml)=四大格细胞总数÷4×10000×稀释倍数,根据计算结果将细胞悬液稀释为(1.5~2.0)×107/ml。
1.2.3 鉴别细胞活力的方法 吸取0.5 ml细胞悬液,滴加0.4%胎盼蓝染液0.5 ml,混匀染色2 min,吸取1滴显微镜下观察,蓝染者为死亡细胞。随机选取7~10个视野,计数1 000个细胞,得出活细胞的比例。
1.2.4 脾细胞移植 移植前3周将供体小鼠的脾细胞悬液1 ml[细胞总数为(1.0~2.0)×107/ml;细胞活力≥95%]经尾静脉输注到受体小鼠体内。接受脾细胞移植的小鼠出现皮肤红斑、脱毛、腹泻、体重减轻时,判为移植物抗宿主反应。
1.3 小鼠大肠癌模型的建立
用1.25 g/L胰蛋白酶溶液收获处于指数生长期CT-26细胞,吹打成单细胞悬液,用Hank's平衡盐溶液(HBSS)洗涤并重悬.用台盼蓝(trypan blue)清除试验鉴定,具有90%以上活力的单细胞悬液用于下一步实验,各组小鼠右侧腋窝皮下接种1×106个CT-26小鼠大肠腺癌细胞,接种肿瘤细胞以后观察各组小鼠的生存时间,监测小鼠肿瘤体积变化。
1.4 实验分组情况
用1.25 g/L胰蛋白酶处理CT26肿瘤细胞,并且台酚蓝染色,滤过坏死细胞,制成90%以上存活率的单细胞悬液。在每组小鼠右侧的腋下皮下注射CT26肿瘤细胞。观察小鼠的存活天数,肿瘤大小和体格情况。
雌性BALB/C系鼠,在第3、14、21、28天经尾静脉输注脾细胞。
接种CT26肿瘤细胞小鼠被随机分为4组,每组8只A组(不加治疗对照组):小鼠注射CT-26大肠癌细胞株+生理盐水注射;B组(环磷酰胺化疗组):小鼠注射CT-26 大肠癌细胞株+腹腔注射100 mg/kg环磷酰胺(CP);C组(DLI治疗组):同种异基因脾细胞输注+3周后小鼠注射CT-26 大肠癌细胞株+同种异基因脾细胞输注;D组(联合治疗组:DLI+CP):同种异基因脾细胞输注+3周后小鼠注射CT-26大肠癌细胞株+同种异基因脾细胞输注+环磷酰胺注射。
1.5 病理学检查
实验组取特定时间处死的小鼠,取皮下肿瘤组织病理切片,取材、固定、脱水、透明、浸蜡、包埋、切片、染色、封片等几个主要步骤,并放大1000倍,进行移植物抗宿主病病理分级并计算抑瘤率。
1.6 数据采集
存活天数为CT26癌细胞接种至死亡的天数。肿瘤抑制率为主要的评估肿瘤生长的方法,每天测量肿瘤的长短径。 肿瘤大小=长径×短径;肿瘤生长抑制=(未治疗组肿瘤大小-治疗组肿瘤大小)-未治疗组肿瘤大小×100%。
1.7 统计分析
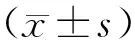
2 结果
2.1 肿瘤模型和生存状况
接种CT26大肠癌细胞后3~5天的小鼠,肿瘤开始明显生长,在光镜下进行观察,放大1000倍。
由表1可见,A组生存天数最短(15.4±2.50)d,B组为(25.5±4.00)d,C组为(19.4±3.42)d,说明CP和DLI对C726肿瘤有作用。D组存活天数最长(34.9±2.75)d,说明CP和DLI联合治疗的有效性。
B组和D组腹腔注射CP后,出现明显的体重减轻、脱毛、行动迟缓等症状,C组和D组中应用DLI的小鼠出现皮肤干皱、活动迟缓,并在治疗过程中逐渐恶化。然而没有因移植排斥反应而死亡的个体。

表1 不同组别小鼠的生存状况
注:a为与A组比较,P<0.01;b为与B组比较,P<0.01;c为与C组比较,P<0.01。
2.2 肿瘤生长状况
四组中的肿瘤生长状况呈现明显的不同,接种肿瘤细胞3天后,肿瘤开始在右腋下接种部位明显生长。A组中生长最快,C组中生长最慢。B组和D组中经CP治疗后3天肿瘤逐渐变小甚至消失。然而,B组肿瘤在CP停药后3天开始逐渐长大。D组中肿瘤在停药后第5天逐渐长大,见表2。
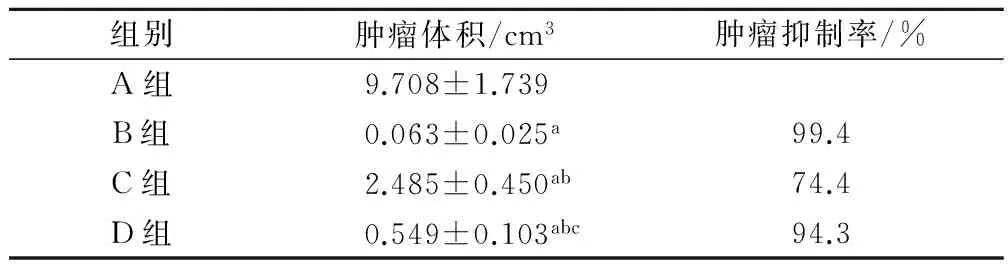
表2 3天后不同组小鼠的肿瘤体积及肿瘤抑制率
注:a为与 A组比较,P<0.01;b为与B组比较,P<0.01;c为与C组比较,P<0.01。
2.3 组织病理学改变
四组小鼠的肿瘤组织中存在不同程度的出血坏死。B组小鼠肿瘤组织中存在明显的细胞增大。D组小鼠肿瘤组织中淋巴滤泡大量增殖。
3 讨论
本实验中,时间的关键点是CT26肿瘤细胞接种后第3天,此时肿瘤的大小可明显观察到。因此,不同治疗组的治疗药物从第3天开始添加。Zinocher团队[6]研究发现时间点的选取对免疫性治疗和化学治疗的治疗效果有关键性的影响。我们发现第3~5天免疫接种的适当的时机。因此,在第3天化疗后进行免疫接种,可以避免小鼠过早死亡。
目前,淋巴细胞的移植仍然局限在实验阶段。尽管有实验说明移植物对肿瘤有治疗效应,但使之应用于临床还存在很多困难。 Moscovith团队发现异源的淋巴细胞在原发性淋巴瘤和转移性乳腺癌中有抗肿瘤作用[7]。此外,移植异源基因诱发GVT抗肿瘤的作用被认为是免疫治疗的最有效手段[8]。临床上已有利用异基因移植治疗卵巢癌、前列腺癌、直肠癌,胰腺癌的报道。综上所述,在实体瘤的研究中,移植物抗肿瘤的效应可能是肿瘤治疗的新突破。
应用异源淋巴细胞取代造血干细胞目的是抑制免疫反应。同时保持受体的造血功能。值得注意的是,治疗前并未对小鼠进行照射。因为在经照射的小鼠会出现淋巴细胞输注后的骨髓抑制[9]。
环磷酰胺(CP)是目前应用广泛的化疗药物[10]。CP主要作用于细胞有丝分裂周期,抑制DNA的合成,因此可以抑制T细胞分化和B细胞产生抗体。T细胞和B细胞对CP高度敏感,然而Th细胞和效应T细胞对CP不敏感。因此,CP主要抑制体液免疫而非细胞免疫。实验发现对异源脾细胞输注后的小鼠用CP进行预处理可诱发轻微的免疫耐受。在小鼠的植皮实验中,由于主要组织相容性复合体(MHC)的差异导致异源物移植和CP联合治疗不能延长小鼠的生存期。因此,这种治疗方式只适用于对免疫耐受较差的肿瘤小鼠的生存期的延长。
鉴于Suzuki团队[11]的研究,CP能杀灭宿主大多数的T细胞。然而小部分T细胞存活并迅速增殖分化。这种T细胞能对CP产生抗性,并分化成记忆性的细胞。在异源物中可能存在不同的组织相容性抗原和不同数量的免疫细胞。所以,对这些细胞的清除是能否诱发移植物耐受的关键。研究发现,通过异基因移植联合CP预处理,再进行大量的异源脾细胞移植可以导致小鼠长期的免疫细胞分离。这种现象可以提高免疫耐受,并且显著提高生存期[12]。
关于移植物抗肿瘤的机制目前还不是十分清楚,体外实验发现移植的脾细胞含有大量CD4+T细胞、NK细胞和单核细胞,在这些细胞中,T细胞和NK细胞可能与抗肿瘤作用关系密切。然而,在移植物抗肿瘤的效应中,T细胞存在着副作用[13]。因此,本实验为以后对T细胞作用以及GVT的机制研究打下了基础。肿瘤的免疫耐受可能与肿瘤起源于自身正常组织相关。在肿瘤发病过程中,Ⅰ类主要组织相容性复合体(MHC)下调。因此,特异性的细胞毒性T细胞不能被激活。进一步的研究表明对于异基因移植(DLI)的策略十分关键,一次性大剂量的植入会引起严重的GVHD反应,而小剂量多次的植入被认为能降低GVHD的效应。本实验认为应首先考虑移植的时机,其次考虑移植的剂量。在CP和DLI联合治疗组中,输注的BALB/C小鼠的脾细胞为1.0×107个/ml,分别于第3、14、21,28天。CP剂量为100 mg/kg。
DLI联合CP处理可以诱发特异性的免疫耐受。本实验中预处理十分重要.。DLI和CP对CT26肿瘤的治疗表现为协同的作用,肿瘤得到了明显的抑制。并且存活期明显延长。供体的脾细胞有潜在的抗肿瘤作用,移植的脾中含有大量的异源淋巴细胞和少量造血干细胞。此理论可能对实体瘤的治疗大有裨益。然而本实验仍存在明显不足,比如未能发现治疗过程中肿瘤的病理学变化,对具体的机制认识不清等。这也将是我们下一阶段的工作方向。
[1] Shi H,Sun M,Liu L.Chimeric antigen receptor for adoptive immunotherapy of cancer:latest research and future prospects〔J〕.Mol Cancer,2014,21(13):219-226.
[2] Thomas-Schoemann A,Batteux F,Mongaret C,et al.Arsenic trioxide exerts antitumor activity through regulatory T cell depletion mediated by oxidative stress in a murine model of colon cancer〔J〕.J Immunol,2012,189(11):5171-5177.
[3] Toomey PG,Vohra NA,Ghansah T,et al.Immunotherapy for gastrointestinal malignancies〔J〕.Cancer Control,2013,20(1):32-42.
[4] Lee EM,Hurh S,Cho B,et al.CD70-CD27 ligation between neural stem cells and CD4+ T cells induces.Fas-FasL-mediated T cell death〔J〕.Stem Cell Res Ther,2013,4(3):56.
[5] Gao J,Bernatchez C,Sharma P,et al.Advances in the development of cancer immunotherapies〔J〕.Trends Immunol,2013,34(2):90-98.
[6] Zinōcker S,Dressel R,Wang XN,et al.Immune reconstitution and graft-versus-host reactions in rat models of allogeneic hematopoietic cell transplantation〔J〕.Front Immunol,2012,3:355.
[7] Mazzarella L.Tales from the Jazz ASH:highlights from the 2013 American Society of Haematology meeting〔J〕.Ecancermedicalscience,2014,8:390.
[8] Grupp SA,Kalos M,Barrett D,et al.Chimeric antigen receptor-modified T cells for acute lymphoid leukemia〔J〕.N Engl J Med,2013,368(16):1509-1518.
[9] McIver Z,Melenhorst JJ,Wu C,et al.Donor lymphocyte count and thymic activity predict lymphocyte recovery and outcomes after matched-sibling hematopoietic stem cell transplant〔J〕.Haematologica,2013,98(3):346-352.
[10] Takeuchi A,Eto M,Yamada H,et al.A reduction of recipient regulatory T cells by cyclophosphamide contributes to an anti-tumor effect of nonmyeloablative allogeneic stem cell transplantation in mice〔J〕.Int J Cancer,2012,130(2):365-376.
[11] Suzuki J,Ricordi C,Chen Z.Immune tolerance induction by integrating innate and adaptive immune regulators〔J〕.Cell Transplant,2013,19(3):253-268.
[12] Leventhal J,Abecassis M,Miller J,et al.Chimerism and tolerance without GVHD or engraftment syndrome in HLA-mismatched combined kidney and hematopoietic stem cell transplantation〔J〕.Sci Transl Med,2012,4(124):124ra28.
[13] Gill S,Porter DL.CAR-modified anti-CD19 T cells for the treatment of B-cell malignancies:rules of the road 〔J〕.Expert Opin Biol Ther,2014,14(1):37-49.
(编辑:吴小红)
Study of Graft Versus Tumor Effect for Colorectal Cancer
ZHANGXiaochuan,TANGShuyao,LIJiyou,etal.
TheFirstAffiliatedHospitalofHarbinMedicalUniversity,Harbin,150000
Objective To build a comprehensive adjuvant therapy for colorectal cancer through graft versus tumor effect(GVT) and related cell factor.Methods Subcutaneous injection of CT26 tumor cells of BALB/C mice was conducted to establish the mouse model of colorectal cancer The mice model were randomized into different group and recorded survival times,tumor size and tumor growth inhibition rates.Results The group treated by DLI+ CP survived (34.9±2.75) days and the untreated group survived (15.4±2.50) days(P<0.01).The tumor inhibitory rate was 94.3% in DLI+CP group and CP or DLI alone group were 69.4% and 74.4%.Conclusion GVT effect is helpful for the treatment of tumor,it is a new method for the treatment of solid tumor cells in the future.
Graft versus tumor effect(GVT);Colorectal cancer;Donor lymphocyte infusion(DLI);Cyclophosphamide (cp)
苏州市2015年度第九批产业技术创新专项(编号:SYS201552)
150000 哈尔滨医科大学第一临床医学院(张晓川,唐树尧,李吉友,陈志男,侯利民);215004 苏州大学附属第二医院(叶振宇)
侯利民
10.3969/j.issn.1001-5930.2017.06.002
R735.3+4
A
1001-5930(2017)06-0875-04
2016-07-08
2017-03-21)
