直肠癌肝转移患者肿瘤组织CD44、CD166阳性表达的临床意义
2017-07-01李幸
李幸


【摘要】 目的:探讨直肠癌肝转移患者肿瘤组织中CD44与CD166阳性表达的临床意义。方法:选取笔者所在医院2013年1月-2016年12月笔者所在医院收治146例直肠癌患者的肿瘤组织标本,其中32例为肝转移患者(转移组),另外114例为未转移患者(对照组),分别对各组样本进行SP免疫组化染色法进行检测,观察两组标本组织中CD44、CD166阳性表达情况,并初步探讨其阳性表达与患者肿瘤浸润深度、肿瘤分化程度的相关性。结果:对照组和转移组CD44阳性表达率分别为42.98%和71.87%,差异有统计学意义(P<0.05);对照组和转移组CD166阳性表达率分别为36.84%和81.25%,差异有统计学意义(P<0.05);肝转移患者中CD44和CD166阳性表达与浸润深度有密切关系,肿瘤浸润深度越深其阳性表达率越高,差异有统计学意义(P<0.05);而与分化程度无密切关联。结论:CD44和CD166高阳性表达可作为直肠癌肝转移的标志性指标,对直肠癌肝转移患者的早期诊断具有积极的作用,并且CD44和CD166高阳性表达与患者浸润深度有密切的关系。
【关键词】 直肠癌; 肝转移; CD44; CD166; 阳性表达
doi:10.14033/j.cnki.cfmr.2017.17.014 文献标识码 B 文章编号 1674-6805(2017)17-0031-03
直肠癌是发生在齿状线至直肠乙状结肠交界处之间的癌,属于消化道最常见的恶性肿瘤之一[1]。近年来随着人们生活水平及饮食习惯的改变,直肠癌发病呈现出上升及年轻化趋势,并且由于直肠癌发病位置较低且深入盆腔,虽较易诊断,但其解剖关系较为复杂,手术不易彻底清除,术后复发率和转移率较高,肝脏是直肠癌发生远处转移的主要靶器官之一,发生肝转移后的直肠癌患者不仅病情更加复杂而且严重影响患者的治疗及预后[2]。临床研究显示,单纯直肠癌5年生存率约66%,而直肠癌肝转移患者3年生存率约12%[3]。早期的诊断与标志物监测对直肠癌肝转移患者的临床治疗与生命安全具有重要的意义与作用。CD44、CD166与直肠癌的发生、发展和转移关系密切,为进一步探讨二者在直肠癌肝转移患者肿瘤组织阳性表达的临床意义,笔者针对146例直肠癌患者的肿瘤组织标本(32例为肝转移患者)进行研究探讨,以为后期直肠癌患者肝转移的临床诊断提供基础参考,现汇报如下。
1 资料与方法
1.1 一般资料
选取笔者所在医院2013年1月-2016年12月笔者所在医院收治的146例直肠癌患者的肿瘤组织标本,其中32例为肝转移患者(转移组),另外114例为未转移患者(对照组),纳入所有标本对应患者留取标本前均未进行相关对应治疗,其中转移组(32例)对应患者男女比例(5∶3),年龄35~69岁,平均(58.29±9.46)岁,病程5~40个月,平均(20.63±10.96)个月;原发肿瘤大小:小于2 cm为6例,2~5 cm为11例,大于5 cm为15例;浸润深度:T2 9例,T3 12例,T4 11例;分化程度:低分化腺癌17例,中分化腺癌10例,高分化腺癌5例;肝转移部位:左侧单叶4例,右侧单叶11例,双叶17例;转移灶数量:单个6例,多个26例。对照组(114例)对应患者男女比例(73∶41),年龄36~70岁,平均(56.87±8.92)岁,病程7~40个月,平均(21.47±11.58)个月;原发肿瘤大小:小于2 cm为15例,2~5 cm为32例,大于5 cm为67例;浸润深度:T2 66例,T3 34例,T4 14例;分化程度:低分化腺癌63例,中分化腺癌39例,高分化腺癌12例。两组患者性别、年龄、病程及浸润深度等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准
纳入标准:(1)诊断明确且临床病历资料完整者;(2)经CT、MRI或术中探查切除标本病理检查确诊者;(3)患者年龄30~70岁者;(4)患者及其家属对本研究知情并同意且签署知情同意书者。
排除标准:(1)合并其他类型肿瘤者;(2)合并其他严重疾病或严重并发症者;(3)恶性肿瘤既往病史者;(4)其他相关禁忌者。
1.3 方法
1.3.1 主要试剂 D44与CD166单抗;聚合物辅助剂;二抗CD44/CD166试剂盒;免疫组化SP染色试剂盒;标记抗山羊辣根酶 IgG多聚体;小牛血清;PBS缓冲液; DAB试剂盒。
1.3.2 实验方法 对所有标本进行厚4 μm连续两张切片,并进行载玻片平铺,65 ℃条件下过夜处理。根据免疫组化SP染色试剂盒操作说明采用SP免疫组化染色法分别对D44与CD166进行检测,采用二甲苯进行脱蜡处理后,采用酒精进行梯度脱水,蒸馏水冲洗完成后采用PBS浸泡5 min。于高压下采用枸橼酸缓冲液进行抗原修复,高压锅喷气3 min,完成后室温下进行冷却。室温下采用百分之三H2O2孵育10 min,PBS 液振荡清洗3 min(重复3次),将CD44/CD166羊抗人抗体采用1∶150的比例进行滴定,37 ℃条件下孵育2 h,完成后PBS冲洗2 min(重复3次),完成后滴加聚合物辅助剂,于37 ℃条件下孵育
20 min后PBS冲洗2 min(重复3次),完成后进行标记抗山羊辣根酶IgG多聚体滴加,37 ℃条件下孵育20 min,再进行PBS冲洗2 min冲洗(重复3次),完成后进行DAB显色,显微镜下控制染色程度,完成后流水冲洗10 min,苏木素复染2 min后予以盐酸酒精进行分化,流水冲洗10 min返蓝。最后酒精梯度脱水,二甲苯透明,中性树胶进行封片。
1.4 观察指标
(1)观察两组标本组织中CD44、CD166阳性表达情况;(2)肝转移患者中CD44阳性表达与患者浸润深度、分化程度的相关性;(3)肝转移患者中CD166阳性表达与患者浸潤深度、分化程度的相关性。
1.5 阳性判定标准
(1)CD44与CD166阳性:细胞质、上皮细胞膜呈棕黄色;(2)CD44与CD166阴性:切片无阳性细胞[4]。
1.6 统计学处理
采用统计学处理软件SPSS 19.0对研究数据进行统计学处理,计量资料以(x±s)表示,采用t检验,计数资料以率(%)表示,采用字2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组标本组织中CD44、CD166阳性表达情况
对照组和转移组CD44阳性表达率分别为42.98%和71.87%,差异有统计学意义(P<0.05);对照组和转移组CD166阳性表达率分别为36.84%和81.25%,差异有统计学意义(P<0.05),见表1。
2.2 不同浸润深度、分化程度肝转移患者CD44阳性表达
结果显示,肝转移患者中CD44阳性表达与浸润深度有密切关系,肿瘤浸润深度越深其阳性表达率越高,差异有统计学意义(P<0.05);而CD44阳性表达与分化程度无密切关联,见表2。
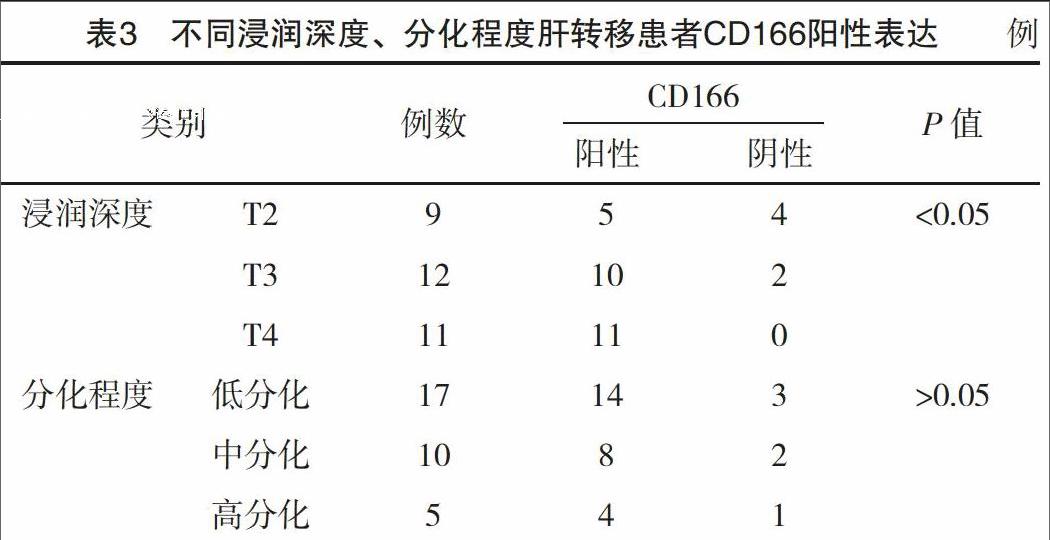
2.3 不同浸润深度、分化程度肝转移患者CD166阳性表达
结果显示,肝转移患者中CD166阳性表达与浸润深度有密切关系,肿瘤浸润深度越深其阳性表达率越高,差异有统计学意义(P<0.05);而CD166阳性表达与分化程度无密切关联,见表3。
3 讨论
近年来,直肠癌发病率逐年上升,并有年轻化的趋势,这与社会因素、遗传因素与饮食因素具有密切的联系[5]。直肠癌肝转移是直肠癌患者远处转移最常见的类型,并且由于直肠癌肝转移患者早期症状不明显,容易被临床和患者忽视而延误病情。临床研究显示,直肠癌患者临床确诊时肝转移率高达25%,且肝转移是严重影响患者预后的重要因素[6]。Schindl等[7]的研究中表示,直肠癌肝转移术后5年生存率仅为19.7%,并且直肠癌肝转移后患者手术切除率较低。在这种情况下,肝转移早期的诊断与相关肿瘤干细胞的检测具有重要的临床意义。
CD44为细胞表面糖基化黏附分子,广泛存在于多种细胞中,CD44基因由高度保守的19~20个外显子构成,在11号染色体短臂上,经转录后生成CD44s(标准型)或CD44v(变异型)两种蛋白,在肿瘤的发生与发展过程中CD44呈现高表达,同时在肿瘤侵袭和转移中起到促进作用[8]。CD166是一种免疫球蛋白,属于超基因家族中的一员,不仅能够与机体淋巴细胞的抗原CD6特异性结合,表现为同嗜性黏附、同型间结合,而且可以呈异嗜性黏附、异型间结合,其在肿瘤组织中呈高表达状态,而且能够调节肿瘤的生长和转移[9]。另一方面,结直肠癌肝转移过程中,肿瘤自身可分泌多种蛋白酶,可降解基底膜和细胞外基质,基底膜被降解后,可向周围组织间质迁移,经脉管进入血液、淋巴循环并逃避免疫系统的攻击,最后伴随血液循环或淋巴循环到达继发部位,于继发部位组织发生黏附,形成克隆并增生生长,继而促使微血管生成,加速转移瘤的形成[10]。在本文研究中,转移组CD44和CD166阳性表达率分别为71.87%和81.25%,均表现为高阳性表达,而未发生转移的患者中,二者阳性表达率均性对较低,结果提示,CD44和CD166高阳性表达可作为直肠癌肝转移的标志性指标。在直肠癌肝转移患者CD44和CD166的研究中,司志英等[11-12]在各自的研究中表示,CD44和CD166高阳性表达与患者性别、年龄、病程及肿瘤大小无明显关联,而与浸润深度和分化程度可能相关,为进一步证实其结论,本文对肝转移患者中CD44和CD166阳性表达与患者浸润深度、分化程度的相关性进行初步探讨,结果显示,肝转移患者中CD44和CD166阳性表达与浸润深度有密切关系,而与分化程度无密切关联。
综上所述,CD44和CD166高阳性表达可作为直肠癌肝转移的标志性指标,对直肠癌肝转移患者的早期诊断具有积极的作用,并且CD44和CD166高阳性表达与患者浸润深度有密切的关系。
参考文献
[1]中华医学会外科学分会胃肠外科学组,中华医学会外科学分会结直肠肛门外科学组,中国抗癌协会大肠癌专业委员会,等.结直肠癌肝转移诊断和综合治疗指南(V2013)[J].中华胃肠外科杂志,2013,16(8):780-788.
[2]孙毅,尚革,包永星,等.77例直肠癌伴肝转移患者的預后因素分析[J].中华肿瘤杂志,2010,32(8):622-625.
[3]孙增峰,孙亚方,谈丽彩,等.结直肠癌脑转移的临床特征及预后因素分析[J].中华肿瘤杂志,2016,38(1):63-68.
[4]吕远.OPN与CD44在结直肠癌及其肝转移组织中的表达、临床意义与预后[D].重庆:第三军医大学,2015.
[5]袁友红,邢祖民,林春水,等.影响结直肠癌手术预后因素的回顾性分析[J].实用医学杂志,2012,28(17):2912-2915.
[6]周鹏扬,王建伟.结直肠癌肝转移的可切除性判断[EB/OL].中华结直肠疾病电子杂志,2016,5(5):390-397.
[7] Schindl M,Wiqmore S J,Currie E J,et al.Prognostic scoring in colorectal cancer liver metastases:development and validation[J].Arch Surg,2005,140(2):183-189.
[8]陈冰琳,郭坤,刘银坤,等.黏附分子 CD44 的表达及其糖基化与肝癌转移的相关性[J].中华肝脏病杂志,2011,19(12):898-903.
[9]张钧书,王科,黄建.肿瘤干细胞标志物 CD166 在结肠癌的表达及其临床生物学意义[J].浙江医学,2013,35(12):1123-1126.
[10]吴肖,王爱军,王红钰,等.结直肠癌侵袭转移与双向调节因子的关系及其作用机制[J].中华实验外科杂志,2016,33(11):2569-2572.
[11]司志英,靳英,李有才.CD44和CD166在直肠癌肝转移诊断中的价值研究[J].中国免疫学杂志,2015,31(8):1105-1108.
[12]吴伟强.肿瘤干细胞标志物CD44、CD166在直肠癌中的表达及其与肝转移相关性研究[D].大连:大连医科大学,2012.
