黑眉锦蛇肠道菌群结构分析
2017-07-01时云朵孙豪
时云朵,孙豪
黑眉锦蛇肠道菌群结构分析
时云朵1,孙豪2*
(1.四川省水产学校,四川成都 611730;2.雅安市农业局畜牧发展中心,四川雅安 625000)
采用PCR–DGGE和Q–PCR技术,分析黑眉锦蛇空肠、回肠和直肠中菌群的结构。结果显示:黑眉锦蛇空肠、回肠和直肠中菌群的多样性指数分别为2.84、3.14、2.69,均匀度分别为0.78、0.86、0.74,丰富度分别为17.20、23.40、14.80,且各肠段中均以厚壁菌门细菌和拟杆菌门细菌居多,总菌和厚壁菌门细菌、拟杆菌门细菌的丰度分别达108.07、106.82和106.30CFU/g以上,梭菌属细菌、乳酸菌属细菌和细菌的丰度均达105.05CFU/g以上,且其丰度均随肠道沿头部向尾部的方向呈先增加后降低的趋势,直肠中的丰度低于空肠中的;肠球菌属细菌和肠杆菌科细菌的丰度均在106.11CFU/g以上,其在直肠中的丰度高于空肠中的。结果表明:黑眉锦蛇肠道中拟杆菌门细菌和厚壁菌门细菌为优势菌群;菌群的丰度随肠道沿头部向尾部的方向呈先增加后降低的趋势;益生菌在直肠中的丰度低于在空肠中的,有害菌在直肠中的丰度高于在空肠中的。
黑眉锦蛇;肠道菌群;微生态;益生菌
黑眉锦蛇()是一种大型无毒蛇,性情温顺,常被当作另类宠物饲养[1],其肉味鲜美,有较高的营养和保健价值,肉、胆、蜕均可作为优良的天然药材,皮是制作工艺品的上乘材料。在黑眉锦蛇养殖中,口腔炎、肠炎和消化不良综合征是其主要的消化系统疾病。目前,蛇类疾病的防治主要是用抗生素类药物,而抗生素类药物严重影响其食用和药用价值[2]。肠道中的正常菌群与机体的消化和健康密切相关[3]。目前,对动物肠道中菌群的研究主要针对哺乳类,对爬行类的研究较少,且多采用活菌培养法。Iqbal等[4]用活菌培养法对眼镜蛇肠道中的需氧和兼性厌氧菌群进行了研究,但未揭示肠道中的菌群结构。现代分子技术已成为微生态研究的主要技术。Sun等[5]采用PCR–DGGE和Q–PCR技术揭示了獭兔胃肠道中的菌群结构;Hill[6]等应用PCR–DGGE技术揭示了响尾蛇肠道中的菌群结构。笔者采用PCR–DGGE和Q–PCR技术分析黑眉锦蛇空肠、回肠和直肠中的菌群结构,旨在为黑眉锦蛇肠道微生态的研究和黑眉锦蛇源益生菌的筛选提供参考依据,并为其人工健康养殖提供技术支撑。
1 材料与方法
1.1试验动物及样品采集
试验动物购自云南省某养殖场。选5条成年健康的黑眉锦蛇,喂养1周后,用75%的乙醇棉球擦拭其体表。用乙醚对其麻醉后断头处死,于无菌环境取其空肠、回肠和直肠中的内容物,-80 ℃保存,备用。
1.2主要试剂与仪器
DcodeTM突变检测系统、PCR仪和荧光定量PCR仪购自Bio–Rad公司;DNA提取试剂盒、胶回收试剂盒和质粒提取试剂盒购自Omege公司;SYBR®Premix ExTM II、pMD®19–T载体和2×MasterMix(含染料)购自宝生物工程(大连)有限公司;大肠杆菌()DH5α购自天根生化科技(北京)有限公司。
1.3细菌总DNA的提取和16S rDNA V3区的扩增
严格按照DNA提取试剂盒的使用说明抽提细菌总DNA,测定其浓度后置于-20 ℃冰箱保存,备用。细菌16S rDNA V3区通用引物序列[5]为314f–GC(5–CCTACGGGAGGCAGCAG–3,下划线部分为“GC”夹子序列)和518(5–AT TACCGCGGCTGCTGG–3)。PCR扩增体系(25 μL):2×MasterMix 12.5 μL,上、下游引物各0.01 nmol,模板DNA 20 ng,用ddH2O补足至25 μL。反应程序:95 ℃预变性4 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸8 min。
1.4PCR–DGGE电泳和条带克隆测序
PCR–DGGE电泳凝胶的浓度为35%~57.5%。变性方向与电泳方向一致。电泳缓冲液为1×TAE,100 V、60 ℃条件下电泳16 h。凝胶经银染后用Bio–Rad®GS800凝胶成像系统拍照。切割回收DGGE图谱中的部分特异和共性条带,进行克隆测序。
1.5标准曲线的绘制和目的细菌的Q–PCR测定
以总DNA为模板对细菌特异性引物(表1)进行PCR扩增。2%琼脂糖凝胶电泳后,对目的条带进行胶回收和克隆测序。抽提阳性克隆质粒,测定质粒的浓度和260 nm/280 nm值。以10倍梯度稀释的重组质粒为模板,用特异性引物进行Q–PCR,绘制目的细菌的标准曲线。以总DNA为模板对菌特异性引物进行Q–PCR。扩增体系(25 μL):2×SYBR Premix ExII 12.5 μL,50×ROX reference dye II 0.5 μL,上、下游引物各0.01 nmol,模板DNA 20 ng,用ddH2O补足25 μL。反应程序:95 ℃预变性3 min;95 ℃变性15 s,适宜退火温度退火15 s,40个循环,在退火后拍照;95 ℃变性15 s,60 ℃退火60 s,从60 ℃到95 ℃每隔0.5 ℃变性5 s拍照。

表1 细菌引物序列
NR134139.1、KT363960.1和AY271254.1分别表示假单胞菌属细菌、气单胞菌属细菌和细菌的16S核糖体基因序列登录号。
1.6数据分析
将DGGE图谱用Quantity one进行数字化和标准化后,用NTSYS 2.10和SPSS 19.0软件进行聚类分析和主成分分析(PCA),并根据文献[7]计算肠道中菌群的多样性指数、均匀度和丰富度。将Q–PCR试验数据取自然对数,以平均值±标准差表示。
2 结果与分析
2.1黑眉锦蛇肠道菌群结构分析
黑眉锦蛇肠道菌群的PCR–DGGE图谱(图1–b)中,条带的数量及位置表示其肠道中细菌的丰富度和种类,颜色深的条带代表其肠道中的优势菌群。由图1可知,黑眉锦蛇的空肠、回肠和直肠样品均有丰富的条带,但条带数目、位置及颜色深浅均具有较大差异,其空肠、回肠和直肠样品的平均条带数为17.20、23.40和14.80,回肠样品条带的颜色较空肠的和直肠的深,表明回肠中的菌群结构更复杂,且菌群丰度更大;聚类图(图1–a)显示黑眉锦蛇各肠段样品分别聚为一族,空肠的和直肠的聚为一大族,个体间回肠样品的相似性系数较空肠的和直肠的低,说明空肠中的菌群结构和直肠中的相似性较高。PCA(图2)显示,PCA1将黑眉锦蛇空肠样品和直肠样品与回肠样品区分为左右两部分,空肠样品和直肠样品间重复相对集中,而回肠样品相对分散,表明回肠中的菌群结构不如空肠中的和直肠中的稳定。此外,黑眉锦蛇空肠、回肠和直肠中菌群的多样性指数分别为2.84、3.14和2.69,均匀度分别为0.78、0.86和0.74,丰富度分别为17.20、23.40和14.80(表2)。
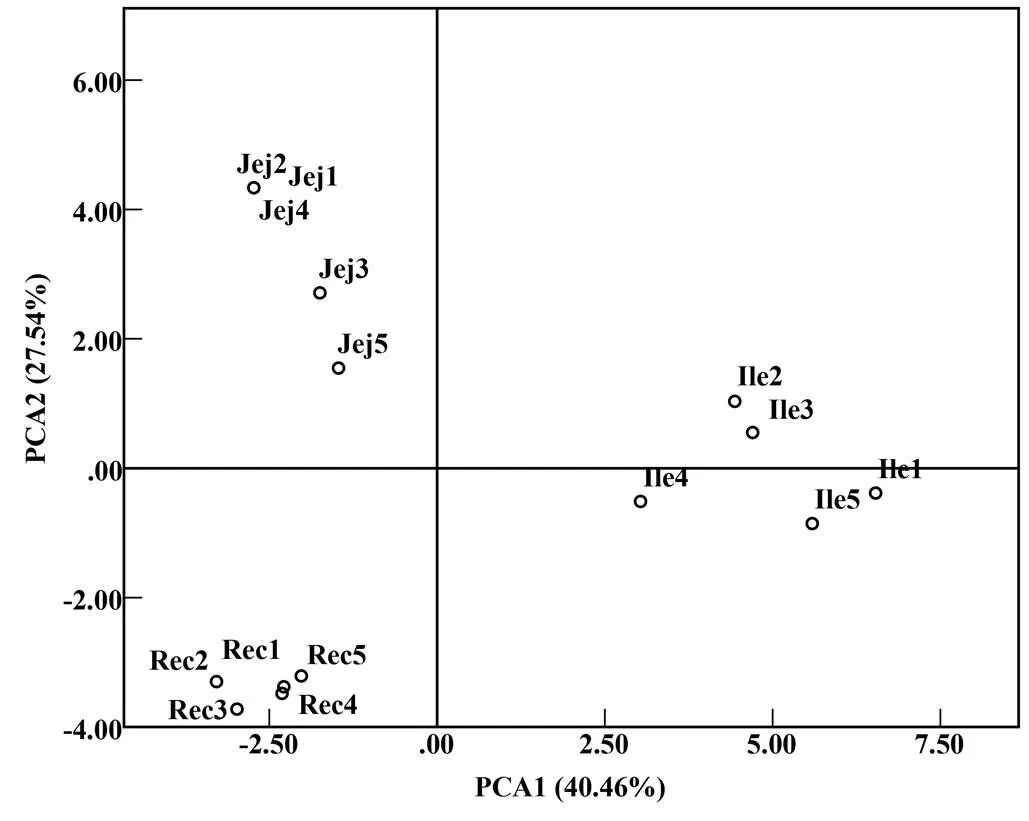
Jej 空肠;Ile 回肠;Rec 直肠。
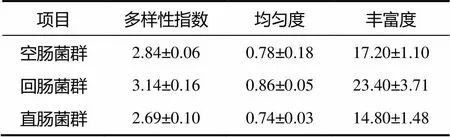
表2 黑眉锦蛇肠道菌群多样性指数和均匀度及丰富度
2.2黑眉锦蛇肠道菌群PCR–DGGE图谱中回收条带克隆测序分析
从PCR–DGGE图谱上回收21条带(图1–b箭头所示)。克隆测序结果于GenBank数据库中进行Blast比对的结果见表3。黑眉锦蛇肠道中含有大量的厚壁菌门(Firmicutes)细菌、拟杆菌门(Bacteroidetes)细菌、变形菌门(Proteobacteria)细菌、朊细菌门(Prion bacterial phyla)细菌、未培养瘤胃细菌(uncultured rumen bacterium)、未培养细菌(uncultured bacterium)和Rhizosphaerae弧菌,其中未培养瘤胃细菌为直肠中的特有细菌,摩氏摩根菌、朵丽拟杆菌、小梭文肯菌、Rhizosphaerae弧菌和发光杆菌为回肠中的特有细菌。由表3可见,大部分测序结果与GenBank数据库中细菌序列的同源性均大于98%,有些的同源性甚至达100%。在GeneBank数据库中,与条带12序列同源性最高的(86%)为不可培养细菌,因此,条带12序列所代表的细菌有可能为新的不可培养细菌;条带1与未培养瘤胃细菌、条带5与摩氏摩根菌、条带7与小梭文肯菌、条带14与未培养细菌和条带17与Piscium乳球菌序列的相似性分别为95%、97%、93%、95%和96%,推测这些条带代表的细菌可能是对应细菌的新种。
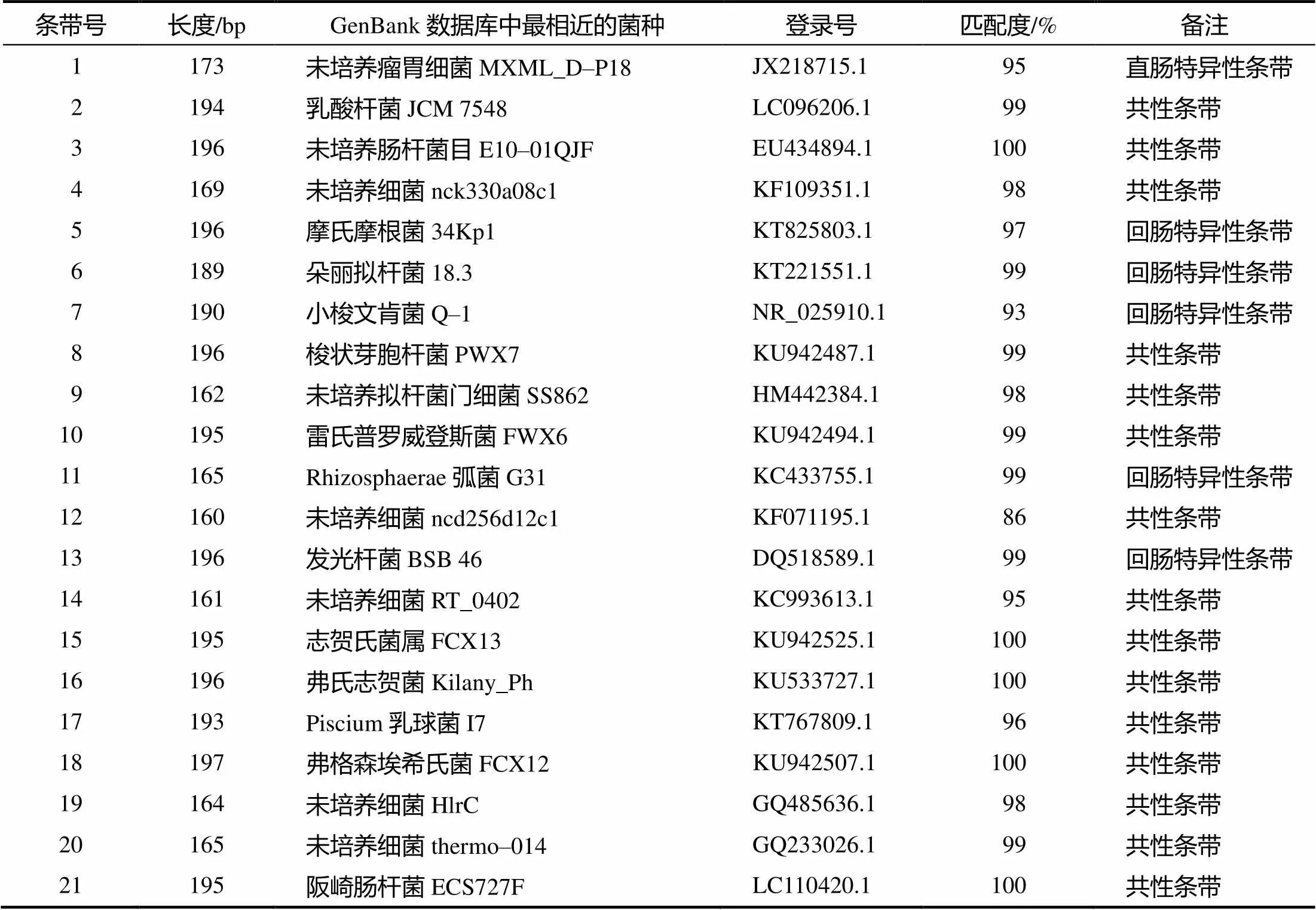
表3 黑眉锦蛇肠道菌群PCR–DGGE图谱特异性条带和共性条带的Blast分析结果
2.3黑眉锦蛇肠道菌群的丰度
由表4可知,黑眉锦蛇空肠、回肠和直肠中的总菌数分别为108.26、109.71和108.07CFU/g,空肠、回肠和直肠中的厚壁菌门细菌数分别为107.02、108.03、106.82CFU/g,空肠、回肠和直肠中拟杆菌门细菌的丰度分别为106.45、107.35、106.30CFU/g,总菌、厚壁菌门细菌和拟杆菌门细菌的丰度随肠道沿头部向尾部的方向呈先增加后降低的趋势,直肠中的菌群丰度低于空肠中的;肠道中梭菌属细菌、乳酸菌属细菌和细菌的丰度均达105.05CFU/g以上,在不同肠段中梭菌属细菌、乳酸菌属细菌和细菌丰度的变化趋势与总菌、厚壁菌门细菌和拟杆菌门细菌丰度的变化趋势相似,而在空肠中未检出双歧杆菌属细菌。肠道中肠球菌属细菌和肠杆菌科细菌的丰度均在106.11CFU/g以上,直肠中的菌群丰度高于空肠中的,表明黑眉锦蛇肠道中主要的病原菌为肠球菌属细菌和肠杆菌科细菌。此外,肠道中的气单胞菌属细菌、假单胞菌属细菌和链球菌属细菌的丰度均达到102.47CFU/g,但小于104.12CFU/g,且气单胞菌属细菌、假单胞菌属细菌和链球菌属细菌在肠道中的分布趋势同肠杆菌科细菌和肠球菌属细菌的分布趋势相似。

表4 黑眉锦蛇肠道菌群的丰度
3 结论与讨论
动物不同肠段的功能不同,肠道中的菌群结构也存在差异[7]。黑眉锦蛇肠道中栖息着数量庞大、结构复杂的菌群,其空肠、回肠和直肠中菌群的结构存在差异,菌群的多样性指数、均匀度和丰富度随肠道沿头部向尾部的方向呈先增加后降低的趋势。这可能与不同肠段的功能相关。拟杆菌门细菌、厚壁菌门细菌和变形菌门细菌为缅甸蟒肠道中的优势细菌[8]。本研究中上述3个菌门的细菌为黑眉锦蛇肠道中的优势细菌。拟杆菌门细菌和厚壁菌门细菌可降解食物中难分解的成分[9],缅甸蟒进食后,其肠道厚壁菌门细菌的丰度显著上升,推测厚壁菌门细菌可促进毛发等难分解食物的降解[8],据此类推,厚壁菌门细菌可能在黑眉锦蛇消化食物的过程中起重要作用。假单胞菌、沙门氏菌、肠杆菌和雷氏普罗威登斯菌等变形菌门细菌为蛇口腔中的主要病原菌[10]。黑眉锦蛇肠道中也含有摩氏摩根菌、志贺氏菌、弗格森埃希氏菌、阪崎肠杆菌、雷氏普罗威登斯菌和小梭文肯菌等多种变形菌门细菌。
梭菌、乳酸菌,双歧杆菌和细菌是公认的益生菌群,分别属于厚壁菌门细菌、放线菌门细菌和疣微菌门细菌,且均为蛇肠道中的正常菌群[8]。梭菌可分解多种难降解物质,是主要的丁酸产生菌[11];乳酸菌通过产生乳酸和尼生素等抗菌物质抑制病原菌的增殖[12];双歧杆菌可抑制肠杆菌科细菌、肠球菌属细菌和链球菌属细菌的增殖[13–15];细菌参与肠黏液的降解和产生[16]。缅甸蟒进食后,其肠道中的梭菌属细菌、乳酸菌属细菌、双歧杆菌属细菌和细菌的丰度增加[8],推测这些细菌在蛇对食物的消化过程中起关键作用。本研究中,梭菌属细菌、乳酸菌属细菌和细菌的丰度在黑眉锦蛇肠道中的丰度均达105.05CFU/g以上,它们的丰度随肠道沿头部向尾部的方向呈先增加后降低的趋势,表明黑眉锦蛇肠道中可能的主要益生菌为梭菌属细菌、乳酸菌属细菌和细菌,且回肠可能为其主要的消化肠段。双歧杆菌属细菌占比较小,与文献[8]中缅甸蟒肠道中放线菌门细菌占比小的研究结果相似。肠杆菌科细菌的气单胞菌属细菌、假单胞菌属细菌和肠球菌属细菌等是病原菌的主要来源,黑眉锦蛇肠道中肠球菌属细菌和肠杆菌科细菌的丰度均在106.11CFU/g以上,表明肠球菌属细菌和肠杆菌科细菌可能是黑眉锦蛇肠道中的主要病原细菌。这与Iqbal[4]的研究结果相似。梭菌属细菌、乳酸菌和细菌等益生菌在黑眉锦蛇直肠中的菌群丰度低于空肠中的,而病原菌在直肠中的丰度高于空肠中的,这可能与益生菌易于粘附肠道上皮形成生物屏障,且不易随食物残渣排出体外,并能有效防止病原菌定植而使病原菌易于排出体外有关。
综上所述,黑眉锦蛇肠道中的总菌数达108.07CFU/g以上,其优势菌群为拟杆菌门细菌、厚壁菌门细菌和变形菌门细菌,主要益生菌群为梭菌属细菌、乳酸菌属细菌和细菌,丰度均达105.05CFU/g以上,而主要病原菌群为肠杆菌科细菌和肠球菌属细菌;菌群多样性随肠道沿头部向尾部的方向呈先增加后降低的趋势,益生菌群在直肠中的丰度低于在空肠中的,但病原菌群在直肠中的丰度高于在空肠中的。回肠中的菌群丰富度最高达109.71CFU/g以上,回肠可能为黑眉锦蛇消化食物的主要肠段。
[1] 张斌.另类宠物饲养和奖赏[M].上海:上海科学技术出版社,2009:121–122.
[2] 顾学玲.蛇养殖与蛇产品加工[M].北京:科学技术文献出版社,2010:144–152.
[3] BENGMARK S.Gut microbiota,immune development and function[J].Pharmacol Res,2013,69(1):87–113.DOI:10.1016/j.phrs.2012.09.002.
[4] IQBAL J,SAGHEER M,TABASSUM N,et al. Culturable aerobic and facultative anaerobic intestinal bacterial flora of black cobra (Naja naja karachiensis) in Southern Pakistan[J].ISRN Veterinary Science,2014,2014:1–5.DOI:10.1155/2014/878479.
[5] SUN H,NI X Q,SONG X,et al.Fermented Yupingfeng polysaccharides enhance immunity by improving the foregut microflora and intestinal barrier in weaning rex rabbits[J].Appl Microbiol Biotechnol,2016,100(18):8105–8120.DOI:10.1007/s00253–016–7619–0.
[6] HILL J G,HANNING I,BEAUPRE S J,et al. Denaturing Gradient Gel Electrophoresis for the determination of bacterial species diversity in the gastrointestinal tracts of two crotaline snakes[J]. Herpetological Review,2008,39(4):433–438.
[7] ZENG Y,ZENG D,ZHANG Y,et al.Characterization of the cellulolytic bacteria communities along the gastrointestinal tract of Chinese Mongolian sheep by using PCR–DGGE and real–time PCR analysis[J].World J Microbiol Biotechnol,2015,31(7):1103–1113. DOI:10.1007/s11274–015–1860–z.
[8] COSTELLO E K,GORDON J I,SECOR S M,et al. Postprandial remodeling of the gut microbiota in Burmese pythons[J].ISME J,2010,4(11):1375–1385. DOI:10.1038/ismej.2010.71.
[9] FLINT H J,BAYER E A,RINCON M T,et al. Polysaccharide utilization by gut bacteria:potential for new insights from genomic analysis[J].Nature Reviews Microbiology,2008,6(2):121–131.DOI:10.1038/ nrmicro1817.
[10] DIPINETO L,RUSSO T P,CALABRIA M,et al.Oral flora of python regius kept as pets[J].Lett Appl Microbiol,2014,58(5):462–465.DOI:10.1111/lam. 12214.
[11] SUCHODOLSKI J S.Companion animals symposium:microbes and gastrointestinal health of dogs and cats[J].J Anim Sci,2011,89(5):1520–1530.DOI:10.2527/jas. 2010–3377.
[12] AMIT–ROMACH E,SKLAN D,UNI Z.Microflora ecology of the chicken intestine using 16S ribosomal DNA primers[J].Poult Sci,2004,83(7):1093–1098.DOI: 10.1093/ps/83.7.1093.
[13] ALOISIO I,MAZZOLA G,CORVAGLIA L T,et al. Influence of intrapartum antibiotic prophylaxis against group Bon the early newborn gut composition and evaluation of the anti–activity ofstrains[J].Appl Microbiol Biotechnol,2014,98(13):6051–6060.DOI:10.1007/ s00253–014–5712–9.
[14] ITAMI T,KONDO M,UOZU M,et al.Enhancement of resistance against enterococcus seriolicida infection in yellowtail,seriola quinqueradiata (Temminck & Schlegel),by oral administration of peptidoglycan derived from[J].Journal of Fish Diseases,1996,19(2):185–187.DOI:10.1111/j. 1365–2761.1996.tb00699.x.
[15] SIMONE M,GOZZOLI C,QUARTIERI A,et al.The probioticbreve B632 inhibited the growth of enterobacteriaceae within colicky infant microbiota cultures[J].Biomed Res Int,2014,2014:301053.DOI:10.1155/2014/301053.
[16] BELZER C,DE VOS W M.Microbes inside–from diversity to function:the case of Akkermansia[J].ISME J,2012,6(8):1449–1458.DOI:10.1038/ismej.2012.6.
责任编辑:王赛群
英文编辑:王库
Characterization of the intestinal microflora of
SHI Yunduo1, SUN Hao2*
(1.Sichuan Fishery School, Chengdu 611730, China; 2.Development of Animal Husbandry Center, Ya'an Agriculture Bureau, Ya’an, Sichuan 625000, China)
The study was aimed to analyze the intestinal microflora ofby using the polymerase chain reaction–denaturing gradient gel electrophoresis (PCR–DGGE) and fluorescent quantitative–polymerase chain reaction (Q–PCR) techniques. The results shown that diversity index of bacteria in jejunum, ileum and rectum ofwere 2.84, 3.14, and 2.69, respectively; and evenness was 0.78, 0.86, and 0.74; richness was 17.20, 23.40, and 14.80, respectively. Sequence analysis results revealed that the microfloras were mostly Firmicutes and Bacteroidetes. Q–PCR results showed that the abundance of total bacteria, firmicutes and bacteroidetes were more than 108.07, 106.82and 106.30CFU/g respectively; the abundance of,andall reached to 105.05CFU/g, and they had the trend of increase at first and decrease later, and the abundance of rectum was lower than that of jejunum; the abundances ofandbacteriaceae were more than 106.11CFU/g, the abundance of rectum was higher than that of jejunum. The results suggested that the dominant intestinal flora inwereBacteroidetes and Firmicutes; and their abundance both increased at first and then decreased wherever in jejunum, ileum and rectum; the abundance of probiotics in rectum were lower than in jejunum; while, harmful bacteria in rectum were higher than that in jejunum.
; intestinal microflora; microecological; probiotics
10.13331/j.cnki.jhau.2017.03.013
Q959.6+2
A
1007-1032(2017)03-0292-06
2016–10–13
2017–03–20
四川省科学技术厅科技支撑计划项目(2013NI0043)
时云朵(1989—),女,河北石家庄人,硕士,主要从事动物微生态研究,shiyunduo01@163.com;
,孙豪,硕士,主要从事动物微生态研究,sunhaolsyd@163.com
投稿网址:http://xb.hunau.edu.cn
