临床研究设计方案要点之药品上市后再评价研究不良事件的管理
2017-07-01曾宪涛朱婷婷孟详喻田国祥
曾宪涛,朱婷婷,孟详喻,田国祥
• 循证理论与实践 •
临床研究设计方案要点之药品上市后再评价研究不良事件的管理
曾宪涛1,朱婷婷2,孟详喻1,田国祥3
药品关系到人民群众的身心健康,其安全性极为重要。药品上市前临床试验的局限使其并不能完全反映药物的安全性,故开展药品上市后再评价对于进一步评价药物的安全性有着积极的意义。药品上市后再评价时最重要的内容是安全性评价即不良反应评价,最主要的研究方法是真实世界研究,实施的关键则是制定管理计划。本文介绍了相关法律法规以及如何制定合理有效的管理计划。
药品;上市后再评价;临床试验;真实世界研究;注册登记研究;管理计划
一个药品能够通过审批上市,主要是基于动物实验和经典的临床试验[1-3]得出的相关数据。然而,囿于经典的临床试验的局限使其并不能完全反映药物的安全性,主要有4大原因:①临床试验受试者人数有限,一些发生率低但严重程度高的不良事件不能在试验阶段被发现;②临床试验对受试者有比较严格的入组和排除标准,致使某些罹患特定疾病的患者不能加入临床试验,其使用该药物的安全性问题也因此不能被观察到;③试验阶段受试者合并用药被相对控制;④受试者试验药暴露时间有限,长期使用的安全性问题不能在临床试验期内被发现[4]。因此,开展药品上市后再评价对于进一步评价药物的安全性有着积极的意义。
1 药品上市后再评价的内涵
药品上市后再评价主要包括有效性、安全性和经济性三个方面。安全性评价即不良反应评价,亦是上市后再评价时最重要的内容,其主要考察药品在人群中发生的新的或严重的不良反应,以及在人群中长期应用而产生的不良反应。开展药品上市后再评价的主要方式是采用真实世界研究(Real World Study,RWS;Real World Research,RWR)[5]。
RWS是近年来兴起的一种新的研究理念,是相对于具有诸多纳入标准、排除标准、剔除标准的“理想世界研究”而言的,即运用现代流行病学研究方法,在真实无偏倚或偏倚较少的人群中,对某种或某些干预措施(包括诊断、治疗、预后)的实际应用情况进行研究。RWS的3大核心要素如下:①遵从临床医疗实际,不设定或限制临床治疗过程;②构建一个结构化信息采集分析系统,使临床与科研信息共享,即达成临床科研一体化[6];③通过医疗实践大数据挖掘,解决临床实际问题。需要说明的是,RWS与随机对照试验在研究设计与具体实施环节上存在差异,但二者并非替代关系,而是承启关系[5]。
药品上市后的RWS可在真实的诊疗环境及广泛使用人群中发现罕见甚至十分罕见的、新的、非预期的、以及与长期用药相关的不良反应。但是当前对于药品上市后临床研究的不良事件/不良反应的管理并没有明确的法律法规可寻,因此,制定一个合理高效的不良事件/不良反应管理计划,无论对申办方还是国家不良反应监测部门都有着积极的意义。
2 不良事件/不良反应涉及的法律法规
2.1 药品上市前注册临床研究 相对于上市后再评价,药品上市前注册临床研究在法律法规方面是成熟的。2007年由国家食品药品监督管理总局(CFDA)颁布的《药品注册管理办法》(局令第28号)中[7]第四十一条规定“临床试验过程中发生严重不良事件的,研究者应当在24 h内报告有关省、自治区、直辖市药品监督管理部门和国家食品药品监督管理局,通知申请人,并及时向伦理委员会报告”。CFDA于2003年颁布的《药物临床试验质量管理规范》(局令第3号)中[8]第二十六条规定“研究者有义务采取必要的措施以保障受试者的安全,并记录在案。在临床试验过程中如发生严重不良事件,研究者应立即对受试者采取适当的治疗措施,同时报告药品监督管理部门、卫生行政部门、申办者和伦理委员会,并在报告上签名及注明日期。第四十条规定:申办者应与研究者迅速研究所发生的严重不良事件,采取必要的措施以保证受试者的安全和权益,并及时向药品监督管理部门和卫生行政部门报告,同时向涉及同一药物的临床试验的其他研究者通报”。
从上述内容可以看到,根据药品注册管理办法和《药物临床试验质量管理规范》中相关规定,对于药品上市前注册临床中发现的严重不良事件,我国目前实施的是双重报告制度(研究者在获知严重不良事件的24 h内报告安监司、注册司、中心伦理委员会、本单位伦理委员会、申办方或其指定的合同研究组织;而申办方或其指定的合同研究组织获知后报告安监司、本研究其他中心的研究者),即研究者和申办者都要报,而且主要通过传真报告。
2.2 药品上市后不良反应的监测 为加强药品的上市后监管,规范药品不良反应报告和监测,及时、有效控制药品风险,保障公众用药安全,2011年时国家卫生部制定并颁布《药品不良反应报告和监测管理办法》(卫生部令第81号)[9]。根据文件精神,国家实行药品不良反应报告制度,药品生产、经营企业和医疗机构应当建立药品不良反应报告和监测管理制度;药品生产企业应当设立专门机构并配备专职人员,药品经营企业和医疗机构应当设立或者指定机构并配备专(兼)职人员,承担本单位的药品不良反应报告和监测工作,应建立严重不良事件及群体不良事件处理程序,主动收集汇报,及时分析评价并开展相关研究。《药品不良反应报告和监测管理办法》也规定了未按照规定建立药品不良反应报告和监测管理制度进行规范收集汇报的相关法律责任、处罚规定及赔偿办法。
3 不良事件管理计划的制定
注册登记研究(Registry Study)是药品上市后RWS的形式之一[5],且大部分的注册登记系统有条件识别和捕捉相关药品的不良事件信息。尽管我国没有法规特别要求采用注册登记研究来捕捉和处理不良事件报告(除外国家重点监测产品),但从系统性数据收集和促进公众健康的角度出发,也应建立健全注册登记系统的不良事件/不良反应管理制度。
上市后药品注册登记研究中,所有不良事件的报告最初都是研究者怀疑暴露于医疗产品的患者经历了某种不良事件,并且这一事件与正在使用的产品可能存在因果关系[10],若研究方案中对于不良事件的处理和报告无特殊要求,当研究者怀疑存在不良事件时,一般按照所在医院不良事件的处理及上报规定进行,而各家医院不良事件的处理及上报规定均存在一定的差异,且有可能会出现医院和申办方重复上报的现象,从实用角度来看,建立一个明确清晰的过程,可帮助各研究中心提高注册登记研究中不良事件管理效率。3.1 方案设计阶段 方案设计阶段,对于研究过程中可能出现的不良事件/不良反应的管理流程需做详细的规定。主要包括以下内容:①不良事件/不良反应/严重不良事件详细定义;②药品可预期的不良反应;③不良事件与药物因果关系的判断,必要时各研究中心可成立不良反应判定小组;④对发生不良事件患者的处理方法及相关的责任方等内容;⑤不良事件的记录和报告流程,即研究者一旦获得不良事件的相关信息后,该采取怎样的措施,该在什么时候、通过什么方式通知合适的人员及需要记录什么信息。
3.2 研究实施阶段 研究实施前,需做好对各中心的研究者的不良事件管理的培训,确保研究过程中关于不良事件的管理一致性。
3.3 推荐药品上市后注册登记研究不良事件管理方法 若某项药品上市后注册登记研究中入组患者出现不良事件,可由患者自述或相关医疗人员主动发现并报告给研究者,研究者于第一时间对相关不良事件进行观察、评估、并给予相关的治疗建议。研究者救助患者后需在该项研究注册登记系统中记录不良事件的相关信息,注册登记系统将相关信息立即推送到申办方相关人员手机中(研究开始前申办方需设专门人员处理该项研究中产生的不良事件),申办方按照上市后《药品不良反应报告和监测管理办法》[9]相关法规进行上报,定期更新产品的安全报告。若为严重不良事件还需报本中心的伦理委员会及组长单位伦理委员会,但伦理委员无需上报,避免与申办方重复上报。具体流程详见图1所示。
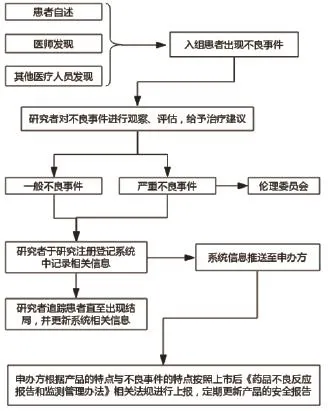
图1 推荐药品上市后注册登记研究不良事件管理方法流程图
4 结语
药品作为特殊商品,关系到人民群众的身心健康,其安全性极为重要。随着近些年监管力度的不断加大和传媒的高度发达,药品在整个生命周期中的各种安全性问题不断显现,公众对药品安全问题呈现出高度的关注,所以关注药品的安全性极为重要。
因RWS可反映药品在临床实际应用过程中真实使用情况,逐渐普遍应用于药品上市后再评价研究中。而RWS实施效果的优劣则很大程度上取决于前瞻性的设计方案,因此,对于研究中制定良好的不良事件管理计划可以使药品上市后的研究更好的服务于上市后药品的安全性管理。
[1] 邬兰,田国祥,王行环,等. 临床试验的注册及注册平台比较分析[J].中国循证心血管医学杂志,2017,9(2):129-34.
[2] 翁鸿,任学群,王行环,等. 临床研究的选题原则及选题[J]. 中国循证心血管医学杂志,2017,9(3): 257-260.
[3] 翁鸿,尹庆锋,王朝阳,等. 临床研究方案设计要点之对照药物的选择[J]. 中国循证心血管医学杂志,2017,9(4):385-7.
[4] 奚晓云,祝蓉. 上市后药品不良事件自发性报告的数据管理[J]. 药物流行病学杂志,2010,19(2):92-4.
[5] 曹越,尹庆锋,曾宪涛. 真实世界研究概述[J]. 武警医学,2017,28(4): 400-3.
[6] 王行环. 基于临床实践的研究选题与转化[J]. 武警医学,2017, 28(2):109-14.
[7] 国家食品药品监督管理总局. 《药品注册管理办法》(局令第28号)[EB/OL]. Available from: http://www.sda.gov.cn/WS01/ CL0053/24529.html.
[8] 国家食品药品监督管理总局. 《药物临床试验质量管理规范》(局令第3号)[EB/OL]. Available from: http://www.sda.gov.cn/ WS01/CL0053/24473.html.
[9] 中华人民共和国卫生部. 《药品不良反应报告和监测管理办法》(卫生部令第81号)[EB/OL]. Available from: http://www.sfda.gov. cn/WS01/CL0053/62621.html.
[10] Gliklich RE,Dreyer NA. Registries for Evaluating Patient Outcomes: A User's Guide, 2nd edition[M]. Rockville (MD): Agency for Healthcare Research and Quality (US), 2010.
本文编辑:孙竹
Key point of clinical research protocol design -- management of adverse event in post-marketing drug evaluation
ZENG Xian-tao*, ZHU Ting-ting, MENG Xiang-yu, TIAN Guo-xiang.*Center for Evidence-Based and Translational Medicine, Zhongnan Hospital of Wuhan University; Center for Evidence-Based and Translational Medicine, Wuhan University; Department of Evidence-Based Medicine and Clinical Epidemiology, The Second Clinical College, Wuhan University, Wuhan 430071, China.
TIAN Guo-xiang, E-mail: tian-gx@126.com.
Drugs play important roles in citizens' physical and mental health. Pre-marketing trials have certain limitations resulting in incomplete safety profies; therefore, post-marketing drug evaluation is essential for further safety evaluation. Assessment of adverse reactions represents the most important measurement, the key approach and implementation element of which is the real world research and determination of management plan, respectively. In this paper, we discussed relevant laws and regulations, and ways to form an adequate management plan.
Drug; Post-Marketing Evaluation; Clinical trial; Real World Study; Registry Study; Management Plan
R4
A
1674-4055(2017)05-0520-03
国家重点研发计划专项基金(2016YFC0106300)
1430071 武汉,武汉大学中南医院循证与转化医学中心 武汉大学循证与转化医学中心 武汉大学第二临床学院循证医学与临床流行病学教研室;2210008 南京,江苏法迈生医学科技有限公司;3100700 北京,中国人民解放军陆军总医院干四科
共同第一作者:朱婷婷
田国祥,E-mail:tian-gx@126.com
10.3969/j.issn.1674-4055.2017.05.03
