1株生防芽孢杆菌对黄瓜根结线虫的防治、促生作用及其鉴定
2017-06-30邢芳芳高明夫胡兆平范玲超
邢芳芳+高明夫+胡兆平++范玲超
摘要:利用1株实验室保藏的、分离自大棚黄瓜根际土壤的芽孢杆菌KN1进行发酵培养,在温室条件下研究KN1菌株对黄瓜根结线虫病的防治效果及其对黄瓜的促生能力,并对该菌株进行分子生物学鉴定。结果表明:接种60 d在温室盆栽试验中,KN1菌剂蘸根处理线虫减退率和防治效果分别为48.2%和41.5%,与单独使用10%噻唑磷颗粒剂效果相当,能够显著减少根结的生成,KN1菌剂蘸根与10%噻唑磷颗粒剂配合使用效果较好,线虫减退率和防治效果分别达71.5%和57.27%;KN1蘸根处理黄瓜植株鲜质量、根系干质量分别比不接种菌剂对照增加30.33%和 70.89%;基于16S rDNA系统发育分析结果显示,菌株KN1属于苏云金芽孢杆菌(Bacillus thuringiensis),与苏云金芽孢杆菌serovar konkukian序列的相似度达99.5%,结合该菌的培养特征、形态特征将其鉴定为苏云金芽孢杆菌。菌株KN1的鉴定及对黄瓜的温室盆栽防治效果为研究其生防机制及开发应用提供了依据。
关键词:黄瓜;根结线虫;防治效果;促生作用;苏云金芽孢杆菌;生防机制;开发应用
中图分类号: S432.4+5文献标志码: A文章编号:1002-1302(2017)08-0101-03
随着设施蔬菜产业的发展,作物的病虫害日趋严重如根腐病、线虫病等病虫害,其中黄瓜根结线虫病为较突出的线虫病害之一。黄瓜根结线虫病由植物线虫南方根结线虫(Meloidogyne incognita)侵染引起的,主要危害侧根和须根,染病株发病初始地上部分症状不明显,发病严重时植株明显矮化,结瓜少而小,地上部分出现萎蔫或逐渐枯黄,最后植株枯死。目前,生产上对根结线虫的防治主要是利用化学药剂和抗病品种。在长期的作物生产中曾采用一系列措施防治根结线虫,包括化学和生物类杀线剂,但效果并不理想,原因在于根结线虫种间致病性和抗药性差异很大[1-2],虽然在大多数情况下化学类杀线剂是有效的,但因存在环境污染和影响人类健康等问题而受到限制,亟待开发一种可代替化学杀线剂的生物类杀线剂。目前,在许多生物防治措施中经常利用食线虫真菌防治植物线虫病害,但尚很少有商品化生防制剂,且部分菌株对人体健康存在影响。因此,对根结线虫病的有效防治很有必要找出一种有效的天然生物制剂来替代巨毒化学农药。利用从健康黄瓜土壤中筛分的芽孢杆菌发酵后进行回接试验,以黄瓜为供试作物,在温室盆栽中进行防治黄瓜根结线虫病的生测试验[3],为开发安全、高效防治黄瓜根结线虫病的生物制剂及合理应用起到一定的指导作用。
1材料与方法
1.1供试菌株
菌株KN1保藏于养分资源高效开发与综合利用国家重点实验室菌种保藏室,筛分自山东省临沂市大棚健康黄瓜根际土壤。
1.2培养基
牛肉膏蛋白胨培养基:牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂18.0 g,蒸馏水1 000 mL,pH值7.0~7.2,在10万Pa下灭菌30 min。种子培养基:胰蛋白胨8 g,酵母提取物5 g,葡萄糖10 g,NaCl 5.0 g,pH值7.0,分装于300 mL三角烧瓶内,每瓶50 mL,10万Pa下灭菌15 min[4]。菌株发酵培养基:玉米淀粉2 g,黄豆饼粉2.67 g,酵母粉0.55 g、K2HPO4 0.03 g,MgSO4·7H2O 0.02 g,CaCO3 0.04 g,ZnSO4 0.02 g,蒸馏水100 mL,pH值7.2,装于500 mL三角烧瓶内,10万Pa灭菌30 min[4]。
1.3菌株KN1的活化
取冰箱保存的试管斜面,划线活化于牛肉膏蛋白胨培养基平板上,置于37 ℃生化培养箱中倒置培养,连续传代2次即得到活化菌株。
1.4菌株KN1制剂的制备
挑取活化后的健壮KN1菌落接种于种子培养基中,于 37 ℃、180 r/min条件下摇床培养18 h,按照10%的接种量接种于发酵培养基中,每瓶发酵培养基接种10 mL,置于 200 r/min 条件下摇床培养32 h,即得KN1发酵液,离心发酵液得上清液和菌体沉淀,將菌体沉淀用灭菌水配成含有100亿CFU/mL的KN1菌剂。
1.5菌株KN1黄瓜盆栽试验
1.5.1试验时间、地点试验于2016年9—12月在金正大生态工程集团股份有限公司的智能玻璃温室内进行,试验期间平均温度28 ℃,湿度70%左右。
1.5.2试验材料供试黄瓜品种北京301,种子由山东省潍坊市蔬菜研究所提供;供试药剂为10%颗粒噻唑磷,由日本石原产业株式会社生产;供试底肥为N、P2O5、K2O含量均为15%的硝基复混肥;供试土壤为砂姜黑土,有机质含量129 g/kg。
1.5.3试验设计先进行苗床育苗,25 d后选取苗床长势一致的黄瓜幼苗进行移栽,每盆2株。从温室大棚中取病土充分混匀,每盆装病土5 kg,硝基复混肥作为底肥一次性施入土壤,施入量为0.33 g/盆。空白对照组(CK),不接菌的病土;处理1(T1),用KN1菌剂(100亿CFU/mL)蘸根,处理2(T2),为药剂处理,将1 g 10%噻唑磷颗粒剂与病土均匀装盆;处理3(T3),在处理2的基础上移栽时再用KN1菌剂蘸根,每组设4个重复,其间适时定量浇水,管理措施一致。
1.5.4KN1菌株对黄瓜根结线虫的防效测定盆栽60 d后,取出根系周围土,混匀,取100 g作为调查土样,用贝曼漏斗法分离土壤中的线虫,调查土壤中2龄线虫的数量,与空白对照相比计算线虫减退率。土壤中线虫数量的测定参考 Castillo 等方法[5];根结指数的测定和分级标准参照Bird等的方法[6-7],并调查病株及根系受侵染程度,计算病情指数和防治效果。病害严重度分级标准[8]:0级,根系上无根结;1级,轻度感染,仅有少量的小根结,根结率在3.0%及以下;2级,根结率为3.1%~25.0%;3级,根结较多,根结率为 25.1%~50.0%;4级,在根瘤上有再次根结,50.1%~750%根系有根结;5级,根结相互连接成根结团块,75.0%以上根系有根结。
1.5.5KN1菌株对黄瓜植株的促生作用的测定收获时测定植株鲜质量、根系干质量[9-10]。
1.5.6数据分析试验数据采用Excel进行处理,利用SPSS 16.0软件进行数据统计及差异显著性分析。
1.616S rDNA序列分析鉴定
菌株KN1的16S rDNA PCR扩增参考谢永丽等的方法[11]。将KN1活化菌株接入种子培养基中,种子培养基装瓶量为70 mL/300 mL,于37 ℃、200 r/min下培养24 h,离心收集菌体,并用灭菌滤纸吸干多余水分,利用Ezup柱式细菌基因组DNA抽提试剂盒[生工生物工程(上海)股份有限公司],提取KN1基因组,扩增引物分别为16S rDNA,通用引物为:27F,5′-AGTTTGATCMTGGCTCAG-3′,1492R,5′-GGTTACCTTGTTACGACTT-3′,引物由生工生物工程(上海)股份有限公司合成。PCR反应体系:10×buffer 2.5 μL,dNTP 1.0 μL,引物27F 0.5 μL、1492R 0.5 μL,Taq酶0.2 μL,G1基因组0.5 μL,加双蒸水至25 μL。PCR反应条件:95 ℃预变性 3 min;95 ℃变性35 s,55 ℃退火45 s,72 ℃延伸90 min,共25个循环;72 ℃延伸10 min,4 ℃终止反应。由生工生物工程(上海)股份有限公司对PCR产物测序,将测得的16S rDNA序列提交至GenBank,与数据库中相似性高的相关菌株的16S rDNA序列进行比对。
2结果与分析
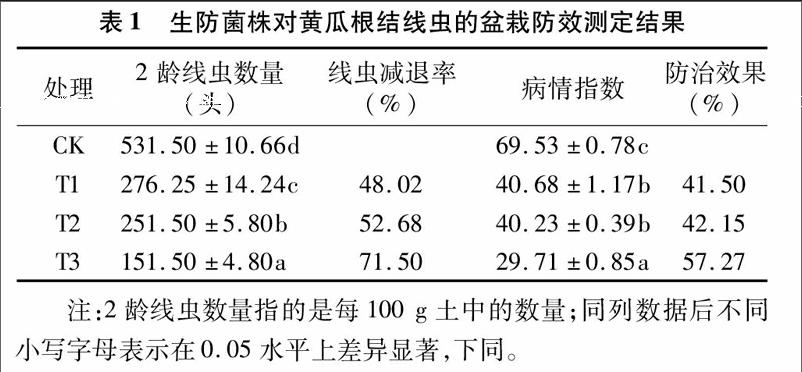
2.1生防芽孢杆菌KN1菌剂对黄瓜根结线虫的盆栽防效
通过盆栽试验发现,处理组对线虫的防治均有一定的效果,其中T3施用噻唑磷拌土、菌剂蘸根处理的线虫减退率和防治效果最高,分别为71.5%和57.27%,T1菌剂蘸根处理线虫减退率和防治效果分别为48.2%和41.5%,仅次于10%噻唑磷颗粒剂土壤处理的52.68%和42.15%。单独施用KN1菌剂和10%噻唑磷颗粒剂线虫防效都达到40%以上,2龄线虫数量和病情指数均显著低于对照,生防菌KN1蘸根配合10%噻唑磷颗粒剂使用线虫减退率达到71.5%,防治效果达到57.27%,具有较好的生防潜力。
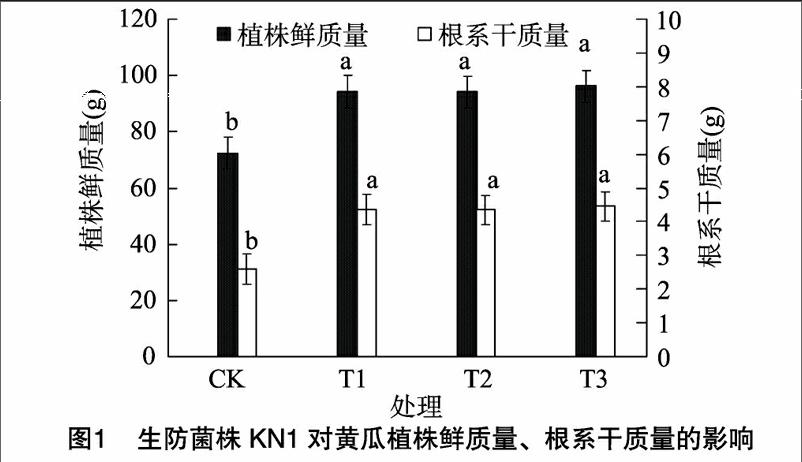
2.2生防芽孢杆菌KN1菌剂对黄瓜盆栽促生效果
与对照相比,生防菌KN1蘸根、10%噻唑磷颗粒剂土壤处理及蘸根配合10%噻唑磷颗粒剂土壤处理都具有增加黄瓜植株鲜质量的作用,较对照组差异达到显著水平。其中,KN1菌剂蘸根处理黄瓜植株鲜质量较对照增加30.33%,10%噻唑磷颗粒剂土壤处理黄瓜植株鲜质量较对照增加 30.12%,蘸根配合10%噻唑磷颗粒剂土壤处理对黄瓜鲜质量影响最大,单株鲜质量达到95.2 g,比对照增加33.03%,略高于10%噻唑磷颗粒剂土壤处理和KN1菌液蘸根处理,但处理组之间差异不显著。各处理组根系干质量较对照显著增加,生防菌KN1蘸根、10%噻唑磷颗粒剂土壤处理及蘸根配合10%噻唑磷颗粒剂土壤处理根系干质量分别较对照增加67.34%、66.95%、70.89%,其中蘸根配合10%噻唑磷颗粒剂土壤处理根系干质量最大达到4.45 g,生防菌KN1蘸根处理其次为4.36 g,但处理组之间差异不显著。由图1可以看出,生防菌KN1蘸根具有明显的提高黄瓜植株鲜质量及促进根系发育的作用。
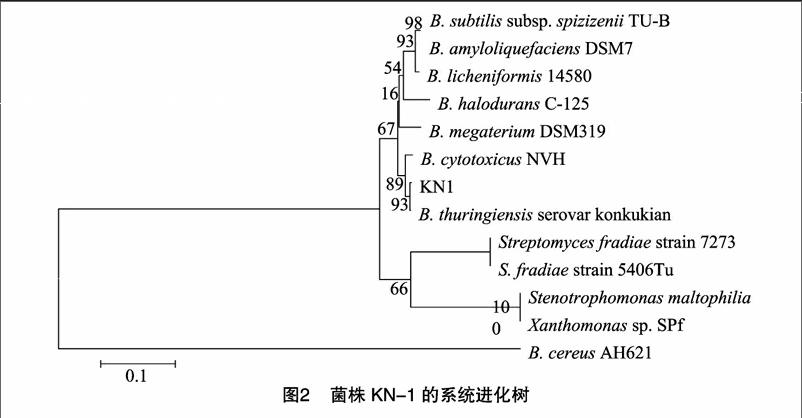
2.316S rDNA测定结果
生防菌株KN1的16S rDNA基因序列扩增后片段长度为1 511 bp,使用BLAST程序将该序列与NCBI数据库中的序列进行比对,然后使用MEGA软件构建系统发育树(图2)。分析结果(图2)表明,菌株KN1与苏云金芽孢杆菌serovar
konkukian同源性最高,匹配程度可达到99.5%,与芽孢杆菌属其他菌株的遗传距离相对较远,结合菌株形态观察确定KN1是苏云金芽孢杆菌。
3讨论与结论
生物防治以其安全、高效和无污染的特点越来越受到重视,是根结线虫未来防控策略中的主要方向之一。芽孢杆菌是自然界中廣泛存在的一类细菌,种类繁多,遗传类型多样,对多种植物病原真菌、细菌和线虫具有拮抗活性,营养要求相对简单,很容易存活、定殖,以其为主剂开发的生防制剂具有加工制作简单、使用方便和耐贮存等优点,是最为理想的生防菌。本研究温室盆栽试验结果表明,生防菌KN1对黄瓜根结线虫具有明显的防治效果,线虫防效均达40%以上,且对黄瓜植株、根系都有明显的促生长作用。生防菌KN1蘸根对黄瓜根结线虫的防效略低于单独使用10%噻唑磷颗粒剂土壤处理防治效果,两者配合使用对线虫的效果最好,线虫减退率达到71.5%,防治效果达到57.27%,具有较好的生防潜力。各处理组植株鲜质量、根系干质量比CK高,其中鲜质量增加21.78~23.88 g,增幅达到30.12%~33.03%,差异达到显著水平,根系干质量增加1.75~1.85 g。生防菌KN1蘸根、10%噻唑磷颗粒剂土壤处理及蘸根配合10%噻唑磷颗粒剂土壤处理根系干质量分别较对照增加67.34%、66.95%、70.89%,试验结果表明菌株KN1具有较强的防治黄瓜根结线虫及促生作用。通过对菌株的16S rDNA序列的测定和分析,鉴定菌株KN1为苏云金芽孢杆菌。
苏云金芽孢杆菌由于具有专一性强、对人畜无害、防治效果好、生物降解无残毒、所用原料简单等优点,在虫害防治中发挥着越来越重要的作用[12],自20世纪60年代实现工业化生产以来,已成为世界上用途最广、商业开发最成功、产量最大的微生物杀虫剂,每年以20%的速度增长[13-14]。尽管目前人们对苏云金芽孢杆菌的杀线机理还不十分清楚,但随着新的杀线虫Bt及其晶体蛋白的发现,在晶体蛋白的结构和作用机制以及Bt制剂的应用研究等方面还是取得了长足的进展。本研究中的苏云金芽孢杆菌KN1具有较好的防治黄瓜根结线虫功能及促生作用,具有较好的生防应用前景。KN1的发酵工艺及制剂配方有待于进一步优化,将对菌株KN1的工业化生产和田间大规模防治根结线虫病害奠定基础。
参考文献:
[1]赵新民,黄璠,付祖姣,等. 杀线虫苏云金芽孢杆菌研究进展[J]. 农药,2007,46(5):296-299,304.
[2]Chandravadana M V,Eugene S,Nidiry J,et al. Nematicidal activity of some plant extracts[J]. Indian J Nematol,1996,26(2):148-151.
[3]万景旺,邵颖,朱华,等. 生防菌Jdm2与生物源农药混用防治黄瓜根结线虫病的效果[J]. 江苏农业科学,2014,42(4):108-110.
[4]Sambrook J,Russell D W. Molecular cloning:a laboratory manual[M]. 3rd ed. New York:Cold Springharbor Laboratory Press,2001:636-648.
[5]Castillo P,Nico A I,Azcon-Aguilar C,et al. Protection of olive planting stocks against parasitism of root-knot nematodes by arbuscular mycorrhizal fungi[J]. Plant Pathology,2006,55(5):705-713.
[6]Bird D M,Kaloshian I. Are Roots special? Nematodes have their say[J]. Physiological and Molecular Plant Pathology,2003,62(2):115-123.
[7]Affokpon A,Coyne D L,Htay C C,et al. Biocontrol potential of native Trichoderma isolates against root-knot nematodes in West African vegetable production systems[J]. Soil Biology & Biochemistry,2011,43(3):600-608.
[8]肖炎農,王明祖,付艳平,等. 蔬菜根结线虫病情分级方法比较[J]. 华中农业大学学报,2000,19(4):336-338.
[9]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科学技术出版社,2000:179-180.
[10]鲍士旦. 土壤农化分析[M]. 北京:中国农业出版社,1999:431-440.
[11]谢永丽,王自章,刘强,等. 草坪草狗牙根中抗逆基因BeDREB的克隆及功能鉴定[J]. 中国生物化学与分子生物学报,2005,21(4):521-527.
[12]姚伟芳,弓爱君,邱丽娜,等. 苏云金芽孢杆菌固态发酵条件的优化[J]. 化学与生物工程,2006,23(11):42-44.
[13]朱仕房,杨曜中. 双水相体系分离苏云金芽孢杆菌伴孢晶体的研究[J]. 世界农药,2000,22(5):39-42.
[14]喻子牛,柯云,刘子铎,等. 微生物农药在病虫害可持续控制中的应用及发展策略[M]. 北京:科技出版社,2000:11-20.
