CRISPR-Cas系统在食品微生物中的应用研究进展
2017-06-29张玉洁宋育阳刘延琳
张玉洁,宋育阳,2,秦 义,2,*,刘延琳,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
CRISPR-Cas系统在食品微生物中的应用研究进展
张玉洁1,宋育阳1,2,秦 义1,2,*,刘延琳1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)及其关联蛋白(CRISPR-associated proteins,Cas)构成CRISPR-Cas系统,该系统作为高效、灵活、易于操作的基因编辑技术,开始广泛应用于微生物基因组位点的靶向编辑中。本文针对CRISPR-Cas9系统在食品微生物领域,特别是在食品酿造微生物和食品病原微生物中的应用进行综述,并进一步讨论影响该系统基因编辑效率的主要因素及发展方向,为CRISPR-Cas9系统在食品微生物中的应用提供参考和依据。
CRISPR-Cas系统;食品微生物;基因编辑
张玉洁, 宋育阳, 秦义, 等. CRISPR-Cas系统在食品微生物中的应用研究进展[J]. 食品科学, 2017, 38(11): 269-275. DOI:10.7506/spkx1002-6630-201711043. http://www.spkx.net.cn
ZHANG Yujie, SONG Yuyang, QIN Yi, et al. Progress in CRISPR-Cas system application in food microbiology[J]. Food Science, 2017, 38(11): 269-275. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201711043. http://www.spkx.net.cn
来源于细菌和古细菌的获得性免疫系统——成簇的规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)及其关联蛋白(CRISPR-associated proteins,CAS)能够降解入侵病毒或噬菌体DNA,是生物体进化过程中形成的免疫系统。其中,根据CRISPR数据库分析发现,45%的细菌基因组及83%的古细菌中存在CRISPR基因座[1]。而位于CRISPR基因座附近的成簇Cas基因,能够编码核酸酶、解旋酶、聚合酶等一系列蛋白,主要参与特异性靶向及剪切病毒或质粒核苷酸片段等过程[2]。
CRISPR-Cas系统主要包括两部分:一系列高度保守的正向重复序列(repeats)与长度相似基因组的间隔序列(spacers)间隔排列组成的CRISPR阵列,及CRISPR阵列附近存在的成簇的Cas基因[3]。
根据CRISPR-Cas系统中Cas基因及编码蛋白功能的差异,可以将其分为3 种类型(Ⅰ~Ⅲ型)以及10 个亚类型(Ⅰ-A、Ⅰ-B、Ⅰ-C、Ⅰ-D、Ⅰ-E、Ⅰ-F、Ⅱ-A、Ⅱ-B、Ⅲ-A和Ⅲ-B)[4-6]。但是目前来源于化脓链球菌(Streptococcus pyogenes)的CRISPR-CasⅡ型系统是研究较为透彻及应用最广泛的系统[7]。在这个系统中主要依赖Cas9作为DNA内切酶靶向基因组原间隔序列侧翼的一段保守短序列,即间隔序列前体旁基序(protospacer adjacent motif,PAM)位点(5-NGG或NAG结构),其中介导Cas9蛋白与DNA的结合主要依赖于CRISPR转录而来的反式激活RNA(tracrRNA)及成熟CRISPR RNA(crRNA)产生DNA双链断裂(DNA double-strand breaks,DSBs),以实现基因组的定点编辑。
为了将其应用于人工基因编辑中,Jinek等[8]首次将crRNA-tracrRNA融合为单链向导RNA(single guide RNA,sgRNA),其中包括与靶DNA互补的20 nt crRNA,以及与Cas9蛋白结合所需的RNA二级结构序列tracrRNA,这种简化结构同样能够引导Cas9蛋白发生特异位点切割,如图1所示[9]。同时,简化的系统也为CRISPR-Cas9系统的广泛应用奠定了基础[10-15]。
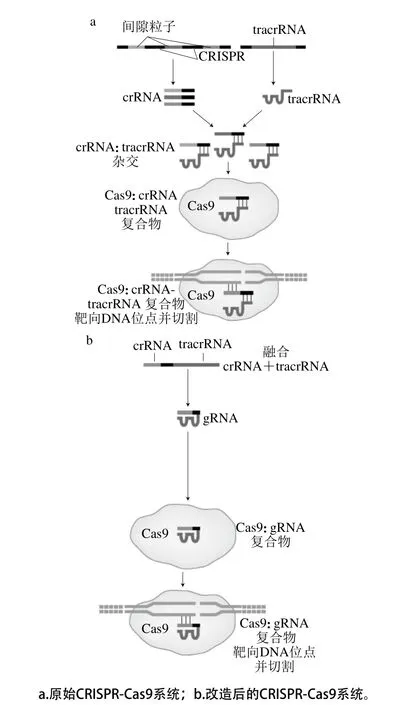
图1 原始及改造后的CRISPR-Cas9系统[9]Fig. 1 Naturally occurring and engineered CRISPR-Cas9 systems[9]
目前,CRISPR-Cas9系统在微生物领域的应用多集中于合成生物学方面,而在食品微生物领域的应用研究也逐步增多。食品微生物是与食品有关的微生物的总称,包括酵母菌、醋酸菌、霉菌等食品酿造微生物,和大肠杆菌、肉毒杆菌等食品病原微生物。本文综述了CRISPR-Cas9系统在食品酿造微生物和食品病原微生物领域中的应用研究进展,分析了影响CRISPR-Cas9编辑效率的因素。
1 CRISPR-Cas9系统在食品酿造微生物中的应用
最常用的食品酿造微生物包括酵母菌、曲霉以及细菌中的乳酸菌、枯草芽孢杆菌等。其中常用的酵母菌有酿酒酵母、椭圆酵母、卡尔酵母和异常汉逊酵母等;常用的霉菌有毛霉属、根霉属、曲霉属和地霉属等。目前,CRISPR-Cas9系统在食品酿造微生物中的应用,更多地集中在生产食品原辅料的微生物细胞工厂改造方面。
1.1 CRISPR-Cas9系统在酿酒酵母中的应用
1.1.1 CRISPR-Cas9系统用于酿酒酵母的基因敲除
DiCarlo等[11]首次在酿酒酵母中采用CRISPR-Cas9系统,他们在CAN1位点(编码精氨酸透过酶)重组90 bp寡肽DNA(包含上下游同源臂及终止密码子)及1.4 kb包含同源臂的KanMX敲除盒,从而实现高效率的定点基因敲除(约100%)。其次,研究发现相比较传统同源重组,以ADE2位点为靶向敲除基因,由CRISPR-Cas9介导,以双链寡肽DNA作为供体的同源重组效率提高了130 倍,且显著高于以单链寡肽DNA作为供体的同源重组效率(5 倍)。DiCarlo等[11]在酿酒酵母中的研究开启了CRISPR-Cas9系统在酵母领域的新时代。随后,Zhang Guochang等[16]在多倍体工业酵母ATCC 4124中采用相同的策略逐步敲除LEU2、TRP1、URA3和HIS3,且效率达到15%~60%,最终成功构建4重缺陷菌株(Δura3 Δtrp1 Δleu2 Δhis3)。此外,Ryan等[17]将RNA聚合酶Ⅲ启动子SNR52替换为tRNATyr作为引导RNA(gRNA)的启动子,随后将改造后的系统应用于二倍体酿酒酵母S288C的11 个非连锁基因(URA3、QCR9、QCR6、COX10、HIS2、ARG80、TRP1、CAN1、MET6、LEU2、LYP1)的敲除上。研究结果发现以120 nt包含标签(barcoded)的DNA为供体,采用gRNA分别敲除基因时,单个基因的敲除效率接近100%。
前期的研究为CRISPR-Cas9系统在酿酒酵母中的应用奠定了基础。但是,CRISPR-Cas9系统在进行独立的单个基因编辑时,并未突显其优势。由此,越来越多的研究开始利用该系统提高酿酒酵母多位点的同源重组效率,同时,针对多个位点进行基因敲除的CRISPR-Cas9系统改造也应运而生。
Bao Zehua等[18]在酿酒酵母中借助原始CRISPR阵列结构并整合供体DNA序列,构建了一步实现多基因敲除的CRISPR-Cas系统——HI-CRISPR(homology-integrated CRISPR-Cas),并成功在4 d内同时敲除CAN1、ADE2及LYP1基因,敲除效率达到27%~87%,由此验证了此系统的有效性。在此基础上,在靶向人工皮质醇合成途径中ATF2、GCY1、YPR1基因的敲除实验中发现,一步敲除效率高达到100%。因此进一步说明HI-CRISPR是进行多基因操作的有力工具。同时,Jakočiūnas等[19]采用USER克隆法,对类异戊二烯代谢途径中关键物质——甲羟戊酸合成途径中的5 个关键位点(yjl064w、ypl062w、bts1、rox1、erg9),分别构建了含1~5 个靶基因的短发夹RNA(sgRNA)载体,随后通过筛选所有敲除组合的高产甲羟戊酸菌株,最终获得甲羟戊酸增产41 倍的菌株。以上针对多位点敲除的gRNA设计,均采用DNA克隆方法合成sgRNA质粒,从而实现一步转化即可完成多基因敲除。而Ryan等[17]在二倍体酿酒酵母S288C中,同时转入针对URA3、LYP1位点及URA3、LYP1、COX10位点的sgRNA,此外,为通过稳定sgRNA来提高基因编辑效率,分别设计5′端带有δ型肝炎病毒核糖(hepatitis delta virus,HDV)酶结构的sgRNA,最终基因敲除效率分别达到43%与19%,并将这个能够进行多位点基因编辑的系统称为CRISPRm(multiplexed CRISPR-Cas9)。
与上述采用环形gRNA载体不同的是,Horwitz等[20]将线性化含选择标记质粒及与其两翼同源的gRNA片段共转化,在体内缺口修复机制下重构环形质粒,最终实现RHR2、ADH5、HO 3 个位点的敲除,且敲除效率达到64%。Mans等[21]采用相似方法进行基因敲除,但是针对MCH1、MCH2及MCH5 3 个基因的敲除效率仅为4%。造成敲除效率显著差异的原因可能是3 个sgRNA片段与线性质粒的环化难以完成。除此之外,Stovicek等[22]将CRISPR-Cas9系统应用于来源背景不同的工业酵母的同源基因编辑中,从而为CRISPR-Cas9系统在工业酵母的细胞工厂中应用提供依据。
1.1.2 CRISPR-Cas9系统用于酿酒酵母的基因整合
利用合成生物学方法和技术构建细胞工厂,是生产人类所需目标物的有效途径[23-24]。尽管基于染色体的同源重组技术及质粒外源表达系统具有较高效率,但是由于工业微生物缺少筛选标记及游离表达质粒的不稳定[25],导致传统的基因整合技术在工业微生物上的应用存在一定困难,而基于CRISPR-Cas的基因整合技术可以有效地避免传统基因整合技术应用上的不足。
Jakočiūnas等[26]利用CRISPR-Cas9系统构建gRNA载体及重组元件(靶基因上下游同源区、启动子、终止子及待整合基因),在酿酒酵母的ADE2、HIS3、URA3位点分别整合了crtYB、crtI、crtE,成功构建类胡萝卜素合成途径,且重组效率达30.6%。这种被称为CasEMBLR的同源重组方法随后被应用于通过解除ARO10、PDC5的负反馈抑制作用来增加芳香族氨基酸(苯丙氨酸、色氨酸)中,即在ARO10、PDC5位点处整合酪氨酸不敏感型ARO4、ARO7重组元件,结果发现即使在两个不含筛选标记位点处发生基因整合,一步整合效率也达到58%。而Ronda等[27]也将基因整合系统EasyClone与改造的CRISPR-Cas9结合(称之为CrEdit),针对类胡萝卜素合成途径代谢通路的3 个位点(约17.5 kb)同时进行基因整合(crtI、crtYB、BTS1),整合效率与存在选择压力下的传统同源重组效率相比提升至84%。Shi Shuobo等[28]利用染色体上Delta位点,重组与木糖利用及(R,R)-2,3-丁二醇(2,3-butanediol,BDO)合成途径有关的基因片段(约24 kb),并最终利用Di-CRISPR(delta integration CRISPR)-Cas9系统成功构建能够直接利用木糖合成丁二醇的菌株,这种进行多拷贝染色体整合的CRISPR-Cas被称为Di-CRISPR。而Horwitz等[20]采用模块化gRNA策略,将CRISPR-Cas9系统应用于酵母己二烯二酸合成途径中,构建靶向GAL80、HO、ARO1位点的gRNA并与线性化含选择标记质粒转化,在缺口修复的机制下实现以上3 个位点一步整合己二烯二酸代谢途径基因(11 个基因,基因片段约24 kb),但是重组效率较低,仅约4.2%。
1.2 CRISPR-Cas9系统在非酿酒酵母中的应用
CRISPR-Cas9系统经改造后也被用于裂殖酵母(Schizosaccharomyces pombe)及其他霉菌的基因编辑中。在酿酒酵母中,采用tRNA启动子作为sgRNA启动子并不影响sgRNA的完整表达[11],而裂殖酵母由于缺少相关RNA聚合酶Ⅲ启动子的研究,从而限制了CRISPR-Cas9系统在裂殖酵母及其他非酿酒酵母中的应用。但是,Jacobs等[29]通过在sgRNA 5’端添加一段可剪切的前导RNA(rrk1编码的K RNA)及在3’末端添加锤头状核酶(hammerhead ribozyme)保证了sgRNA的完整表达,随后采用此系统对ADE6位点进行突变验证,突变效率在85%~98%之间。而在解脂耶氏酵母(Yarrowia lipolytica)中,Schwartz等[30]在比较不同sgRNA启动子对CRISPR-Cas9系统的编辑效率的影响后,发现合成启动子(RPR1′-tRNAGly、SCR1′-tRNAGly、SNR52′-tRNAGly)相对于自身RNA聚合酶Ⅱ及RNA聚合酶Ⅲ启动子来说,能够有效提高基因敲除及基因整合效率,其中,SCR1′-tRNAGly作为sgRNA启动子时编辑效率最高。
1.3 CRISPR-Cas9系统在霉菌中的应用
L i u R u i等[31]也首次针对丝状真菌里氏木霉(Trichoderma reesei)改造了CRISPR-Cas9系统,即采用Cas9密码子优化、体外转录gRNA及改造Cas9的组成型启动子为诱导性启动子,实现CRISPR-Cas9系统在丝状真菌中的可调控基因编辑。同时,采用优化后的CRISPR-Cas9系统能够实现双基因及3 个基因位点的基因敲除,效率分别达到45%和4.2%。尽管针对3 个位点的编辑效率较低,但是CRISPR-Cas9在真菌中一步实现多位点基因编辑仍具有发展前景及应用价值[31]。随后,在丝状真菌链孢霉(Neurospora crassa)中CRISPR-Cas9被用于启动子替换及基因插入[32]。与Jacob等[29]对裂殖酵母sgRNA启动子的改造方式类似,Nødvig等[33]在进行野生棘孢曲霉(Aspergillus aculeatus)的基因编辑中,分别将两段核酶序列融合在sgRNA的5’端(hammerhead,HH)及3’端HDV以确保sgRNA的精确表达,随后在曲霉属(Aspergillus)的6 个曲霉种(A. nidulans、A. aculeatus、A. niger、A.carbonarius、A. luchuensis、A. brasiliensis)中进一步验证了CRISPR-Cas9系统的高效性。
尽管多数情况下在Cas9酶切产生双链基因断裂后,通常采用HR修复机制来实现基因的高效编辑。但是在烟曲霉菌(Aspergillus fumigatus)中,Fuller等[34]通过NHEJ介导的修复机制完成了单基因的敲除(敲除效率25%~53%),经测序后却发现造成基因敲除的主要原因是大片段的插入及终止子的提前引入。
2 CRISPR-Cas系统在食品病原微生物领域中的应用
食品微生物安全是食品安全的重要组成部分。这其中,在食品储运和加工过程中污染的病原菌越来受到关注。近年来,由于食品病原微生物带来的食物中毒事件偶有发生。因此,对食品病原微生物的预防、检测和控制是保障食品安全的重要方面。
2.1 CRISPR-Cas系统应用于食品病原微生物的基因分型与检测
根据前期对CRISPR-Cas系统分析发现,细菌间的CRISPR位点具有高度变异性,从而为基因分型提供理想位点。CRISPR位点的差异主要体现在以下3 个方面:首先,特定位点的间隔区的数目差异很大,其主要来源于外源病毒及质粒的入侵,据此可以估计菌株的来源进化途径等[35];其次,不同位点的CRISPR差异较大,而重复序列的长度在同一物种中保守型较高[1];第三,由Cas酶的多态性造成的差异[6];尽管针对Cas酶序列的生物信息学分析(包括对Cas操纵子的结构及组成分析)及与Cas1的亲缘关系能够实现部分CRISPR-Cas系统的分类,但是不同物种的基因组测序结果揭示了CRISPR-Cas的多样性;随后,Makarova等[36]通过系统发育结合比较基因组学的方法实现了对现有CRISPR-Cas的分类及命名。
鉴于以上差异,CRISPR位点已被广泛应用于食品病原微生物的分子分型及检测方面等。其中,分枝杆菌属下的结核杆菌(Mycobacterium tuberculosis)是最早开始采用CRISPR位点分类的食品病原微生物。这种被称为“间隔区寡核苷酸分型”(spoligotyping)的分类方法能够有效且快速检测菌株[37-38]。同样,采用基于CRISPR位点的“间隔区寡核苷酸分型”能够有效进行棒状杆菌属(Corynebacterium)Corynebacterium diphteriae的流行病监测及菌株系统发育分析[39]。随后,针对不同属菌株的分型工作逐渐展开,如耶尔森氏菌属(Yersinia)[40]、链球菌属(Streptococci)[41]、埃希氏杆菌属(Escherichia)[42]、沙门氏菌属(S a l m o n e l l a)[43]、乳杆菌属(Lactobacillus)[44]、双歧杆菌属(Bif i dobacterium)[45]等。
尽管依据CRISPR基因簇能够有效区分属、种及不同株系的菌株,但该方法也存在局限性。比如,某些细菌中的CRISPR位点出现频率低或间隔区种类过于丰富,从而导致单纯依赖CRISPR位点的分辨效果降低;而结合扩增片段长度多态性(amplified fragment length polymorphism,AFLP),多位点序列分型(multilocus sequence typing,MLST)等传统分型方法与单独使用CRISPR位点相比,能够显著提高分辨能力,因而受到更多关注[43,46]。除此以外,新获得的CRISPR间隔区是否能够区分出近缘菌株也是基于CRISPR的基因分型面临的问题之一。通常,根据CRISPR序列尾部末端保守的祖先间隔区能够实现菌株的系统发育分析,而实现时间及空间分类菌株则通过对前导序列末端、来源于新噬菌体的间隔区的分析来完成[47]。因此,深入解析CRISPR位点的保守性及特异性是将其作为有效分型方法的前提。
2.2 CRISPR-Cas系统应用于食品病原微生物的控制
乳酸乳球菌(Lactococcus lactis)通常作为乳制品的发酵微生物被广泛应用于工业生产中,而噬菌体的侵染会导致乳制品污染及腐败[43]。早期报道乳酸菌能够通过自然进化形成具有抵御病原噬菌体的防御机制[48]。近年来,随着对乳酸菌CRISPR位点的深入探索,不同菌株中的特异CRISPR位点为乳酸菌的防御机制进化提供证据,同时也为解决乳酸菌在食品生产过程的腐败问题提供新的视角[49-50]。作为同型发酵乳酸菌——嗜热链球菌(Streptococcus thermophilus),其分化于致病性Streptococcus种,但出现退化及缺失与病毒有关的特性。研究者通过将S. thermophilus反复暴露于潜在噬菌体的威胁下,而后在自然条件下筛选获得噬菌体间隔区的抗性的菌株,最终得到S. thermophilus噬菌体抗性突变菌株(bacteriophage-insensitive mutants,BIMs)[51]。这种非人工转基因的自然进化方式所获得菌株能够广泛应用于乳制品及其他食品生产中。而通常被广泛用于工业生产酶、维生素及抗生素等的革兰氏阳性细菌枯草芽孢杆菌(Bacillus subtilis)能够通过构建来源于嗜热链球菌的Cas9及噬菌体SPP1的间隔区来获得具有活性的外源CRISPR-Cas系统,从而具备抵御噬菌体侵染的能力,为解决工业生产中噬菌体污染问题提供思路[52]。
3 影响CRISPR-Cas9系统基因编辑效率的因素
CRISPR-Cas9系统的基因编辑效率在应用中受到多个因素的影响。首先,进行靶基因gRNA设计时需要考虑脱靶效应[53-54]。尽管目前关于gRNA的设计可以借助CRISPy(http://staff.biosustain.dtu.dk/laeb/crispy_yeast)、E-CRISP(http://www.e-crisp.org)、CRISPRdirect(http://crispr.dbcls.jp)等网站、软件[55],在一定程度上帮助降低脱靶效应,但是其他因素,如目标序列的长度、序列的互补性、发生错配的碱基个数、目标序列“种子序列(seed region)”的长度、PAM(protospacer adjacent motifs)序列的种类及由DNA和RNA造成的“凸起效应”等均会影响其编辑效率[56-58]。而在以同源重组为主要DNA修复机制的微生物中,通过对全基因组测序后,推测基因组中单核苷酸多态性(single nucleotide polymorphism,SNP)并非来源于Cas9酶切造成的gRNA脱靶,可能与参考基因组注释有关[17,19]。目前,降低脱靶效应的有效方法之一是采用突变型Cas9切口酶。野生型Cas存在RuvC、HNH两个内切酶活性结构域,分别负责切割单链DNA。其中,任何一个活性结构域的突变都会造成Cas只能切割DNA单链而成为切口酶(Cas9n)。而在此系统中,采用成对的gRNA与Cas切口酶结合的双切口法能够有效增加编辑位点的特异性,从而降低脱靶效应[59]。同时,来源于化脓链球菌Cas9的不同突变体的筛选也能够显著降低细胞内脱靶效应[60];除此之外,遵循一定标准,设计gRNA也能够在一定程度上降低脱靶的发生[61-62]。
其次,采用不同启动子构建gRNA载体时也会影响其编辑效率。如在多倍体工业酵母ATCC 4124中,采用非tRNA启动子PSNR52不能有效靶向目标基因,而采用tRNAPro能够有效实现目的基因编辑[17]。通常情况下,gRNA在RNA聚合酶Ⅲ型启动子下转录而成。RNA聚合酶Ⅱ型启动子由于负责mRNA的合成,会造成gRNA的修饰加工,最终因改变gRNA结构不能实现CRISPR-Cas系统的功能。因此,RNA聚合酶Ⅱ启动子不能直接参与gRNA的转录,而采用RNA聚合酶Ⅲ与RNA聚合酶Ⅱ结合启动子能够实现高编辑效率,或在核酶的帮助下自催化剪切为成熟gRNA[30]。
第三,有研究者发现Cas9的表达水平也会造成CRISPR-Cas9系统基因编辑效率的差异[30]。如采用超表达质粒提高Cas酶的表达水平能够显著提高敲除效率[18],但是部分研究也指出过量表达Cas9会造成不必要的DSBs,从而造成致死效应。此外,CRISPR-Cas9系统组分的表达方式也会影响基因编辑效率。尽管组成型表达质粒能够增加靶向基因的编辑效率,但是同时也会增加脱靶水平,导致基因编辑效率降低。
4 结 语
由于具备低成本、高效率且操作简便等显著优势,CRISPR-Cas9系统目前已获得研究者的广泛关注及应用。但是,也存在很多问题需要阐释及许多未知方面需要探索。
首先,目前来源于S. pyogenes中的CRISPR-Cas9系统研究较为透彻,但是自然界中其他类型CRISPR-Cas系统及其亚型的信息尚未被深刻认识。就PAM区为例,目前采用NGG形式的序列较为广泛,但是其他细菌提供的PAM序列可能帮助扩大基因组靶向位点,如,嗜热链球菌(Streptococcus thermophilus)为5’-NNAGAAW,脑膜炎奈瑟氏菌(Neisseria meningitidis)为5’-NNNNGATT[63-64]。因此,针对不同CRISPR-Cas系统的研究应当不断深入。除此之外,不同Cas9突变体的发现也为CRISPR-Cas系统的深入研究提供依据[18]。
其次,采用CRISPR-Cas9系统编辑基因时,突变体的筛选方法需要优化。当前筛选突变体的方法主要包括两方面,当靶基因的突变造成表型的显著差异时,通过表型(如营养缺陷或菌落颜色)等能够有效筛选得到突变体,但是大部分基因的筛选只能通过PCR扩增及测序完成,从而造成筛选工作量的增加。因此,建立一套简便及高效的筛选方法将为CRISPR-Cas9系统在高通量基因筛选的应用中提供广阔平台。
第三,随着不同微生物全基因组测序的完成,如何高效快速进行基因功能解析成为研究者亟欲解决的问题之一。目前,针对小鼠及人类的sgRNA敲除文库分别构建87 897、64 751 个gRNA,从而实现了高通量功能基因的筛选[64-65]。因此,结合微生物领域研究方向,可以通过构建基于代谢途径的gRNA文库,筛选新型蛋白或了解生物体代谢途径及基因的作用机制。此外,在微生物育种中,CRISPR-Cas9系统能够帮助开展定向育种工作,培育抗逆、高产某代谢物的菌种,在一定程度上加快菌种育种速度。
综上,CRISPR-Cas9系统基因编辑技术,凭借其快速、高效、简便等优势迅速成为21世纪后期基因功能研究的热点工具。因此,随着越来越多的深入研究,利用CRISPR-Cas9系统在微生物合成代谢途径中的关键作用,将为推动食品生物技术及代谢工程领域的快速发展提供新机会。
参考文献:
[1] GRISSA I, VERGNAUD G, POURCEL C. The CRISPRdb database and tools to display CRISPRs and to generate dictionaries of spacers and repeats[J]. BMC Bioinformatics, 2007, 8(1): 172. DOI:10.1186/1471-2105-8-172.
[2] MAKAROVA K S, WOLF Y I, ALKHNBASHI O S, et al. An updated evolutionary classification of CRISPR-Cas systems[J]. Nature Reviews Microbiology, 2015, 13: 722-736. DOI:10.1038/ nrmicro3569.
[3] WIEDENHEFT B, STERNBERG S H, DOUDNA J A. RNA-guided genetic silencing systems in bacteria and archaea[J]. Nature, 2012, 482: 331-338. DOI:10.1038/nature10886.
[4] MAKAROVA K S, HAFT D H, BARRANGOU R, et al. Evolution and classification of the CRISPR-Cas systems[J]. Nature Reviews Microbiology, 2011, 9(6): 467-477. DOI:10.1038/nrmicro2577.
[5] JIANG W Y, SAMAI P, MARRAFFINI L A. Degradation of phage transcripts by CRISPR-associated RNases enables type Ⅲ CRISPRCas immunity[J]. Cell, 2016, 164(4): 710-721. DOI:10.1016/ j.cell.2015.12.053.
[6] MAKAROVA K S, WOLF Y I, KOONIN E V. The basic building blocks and evolution of CRISPR-CAS systems[J]. Biochemical Society Transactions, 2013, 41(6): 1392-1400. DOI:10.1042/BST20130038. [7] MALI P, YANG L H, ESVELT K M, et al. RNA-guided human genome engineering via Cas9[J]. Science, 2013, 339: 823-826. DOI:10.1126/science.1232033.
[8] JINEK M, CHYLINSKI K, FONFARA I, et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J]. Science, 2012, 337: 816-821. DOI:10.1126/science.1225829.
[9] SANDER J D, JOUNG J K. CRISPR-Cas systems for editing, regulating and targeting genomes[J]. Nature Biotechnology, 2014, 32(4): 347-355. DOI:10.1038/nbt.2842.
[10] JIANG W Y, BIKARD D, COX D, et al. RNA-guided editing of bacterial genomes using CRISPR-Cas systems[J]. Nature Biotechnology, 2013, 31(3): 233-239. DOI:10.1038/nbt.2508.
[11] DiCARLO J E, NORVILLE J E, MALI P, et al. Genome engineering in Saccharomyces cerevisiae using CRISPR-Cas systems[J]. Nucleic Acids Research, 2013, 41(7): 4336-4343. DOI:10.1093/nar/gkt135. [12] BASSETT A R, TIBBIT C, PONTING C P, et al. Highly efficient targeted mutagenesis of Drosophila with the CRISPR/Cas9 system[J]. Cell Reports, 2013, 4(1): 220-228. DOI:10.1016/j.celrep.2013.06.020. [13] SONG G Y, JIA M L, CHEN K, et al. CRISPR/Cas9: a powerful tool for crop genome editing[J]. The Crop Journal, 2016, 4(2): 75-82. DOI:10.1016/j.cj.2015.12.002.
[14] SHAN Q W, WANG Y P, LI J, et al. Targeted genome modification of crop plants using a CRISPR-Cas system[J]. Nature Biotechnology, 2013, 31(8): 686-688. DOI:10.1038/nbt.2650.
[15] WANG H Y, YANG H, SHIVALILA C S, et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Casmediated genome engineering[J]. Cell, 2013, 153(4): 910-918. DOI:10.1016/j.cell.2013.04.025.
[16] ZHANG Guochang, KONG I I, KIM H, et al. Construction of a quadruple auxotrophic mutant of an industrial polyploid Saccharomyces cerevisiae strain by using RNA-guided Cas9 nuclease[J]. Applied and Environmental Microbiology, 2014, 80(24): 7694-7701. DOI:10.1128/AEM.02310-14.
[17] RYAN O W, SKERKER J M, MAURER M J, et al. Selection of chromosomal DNA libraries using a multiplex CRISPR system[J]. Elife Sciences, 2014, 3: 1-15. DOI:10.7554/eLife.03703.
[18] BAO Zehua, XIAO Han, LIANG Jing, et al. Homology-integrated CRISPR-Cas (HI-CRISPR) system for one-step multigene disruption in Saccharomyces cerevisiae[J]. ACS Synthetic Biology, 2015, 4(5): 585-594. DOI:10.1021/sb500255k.
[19] JAKOČIŪNAS T, BONDE I, HERRGARD M, et al. Multiplex metabolic pathway engineering using CRISPR/Cas9 in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2015, 28: 213-222. DOI:10.1016/j.ymben.2015.01.008.
[20] HORWITZ A A, WALTER J M, SCHUBERT M G, et al. Efficient multiplexed integration of synergistic alleles and metabolic pathways in yeasts via CRISPR-Cas[J]. Cell Systems, 2015, 1(1): 86-96. DOI:10.1016/j.cels.2015.02.001.
[21] MANS R, van ROSSUM H M, WIJSMAN M, et al. CRISPR/Cas9: a molecular Swiss army knife for simultaneous introduction of multiple genetic modifications in Saccharomyces cerevisiae[J]. FEMS Yeast Research, 2015, 15(2): 1-15. DOI:10.1093/femsyr/fov004.
[22] STOVICEK V, BORODINA I, FORSTER J. CRISPR-Cas system enables fast and simple genome editing of industrial Saccharomyces cerevisiae strains[J]. Metabolic Engineering Communications, 2015, 2: 13-22. DOI:10.1016/j.meteno.2015.03.001.
[23] KAVSCEK M, STRAZAR M, CURK T, et al. Yeast as a cell factory: current state and perspectives[J]. Microbial Cell Factories, 2015, 14: 94-103. DOI:10.1186/s12934-015-0281-x.
[24] MATTANOVICH D, SAUER M, GASSER B. Yeast biotechnology: teaching the old dog new tricks[J]. Microbial Cell Factories, 2014, 13(1): 34-38. DOI:10.1186/1475-2859-13-34.
[25] ZHANG Z, MOO-YOUNG M, CHISTI Y. Plasmid stability in recombinant Saccharomyces cerevisiae[J]. Biotechnology Advances, 1996, 14(4): 401-435. DOI:10.1016/S0734-9750(96)00033-X.
[26] JAKOČIŪNAS T, RAJKUMAR A S, ZHANG J, et al. CasEMBLR: Cas9-facilitated multiloci genomic integration of in vivo assembled DNA parts in Saccharomyces cerevisiae[J]. ACS Synthetic Biology, 2015, 4(11): 1226-1234. DOI:10.1021/acssynbio.5b00007.
[27] RONDA C, MAURY J, JAKOČIŪNAS T, et al. CrEdit: CRISPR mediated multi-loci gene integration in Saccharomyces cerevisiae[J]. Microbial Cell Factories, 2015, 14: 97-107. DOI:10.1186/s12934-015-0288-3.
[28] SHI Shuibo, LIANG Youyun, ZHANG Mingzi, et al. A highly efficient single-step, markerless strategy for multi-copy chromosomal integration of large biochemical pathways in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2015, 33: 19-27. DOI:10.1016/j.ymben.2015.10.011.
[29] JACOBS J Z, CICCAGLIONE K M, TOURNIER V, et al. Implementation of the CRISPR-Cas9 system in fission yeast[J]. Nature Communications, 2014, 5: 5344. DOI:10.1038/ncomms6344.
[30] SCHWARTZ C M, HUSSAIN M S, BLENNER M, et al. Synthetic RNA polymerase Ⅲ promoters facilitate high-efficiency CRISPRCas9-mediated genome editing in Yarrowia lipolytica[J]. ACS Synthetic Biology, 2016, 5(4): 356-359. DOI:10.1021/acssynbio.5b00162.
[31] LIU Rui, CHEN Lin, JIANG Yanping, et al. Efficient genome editing in filamentous fungus Trichoderma reesei using the CRISPR/Cas9 system[J]. Cell Discovery, 2015, 1: 15007. DOI:10.1038/celldisc.2015.7.
[32] MATSU-URA T, BAEK M, KWON J, et al. Efficient gene editing in Neurospora crassa with CRISPR technology[J]. Fungal Biology and Biotechnology, 2015, 2(1): 4-10. DOI:10.1186/s40694-015-0015-1. [33] N☒DVIG C S, NIELSEN J B, KOGLE M E, et al. A CRISPR-Cas9 system for genetic engineering of filamentous fungi[J]. PLoS ONE, 2015, 10(7): 1-18. DOI:10.1371/journal.pone.0133085.
[34] FULLER K K, CHEN S, LOROS J J, et al. Development of the CRISPR/Cas9 system for targeted gene disruption in Aspergillus fumigatus[J]. Eukaryotic Cell, 2015, 14(11): 1073-1080. DOI:10.1128/ ec.00107-15.
[35] HARRISON M M, JENKINS B V, O’CONNOR-GILES K M, et al. A CRISPR view of development[J]. Genes & Development, 2014, 28(17): 1859-1872. DOI:10.1101/gad.248252.114.
[36] MAKAROVA K S, HAFT D H, BARRANGOU R, et al. Evolution and classification of the CRISPR-Cas systems[J]. Nature Reviews Microbiology, 2011, 9(6): 467-477. DOI:10.1038/nrmicro2577.
[37] GOYAL M, SAUNDERS N, van EMBDEN J, et al. Differentiation of Mycobacterium tuberculosis isolates by spoligotyping and IS6110 restriction fragment length polymorphism[J]. Journal of Clinical Microbiology, 1997, 35(3): 647-651.
[38] ZHANG J, ABADIA E, REFREGIER G, et al. Mycobacterium tuberculosis complex CRISPR genotyping: improving efficiency, throughput and discriminative power of ‘spoligotyping’ with new spacers and a microbead-based hybridization assay[J]. Journal of Medical Microbiology, 2010, 59(3): 285-294. DOI:10.1099/ jmm.0.016949-0.
[39] MOKROUSOV I, LIMESCHENKO E, VYAZOVAYA A, et al. Corynebacterium diphtheriae spoligotyping based on combined use of two CRISPR loci[J]. Biotechnol Journal, 2007, 2(7): 901-906. DOI:10.1002/biot.200700035.
[40] CUI Y J, LI Y J, GORG O, et al. Insight into microevolution of Yersinia pestis by clustered regularly interspaced short palindromic repeats[J]. PLoS ONE, 2008, 3(7): 1-10. DOI:10.1371/journal. pone.0002652.
[41] HORVATH P, ROMERO D A, CO☒T☒-MONVOISIN A C, et al. Diversity, activity, and evolution of CRISPR loci in Streptococcus thermophilus[J]. Journal of Bacteriology, 2008, 190(4): 1401-1412. DOI:10.1128/JB.01415-07.
[42] DELANNOY S, BEUTIN L, FACH P. Use of clustered regularly interspaced short palindromic repeat sequence polymorphisms for specific detection of enterohemorrhagic Escherichia coli strains of serotypes O26:H11, O45:H2, O103:H2, O111:H8, O121:H19, O145:H28, and O157:H7 by real-time PCR[J]. Journal of Clinical Microbiology, 2012, 50(12): 4035-4040. DOI:10.1128/Jcm.02097-12.
[43] SHARIAT N, SANDT C H, DIMARZIO M J, et al. CRISPRMVLST subtyping of Salmonella enterica subsp. enterica serovars Typhimurium and Heidelberg and application in identifying outbreak isolates[J]. BMC Microbiology, 2013, 13(1): 1-17. DOI:10.1186/1471-2180-13-254.
[44] BRINER A E, BARRANGOU R. Lactobacillus buchneri genotyping on the basis of clustered regularly interspaced short palindromic repeat (CRISPR) locus diversity[J]. Applied and Environmental Microbiology, 2014, 80(3): 994-1001. DOI:10.1128/AEM.03015-13.
[45] BRINER A E, LUGLI G A, MILANI C, et al. Occurrence and diversity of CRISPR-Cas systems in the genus Bif i dobacterium[J]. PLoS ONE, 2015, 10(7): 1-16. DOI:10.1371/journal.pone.0133661.
[46] SCHOULS L M, REULEN S, DUIM B, et al. Comparative genotyping of Campylobacter jejuni by amplified fragment length polymorphism, multilocus sequence typing, and short repeat sequencing: strain diversity, host range, and recombination[J]. Journal of Clinical Microbiology, 2003, 41(1): 15-26. DOI:10.1128/JCM.41.1.15-26.2003.
[47] BARRANGOU R, DUDLEY E G. CRISPR-based typing and next-generation tracking technologies[J]. Annual Review of Food Science and Technology, 2016, 7: 395-411. DOI:10.1146/annurevfood-022814-015729.
[48] COFFEY A, ROSS R P. Bacteriophage-resistance systems in dairy starter strains: molecular analysis to application[M]. Berlin: Springer, 2002: 303-321.
[49] HORVATH P, CO☒T☒-MONVOISIN A C, ROMERO D A, et al. Comparative analysis of CRISPR loci in lactic acid bacteria genomes[J]. International Journal of Food Microbiology, 2009, 131(1): 62-70. DOI:10.1016/j.ijfoodmicro.2008.05.030.
[50] BARRANGOU R, van PIJKEREN J P. Exploiting CRISPR-Cas immune systems for genome editing in bacteria[J]. Current Opinion in Biotechnology, 2016, 37: 61-68. DOI:10.1016/j.copbio.2015.10.003.
[51] BARRANGOU R, FREMAUX C, DEVEAU H, et al. CRISPR provides acquired resistance against viruses in prokaryotes[J]. Science, 2007, 315: 1709-1712. DOI:10.1126/science.1138140.
[52] JAKUTYTE-GIRAITIENE L, GASIUNAS G. Design of a CRISPRCas system to increase resistance of Bacillus subtilis to bacteriophage SPP1[J]. Journal of Industrial Microbiology and Biotechnology, 2016, 43(8): 1183-1188. DOI:10.1007/s10295-016-1784-0.
[53] LIN Y N, CRADICK T J, BROWN M T, et al. CRISPR/Cas9 systems have off-target activity with insertions or deletions between target DNA and guide RNA sequences[J]. Nucleic Acids Research, 2014, 42(11): 7473-7485. DOI:10.1093/nar/gku402.
[54] FU Y F, FODEN J A, KHAYTER C, et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells[J]. Nature Biotechnology, 2013, 31(9): 822-826. DOI:10.1038/nbt.2623.
[55] BLIN K, PEDERSEN L E, WEBER T, et al. CRISPy-web: an online resource to design sgRNAs for CRISPR applications[J]. Synthetic and Systems Biotechnology, 2016, 1(2): 118-121. DOI:10.1016/ j.synbio.2016.01.003.
[56] KLEINSTIVER B P, PREW M S, TSAI S Q, et al. Engineered CRISPR-Cas9 nucleases with altered PAM specificities[J]. Nature, 2015, 523: 481-485. DOI:10.1038/nature14592.
[57] QI L S, LARSON M H, GILBERT L A, et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression[J]. Cell, 2013, 152(5): 1173-1183. DOI:10.1016/j.cell.2013.02.022.
[58] SEMENOVA E, JORE M M, DATSENKO K A, et al. Interference by clustered regularly interspaced short palindromic repeat (CRISPR) RNA is governed by a seed sequence[J]. Proceedings of the National Academy of Sciences, 2011, 108(25): 10098-10103. DOI:10.1073/ pnas.1104144108.
[59] RAN F A, HSU P D, LIN C Y, et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity[J]. Cell, 2013, 154(6): 1380-1389. DOI:10.1016/j.cell.2013.08.021.
[60] KLEINSTIVER B P, PATTANAYAK V, PREW M S, et al. High-fidelity CRISPR-Cas9 nucleases with no detectable genome-wide off-target effects[J]. Nature, 2016, 529: 490-495. DOI:10.1038/nature16526.
[61] HSU P D, SCOTT D A, WEINSTEIN J A, et al. DNA targeting specificity of RNA-guided Cas9 nucleases[J]. Nature Biotechnology, 2013, 31(9): 827-832. DOI:10.1038/nbt.2647.
[62] ESVELT K M, MALI P, BRAFF J L, et al. Orthogonal Cas9 proteins for RNA-guided gene regulation and editing[J]. Nature Methods, 2013, 10(11): 1116-1121. DOI:10.1038/nmeth.2681.
[63] HOU Z G, ZHANG Y, PROPSON N E, et al. Efficient genome engineering in human pluripotent stem cells using Cas9 from Neisseria meningitidis[J]. Proceedings of the National Academy of Sciences, 2013, 110(39): 15644-15649. DOI:10.1073/pnas.1313587110.
[64] SHALEM O, SANJANA N E, HARTENIAN E, et al. Genome-scale CRISPR-Cas9 knockout screening in human cells[J]. Science, 2014, 343: 84-87. DOI:10.1126/science.1247005.
[65] KOIKE-YUSA H, LI Y, TAN E P, et al. Genome-wide recessive genetic screening in mammalian cells with a lentiviral CRISPR-guide RNA library[J]. Nature Biotechnology, 2014, 32(3): 267-273. DOI:10.1038/nbt.2800.
Progress in CRISPR-Cas System Application in Food Microbiology
ZHANG Yujie1, SONG Yuyang1,2, QIN Yi1,2,*, LIU Yanlin1,2,*
(1. College of Enology, Northwest A & F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Wine and Viticulture, Yangling 712100, China)
The clustered regularly interspaced short palindromic repeat (CRISPR)-associated protein 9 nuclease (Cas9) system has been widely applied in genome editing in microbiology due to its high efficacy, versatility and easy programmability. Herein, we review its applications in the field of food microbiology, especially in food fermentation and pathogenic microbiology. Also, the major factors affecting the genome editing efficacy and future perspectives for the development of this system are discussed. Finally, this review is expected to provide references for research in food microbiology by using CRISPR-Cas9 system.
CRISPR-Cas system; food microbiology; genome editing
10.7506/spkx1002-6630-201711043
TS201.3
A
1002-6630(2017)11-0269-07引文格式:
2016-05-16
国家自然科学基金面上项目(31571812);国家自然科学基金青年科学基金项目(31301541);国家现代农业(葡萄)产业技术体系建设专项(CARS-30-jg-3);中央高校基本科研业务费专项资金项目(QN2013021)
张玉洁(1991—),女,硕士研究生,研究方向为葡萄酒微生物。E-mail:zhangdreamer333@163.com
*通信作者:秦义(1982—),男,副教授,博士,研究方向为酿酒微生物。E-mail:qinyi@nwsuaf.edu.cn刘延琳(1966—),女,教授,博士,研究方向为葡萄酒及酿酒微生物。E-mail:yanlinliu@nwsuaf.edu.cn
