维持性血液透析患者的血浆可溶性尿激酶型纤溶酶原激活物受体与冠脉钙化及心血管事件的关系
2017-06-29伍文娟崔燕海黎思嘉徐丽霞陈源汉莫立仪田秀兰卓王力芬梁华般李锐钊叶智明梁馨苓刘双信
伍文娟 崔燕海 黎思嘉 徐丽霞 陈源汉 莫立仪 田秀兰 张 丽 李 卓王力芬 梁华般 李锐钊 叶智明 史 伟 梁馨苓 刘双信
维持性血液透析患者的血浆可溶性尿激酶型纤溶酶原激活物受体与冠脉钙化及心血管事件的关系
伍文娟1,2崔燕海3黎思嘉2徐丽霞2陈源汉2莫立仪2田秀兰2张 丽2李 卓2王力芬2梁华般2李锐钊2叶智明2史 伟2梁馨苓2刘双信1,2
目的:探讨维持性血液透析(MHD)患者的血浆可溶性尿激酶型纤溶酶原激活物受体(suPAR)与冠脉钙化、心血管事件与死亡的关系。 方法:在2010年至2016年期间随访99例MHD患者,用ELISA方法检测血浆suPAR,用64层螺旋CT(MDCT)测定冠状动脉钙化积分(CACS),分析suPAR与 CACS的关系,及其对心血管事件发生率和全因死亡的影响。 结果:2010年~2016年,91例(91.9%)存在不同程度的血管钙化,Spearman相关分析中,suPAR与冠状动脉钙化程度呈正相关(P=0.001,r=0.315),与CACS<100分组比较,CACS≥100分组血浆suPAR显著提高(P=0.048)。根据血浆suPAR的四分位数进行分析,发现高suPAR组心血管事件和全因死亡率最高(P<0.05)。单因素COX回归分析中,suPAR是心血管事件和全因死亡的危险因素;多因素COX回归模型显示suPAR仍然是心血管事件发生的独立危险因素。 结论:在MHD患者中,suPAR与冠状动脉钙化程度呈正相关,suPAR作为心血管事件发生的独立危险因素,对MHD患者心血管事件的发生有一定的预测作用。
血液透析 可溶性尿激酶型纤溶酶原激活物受体 血管钙化 心血管疾病
近年来,我国维持性血液透析 (MHD)患者数量持续大幅增长,其中心血管事件造成的死亡占总死亡原因的50%以上[1],而血管钙化是造成透析患者心血管疾病(CVD)高发病率和高病死率的重要因素。因此对于心血管事件早期预测有着重要的临床意义。最近研究显示,可溶性尿激酶型纤溶酶原激活物受体(suPAR) 作为一种新型的炎症标志物,在吸烟、糖尿病、慢性肾脏病(CKD)患者体内呈高表达,且能增加心脑血管疾病发生[2-4]。此外,有报道显示suPAR 能预测普通人群CVD发生及与血管钙化有关[4-6]。但是,尚无文献报道MHD患者suPAR是否与血管钙化及CVD有关。因此,本研究旨在探讨MHD患者血浆suPAR与血管钙化、CVD之间的关系,了解其在MHD患者中的价值,为其临床应用提供理论依据。
对象和方法
研究对象 2010年~2016年,在广东省人民医院血液透析中心行MHD>6个月的成年患者(18~75岁)115例,剔除伴明显炎症状态者16例[高敏C反应蛋白(hs-CRP)>12 mg/L],最终入组99例,其中男性53例,女性46例,平均年龄(52.0±14.3)岁,平均透析龄(72.5±58.6)月。原发病为慢性肾炎63例,糖尿病肾病14例,高血压肾损害12例,多囊肾4例,肾动脉狭窄2例,梗阻性肾病2例,肾恶性肿瘤1例,原因不明1例。所有患者皆使用自体动静脉内瘘、高通量合成膜透析器、碳酸氢盐透析液,透析3次/周、4h/次。透析液的钙浓度1.25~1.50 mmol/L。患者定期进行透析充分性评估,单次透析尿素氮的清除率(spKt/V)>1.2。随访期间患者如果出现心血管事件或死亡被统一登记于本院透析管理系统。
方法
冠状动脉钙化积分(CACS)的测定 64层螺旋CT(MDCT)检查在广东省人民医院放射科进行(美国GE light Speed VCT 64层螺旋CT扫描仪),由头向足侧扫描,从气管隆突至心脏膈面。冠状动脉成像采用增强扫描回顾性心电门控,根据患者的心率确定扫描方式。心率<70次/min用单扇区重组,70~90次/min用双扇区重组,>90次/min用四扇区重组,探测器宽度为64 mm×0.625 mm,扫描速度为0.35 s/r,扫描时相75%。原始数据分别在心动周期40%~80%相位窗上,以5%增量进行横断面图像重组。将原始数据传至ADW4.2工作站,冠状动脉量化分析由放射科专业医师在平扫图像上测量,计算CACS。
相关因素检测 入组患者在透析当日的透析前抽血检测血红蛋白(Hb)、血清钙、血清磷、血清白蛋白(Alb)、碱性磷酸酶(ALP)、hs-CRP、全段甲状旁腺激素(iPTH)和血浆suPAR水平(采用Human uPAR Quantikine ELISA试剂盒,购于R&D Systems)。
CVD的诊断 随访期间,临床上出现充血性心力衰竭、缺血性心脏病、症状性心律失常、缺血性脑卒中即确定为CVD。CVD定义参照“国际疾病分类”第10版[7]定义如下:(1)充血性心力衰竭:根据临床和心功能判定;(2)冠状动脉疾病:临床和心电图和实验室检查诊断的心肌梗死;典型心绞痛和(或)冠状血管造影证实的冠状动脉疾病,接受冠状动脉旁路手术或经皮腔内出血管术;临床诊断的急性冠状动脉综合征。(3)症状性心律失常:根据临床症状和心电图诊断。(4)缺血性脑卒中:神经功能缺损超过24h,不包括出血性脑卒中。
死亡的统计 以2016-06-01或患者死亡作为研究终点,将转入肾移植、腹膜透析或中途中断HD治疗的患者退出本研究,统计在研究终点前一直进行MHD治疗患者的死亡人数及死亡原因。
统计学分析 用SPSS 23.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验。非正态分布的计量资料以中位数(四分位间距)表示,用Log转换后进行统计。组间比较采用Mann-Whitney U检验。计数资料以百分率表示,组间比较采用卡方检验。使用Kaplan-Meier法计算终点事件的累积发生率,应用Log-rank比较累积发病率曲线。用多变量COX回归模型分析影响CVD和全因死亡发生的危险因素,将单因素分析结果中P<0.2的变量纳入多因素COX回归模型,结果以风险比值[HR,95%CI]表示。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
基本资料 将入组患者是否发生新发心血管事件分为两组,新发心血管事件组透析龄、hs-CRP、CACS、suPAR明显高于未发心血管事件组,两组差异有统计学意义(表1)。
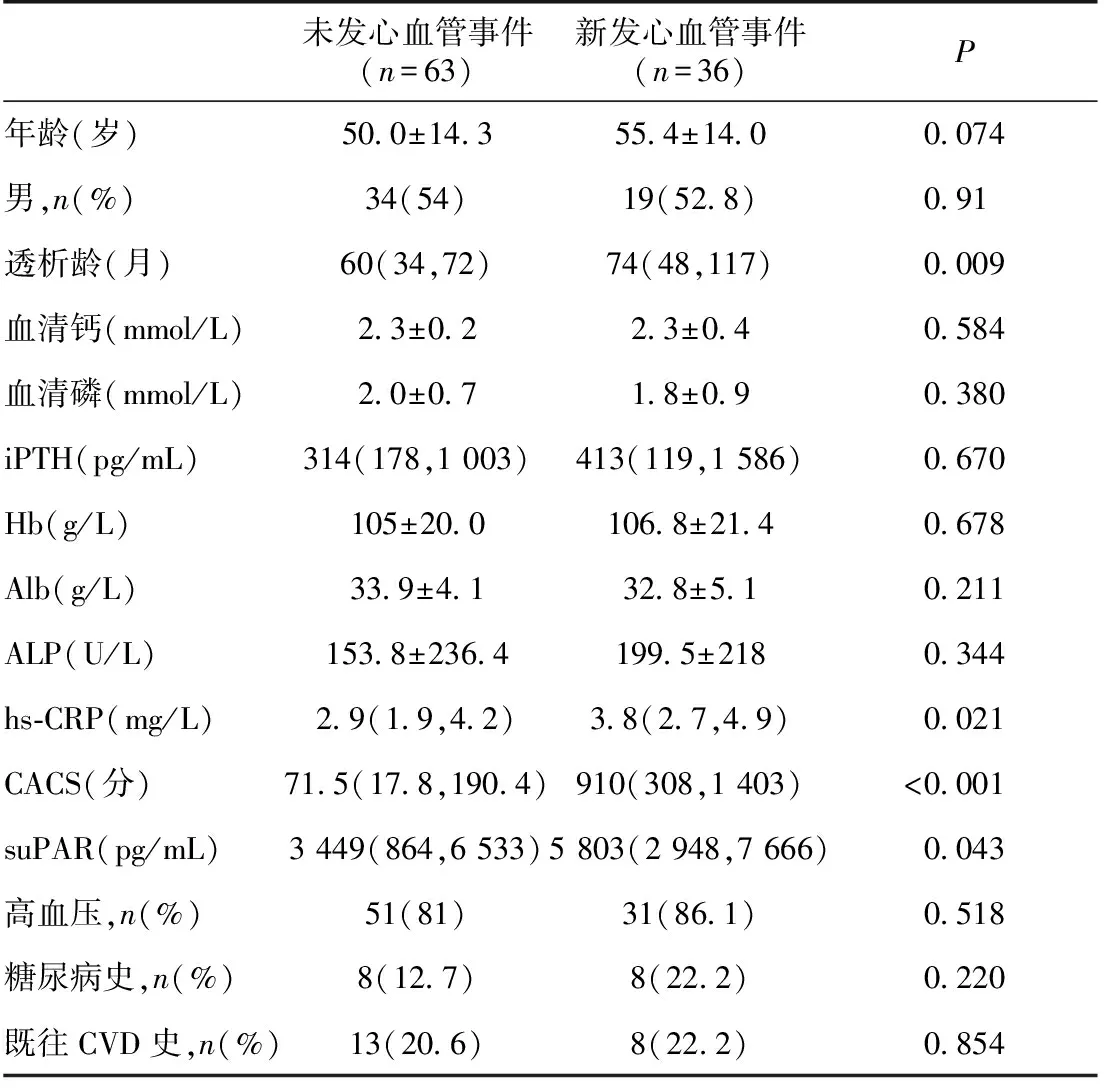
表1 两组患者临床基本资料
iPTH:全段甲状旁腺激素;Hb:血红蛋白;Alb:血清白蛋白;ALP:碱性磷酸酶;hs-CRP:高敏C反应蛋白;CACS:冠状动脉钙化积分;suPAR:可溶性尿激酶型纤溶酶原激活物受体;CVD:心血管疾病
血浆suPAR与其他各因素的相关分析 本研究中非糖尿病患者83例,糖尿病患者16例,两组suPAR水平分别为4 193(1 388,6 646)和6 033(1 665,7 682) pg/ml,无统计学差异(P=0.239)。
双变量相关分析(Spearman)发现,血浆suPAR与年龄、女性、透析龄、iPTH、血清磷、ALP、hs-CRP成正相关,具有统计学意义(表2)。
血浆suPAR与CACS的相关分析 Spearman相关分析发现suPAR与CACS成正相关(图1)。将CACS分为<100分和≥100分两组,两组suPAR水平分别为2 742(644,6 572) pg/ml和4 808(2 350,7 267) pg/ml,两组之间差别有统计学意义(P=0.048)。
suPAR:可溶性尿激酶型纤溶酶原激活物受体;iPTH:全段甲状旁腺激素;hs-CRP:高敏C反应蛋白

图1 血浆suPAR与CACS相关分析散点图suPAR:可溶性尿激酶型纤溶酶原激活物受体;CACS:冠状动脉钙化积分
血浆suPAR与CVD事件及死亡的关系 随访截止2016-06-01,中位观察33(22,58)月。在随访期间,36例(36.4%)至少发生过1次CVD,10例(10.1%)死亡(8例死于CVD;2例死于CVD继发的肢体感染致全身衰竭)。
根据血浆suPAR水平的四分位数进行分组,比较第一次新发心血管事件和死亡的发生率。高水平的suPAR心血管事件和全因死亡率更高(P<0.05)(表3)。Kaplan-Meier曲线显示血浆suPAR四分位与心血管事件发生率显著相关(Log rank 32.482,P<0.001),与全因死亡发生显著相关(Log rank 6.555,P=0.001)。
在单因素COX回归分析中,suPAR是心血管事件和全因死亡的独立危险因素(P<0.05)。对年龄、性别、透析龄等临床资料与心血管事件进行单因素分析,结果显示suPAR、CACS、年龄、透析龄、ALP、hs-CRP与心血管事件发生有统计学意义(P<0.05),然后在单因素分析基础上对P<0.2的变量进行多因素COX比例风险模型分析及多因素模型a分析,suPAR水平仍然是心血管事件发生的独立危险因素(表4)。同样,对年龄、性别、透析龄等临床资料与全因死亡进行单因素分析,结果显示suPAR、CACS、年龄、糖尿病史与全因死亡发生有统计学意义(P<0.05),然后在单因素分析基础上对P<0.2的变量进行多因素COX比例风险模型分析及多因素模型a分析,suPAR不是死亡发生的独立危险因素(表4)。

表3 不同suPAR水平患者新发心血管事件和全因死亡的比较[n(%)]
suPAR:可溶性尿激酶型纤溶酶原激活物受体
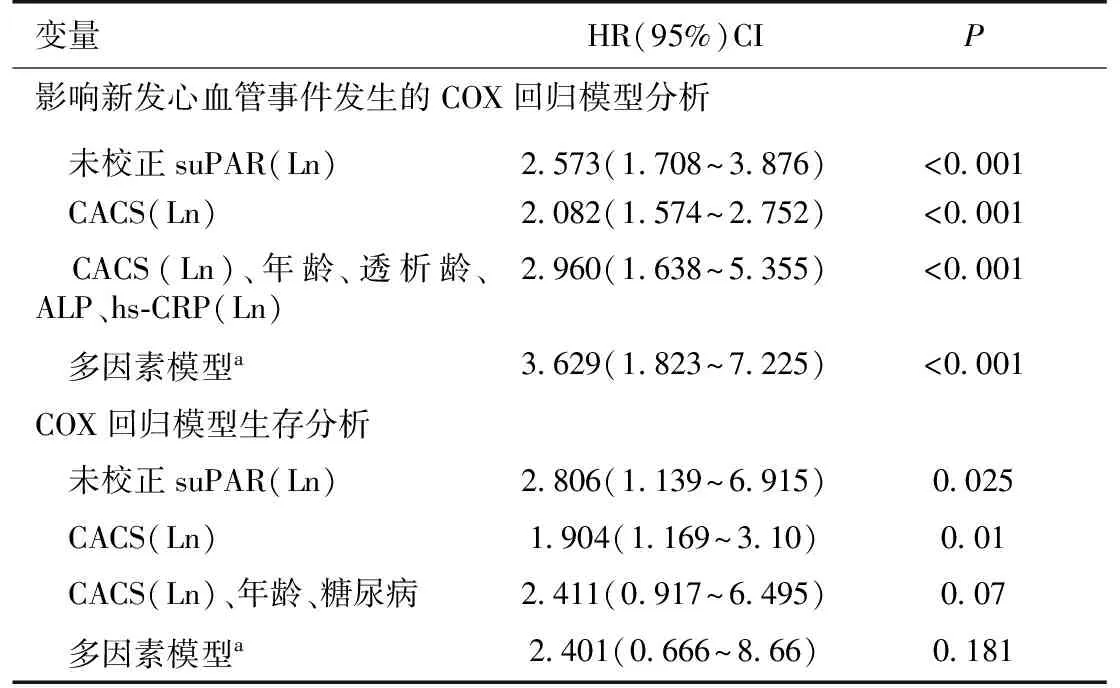
表4 影响新发心血管事件发生的COX回归模型分析及COX回归模型生存分析
ALP:碱性磷酸酶;suPAR:可溶性尿激酶型纤溶酶原激活物受体;hs-CRP:高敏C反应蛋白;CACS:冠状动脉钙化积分;a年龄、性别、透析龄、血钙、血磷、Hb、ALb、ALP、糖尿病、高血压、心血管疾病、iPTH(Ln)、CACS(Ln)、hs-CRP(Ln)
讨 论
终末期肾病患者CVD的发病率和死亡率明显高于普通人群,造成CVD高发病率的一部分原因为普通人群的传统致病因素,如男性、老龄、高血压、糖尿病[8]、脂代谢异常等,但这些因素还远远不足以预测CKD患者CVD发生的危险程度,而血管钙化不论是在普通人群或是肾衰竭人群,都是CVD的主要致病因素之一。有研究显示通过CT测定CACS是预测患者动脉粥样硬化的一个有效标志[9-10],且是预测心血管事件的重要的非传统因子[11]。另有研究证实CACS与患者长期生存率有关[12],这与我们观察到CACS与心血管事件发生和全因死亡单独相关的结果相符。
suPAR是尿激酶型纤溶酶原激活物受体(uPAR)的可溶形式。uPAR含3个同源折叠区域即DⅠ、DⅡ和DⅢ[13]。在多种蛋白酶和炎症因子作用下,形成失去糖基化磷脂酰肌醇(GPI)结构的suPAR。suPAR有3种结构形式,可存在于血浆、血清等体液中,其分子量为56 kD,不能被普通透析器清除[14]。在既往研究中发现suPAR在年龄>50岁的女性患者中较高[2],这与我们的研究结果一致,不仅如此,我们还发现suPAR在MHD患者中与透析龄、iPTH、血清磷、ALP成正相关,提示suPAR可能在CKD发展中具有一定的提示和预测作用。
除了尿毒症及透析治疗本身的特有因素如贫血、骨矿物质代谢异常外[15],慢性炎症状态成为CKD患者相关的CVD和死亡的重要因素[16-17],特别在终末期肾病患者尤为明显[18]。最近有研究证实,suPAR作为一种新型的炎症标志物,能够反映体内炎症水平和免疫激活程度,并且还可通过促进单核巨噬细胞和平滑肌细胞黏附、迁移和增殖来参与动脉粥样硬化的进展,在CVD中呈高表达。Lynqbaek等[19]发现,suPAR能够提供比弗莱明汉危险记分(FRS)更好的预测信息,将suPAR和CRP联合应用可显著提高其对心血管事件的预测能力。suPAR是反映全身炎症水平的指标,受系统性炎症的影响较大,故本研究将有明显炎症状态的患者剔除后,与CRP等因素联合,发现其HR值较单独用suPAR预测的HR值高。既往有研究显示suPRA在CKD患者中的意义。Salim等[20]纳入了3 683例患者,结果提示高suPAR不仅与已诊断为CKD患者的eGFR下降独立相关,而且与肾功能正常的人群eGFR的迅速下降独立相关。
另外,有研究提示suPAR是心血管事件的危险因素,且对其发生有一定的预测作用。 Lynqbaek等[19]纳入296例持续胸痛诊断为ST段抬高型心肌梗死、行早期经冠状动脉介入(PCI)术的患者,进行长达5.76年的随访,结果发现,随着suPAR升高,其他原因的死亡率和再发心梗风险也相应增加。Sørensen等[6]纳入1 126例中年健康人群进行长达10年的随访,发现suPAR独立于系统性冠状动脉危险计分(SCORE),与CACS显著相关,并且在女性患者中更加显著。这也与本研究结果一致。我们发现血浆suPAR无论在单因素或多因素模型中都是MHD患者心血管事件发生的独立危险因素,但并不是多因素模型中死亡发生的独立危险因素,这可能与MHD患者死亡的原因多样、本研究观察的时间不够长有关。
此外,suPAR可能是现有已诊断为CVD的一个标志性因子[21-23],并且实验中相比既往诊断有CVD的患者,新发CVD患者的suPAR水平更高(P<0.001)。把这个因素考虑进来,在多因素分析中,在校正既往CVD史后,suPAR仍然是CVD的独立因素。
本研究存在以下不足:(1)本研究不仅发现suPAR与CKD特有心血管危险因素相关,还发现MHD人群中suPAR与心血管事件和死亡有显著的相关。但本文未研究suPAR和心血管事件相关的机制,不能证实suPAR在CVD中具有致病作用,还是仅仅反映疾病过程。(2)本研究首次报道血浆suPAR与MHD患者血管钙化、心血管事件和死亡的关系,证实血浆suPAR水平对MHD患者心血管事件的发生有一定的预测价值。但本研究样本量较小,随访时间较短,其结果有待大样本量长时间的随访研究的证实。
总之,在MHD患者中,suPAR与冠状动脉钙化程度呈正相关,suPAR作为心血管事件发生的独立危险因素,对MHD患者心血管事件的发生有一定的预测作用。
1 Go AS,Chertow GM,Fan D,et al.Chronic kidney disease and the risks of death,cardiovascular events,and hospitalization.N Engl J Med,2004,351(13):1296-1305.
2 Botha S,Fourie CM,Schutte R,et al.Associations of suPAR with lifestyle and cardiometabolic risk factors.Eur J Clin Invest,2014,44(7):619-626.
3 Theilade S,Lyngbaek S,Hansen TW,et al.Soluble urokinase plasminogen activator receptor levels are elevated and associated with complications in patients with type 1 diabetes.J Intern Med,2015,277(3):362-371.
4 Meijers B,Poesen R,Claes K,et al.Soluble urokinase receptor is a biomarker of cardiovascular disease in chronic kidney disease.Kidney Int,2015,87(1):210-216.
5 Eugen-Olsen J,Andersen O,Linneberg A,et al.Circulating soluble urokinase plasminogen activator receptor predicts cancer,cardiovascular disease,diabetes and mortality in the general population.J Intern Med,2010,268(3):296-308.
6 Sørensen MH,Gerke O,Eugen-Olsen J,et al.Soluble urokinase plasminogen activator receptor is in contrast to high-sensitive C-reactive-protein associated with coronary artery calcifications in healthy middle-aged subjects.Atherosclerosis,2014,237(1):60-66.
7 董景玉,主译.疾病和有关健康问题的国际统计分类(ICD-10)(第2版)(第一卷).北京:人民卫生出版社,2008:377-410.
8 Foley RN,Parfrey PS,Sarnak MJ.Epidemiology of cardiovascular disease in chronic renal disease.J Am Soc Nephrol,1998,9(12 Suppl):S16-S23.
9 Rumberger JA,Simons DB,Fitzpatrick LA,et al.Coronary artery calcium area by electron-beam computed tomography and coronary atherosclerotic plaque area.A histopathologic correlative study.Circulation,1995,92(8):2157-2162.
10 Diederichsen AC,Petersen H,Jensen LO,et al.Diagnostic value of cardiac 64-slice computed tomography:importance of coronary calcium.Scand Cardiovasc J,2009,43(5):337-344.
11 Polonsky TS,McClelland RL,Jorgensen NW,et al.Coronary artery calcium score and risk classification for coronary heart disease prediction.JAMA,2010,303(16):1610-1616.
12 Nakanishi R,Li D,Blaha MJ,et al.The relationship between coronary artery calcium score and the long-term mortality among patients with minimal or absent coronary artery risk factors.Int J Cardiol,2015,185:275-281.
13 Koch A,Voigt S,Kruschinski C,et al.Circulating soluble urokinase plasminogen activator receptor is stably elevated during the first week of treatment in the intensive care unit and predicts mortality in critically ill patients.Crit Care,2011,15(1):R63.
14 Thunø M,Macho B,Eugen-Olsen J.suPAR:the molecular crystal ball.Dis Markers,2009,27(3):157-172.
15 Meyer TW,Hostetter TH.Uremia.N Engl J Med,2007,357(13):1316-1325.
16 Carrero JJ,Ortiz A,Qureshi AR,et al.Additive effects of soluble TWEAK and inflammation on mortality in hemodialysis patients.Clin J Am Soc Nephrol,2009,4(1):110-118.
17 Liabeuf S,Barreto DV,Barreto FC,et al.The circulating soluble TRAIL is a negative marker for inflammation inversely associated with the mortality risk in chronic kidney disease patients.Nephrol Dial Transplant,2010,25(8):2596-2602.
18 Stinghen AE,Bucharles S,Riella MC,et al.Immune mechanisms involved in cardiovascular complications of chronic kidney disease.Blood Purif,2010,29(2):114-120.
19 Lyngbaek S,Marott JL,Møller DV,et al.Usefulness of soluble urokinase plasminogen activator receptor to predict repeat myocardial infarction and mortality in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous intervention.Am J Cardiol,2012,110(12):1756-1763.
20 Hayek SS,Quyyumi AA,Reiser J.Soluble Urokinase Receptor and chronic kidney disease.N Engl J Med,2016,374(9):891.
21 Edsfeldt A,Nitulescu M,Grufman H,et al.Soluble urokinase plasminogen activator receptor is associated with inflammation in the vulnerable human atherosclerotic plaque.Stroke,2012,43(12):3305-3312.
22 Chavakis T,Willuweit AK,Lupu F,et al.Release of soluble urokinase receptor from vascular cells.Thromb Haemost,2001,86(2):686-693.
23 Pawlak K,Mysliwiec M,Pawlak D.The urokinase-type plasminogen activator/its soluble receptor system is independently related to carotid atherosclerosis and associated with CC-chemokines in uraemic patients.Thromb Res,2008,122(3):328-335.
(本文编辑 书 实)
Soluble urokinase plasminogen activator receptor is associated with coronary aretery calcification and cardiovascular events in maintenance hemodialysis patients
WUWenjuan1,2,CUIYanhai3,LISijia2,XULixia2,CHENYuanhan2,MOLiyi2,TIANXiulan2,ZHANGLi2,LIZhuo2,WANGLifen2,LIANGHuaban2,LIRuizhao2,YEZhiming2,SHIWei2,LIANGXinling2,LIUShuangxin1,2
1SouthernMedicalUniversity,Guangzhou510515,China2DepartmentofNephrology,GuangdongGeneralHospital,GuangdongAcademyofMedicalScience,Guangzhou510080,China3DepartmentofRadiology,GuangdongGeneralHospital,GuangdongAcademyofMedicalScience,Guangzhou510080,China
LIUShuangxin(E-mail:13543456446@139.com)
Objective:To investigate the associations between soluble urokinase plasminogen activator receptor (suPAR) and coronary aretery calcification and clinical outcomes in maintenance hemodialysis patients. Methodology:A total of 99 adult hemodialysis patients were enrolled in this study. Plasma samples were analyzed for suPAR by ELISA and coronary aretery calcification score (CACS) was detected by MDCT. Occurrences of new on-set cardiovascular events and all-cause mortality were examined until 1st June 2016.The association of suPAR to CACS was evaluated by Bivariate and risk factors of mortality were identified with a multivariate COX proportional hazard model. Results:Of the 99 MHD patients, 91 (91.9%) had varying degrees of CAC. SuPAR was positively correlate with CAC Score using Spearman analysis(P=0.001,r=0.315). In comparison with the CACS<100 group, suPAR was higher in the CACS≥100 group (P=0.048). Quartiles of suPAR were employed as the cutoff point for subgroup analysis, the incidence of CVD and all-cause mortality was much higher in the higher quartiles of suPAR. In the univariate COX regression analysis, higher suPAR is a risk factor of CVD and all-cause mortality. In the COX proportional hazards model after adjustment for multi-factors, suPAR remained an independent factor of CVD. Conclusion:suPAR is associated with CACS core and show a clear, graded association with a higher risk for new on-set cardiovascular disease in MHD patients.
hemodialysis soluble urokinase plasminogen activator receptor vascular calcification cardiovascular diseases
10.3969/cndt.j.issn.1006-298X.2017.01.005
国家临床重点专科建设项目;国家自然科学基金项目(81670665);广东省自然科学基金 (2014A030313544);广州市科技计划项目(201605110852556)
1南方医科大学(广州,510515);2广东省人民医院(广东省医学科学院)肾内科,3放射科
刘双信(E-mail:13543456446@139.com)
2016-10-14
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有
