西那卡塞联合帕立骨化醇治疗血液透析患者继发性甲状旁腺功能亢进的疗效与安全性
2017-06-29刘颖
刘 颖
西那卡塞联合帕立骨化醇治疗血液透析患者继发性甲状旁腺功能亢进的疗效与安全性
刘 颖
目的 观察西那卡塞联合帕立骨化醇治疗维持性血液透析患者继发性甲状旁腺功能亢进症(Secondary hyperparathyroidism,SHPT)的疗效及安全性。方法 选择我科血液净化中心进行维持性治疗的19例患者,血全段甲状旁腺素(Intact parathyroid hormone,iPTH)≥600 pg/mL,根据iPTH水平使用帕立骨化醇和西那卡塞治疗,共观察12周。分别于治疗前及治疗后第2、4、8、12周测定患者的iPTH、血钙、血磷、碱性磷酸酶(Alkaline phosphatase,AKP)水平。结果 治疗后第2周,19例患者的血清iPTH水平开始下降,但差异无统计学意义(P>0.05)。从治疗后第4周开始,iPTH水平与治疗前比较差异有统计学意义(P<0.05);治疗后第12周时,下降至(841.78±730.17) pg/mL。治疗后,血钙水平显著降低(P<0.05)。治疗前后AKP、血磷、钙磷乘积水平比较差异无统计学意义(P>0.05)。治疗过程中,患者耐受性良好。结论 西那卡塞联合帕立骨化醇治疗维持性血液透析患者SHPT安全、有效。
继发性甲状旁腺功能亢进症;血液透析;帕立骨化醇;西那卡塞
0 引言
继发性甲状旁腺功能亢进(Secondary hyperparathyroidism,SHPT)为慢性肾脏病(Chronic kidney disease,CKD)的主要并发症,常引起钙磷代谢紊乱,继而导致骨痛、皮肤瘙痒、软组织及血管钙化,为不良预后重要因子,严重影响患者生存质量[1]。目前,SHPT患者通过低磷饮食、充分透析、应用磷结合剂及活性维生素D等一系列措施控制病情进展[2]。部分患者由于治疗不规范、难以纠正高磷血症进展为难治性SHPT[3]。帕立骨化醇为选择性维生素D受体激动剂,特异性抑制甲状旁腺激素(Parathyroid hormone,PTH)的合成和分泌,对肠道维生素D受体作用较小,减少肠道对钙、磷的吸收[4]。西那卡塞是一种钙敏感受体激动剂,不仅可以抑制PTH的合成和分泌,同时具有降低血钙、血磷的效果[5]。本文探讨西那卡塞联合帕立骨化醇治疗维持性血液透析(Maintenance hemodialysis,MHD)患者SHPT的临床疗效及安全性,为临床治疗提供参考。
1 对象与方法
1.1 研究对象 选择2013年3月至2017年3月在我院第一血液净化中心维持性血液透析的SHPT患者19例,男11例,女8例,所有患者均采用高通量透析,3次/周,透析液钙浓度1.5 mmol/L,平均年龄(52.72±12.54)岁,透析龄(67.41±43.76)个月;原发性肾小球肾炎9例,糖尿病肾病7例,药物性肾损伤1例,原因未明 1 例,多囊肾1例。19例患者均存在甲状旁腺增生。入选者符合下述要求:①用药前已行规律血液透析治疗2个月以上,透析频率为每周3次,且预计用药期间继续行血液透析治疗;②血液透析前iPTH水平≥600 pg/mL;③2周内未使用维生素D制剂及影响骨代谢的药物。排除严重心脑血管并发症、严重感染、对药物不能耐受或过敏、预期寿命短于6个月的患者,以及孕期、哺乳期女性或进入研究后6个月内计划怀孕的女性。
1.2 研究方法 所有患者均使用碳酸氢盐透析液,透析液钙浓度≤1.5 mmol/L,帕立骨化醇[胜普乐®Zemplar,美国艾伯维(AbbVie)公司,注射针剂,规格:1 mL∶5 μg],采用起始剂量0.08 μg/kg,每次透析结束前30 min透析管路给药,3次/周;西那卡塞[盖平®REGPARA®,协和发酵麒麟(中国)制药有限公司,片剂,规格:25 mg]首次剂量 25 mg/d;每4周复查血清钙、磷、PTH,依据检测结果进行药物剂量调整。
1.3 生化指标及检测方法 检测患者治疗前及治疗后2、4、8、12周血清Ca、P、iPTH、AKP及不良事件发生。所有标本采集透析当日清晨空腹血液,血清Ca、P及AKP均采用全自动分析仪检测,iPTH测定采用放免分析法。

2 结果
2.1 治疗前后血钙、血磷及钙磷乘积变化 治疗后2、4、8、12周,19例患者血清钙水平显著降低(P<0.01),血清磷水平、钙磷乘积在整个治疗期间平稳,差异无统计学意义(P>0.05),见表1。
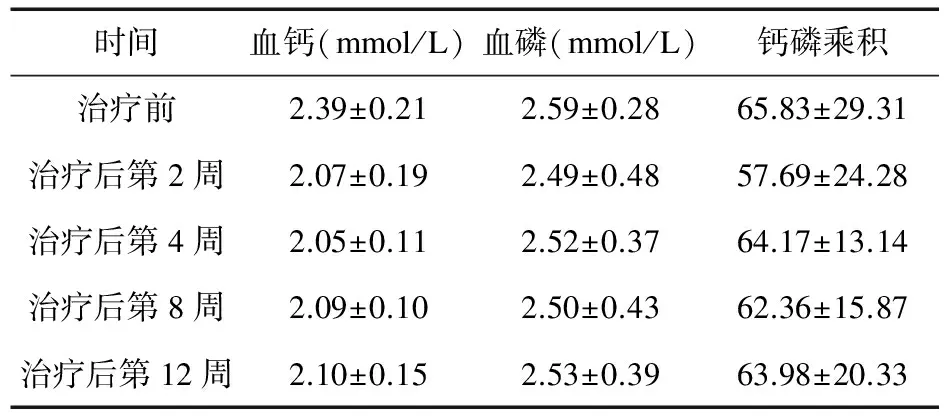
表1 治疗前后血钙、血磷及钙磷乘积水平的变化(n=19)
2.2 血清iPTH及AKP水平比较 治疗后2、4、8、12周,iPTH 水平显著降低(P<0.01);治疗后AKP水平较治疗前下降,但各检测时间点比较差异无统计学意义(P>0.05),见表2。

表2 治疗前后血清iPTH及AKP水平的变化(n=19)
2.3 临床症状与不良事件比较 治疗前3例不安腿患者完全缓解,19例有瘙痒症状患者中12例完全缓解,3例骨痛患者中1例完全缓解。至观察结束时,5例患者胃肠道不适,上述患者均无因不良反应终止用药者。
3 讨论
随着人口老龄化和相关疾病谱改变,如高血压、糖尿病及肥胖等发病率逐年增加,慢性肾脏疾病(Chronic kidney disease,CKD)患病率也进行性增加。其中继发性甲状旁腺功能亢进症是CKD患者常见且严重的并发症,随着残肾功能逐渐丧失,SHPT发病率进行性上升[6]。CKD 1期和2期患者的SHPT患病率约为20%,CKD 3期增加至40%左右,CKD 5期及进入肾脏替代治疗患者中发病率可达70%以上[7]。
SHPT的发生发展,可导致机体多系统、多脏器衰竭,如骨脆性增加,骨营养不良,软组织及血管钙化,使骨折及心血管事件风险增加,医疗开支增多,严重影响患者的生活质量[5]。目前,国内外对SHPT治疗及iPTH达标率尚不理想,根据2011-2014年我国血液透析患者在线登记结果统计,以血磷1.13~1.78 mmol/L、iPTH 150~300 pg/mL为达标值,仅有33%患者血磷达标,24%患者iPTH达标[8]。因此,合理有效诊治SHPT对改善终末期肾脏病患者预后至关重要。
目前,治疗SHPT的传统方法主要包括限磷饮食、应用磷结合剂及活性维生素D[9]。最新对SHPT发病机制的研究表明,由于肾功受损,血磷清除减少,循环成纤维细胞生长因子23(FGF-23)代偿性增加,促进尿磷排泄及抑制肾脏活性维生素D,并与Klotho蛋白共同作用于甲状旁腺,增加钙敏受体表达,以调节体内钙磷及PTH平衡。随着肾小球滤过率下降,FGF-23在体内逐渐蓄积并产生抵抗,最终出现PTH矫枉失衡[10]。随着磷结合剂和活性维生素D的应用,SHPT病程得到有效的控制。但是部分患者因为高钙、高磷、高PTH,活性维生素D应用受到了限制。
帕立骨化醇为新型选择性维生素D受体激动剂,能有效抑制iPTH合成和甲状旁腺增生,对肠道钙吸收及骨钙动员的作用仅为骨化三醇的1/10,且不影响成骨细胞的活性。与其他非选择性活性维生素D相比,帕立骨化醇通过有效降低iPTH、降低高钙血症发生率、提高长期存活率、延缓CKD进展显示其独有的优越性[11-12]。虽然帕立骨化醇促进肠道钙吸收及骨钙动员的作用只是骨化三醇的10%,与其他类型活性维生素D相同,仍有高磷、高钙风险,且与剂量相关[11]。
西那卡塞为新型拟钙剂,通过变构激活甲状旁腺细胞钙敏感受体抑制iPTH分泌[13]。已有研究证实,西那卡塞能有效降低MHD患者iPTH水平,改善血管及软组织钙化[14],因其良好的治疗效果称为内科药物性PTX,极大程度降低了MHD患者外科手术例数[15]。应用西那卡塞过程中,发现血清钙明显降低,部分SHPT患者因严重低钙调整西那卡塞剂量甚至停药[16]。
在12周的随访过程中,我们将两种药物联合应用治疗MHD患者SHPT,结果发现,MHD患者血清iPTH水平在治疗后开始下降,随着治疗的进行,下降趋势更为明显。同时未见患者出现持续高钙血症;联合用药治疗1个月,血清钙进行性降低,无严重高钙(血清钙>2.85 mmol/L)血症发生;这与文献研究结果相似[17]。而血磷及钙磷乘积的水平一直保持相对平稳,降低了转移性钙化的几率,保证了治疗的延续性。整个观察期间患者血清AKP水平呈下降趋势,因血清AKP 水平与死亡风险正相关[18],AKP水平下降可能提示MHD患者从中受益。一项大型观察性研究纳入了1 313例患者,应用帕立骨化醇治疗SHPT 6个月,结果显示,患者iPTH水平明显下降,血钙、血磷及钙磷乘积在治疗前后保持稳定,血清AKP水平明显下降[19]。本研究中,患者血清AKP水平较治疗前有所下降,但差异不明显,可能与观察例数较少、时间较短有关。
总之,应用帕立骨化醇联合西那卡塞治疗MHD患者SHPT,不仅能显著降低血清iPTH水平,且无显著高钙血症、高磷血症及心血管事件等不良反应发生,是一种安全、有效的治疗方法,有广泛的临床应用前景。但帕立骨化醇和西那卡塞在我国上市时间短,价格昂贵,针对我国人群相应临床随机对照研究少,入组的样本量偏少,尚需大型的临床研究进一步验证其药物疗效及安全性。
[1] Wei Y,Lin J,Yang F,et al.Risk factors associated with secondary hyperparathyroidism in patients with chronic kidney disease[J].Exp Ther Med,2016,12(2):1206-1212.
[2] 李月红,王梅.北京市2007年慢性维持性血液透析患者钙磷代谢分析[J].中国血液净化,2010,9(2):112-115.
[3] 李铎,宋韩明,李文歌,等.难治性继发性甲状旁腺功能亢进的相关因素分析[J].肾脏病与透析肾移植杂志,2012,21(2):115-119.
[4] Cheng J,Zhang W,Zhang X,et al.Efficacy and safety of paricalcitol therapy for chronic kidney disease:a meta-analysis[J].Clin J Am Soc Nephrol,2012,7(3):391-400.
[5] Cozzolino M,Foque D,Ciceri P,et al.Phosphate in chronic kidney disease progression[J].Contrib Nephrol,2017,190:71-82.
[6] Massry S.K/DOQI guidelines released on bone metabolism and disease in CKD[J].Nephrol News Issues,2003,17(12):38-41,44.
[7] Wetmore JB,Santos PW,Mahnken JD,et al.Elevated FGF23 levels are associated with impaired calcium-mediated suppression of PTH in ESRD[J].J Clin Endocrinol Metab,2011,96(1):E57-E64.
[8] 韩鹦赢,王彤,张文玉,等.骨化三醇联合西那卡塞治疗血液透析患者继发性甲状旁腺功能亢进的疗效观察[J].现代药物与临床,2015(12):1451-1454.
[9] Pronai W,Rosenkranz AR,Bock A,et al.Management of secondary hyperparathyroidism:practice patterns and outcomes of cinacalcet treatment with or without active vitamin D in Austria and Switzerland-the observational TRANSIT Study[J].Wien Klin Wochenschr,2017,129(9-10):317-328.
[10]Kawakami K,Takeshita A,Furushima K,et al.Persistent fibroblast growth factor 23 signalling in the parathyroid glands for secondary hyperparathyroidism in mice with chronic kidney disease[J].Sci Rep,2017,7:40534.
[11]Matuszkiewicz-Rowinska J,Zebrowski P.Paricalcitol-a selective vitamin D receptor activator for secondary hyperparathyroidism in patients with chronic kidney disease[J].Wiad Lek,2016,69(5):756-759.
[12]Olaizola I,Caorsi H,Fajardo L,et al.Effectiveness and safety of a 6-month treatment with paricalcitol in patients on hemodialysis with secondary hyperparathyroidism[J].J Bras Nefrol,2016,38(3):302-312.
[13]Zawierucha J,Malyszko J,Malyszko J,et al.[Treatment of secondary hyperparathyroidism in hemodialysed patients--paricalcitol with or without cinacalcet][J].Przegl Lek,2016,73(4):229-232.
[14]Block GA,Bushinsky DA,Cheng S,et al.Effect of etelcalcetide vs cinacalcet on serum parathyroid hormone in patients receiving hemodialysis with secondary hyperparathyroidism:a randomized clinical trial[J].JAMA,2017,317(2):156-164.
[15]Soliman AR,Maamoun HA,Soliman MA,et al.Cinacalcet versus parathyroidectomy in the treatment of secondary hyperparathyroidism post renal transplantation[J].Rom J Intern Med,2016,54(3):184-189.
[16]Pronai W,Rosenkranz AR,Bock A,et al.Management of secondary hyperparathyroidism:practice patterns and outcomes of cinacalcet treatment with or without active vitamin D in Austria and Switzerland-the observational TRANSIT Study[J].Wien Klin Wochenschr,2017,129(9-10):317-328.
[17]Fishbane S,Shapiro WB,Corry DB,et al.Cinacalcet HCl and concurrent low-dose vitamin D improves treatment of secondary hyperparathyroidism in dialysis patients compared with vitamin D alone:the ACHIEVE study results[J].Clin J Am Soc Nephrol,2008,3(6):1718-1725.
[18]Kalantar-Zadeh K,Kuwae N,Regidor DL,et al.Survival predictability of time-varying indicators of bone disease in maintenance hemodialysis patients[J].Kidney Int,2006,70(4):771-780.
[19]Biggar P,Kovarik J,Klauser-Braun R,et al.Paricalcitol treatment of secondary hyperparathyroidism in hemodialysis patients:a German-Austrian,single-arm,open-label,prospective,noninterventional,observational study[J].Nephron Clin Pract,2014,126(1):39-50.
Clinical study of paricalcitol and cinacalcet for treatment of secondary hyperparathyroidism in maintenance hemodialysis patients
LIU Ying
(Department of Nephrology, Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To evaluate the efficiency and security of paricalcitol and cinacalcet in treating secondary hyperparathyroidism in maintenance hemodialysis(MHD)patients.Methods A total of 19 MHD patients with intact parathyroid hormone(iPTH)above 600 pg/mL were given paricalcitol and cinacalcet.The full course of the study was 12 weeks.Levels of serum iPTH,calcium,phosphorus and alkaline phosphatase(AKP) were tested before and after 2,4,8 and 12 weeks during the study period.Results The serum iPTH level was decreased slightly at 2nd week after treatment, there was no significant difference (P>0.05), and it was obviously decreased from the 4th week (P<0.05).The serum iPTH level was (841.78±730.17) pg/mL at 12th weeks (P<0.01). The serum calcium level was obviously decreased after treatment (P<0.05), but there was no significant difference in the levels of serum AKP, phosphorus and calcium phosphorus product before and after treatment (P>0.05).The tolerance of the patients was good during the treatment.Conclusion The treatment of paricalcitol and cinacalcet for secondary hyperparathyroidism in MHD was effective and safe.
Secondary hyperparathyroidism;Hemodialysis;Paricalcito;Cinacalcet
2016-10-25
中国医科大学附属盛京医院肾脏内科,沈阳 110004
10.14053/j.cnki.ppcr.201706021
