蝴蝶兰茎尖脱毒再生体系建立与优化
2017-06-29朱娇马蕾刘芳杨元军张冀华
朱娇++马蕾++刘芳++杨元军++张冀华++泮海军++董道峰


摘要:以蝴蝶兰茎尖为外植体进行组织培养,研究培养基中无机盐浓度、糖浓度、激素比例及外植体大小对其茎尖生长点成活率及脱毒效果的影响。结果表明,蝴蝶兰茎尖组培脱毒外植体大小为0.2~0.4 mm,并附带1个叶原基,可脱除ORSV病毒。适当降低培养基中无机盐与6-BA浓度有利于提高茎尖生长点的成活率。培养基中添加15 g/L的绵白糖有利于茎尖的成活及生长。1/3MS + 1.0 mg/L 6-BA + 0.2 mg/L NAA为最适宜的蝴蝶兰茎尖培养基。
关键词:蝴蝶兰;脱毒;茎尖;再生
中图分类号:S682.310.4+3文献标识号:A文章编号:1001-4942(2017)06-0060-04
AbstractThe shoot tip of Phalaenopsis amabilis was cultured as explant to study the effects of inorganic salt concentration, sugar concentration, hormone proportion and explant size on survival rate and virus-free effect of shoot tip growing point. The results showed that when the explant had the size of 0.2 to 0.4 mm and attached 1 leaf primordium, the ORSV could be eradicated. When the inorganic salt and sugar concentration decreased properly, the survival rate of shoot tip growing point could improve. When 15 g/L soft sugar was added into culture medium, it was beneficial to survival and growth of shoot tip. The medium containing 1/3 MS+1.0 mg·L-1 6-BA+0.2 mg·L-1 NAA was suitable for shoot tip culture of Phalaenopsis amabilis.
KeywordsPhalaenopsis amabilis; Virus free; Tip shoot; Regeneration
蝴蝶兰(Phalaenopsis amabilis)属热带或亚热带的气生兰,因其株型美观,花形奇特,色彩艳丽,花期长久,素有“兰花皇后”之美称,在国际花卉市场上具有很高的经济价值[1]。随着蝴蝶兰种苗组培快繁技术的发展以及国际贸易的日趋频繁,兰花病毒病成为阻碍蝴蝶兰产业发展的瓶颈[2]。由于病毒可通过蚜虫、飞虱、机械性伤口等进行传播,而蝴蝶兰商品苗主要采用组织培养方式快繁,若感染病毒,很容易快速蔓延造成严重损失。目前兰花病毒病害没有有效的防治方法,为了从根源上避免病毒的扩散和危害,研究蝴蝶兰的脱毒技术对培育无病毒种苗具有十分重要的现实意义。
茎尖培养不仅是组织培养的一种重要手段,也是脱毒的关键步骤之一。前人研究表明,病毒在植物体内分布不均,一般顶端分生组织细胞的分裂速度较快,超过病毒的繁殖速度,因此病毒含量很低,甚至不含病毒[3]。茎尖的成活率和脱毒率是决定茎尖脱毒技术成功的两个关键因子。褐化是导致茎尖培养成活率降低的主要原因。褐化程度受植物基因型、取材时间、茎尖长度、培养基类型、激素配比、培养基添加物及培养方式等因素的影响。茎尖越小,褐化越严重,越容易死亡,尤其对于兰花类植物,褐化尤为严重,是影响茎尖成活率的关键问题之一[4,5]。目前已在马铃薯、草莓、甘蔗、百合、葡萄等植物中利用茎尖脱毒技术成功获得了脱毒种苗[6-10]。有关蝴蝶兰脱毒种苗的研究已有报道[11,12],但研究重点在于比较各种脱毒方法,对于茎尖再生培养体系的建立未进行深入研究。景维杰等[13]对培养基的无机盐浓度、钾浓度比例、氮素形态、植物生长调节剂进行了试验优化,研究表明1/5大量元素的无机盐浓度适合蝴蝶兰茎尖生长点的培养,一定浓度范围内,提高氮源中硝态氮的比例,或提高培养基中钾的浓度比例,均有助于蝴蝶兰茎尖生长点的存活,但该研究并未对影响茎尖成活率的基本培养基及糖浓度等重要因素进行深入研究[13]。
本试验系统研究了茎尖大小、基本培养基、激素配比、糖浓度等对蝴蝶兰茎尖组织培养再生的影响,旨在建立高效的蝴蝶兰茎尖脱毒再生体系,为蝴蝶兰脱毒种苗的研究及生产提供技术支持。
1材料与方法
1.1材料
以建兰花叶病毒(Cymbidium mosaic virus,CymMV)和齿舌兰环斑病毒(Odontoglossum ringspot virus,ORSV) 复合感染的蝴蝶兰1031组培苗为试验材料。CymMV和ORSV病毒检测试剂盒购自安德珍生物技术有限公司(ADGEN Biotechnology Co., Ltd.)。
1.2方法
蝴蝶兰组培苗的无菌操作在超净工作台上进行。在 40倍冷光源解剖镜下用解剖针和手术刀剥去生长点外围的幼叶,露出微凸、穹形、发亮的生长点。切下生长点快速放在培养基上表面。基本培养基试验、激素配比试验及糖浓度试验所用外植体均为0.2~0.4 mm带1个叶原基的茎尖生长点。每瓶接种3个茎尖,每个处理8瓶,重复2次。接種后暗处理2周,然后进行光照培养,光照条件800 lx,光照时间为10 h/d,温度22~28℃。培养40 d后,统计茎尖的成活率、褐化率及死亡率。试验设计如下。
1.2.1基本培养基试验基本培养基共设5个处理:M1,MS;M2,1/2MS;M3,1/3MS;M4,1/4MS;M5,1/5MS。其中,1/2MS、1/3MS、1/4MS、1/5MS是指将MS中的大量元素变为原来的1/2、1/3、1/4、1/5。每个处理培养基均添加3.0 mg/L 6-BA +0.5 mg/L NAA + 25 g/L绵白糖+ 1.0 g/L AC(活性炭)+15%CW(椰乳)。
1.2.2激素配比试验激素配比共设5个处理:A1,8.0 mg/L 6-BA +1.0 mg/L NAA;A2,5.0 mg/L 6-BA +1.0 mg/L NAA;A3,3.0 mg/L 6-BA +0.5 mg/L NAA;A4,2.0 mg/L 6-BA +0.5 mg/L NAA;A5,1.0 mg/L 6-BA +0.2 mg/L NAA。每个处理培养基均添加1/2MS +25 g/L绵白糖+1.0 g/L AC +15%CW。
1.2.3糖浓度试验绵白糖浓度共设5个处理:T1,10 g/L;T2,15 g/L;T3,20 g/L;T4,25 g/L;T5,30 g/L。其中每种培养基均添加1/2MS+ 3.0 mg/L 6-BA +0.5 mg/L NAA+1.0 g/L AC +15%CW。
1.2.4茎尖大小试验茎尖大小共设3个处理:S1,≤0.2 mm,茎尖生长点不带叶原基;S2,0.2~0.4 mm,茎尖生长点带1个叶原基;S3,≥0.5 mm,茎尖生长点带2个叶原基。培养基为1/2MS+1.0 mg/L 6-BA+0.2 mg/L NAA+25 g/L绵白糖+1.0 g/L AC+15% CW。
1.3数据处理
试验数据均采用Microsoft Excel 2007及SPSS 18.0统计软件进行分析,以邓肯氏新复极差法测验,比较0.05水平上的差异显著性。
2结果与分析
2.1无机盐浓度对蝴蝶兰茎尖组织培养的影响
由表1可见,无机盐浓度对蝴蝶兰茎尖褐化率、成活率及外植体生长有显著影响。在一定浓度范围内,随着无机盐浓度的降低,茎尖成活率显著增加。无机盐浓度太高或是太低均导致茎尖生长点发黄褐化、玻璃化明显。其中M3处理的茎尖叶色翠绿,长势健康,为茎尖生长点培养的最适宜浓度。
2.2激素配比对蝴蝶兰茎尖组织培养的影响
由表2可见,不同激素配比的培养基中蝴蝶兰茎尖外植体褐化率、成活率及长势特征差异明显。A3处理茎尖成活率最高,但茎尖芽小,长势弱;而A5处理成活率虽较A3处理略低,但茎尖生长势健壮,为最适激素配比。另外,高浓度的6-BA易导致茎尖生长点发黄褐化、玻璃化严重,且有变异现象。
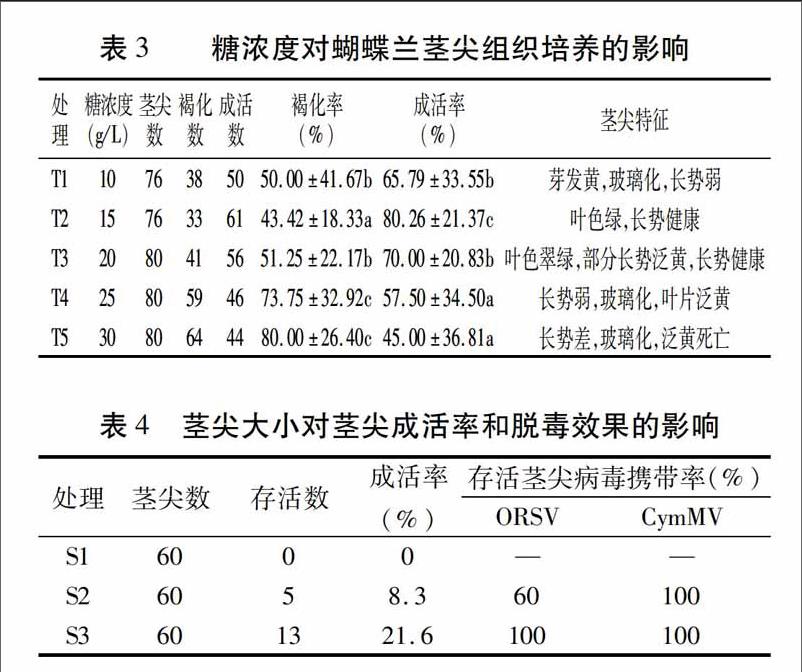
2.3糖浓度对蝴蝶兰茎尖组织培养的影响
由表3可见,糖浓度对蝴蝶兰茎尖褐化率、成活率有显著的影响,且不同糖浓度处理外植体长势特征差异明显。随着糖浓度的升高,茎尖成活率显著降低,糖浓度太高或是太低均导致茎尖生长点发黄褐化、玻璃化明显。其中T2处理茎尖长势健康,叶色翠绿,为茎尖生长点组织培养最适宜的糖浓度。
2.4茎尖大小对其组培成活率和脱毒效果的影响
随着外植体增大,茎尖培养成活率相应提高,主要是因为材料越小创伤面积相对越大,成活率低。其中,S1处理茎尖全部死亡;S2处理茎尖成活率为8.3%,有2株未检测到ORSV病毒,病毒脱除率为40%,表明茎尖大小介于0.2~0.4 mm之间,带1个叶原基,有利于脱除ORSV病毒;S3 处理茎尖成活率为21.6%,但均未脱除CymMV和ORSV病毒,表明茎尖大小大于0.5 mm,带2个叶原基,外植体成活率虽高,但不能达到脱毒效果(表4)。
3讨论与结论
茎尖大小是影响脱毒率的主要因素。通常切取的茎尖越小,脱除效果越好,但成活率低。不同的植物种类因基因型和个体的差异,脱毒茎尖长度也不相同。席梦利等[14]研究发现当宜兴百合茎尖接种长度为0.8~2.0 mm时,成活率可达90%~100%,但起不到脱除病毒的作用;只有0.8 mm以下的茎尖才有可能获得无病毒植株。而本研究结果表明蝴蝶兰茎尖大小介于0.2~0.4 mm且带1个叶原基时,有利于脱除ORSV病毒,但茎尖生长缓慢,易褐化死亡,成苗率较低。这可能是由于植物材料不同所致。
MS培养基中无机盐的浓度对茎尖成活率影响显著,本研究中随着培养基中无机盐浓度的降低,茎尖成活率明显增加。景维杰等[13]研究表明,培养基的无机盐浓度对蝴蝶兰茎尖组织培养的外植体存活率有重要影响,无机盐浓度过高造成的培养基高渗透压逆境降低了蝴蝶兰茎尖组织培养的存活率,这与本研究的结果一致。
激素配比对植物组织培养有重要的影响。本研究发现过高或过低的激素配比均不利于茎尖的成活,激素配比过高容易导致茎尖发生变异死亡,过低又不利于诱导生长点启动,这与贺嘉[15]的研究结果一致。糖浓度是影响培养基渗透压的重要因素,而渗透压又直接影响了茎尖生长点的成活率,本研究结果表明糖浓度与茎尖成活率呈负相关关系。
综上可得,1/3MS+ 1.0 mg/L 6-BA +0.2 mg/L NAA +15 g/L绵白糖为最适宜的蝴蝶兰茎尖生长点培养基。本试验中蝴蝶兰茎尖存活率虽有所提高,但脱毒比率仍然较低。分析原因可能是:第一,本研究采用CymMV和ORSV两种病毒复合感染蝴蝶兰,加大了脱除病毒的难度;第二,茎尖剥离技术不精准,还有待进一步改进。因此建议在以后的研究中对于复合感染的材料,可以先使用病毒抑制试剂(如病毒唑等)進行预培养,降低外植体所带病毒的浓度,再配合茎尖培养脱毒;其次,在茎尖基本培养基中添加抗褐化试剂如活性炭或抗坏血酸,以减弱外植体的褐化程度,以提高茎尖成活率。
参考文献:
[1]朱根发. 蝴蝶兰种质资源及杂交育种进展[J]. 广东农业科学,2015, 42(5): 31-38.
[2]李正民,王安石,王健,等. 病毒抑制剂对蝴蝶兰病毒植株的脱毒效果[J]. 热带生物学报,2013,4(1):56-60,73.
[3]Zilkah S, Faingersh E, Rotbaum A, et al. In vitro micropropagation of indicator plants for indexing Prunus necrotic ring spot virus[J]. Acta Horticulturae,1993,35(336): 121-126.
[4]艾鹏飞,罗正荣. 柿休眠芽茎尖玻璃化法超低温保存及植株再生[J]. 中國农业科学,2003, 36(5): 553-556.
[5]刘华清. 果树无病毒化栽培及脱毒技术应用[J]. 福建果树,1997(3): 30-31.
[6]唐红琴,方锋学,韦金菊,等. 甘蔗茎尖脱毒组织培养技术研究进展[J]. 南方农业学报,2011,42(8):860-865.
[7]高慧卿,樊兰瑛,王秀红,等. 茎尖培养及热处理技术在百合脱毒中的应用研究[J]. 山西农业大学学报(自然科学版),2010,30(6):528-532.
[8]蒋瑜,张丽芳,朱维贤,等. 马铃薯茎尖脱毒培养基的筛选及影响因素分析[J]. 长江蔬菜,2010(4): 11-13.
[9]何家涛,赵劲松,董珍文,等. 高妻葡萄茎尖脱毒技术与高效再生体系研究[J]. 广东农业科学,2007(4): 39-42.
[10]何欢乐,阳静,蔡润,等. 草莓茎尖培养脱毒效果研究[J]. 北方园艺,2005(5): 79-81.
[11]李正民. 蝴蝶兰无毒苗组培快繁技术研究[D]. 海口:海南大学, 2013.
[12]靖晶. 蝴蝶兰组织培养与脱除病毒技术研究[D]. 北京:北京林业大学, 2011.
[13]景维杰,黄容清,蒋明殿,等. 蝴蝶兰茎尖培养脱病毒技术初步研究[J]. 中国园艺文摘,2013(4): 13-16.
[14]席梦利,王节萍,章静娟,等. 宜兴百合脱毒技术[J]. 江苏农业学报,2001, 17(1): 49-51.
[15]贺嘉. 蝴蝶兰(Phalaenopsis)脱毒快繁关键技术及其生理基础的研究[D]. 南京:南京农业大学, 2010.
