吡啶衍生物合成及抗幽门螺杆菌活性研究
2017-06-29林华鑫宋欣沛邹远军郑一敏
钟 猛,丁 锐,林华鑫,宋欣沛,邹远军,王 锐,郑一敏
(重庆理工大学 药学与生物工程学院, 重庆 400054)
吡啶衍生物合成及抗幽门螺杆菌活性研究
钟 猛,丁 锐,林华鑫,宋欣沛,邹远军,王 锐,郑一敏
(重庆理工大学 药学与生物工程学院, 重庆 400054)
合成了系列吡啶衍生物,并对其进行抗幽门螺杆菌(Helicobacter pylori,HP)作用研究,以得到较高活性的先导化合物。以2-氯甲基-3-甲基-4-甲氧基吡啶盐酸盐为原料,通过亲核取代、间氯过氧苯甲酸(m-CPBA)氧化合成了系列吡啶衍生物;采用琼脂扩散法,以阿莫西林为阳性对照,进行了初步体外抗幽门螺杆菌( Anti-Helicobacter pylori)活性评价。成功合成了2a~2c、3a~3c、4a、5a、6a~6c十一个吡啶衍生物,并经过MS、1H NMR和13CNMR 结构确证,发现化合物2a、6a均有良好活性。由此发现了新型的具有抗幽门螺杆菌作用的吡啶类先导化合物。
吡啶衍生物; 先导化合物; 幽门诺杆菌; 合成; 阿莫西林
幽门螺旋杆菌(Helicobacter pylori,HP)是由2005年诺贝尔生理学和医学奖获得者Warren和Marshall于1979年从慢性胃炎病人的胃镜活检标本中分离得到的一种多鞭毛革兰氏阴性微需氧杆菌。从发现以来,HP一直受到国内外医学界的广泛关注。幽门螺杆菌感染是慢性活动性胃炎、消化性溃疡、胃黏膜相关淋巴组织(MALT) 淋巴瘤和胃癌的主要致病因素[1-2]。目前,世界范围内有超过50%的人存在HP感染[3]。因此,1994年世界卫生组织/国际癌症研究机构(WHO/IARC) 将幽门螺杆菌定为Ⅰ类致癌因子[4]。根除HP有助于降低溃疡复发,预防MALT-淋巴瘤(黏膜相关组织淋巴瘤)及其他胃部恶性肿瘤[5]。目前对胃炎、胃溃疡、十二指肠溃疡的治疗,主要以抑制胃酸分泌的H2受体拮抗剂、质子泵抑制剂及胃粘膜保护药物为主流,但是这些溃疡治疗药物对复发性胃病疗效甚微[1]。根除幽门螺杆菌是治疗复发性胃病的基本途径。在此前提下,由抗生素及合成抗菌药(如阿莫西林、克拉霉素、替硝唑等抗生素二选一与质子泵抑制剂(proton pump inhibitors,PPI))构成的三联疗法成为临床治疗感染幽门螺杆菌消化性溃疡的主要治疗药物[2-7]。然而,作为一线临床方案的三联疗法存在下列显著问题:① 广谱抗生素缺乏选择性,且临床上大剂量给药及患者的长期使用会伴随有恶心、呕吐、腹泻等副作用,为治疗方案的临床普及带来困难;另一方面,会导致胃肠道内的有用菌群失调,产生便溏、腹泄、味觉异常、舌炎、口腔炎、肝功能障碍、肝功能异常、出血性肠炎等副作用,甚至助长耐甲氧西林金黄色葡萄球菌(MRSA) 的出现[7]。② 长期使用PPI会导致胃炎类型改变,使胃窦胃炎转向胃体胃炎。其原因在于:长期使用PPI使胃内pH值增加,会导致HP从胃窦向胃体迁移,而胃体炎症及萎缩会减少胃酸分泌,其最终结果是促进胃癌得病几率增加[1-2]。③ 阿莫西林(AMX)在pH值低于4、克拉霉素CLR在pH值低于5时不稳定,易水解。显然,通常胃酸pH值(1~2)更易使其迅速水解,从而使药效降低[8]。④ 三联疗法导致HP的克拉霉素、甲硝唑抗性菌株频现,抵抗率逐年上升,抗药性使HP根治日益困难[9]。
研究表明:MK-6(甲萘醌-6)及未确定的一些醌类在HP呼吸中起重要作用。在HP中MK-6或MK-1充当着辅酶Q类似的角色作用[10]。MK-6是幽门诺杆菌电子转移链中重要的移动组分,而电子转移链的存在是通过氧化磷酸化合成ATP的前提条件。显然,合成辅酶Q的结构类似物——结构更简单的吡啶衍生物——可以与MK-6相竞争,从而抑制HP电子传递。另外,在吡啶衍生物2位引入长链烷基后,将有助于渗入外膜,并可能改变膜的流动性,从而引起通透性改变而起到杀菌作用[11]。Diggle 等[12-13]研究了2-烷基4-喹诺酮(AQs)可控制菌群的行为,认为AQs对铜绿假单胞菌、类鼻疽伯霍尔德杆菌、枯草杆菌及白色念珠菌可产生抑制。Liu等[14]揭示硫醚类化合物对HP的 MIC为8~64 μg/mL, 小鼠胃部脲酶活性可降低70%,体内活性好,且该化合物耐热,100 ℃ 下仍保持良好的抗菌效果。为此,本研究合成了结构更简单的2-烷基喹诺酮结构类似物——吡啶类化合物(合成路线见图1),并探究其抗幽门螺杆菌活性[15]。
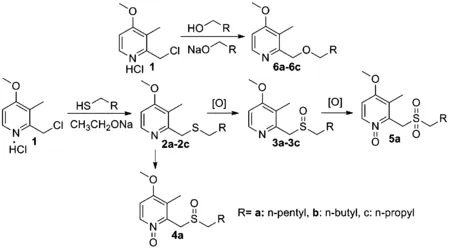
图1 吡啶衍生物合成路线
1 仪器与试剂
HWCL-1恒温磁力搅拌器,郑州长城仪器有限公司出品。PSL-1810型磁力搅拌低温槽,EYELA东京理化器械株式会社出品。层析用硅胶,300~400目。
合成原料试剂均购于Adamas及General Regent。核磁(NMR)由Bruker Avance-600MHz测定(内标TMS)。质谱(MS)由Finnigan-LCQDECA (ESI-MS) 及Bruker Daltonics Bio TOF-Q测定。MGC AnaeroPack 系列2.5L厌氧培养罐由上海宝曼生物科技有限公司生产。AnaeroPack微需氧产气袋由上海宝曼生物科技有限公司提供。幽门螺旋杆菌NCTCJ 99 sw-2由第三军医大学医学检验系临床微生物教研室提供。布氏肉汤由青岛海博生物技术有限公司提供。脑心浸液琼脂干粉由青岛海博生物技术有限公司提供。选择性抗生素(每毫升含萘啶酮酸1 mg、TMP 0.5 mg、万古霉素0.3 mg、两性霉素B 0.2 mg)由青岛海博生物技术有限公司提供。琼脂粉由成都科龙化工试剂厂生产。脱纤维羊血由广州蕊特生物科技有限公司提供。小牛血清由杭州四季青有限公司提供。氧化酶试纸由杭州天和微生物试剂有限公司生产。尿素酶试纸由珠海市克迪科技开发有限公司生产。Nisin A由兰州生物制品所提供。万古霉素由华北制药股份有限公司生产。实验所用试剂均为市售分析纯。
2 实验方法
2.1 吡啶类化合物的合成
2.1.1 目标化合物2a~2c的合成
2a的合成:氮气保护下,将0.26 g Na(11.3 mmol) 溶解在10 mL无水乙醇中,反应完成后冷却至0~5 ℃,加入2-氯甲基-4-甲氧基吡啶盐酸盐(5 mmol)、1-己硫醇(6 mmol),混合物室温隔夜搅拌。反应完成后,真空旋除溶剂,残留物低温下加入20 mL冰水,以乙醚萃取(20 mL×3),合并有机相,无水硫酸钠干燥,真空旋除溶剂,残留物硅胶柱层析(石油醚∶乙酸乙酯=3∶1~1∶1梯度洗脱),可得到无色油状液体1.14 g,收率为90%。 ESI-MS:m/z 254([M+H]+)。1H NMR (500 MHz,CDCl3):δ=8.20 (d,J=5.5 Hz,1H),6.61 (d,J=5.5 Hz,1H),3.78 (s,5H),2.50 (t,J=7.5 Hz,2H),2.17 (s,3H),1.50 (dt,J=15.0,7.4 Hz,2H),1.30-1.18 (m,6H),0.82 (t,J=7.0 Hz,3H).13CNMR (125 MHz,CDCl3):δ=163.80,157.32,147.28,120.03,104.34,55.16,36.16,31.80,31.21,29.25,28.34,22.33,13.83,10.43。
2b的合成:合成方法同2a。得到无色油状液体1.10 g,收率为92%。ESI-MS:m/z 240 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.25 (d,J=6.0 Hz,1H),6.66 (d,J=6.0 Hz,1H),3.84 (d,J=2.8 Hz,5H),2.55 (t,J=7.6Hz,2H),2.21 (s,3H),1.59-1.52 (m,2H),1.32-1.26 (m,4H),0.87 (t,J=6.8 Hz,3H).13CNMR (100 MHz,CDCl3):δ=164.04,157.55,147.47,120.27,104.55,55.37,36.37,32.01,31.05,29.20,22.26,13.95,10.63。
2c的合成:合成方法同2a。得到无色油状液体1.05 g,收率为93%。ESI-MS:m/z 226 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.17 (d,J=6.0 Hz,1H),6.58 (d,J=6.0 Hz,1H),3.76 (s,5H),2.49 -2.42 (t,J=7.6Hz,2H),2.14 (s,3H),1.50 (dt,J=15.2,7.6 Hz,2H),1.32-1.26 (m,2H),0.81 (t,J=7.2 Hz,3H).13CNMR (100 MHz,CDCl3):δ=163.97,157.44,147.39,104.50,76.87,55.31,36.26,31.61,31.53,21.91,13.60,10.55。
2.1.2 目标化合物6a~6c的合成
6a的合成:氮气保护下,向己醇钠(22 mmol钠溶解在15 mL己醇中)滴加相应3-甲基4-甲氧基吡啶盐酸盐(10 mmol,溶解在10 mL己醇中)。滴加完成后,混合物加热至90 ℃,搅拌18~20 h(TLC监控)。反应完成后冷却至室温,加入20 mL 冰水,以乙醚萃取(20 mL×3),合并有机相,无水硫酸钠干燥,真空旋除溶剂,残留物柱层析(石油醚∶乙酸乙酯=3∶1-1∶1梯度洗脱),可得到淡黄色油状液体0.90 g,产率为76%。ESI-MS:m/z 238 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.23 (d,J=3.2 Hz,1H),6.63 (d,J=3.2 Hz,1H),4.55 (t,J=3.2 Hz,2H),3.78 (dd,J=5.3,3.6 Hz,3H),3.45 (dd,J=6.4,2.0 Hz,2H),2.19 (d,J=2.8 Hz,3H),1.53 (d,J=6.4 Hz,2H),1.27-1.20 (m,6H),0.82 (t,J=4.0,2.0 Hz,3H).13CNMR (100 MHz,CDCl3):δ=164.05,156.32,147.55,121.69,105.20,73.32,70.76,55.27,31.59,29.64,25.78,22.54,13.96,10.15。
6b的合成:合成方法同6a。得到浅黄色油状液体0.892 g,收率为80%。ESI-MS:m/z 224 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.28 (d,J=5.6 Hz,1H),6.68 (d,J=5.6 Hz,1H),4.58 (s,2H),3.82 (s,3H),3.47 (t,J=6.8 Hz,2H),2.22 (s,3H),1.59-1.55 (m,2H),1.30-1.26 (m,4H),0.86 (t,J=6.8 Hz,3H).13CNMR (100 MHz,CDCl3):δ=164.10,156.34,147.59,121.74,105.24,73.34,70.82,55.33,29.39,28.30,22.47,13.97,10.19。
6c的合成:合成方法同6c。得到浅黄色油状液体0.173 g,收率为83%。MS:m/z 210 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.28 (d,J=5.6 Hz,1H),6.70 (d,J=5.6 Hz,1H),4.59 (s,2H),3.82 (s,3H),3.49 (t,J=6.8 Hz,2H),2.22 (s,3H),1.59-1.52 (m,2H),1.37-1.31 (m,2H),0.88 (t,J=7.2 Hz,3H).13CNMR (100 MHz,CDCl3):δ=164.10,156.35,147.61,121.75,116.86,105.25,104.57,73.37,70.52,55.33,31.79,19.32,13.85,10.19。
2.1.3 目标化合物3a-3c的合成
3a的合成:在氩气保护下,将5 mmol 2a溶解在40 mL 无水二氯甲烷中。随后加入25 mL饱和NaHCO3溶液。混合物冷却至0 ℃,剧烈搅拌下滴加m-CPBA(77%,1.1 g)/二氯甲烷 (8.5 mL)。搅拌反应10~20 min(淀粉纸显示过酸消耗完毕),分离有机相,水相以二氯甲烷萃取,合并有机相,旋除溶剂,残留物柱层析(石油醚∶乙酸乙酯=1∶1),可得到无色油状液体1.214 g,收率为84%。ESI-MS:m/z 290 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.26 (d,J=5.6 Hz,1H),6.68 (d,J=5.6 Hz,1H),4.26 (d,J=12.8 Hz,1H),4.15 (d,J=12.8 Hz,1H),3.82(s,3H),2.77-2.71 (m,2H),2.22 (s,3H),1.75-1.71 (m,2H),1.25-1.22 (m,4H),0.83 (t,J=6.8 Hz,3H).13CNMR (100 MHz,CDCl3):δ=164.30,150.11,148.19,122.75,105.21,58.01,55.53,52.12,31.31,28.42,22.45,22.32,13.91,11.21。
3b的合成:合成方法同3a。得到无色油状液体1.084 g,收率为85%。MS:m/z 256 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.28 (d,J=5.6 Hz,1H),6.69 (d,J=5.6 Hz,1H),4.28 (d,J=12.8 Hz,1H),4.16 (d,J=12.8 Hz,1H),3.83 (s,3H),2.78-2.72 (m,2H),2.24 (s,3H),1.78 -1.74 (m,2H),1.38-1.27 (m,4H),0.87 (t,J=7.2 Hz,3H).13CNMR (400 MHz,CDCl3):δ=164.21,150.23,148.35,122.67,105.19,58.19,55.50,52.09,30.92,22.26,22.21,13.79,11.23。
3c的合成:合成方法同3a。得到无色油状液体1.048 g,收率为87%。ESI-MS:m/z 242 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.06 (d,J=5.6 Hz,1H),6.50 (d,J=5.2 Hz,1H),4.06 (d,J=12.8 Hz,1H),3.96 (d,J=12.8 Hz,1H),3.61 (s,3H),2.59-2.52 (m,2H),2.02 (s,3H),1.24-1.16 (m,2H),0.70 (t,J=7.2 Hz,3H).13CNMR (100 MHz,CDCl3):δ=164.05,149.96,148.09,122.41,105.11,57.79,55.38,51.56,24.31,21.78,13.49,11.02。
2.1.4 目标化合物4a的合成
将2a(2 mmol)溶解在10 mL氯仿中,随后在室温下加入m-CPBA(77%,0.536 g)/氯仿(10 mL)。室温搅拌反应20 h。反应结束后,加入10% NaOH溶液,调节pH值至8左右,用二氯甲烷萃取,合并有机相,无水硫酸钠干燥,过滤,真空旋除溶剂,残留物硅胶柱层析(石油醚∶乙酸乙酯=1∶1,甲醇∶乙 酸乙酯=1∶3梯度洗脱),可得到无色油状液体0.245 g,收率为43%。ESI-MS:m/z 286 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.30 (d,J=5.6 Hz,1H),6.75 (d,J=5.6 Hz,1H),4.44 (s,2H),3.86 (s,3H),3.08 (t,J=8 Hz 2H),2.30 (s,3H),1.88-1.80 (m,2H),1.44-1.36 (m,2H),1.31-1.27(m,4H),0.89 (t,J=6.8Hz,3H).13CNMR (100 MHz,CDCl3):δ=164.56,148.68,148.21,124.14,105.71,58.81,55.58,52.18,31.18,28.09,22.29,21.57,13.94,11.56。
2.1.5 目标化合物5a的合成
将3a(2.13 mmol,0.572 g)溶解在15 mL氯仿中,随后加入m-CPBA(77%,0.914 g)/氯仿 (15 mL),加热回流3 h。反应完成后,冷却至室温。加入10% NaOH溶液调节pH值至8左右,用二氯甲烷萃取,合并有机相,无水硫酸钠干燥,过滤,真空旋除溶剂,残留物硅胶柱层析(石油醚∶乙酸乙酯=1∶1,甲醇∶乙酸乙酯=1∶3梯度洗脱),可得到白色固体0.365 g,收率为57%。ESI-MS:m/z 302 ([M+H]+)。1H NMR (400 MHz,CDCl3):δ=8.18 (d,J=7.2 Hz,1H),6.77 (d,J=7.2 Hz,1H),4.85 (s,2H),3.89 (s,3H),3.33 (t,J=8.0 Hz,2H),2.35 (s,3H),1.91 (dt,J=15.6,7.6 Hz,2H),1.46-1.39 (m,2H),1.31-1.27(m,4H ),0.88 (t,J=2.8 Hz, 3H).13CNMR (100MHz,CDCl3):δ=156.51,140.91,137.13,127.91,107.02,56.45,56.19,52.42,31.28,28.14,22.29,21.85,13.89,12.70。
2.2 吡啶类化合物抗幽门螺杆菌活性试验
2.2.1 培养基制备
脑心浸液牛血清糊精琼脂平板制备:称取脑心浸液琼脂干粉(BHI)5.2 g,加入琼脂粉0.2 g、β-环糊精0.1 g,溶于93 mL蒸馏水中,121 ℃ 15 min 高压灭菌。待培养基温度降至50~55 ℃时,加入1 mL混合抗生素(选择性抗生素中加入300 μL Nisin)、7 mL小牛血清及0.004%(mg·mL-1)的活菌染色剂TTC(氯代三苯基四氮唑),混匀,趁热用无菌移液管吸取15 mL培养基加入灭菌培养皿内(直径90 mm),放置于无菌工作台上,冷却凝固后用无菌袋包装好,放置于4 ℃冰箱保存备用。
2.2.2 幽门螺杆菌菌悬液的制备
取冷冻保存的菌株立即放入37 ℃水浴30 s,用移液枪吸取50 μL加入脑心浸液血糊精琼脂平板,用灭菌接种环密集划线后,放于厌氧罐中,加入微需氧产气袋,放于37 ℃恒温培养箱养2 d后,在平板中加入布氏肉汤1 mL,用L棒刮下菌苔,用比浊法将菌浓度调节至1×109 CFU·mL-1,备用。
2.2.3 样品配制
用50% PEG将样品配制10 μg·mL-1、1 μg·mL-1两个浓度。
2.2.4 活性评价
用直径10 mm的打孔器在抑菌平板上打孔,取出孔内培养基后,每孔加样品100 μL,然后将平板放于厌氧罐中,加入微需氧产气袋,放于37 ℃恒温培养箱培养48 h后观察结果。每个化合物活性评价均经过3~5次重复验证实验,实验数据均是经过统计学分析得到,见表1。
表1 合成吡啶衍生物抗HP活性结果±s)
3 讨论
对合成的2位烷基取代吡啶类化合物进行活性测定,实验结果见表1。由2a~2c可以看出:化合物2a活性较好。由3a~3c可知:3a抗HP活性较好。从6a~6c可知:6a抗Hp活性较好。由此可以得出:2位取代的烷基链增长,活性有所增加,但是随着烷基链的延长,物质的脂溶性增加,成药性降低。从表1可以看出:4a和5a在10 μg·mL-1是几乎没有活性;3c和6c在1 μg·mL-1时几乎没有活性。由2a、3a、4a、5a和6a,2b、3b和6b,2c、3c和6c可以看出:吡啶硫醚类、吡啶醚类、吡啶亚砜类、吡啶亚砜氮氧化物、吡啶砜氮氧化物类化合物抗幽门活性依次降低。2a、6a表现出较好的抗幽门诺杆菌活性,可做为新的先导化合物,继续进行深入、系统的构效关系研究及机制研究,为治疗抗幽门螺杆菌的新药筛选提供新思路。
[1] GISBERT J P,PAJARES R,PAJARES J M.Evolution of Helicobacter pylori therapy from a meta-analytical perspective[J].Helicobacter,2007,12(2):50-58.
[2] GISBERT J P,PAJARES J M.Treatment of Helicobacter pylori infection:the past and the future[J].Eur J Int Med,2010,21(5):357-359.
[3] TONKIC A,TONKIC M,LEHOURS P,et al.Epidemiology and diagnosis of Helicobacter pylori infection[J].Helicobacter,2012,17(s1):1-8.
[4] SETTE A,KEOGH E,ISHIOKA G,et al.Epitope identification and vaccine design for cancer immunotherapy[J].Curr Opin Investig Drugs,2002,3(1):132-139.
[5] 储建坤,李增宁,马金城,等.中西医结合治疗幽门螺杆菌相关性胃炎的临床研究[J].时珍国医国药,2013 (2):496-497.
[6] BOCIAN KM,JAGUSZTYN- KRYNICK A E K.The controversy over anti-Helico- bacter pylori therapy[J].Pol J Microbiol,2012,61:239-246.
[7] CHUAH S K,TSAY F W,HSU P I,et al.A new look at anti-Helicobacter pylori therapy[J].World J Gastroenterol,2011,17(35):3971-3975.
[8] WANG Y C,LI W Y,WU D C,et al.In Vitro Activity of 2-methoxy-1,4-nap- hthoquinone and Stigmasta-7,22-diene -3β -ol from Impatiens balsamina L against Multiple Antibiotic-Resistant Helicobacter pylori[J].Evid-Based Compl Alt,2011(3):126-134.
[9] MALFERTHEINER P,MEGRAUD F,O’MORAIN C A,et al.Management of Helicobacter pylori infection—the Maas- tricht IV/ Florence Consensus Report[J].Gut,2012; 61:646-664.
[10]JIANG M,CAO Y,GUO Z F,et al.Menaquinone biosynthesis in escherichia coli:identification of 2-succinyl-5-enolp- yruvyl-6-hydroxy-3-cyclohexene-1-carb-oxylate as a novel intermediate and re-evaluation of MenD activity[J].Biochemistry,2007,46(38):10979-10989.
[11]KOGA T,INOUE H,ISHII C,et al.Effect of plaunotol in combination with clarithromycin or amoxicillin on Helic- obacter pylori in vitro and in vivo[J].Journal of Antimicrob Chemoth,2002,50(1):133-136.
[12]DIGGLE SP,MATTHIJS S,WRIGHT V J,et al.The Pseudomonas aeruginosa 4-quinolone signal molecules HHQ and PQS play multifunctional roles in quorum sensing and iron entrapment[J].Chem Biol,2007,14(1):87-96.
[13]REEN F J,MOOIJ M J,HOLCOMBE L J,et al.The Pseudomonas quinolone signal (PQS),and its precursor HHQ,modulate interspecies and interkingdom behaviou[J].FEMS Microbiol Ecol,2011,77:413-428.
[14]LIU W,HSU C,YIN M.In vitro anti-Helicobacter pylori activity of diallyl sulphides and protocatechuic acid[J].Phytother Res,2008,22(1):53-57.
[15]ABE H,KAWADA M,INOUE H,OHBA S,et al.Structure-activity relationship study of intervenolin derivatives:synthesis,antitumor,and anti-Helicobacter pylori activities[J].Tetrahedron,2013,69(36):7608-7617.
(责任编辑 何杰玲)
Synthesis and Anti-HelicobacterPyloriActivity of Pyridine Derivatives
ZHONG Meng, DING Rui, LIN Hua-xin, SONG Xin-pei, ZOU Yuan-jun, WANG Rui, ZHENG Yi-min
(College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing 400054, China)
We compounded a series of pyridine derivatives and evaluated its activity of anti-Helicobacterpylorito get lead compounds with higher activity. The target compounds were synthesized through nucleophilic substitution, oxidation bym-CPBA using 2-chloromethyl-4-methoxy-3-methylpyridine hydrochloride as starting material, and evaluated anti-Helicobacterpyloriactivity of pyridine derivatives by the agar diffusion method and amoxicillin as positive control. The target compounds were successfully synthesized and verified by13CNMR,1H NMR and MS spectra, which included 2a~2c, 3a~3c, 4a, 5a, 6a~6c, etc. 11compouds altogether, and then found that 2a and 6a exhibited comparable efficacy to amoxicillin. A new family of anti-Helicobacterpyloriactivity of pyridine derivatives is disclosed.
pyridine derivative; lead compound;Helicobacterpylori; synthesis; amoxicillin
2017-01-04 基金项目:重庆高校创新团队建设计划资助项目(CXTDX201601031)
钟猛(1990—),男,硕士研究生,主要从事微生物与生化药学研究,E-mail:zhongmeng789@163.com;通讯作者 王锐,男,博士,副教授,主要从事新药设计与合成研究,E-mail:wangrx1022@163.com。
钟猛,丁锐,林华鑫,等.吡啶衍生物合成及抗幽门螺杆菌活性研究[J].重庆理工大学学报(自然科学),2017(5):105-110.
format:ZHONG Meng, DING Rui, LIN Hua-xin, et al.Synthesis and Anti-HelicobacterPyloriActivity of Pyridine Derivatives[J].Journal of Chongqing University of Technology(Natural Science),2017(5):105-110.
10.3969/j.issn.1674-8425(z).2017.05.018
R914
A
1674-8425(2017)05-0105-06
