干酪乳杆菌对利福平和异烟肼联用所致大鼠肝损伤的保护作用
2017-06-29王寅李园园郝海波梁惠马爱国
王寅 李园园 郝海波 梁惠 马爱国
·论著·
干酪乳杆菌对利福平和异烟肼联用所致大鼠肝损伤的保护作用
王寅 李园园 郝海波 梁惠 马爱国
目的 观察干酪乳杆菌代田株(Lactobacilluscaseistrain Shirota,LcS)对RFP和INH联合用药所致大鼠肝损伤的保护作用。方法 将72只无特定病原体(SPF)级雄性SD大鼠,按随机数字表法分为:正常对照组,模型组, LcS低、中、高剂量组,双环醇组,每组12只。模型组,LcS低、中、高剂量组及双环醇组大鼠每天灌胃RFP(50 mg/kg)和INH(50 mg/kg),2 h后LcS低、中、高剂量组大鼠分别灌胃10×108、20×108、40×108菌落形成单位(CFU)/kg的LcS,持续28 d。正常对照组大鼠灌胃0.9%生理盐水(20 ml/kg),双环醇组大鼠灌胃7.5 mg/kg双环醇,每天1次,持续28 d。检测大鼠肝脏指数、肝匀浆超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量、血清谷氨酸氨基转氨酶(ALT)、天冬氨酸氨基转氨酶(AST)、碱性磷酸酶(ALP)、血清总胆汁酸(TBA)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)等,并进行比较。结果 RFP和INH给药28 d后,模型组大鼠肝脏系数升高到(3.14±0.15) %,肝匀浆中MDA和SOD分别达到(4.52±0.52) nmol/mg蛋白和(72.51±11.05) U/mg 蛋白;血清ALT和ALP分别达到(65.45±20.10) U/L和(322.79±61.73) U/L,TBA、TBIL、DBIL、IBIL分别达到(91.34±16.93) μmol/L、(7.82±2.53) μmol/L、(4.70±1.29) μmol/L和(3.69±0.54) μmol/L。LcS补充后,与模型组相比,LcS高剂量组大鼠肝脏系数降低到(2.88±0.12) %;LcS低、中、高剂量组大鼠MDA含量明显下降,分别达到(2.94±0.48) nmol/mg蛋白、(2.82±0.36) nmol/mg蛋白和(2.62±0.28) nmol/mg蛋白;SOD活性明显增强,分别达到(84.60±8.50) U/mg蛋白、(86.28±5.52) U/mg蛋白和(2.62±0.28) U/mg蛋白。与模型组相比,LcS高剂量组的ALT、ALP均降低,分别为(49.92±15.32) U/L和(280.70±54.32) U/L;LcS低、中、高剂量组的TBA水平分别降低到(67.63±18.95) μmol/L、(55.32±19.17) μmol/L 和(52.92±23.00) μmol/L;LcS中、高剂量组的DBIL和IBIL水平也明显降低,其中DBIL分别降低到(3.64±1.68) μmol/L和(2.92±0.86) μmol/L,IBIL分别降低到(3.21±0.22) μmol/L和(3.12±0.42) μmol/L,差异均有统计学意义(P值均<0.05)。与模型组相比,双环醇组大鼠的血清TBA、TBIL、DBIL、IBIL水平分别降低到(64.49±22.41) μmol/L、(6.33±1.46) μmol/L、(3.54±1.21) μmol/L和(3.01±0.36) μmol/L,差异均有统计学意义(P值均<0.05)。结论 干酪乳杆菌能减轻RFP和INH联合所致的大鼠肝损伤。
乳杆菌,干酪; 利福平; 异烟肼; 药物性肝损伤; 结果与过程评价(卫生保健); 动物实验
利福平(RFP)和异烟肼(INH)是临床治疗肺结核常用的一线抗结核药物,但具有潜在的肝毒性,是药物性肝损伤临床检测的重点药物[1]。由于“肝-肠轴”和肝肠循环的存在,肠道微生态的动态平衡的破坏可促进肝病发生和发展[2]。我国抗结核药物所致药物性肝损伤发生率较高,约为8%~30%[3],是导致患者抗结核药物治疗中断或失败、产生耐药性的重要原因,直接影响治疗效果及病情转归。益生菌是一类能促进肠道菌群生态平衡,对宿主健康有益的活体微生态制剂。近些年来,通过补充益生菌来预防肝脏疾病得到越来越多的关注。已经有研究报道显示,益生菌对于由饮酒、病毒感染及代谢性疾病引起的慢性肝损伤有保护作用[4-5]。也有研究表明,植物乳酸菌与L-精氨酸联合使用可以保护内毒素诱导的肝损伤[6],然而其机制尚不明确。干酪乳杆菌代田株(Lactobacilluscaseistrain Shirota,LcS)是在世界范围内广泛流行和被研究的益生菌,已有研究证实LcS可以通过改善肠道微生物组成,以及调节免疫应答从而发挥对人体健康的有益作用。笔者拟通过RFP和INH灌胃建立大鼠肝损伤模型,研究补充LcS对RFP和INH所致大鼠肝损伤的保护作用,为开发LcS的临床应用奠定基础。
材料和方法
一、材料和试剂
养乐多风味乳酸杆菌饮料[LcS含量:1×108菌落形成单位(CFU)/ml,日本养乐多株式会社];利福平胶囊和异烟肼片(沈阳红旗制药有限公司);双环醇片(北京协和药厂);超氧化物歧化酶(SOD)、丙二醛(MDA试剂盒)、考马斯亮蓝蛋白定量测试试剂盒(三者均由南京建成生物工程研究提供);TIANamp Stool DNA Kit粪便基因组DNA提取试剂盒、SuperReal荧光定量预混试剂增强版(SYBR Green)均由天根生化科技(北京)有限公司提供。
二、模型建立及分组
无特定病原体(specific pathogen free,SPF)级雄性SD大鼠72只,体质量为 180~220 g,购于山东鲁抗医药股份有限公司[实验动物生产许可证号:SCXK(鲁)20080002]。适应性喂养1周后,按随机数字表法分为6组:正常对照组,模型组,LcS低、中、高剂量组,双环醇组,每组12只。INH直接溶于无菌生理盐水,制成浓度为30 g/L的灌胃液,RFP溶于pH 3.0的盐酸溶液,制成浓度为30 g/L的灌胃液,双环醇溶于药用聚乙二醇(PEG400),制成浓度为30 g/L的灌胃液。正常对照组灌胃0.9%氯化钠注射液(20 ml/kg,连续28 d);其余各组大鼠每天1次灌胃RFP 50 mg/kg和INH 50 mg/kg,连续28 d,灌胃体积为20 ml/kg,建立肝损伤模型。在给予RFP和INH 2 h后,LcS的3个剂量组分别灌胃10×108、20×108、40×108cFU/kg的LcS;双环醇组大鼠灌胃7.5 mg/kg双环醇;每天1次,持续28 d。
各组大鼠末次灌胃后禁食12 h,称重后给予3%戊巴比妥钠30 mg/kg麻醉,腹主动脉取血,留取血清;完整分离肝脏并称重,计算肝脏指数;剩余组织于-80 ℃冻存备用。
三、观察及测量指标
1.一般情况观察:试验期间每周称大鼠体质量1次,并观察大鼠的生长情况、毛发颜色的变化、精神状况、食欲及对外界的刺激回应。
2.肝脏指数计算:大鼠处死后,完整分离其肝脏,冷生理盐水冲洗表面血污,滤纸吸干,称重,计算肝脏指数。肝脏指数(%)=肝质量(g)/体质量(g)×100%。
3.肝组织超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量测定:分离大鼠肝脏并称重后,取0.5 g大鼠肝组织,加入冰生理盐水5 ml,用电动匀浆机在冰水中碾磨匀浆,制造10%肝匀浆,1249×g离心15 min,取上清液于-80 ℃冻存备用。采用考马斯亮蓝法测定肝组织蛋白浓度,羟胺法测定SOD活性,硫代巴比妥酸(thiobarbituric acid,TBA)法检测其中MDA含量,详细检测方法按试剂盒说明操作。
4.生化指标检测:给药28d后,麻醉大鼠,腹主动脉取血至无肝素的采血管,室温静置30 min,1880×g离心10 min,制备血清,-80 ℃冻存备用。用全自动生化分析仪测量每组大鼠血清中的谷氨酸氨基转氨酶(ALT)、天冬氨酸氨基转氨酶(AST)、碱性磷酸酶(ALP)、血清总胆汁酸(TBA)、总胆红素(TBIL)、直接胆红素(DBIL)、间接胆红素(IBIL)。
5.大鼠粪便肠道菌群检测:给药28 d后,取大鼠粪便样品,严格按照TIANamp Stool NDA Kit粪便基因组DNA提取试剂盒要求提取大鼠粪便基因组总DNA,-20 ℃冻存。用实时荧光定量PCR方法对大鼠粪便中乳酸杆菌、双歧杆菌、大肠杆菌及粪肠球菌16S rDNA V3可变区进行定量分析并制作标准曲线,将提取的大鼠粪便基因组DNA进行以上4种菌株16S rDNA V3可变区荧光定量PCR反应,反应完毕后进行溶解曲线分析。根据读取的荧光数据,由系统软件Eppendorf Mastercycler ep realplex自动分析Ct值(即PCR扩增过程中,扩增产物的荧光信号达到设定的阈值时所经过的循环次数),将Ct值代入标准曲线,求出大鼠粪便样品中4种菌株的含量
四、统计学分析

结 果
一、各组大鼠的一般情况
1.毛色变化:正常对照组大鼠毛色无明显变化。其余各组大鼠在灌胃第2周时开始出现不同程度的毛色变黄、无光泽,灌胃期间毛色变黄为持续性,处死前大鼠的毛色泛黄,没有光泽。
2.精神状态:正常对照组大鼠在灌胃期间无明显变化。其余组大鼠在灌胃第1周时精神状态良好,食欲佳,对外界刺激敏感;在灌胃第2周出现精神状态不佳,食欲降低,对外界刺激迟钝。
二、各组大鼠的肝脏指数测定
给药28 d后,正常对照组,模型组,LcS低、中、高剂量组及双环醇组大鼠肝脏指数分别为(2.81±0.25) %、(3.14±0.15) %、(3.06±0.17) %、(3.03±0.07) %、(2.88±0.12) %、(2.87±0.17) %,组间差异有统计学意义(F=4.90,P<0.01)。进一步两两比较发现,与正常对照组相比,模型组大鼠的肝脏指数升高;与模型组相比,LcS高剂量组和双环醇组的肝脏指数均降低,差异均有统计学意义(P<0.05)。
三、各组大鼠肝组织SOD活性和MDA含量的测定
给药28 d后,与正常对照组相比,模型组大鼠肝匀浆中MDA平均含量升高了38.5%,SOD活性降低了20.7%;与模型组相比,LcS各剂量组的MDA含量明显降低,SOD活性明显增强,见表1。

表1 给药28 d后各组大鼠肝组织MDA含量及SOD活性变化
注a:与正常对照组比较,差异有统计学意义(P值均<0.05);b:与模型组比较,差异有统计学意义(P值均<0.05)。MDA:丙二醛;SOD:超氧化物歧化酶
四、大鼠血清生化指标
给药28 d后,各组大鼠血清ALT、AST、ALP的变化情况见表2。与正常对照组相比,模型组的ALT、AST、ALP均升高,其中ALT和ALP平均水平分别升高了20.0%和19.3%,差异有统计学意义。与模型组相比,益生菌高剂量组的ALT、ALP平均水平分别降低了16.3%和14.4%,差异有统计学意义。
给药28 d后,各组大鼠血清TBA、TBIL、DBIL、IBIL的变化见表3。与正常对照组相比,各组大鼠的TBA、TBIL、DBIL、IBIL的水平均明显升高,差异有统计学意义。与模型组相比,益生菌各组及双环醇组TBA平均水平均明显降低,分别降低了26.0%、39.4%、42.1%、29.4%;双环醇组TBIL平均水平降低了19.1%,差异均有统计学意义;益生菌中、高剂量组和双环醇组的DBIL和IBIL也明显降低,其中DBIL平均水平分别降低了22.6%、37.9%、24.7%,IBIL平均水平分别降低了13%、15.4%、18.4%。
五、大鼠的肠道菌群变化情况
给药28 d后,各组大鼠粪便菌群分析结果见表4。与正常对照组相比,模型组的双歧杆菌和乳酸杆菌含量明显降低,粪肠球菌和大肠杆菌含量明显增加,差异有统计学意义(P值均<0.05)。与模型组相比,LcS组大鼠粪便中双歧杆菌和乳酸杆菌的含量明显升高,而粪肠球菌和大肠杆菌的含量明显降低,差异有统计学意义(P值均<0.05)。
讨 论
药物性肝损伤在临床上是需要重点关注的问题,其关系到患者用药后的生命安全。RFP和INH是临床广泛使用的一线抗结核药物,但两者联用会明显增加肝毒性,严重影响肺结核的系统治疗和患者的生存质量。美国胸科协会认为INH的肝毒性机制是其代谢过程中形成的肼及乙酰肼[7]。RFP可以竞争性的抑制胆红素的排泄,导致胆红素的淤肝脏与肠道有紧密的解剖与功能关系,肠道微生物在肠道中与宿主相互作用,通过肝肠循环,在肝病的发生、发展中起到重要的作用[9-10]。有资料显示,益生菌可以促进急性胆汁淤积大鼠的胃肠消化间期移行性肌电复合波(MMC)节律性恢复,从而改善肝损伤,减轻胆汁淤积,对肝脏起到保护的作用[11]。在肺结核的治疗过程中,需要长期、联合应用大剂量的抗生素,RFP更是一种广谱抗生素,在长期的抗结核药物治疗过程中容易导致患者肠道微生物群的紊乱。因此,笔者通过补充益生菌,调节大鼠肠道微生态平衡,观察LcS是否对RFP和INH联合所致肝损伤有保护作用。合理摄入活性益生菌,能够改善和修复肠道菌群失调。在2001年,我国公布了双歧杆菌、乳酸杆菌、嗜热链球等三类共计9种可用于保健食品的益生菌名单。本次实验采用的是LcS作为干预物,研究其对RFP和INH联合所致肝损伤的保护作用。结果显示,LcS对RFP和INH联合所致大鼠肝损伤有一定的保护作用。
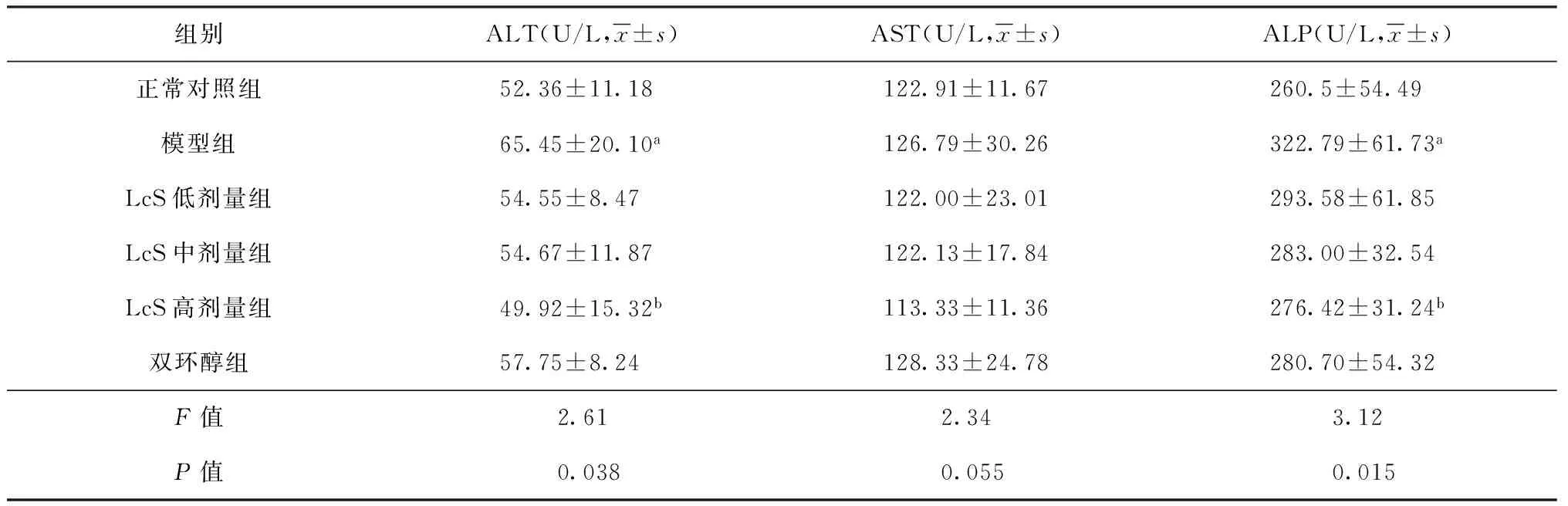
表2 给药28 d后各组大鼠血清生化指标检测结果
注a:与正常对照组比较,差异有统计学意义(P值均<0.05);b:与模型组比较,差异有统计学意义(P值均<0.05)。ALT:丙氨酸氨基转氨酶;AST:天冬氨酸氨基转氨酶;ALP:碱性磷酸酶
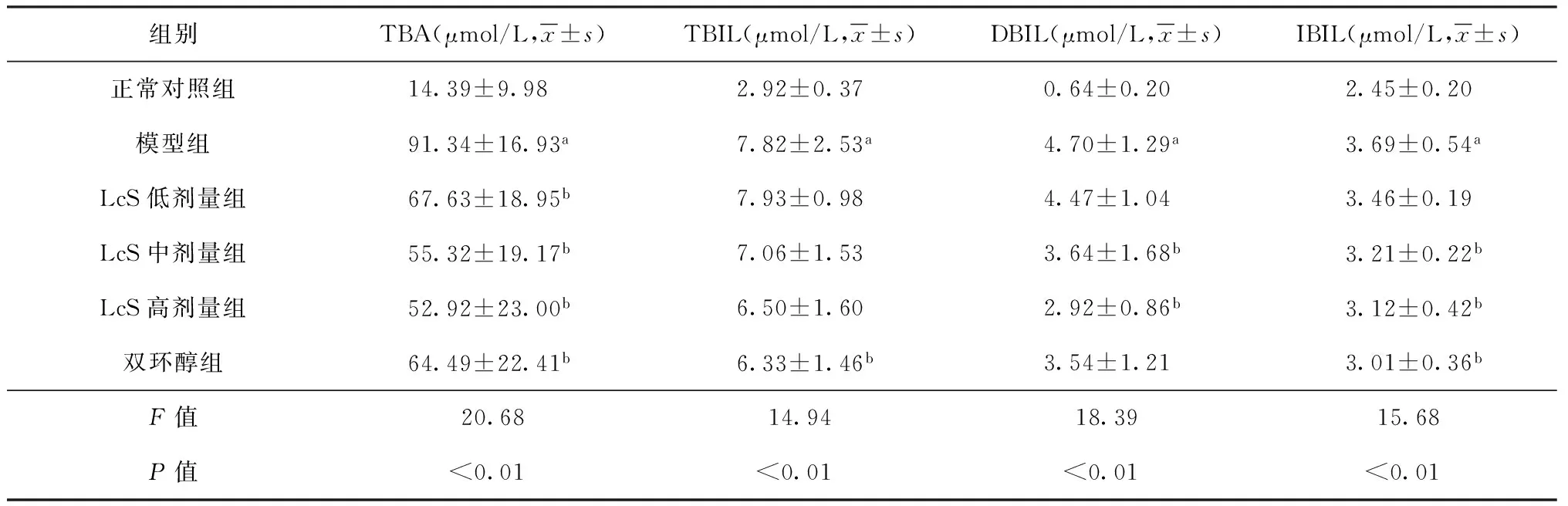
表3 给药28 d后各组大鼠血清生化指标分析结果
注a:与正常对照组比较,差异有统计学意义(P值均<0.05);b:与模型组比较,差异有统计学意义(P值均<0.05)。TBA:血清总胆汁酸;TBIL:总胆红素;DBIL:直接胆红素;IBIL:间接胆红素积;还可以诱导肝药酶的活性,加快INH的代谢,增加乙酰肼代谢的活性中间体和肼,与肝细胞过氧化反应增强,从而加重INH的肝毒性。有研究表明,氧化应激是INH和RFP联用致肝损伤的机制之一[8]。
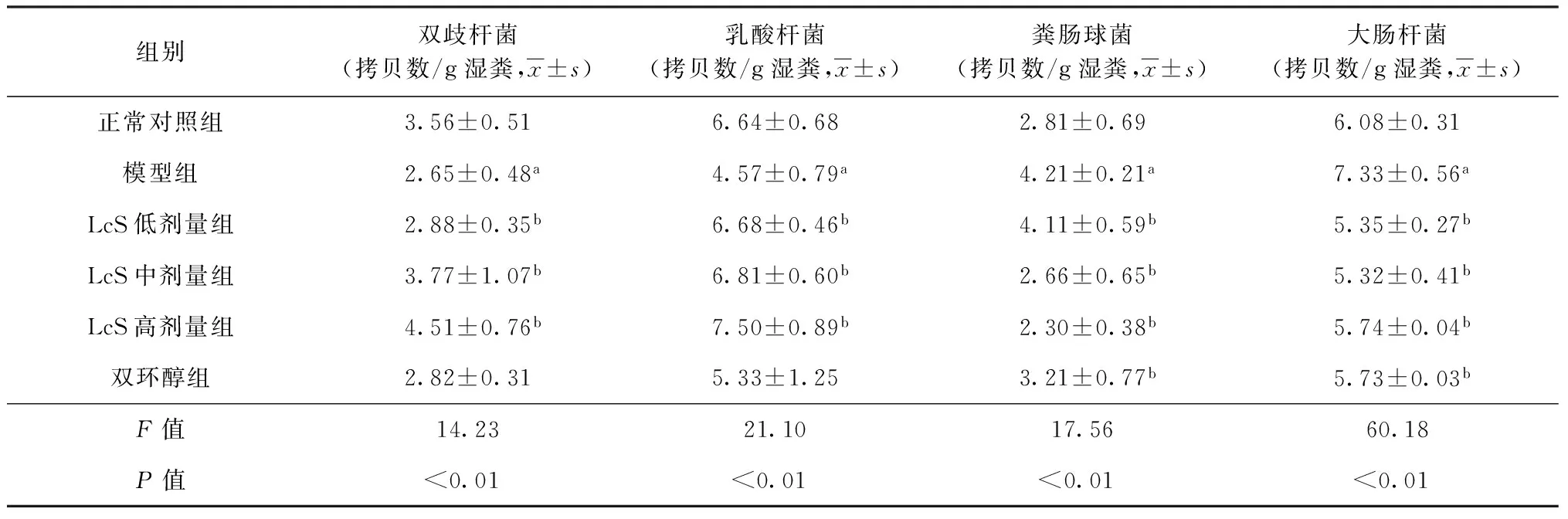
表4 给药28 d后各组大鼠肠道菌群检测结果
注a:与正常对照组比较,差异有统计学意义(P值均<0.05);b:与模型组比较,差异有统计学意义(P值均<0.05)
肝脏指数反映肝组织肿胀的严重程度。本次实验中,与正常对照组相比,模型组大鼠肝脏指数明显升高;LcS高剂量组大鼠的肝脏指数较模型组大鼠明显降低,一定程度上说明益生菌能减轻RFP和INH联合所致肝损伤。
MDA是脂质过氧化产物,SOD是防御超氧负离子损伤的重要酶,两者在机体氧化-抗氧化平衡中起着重要的作用。MDA含量的高低间接反映了机体脂质过氧化的严重程度[12],SOD活力的高低反映了细胞清除自由基能力的大小。本次试验中,与正常对照组相比,模型组大鼠肝匀浆中MDA含量升高,SOD活性降低,说明RFP和INH联用能引起细胞脂质过氧化增强,细胞清除自由基的能力下降,细胞氧化与抗氧化系统失衡。补充LcS后,益生菌各组大鼠的肝匀浆MDA含量都有明显降低,SOD活性升高。这一结果与王俊国等[13]和张书文等[14]等报道的结果一致。
ALT、AST和ALP活力与肝细胞损伤的严重程度相关。本次研究大鼠是在RFP和INH联合灌胃28 d后,检测其血清中ALT、AST和ALP水平,结果发现,与正常对照组相比,模型组大鼠血清ALT和ALP升高;与模型组相比,LcS高剂量组大鼠血清ALT和ALP水平明显降低。TBA是胆固醇在肝脏的分解代谢产物,其代谢改变会直接影响正常的肝功。IBIL来自死亡的红细胞,经肝脏转化为直接胆红素,为胆汁的组成成分之一。DBIL和IBIL之和就是TBIL。当肝细胞受到损害,胆红素不能直转化为胆汁,胆汁排泄受阻,造成血中胆红素升高。本次实验中,与正常对照组相比,模型组大鼠血清中TBA、IBIL、DIIL、TBIL升高,与而王莉等[15]和何雪等[16]的研究结果一致。与模型组相比,LcS各组大鼠血清TBA水平降低;LcS中、高剂量组的DBIL和IBIL也明显降低。
另外,笔者对实验动物的肠道菌群进行了研究,结果显示,各组大鼠的肠道菌群分布发生了改变,主要表现在与正常对照组相比,模型组大鼠粪便中双歧杆菌和乳酸杆菌数量减少,粪球菌和大肠杆菌数量增加;与模型组相比,LcS各组大鼠粪便中双歧杆菌和乳酸杆菌的含量升高,粪球菌和大肠杆菌含量降低。有研究显示,益生菌制剂可降低肝硬变、肝昏迷患者血浆内毒素水平、改善肝功能[17];可促进烫伤大鼠、肝硬变大鼠、急性肝损伤大鼠受损肠黏膜屏障修复,有效防治肠道细菌或内毒素易位[18-19]。
综上所述,LcS可以调节肠道微生态紊乱,改善肠道屏障功能,对RFP和INH联用所致大鼠肝损伤时发挥保护作用。LcS作为一种安全有效的活体微生物制剂,值得在肺结核患者抗结核药物所致肝损伤的预防方面进行进一步推广应用。
[1] 赵东, 徐桂芳, 邹晓平. 益生菌的作用机制. 国际消化病杂志, 2012, 32(2): 71-73.
[2] Schnabl B, Brenner DA. Interactions between the intestinal microbiome and liver diseases. Gastroenterology, 2014, 146(6): 1513-1524.
[3] 雷建平. 我国结核病化疗药物不良反应的防治现状与进展. 中国防痨杂志, 2014, 36(9):774-782.
[4] Cesaro C, Tiso A, Del Prete A, et al. Gut microbiota and probiotics in chronic liver diseases. Dig Liver Dis, 2011, 43(6):431-438.
[5] Wang Y, Kirpich I, Liu Y, et al. Lactobacillus rhamnosus GG treatment potentiates intestinal hypoxia-inducible factor, promotes intestinal integrity and ameliorates alcohol-induced liver injury. Am J Pathol, 2011, 179(6):2866-2875.
[6] Rishi P, Bharrhan S, Singh G, et al. Effect of Lactobacillus plantarum and L-arginine against endotoxin-induced liver injury in a rat model. Life Sci, 2011, 89(23/24):847-853.
[7] Saukkonen JJ, Cohn DL, Jasmer RM, et al. An official ATS statement: hepatotoxicity of antituberculosis therapy. Am J Respir Crit Care Med, 2006, 174(8):935-952.
[8] Sodhi CP, Rana SV, Mehta SK, et al. Study of oxidative-stress in isoniazid-Rifampicin induced hepatic injury in young rats. Drug Chem Toxicol, 1997, 20(3): 255-269.
[9] Dapito DH, Mencin A, Gwak GY, et al. Promotion of Hepatocellular carcinoma by the intestinal microbiota and TLR4. Cancer Cell, 2012, 21(4): 504-516.
[10] Chassaing B, Etienne-Mesmin L, Gewirtz AT. Microbiota-liver axis in hepatic disease. Hepatology, 2014, 59(1): 328-339.
[11] 胡玉莲, 黄志华, 王晓东, 等. 双歧三联活菌片对淤胆幼鼠移行性肌电复合波影响及其干预胆汁淤积的机制. 中华实用儿科临床杂志, 2007, 22(19): 1487-1489.
[12] Romero FJ, Bosch-Morell F, Romero MJ, et al. Lipid peroxidation products and antioxidants in human disease. Environ Health Perspect, 1998, 106 Suppl 5: 1229-1234.
[13] 王俊国, 孟和毕力格, 张和平, 等. 干酪乳杆菌Zhang对大鼠抗氧化能力的影响. 营养学报, 2009, 31(1): 63-65.
[14] 张书文, 吕加平, 孟和毕力格, 等. 干酪乳杆菌干酪亚种Lactobacillus casei subsp.casei SY13 对衰老模型小鼠的抗氧化作用. 中国农业科学, 2010, 43(10): 2141-2146.
[15] 王莉, 宋育林, 何雪. PPARα激活可改善利福平合用异烟肼所致的大鼠肝损伤. 安徽医科大学学报, 2014, 49(8): 1057-1061.
[16] 何雪, 宋育林, 王莉, 等. 吡咯烷二硫代氨基甲酸盐对抗结核药所致肝损伤时高迁移率族蛋白 B1表达的影响. 中国临床药理学杂志, 2015, 31(7):519-522.
[17] 于敏, 霍继明, 杨景云. 微生态调节剂的作用与发展趋势. 中国微生态学杂志, 1998, 10(2):117-119.
[18] Kasravi FB, Adawi D, Molin G, et al. Effect of oral supplementation of lactobacilli on bacterial translocation in acute liver injury induced by D-galactosamine. J Hepatol, 1997, 26(2):417-424.
[19] 金峰, 张捷, 张志坚, 等. 双歧杆菌制剂对大鼠肝硬化模型的保护作用. 海峡药学, 2003, 15(4):21-23.
(本文编辑:李敬文)
Protective effects of Lactobacillus casei on liver injury induced by rifampicin combined with isoniazid in rats
WANGYin,LIYuan-yuan,HAOHai-bo,LIANGHui,MAAi-guo.
InstituteofNutrition,MedicalCollegeofQingdaoUniversity,Qingdao266021,China
MAAi-guo,Email:magfood@126.com
Objective To explore the protective effect of Lactobacillus casei strain Shirota (LcS) on liver injury induced by rifampin (RFP) combined with isoniazid (INH) in rats. Methods Seventy-two specific pathogen free (SPF) male SD rats were randomly divided into 6 groups including normal control group, model group, low-dose, mid-dose and high-dose LcS groups, and bicyclol group (eachn=12). Rats in model group, low-dose, mid-dose, high-dose LcS groups and bicyclol group were given by gavage with INH (50 mg/kg) and RFP (50 mg/kg) once a day, and two hours later, low-dose, mid-dose, high-dose LcS groups were given by gavage LcS of 10×108CFU/kg, 20×108CFU/kg and 40×108CFU/kg, respevtivel; the normal control group were given by gavage with physiological saline (20 ml/kg) once a day, and the bicyclol group were given by gavage with bicylol (7.5 mg/kg) once a day. Total duration of the 6 groups was all 28 days. The 1iver index, superoxidedismutase (SOD), malondialdehyde (MDA), alanine aminotransferase (ALT), aspartate transaminase (AST), alkaline phosphatase (ALP), total biliary acid (TBA), total bilirubin (TBIL), direct bilirubin (DBIL) and indirect bilirubin (IBIL) wre tested and compared. Results When RFP and INH were given by gavage for 28 days, in model group, the liver index increased to (3.14 ± 0.15) %, the contents of MDA and SOD in model group were (4.52±0.52) nmol/mgprot and (72.51±11.05) U/mgprot, the ALT and ALP were (65.45±20.10) U/L and (322.79±61.73) U/L, the contents of TBA, TBIL, DBIL and IBIL were (91.34±16.93) μmol/L, (7.82±2.53) μmol/L, (4.70±1.29) μmol/L and (3.69±0.54) μmol/L, respectively. After supplement of LcS, the liver index of LcS high-dose group decreased to (2.88 ± 0.12) %; the content of MDA in the probiotics groups decreased significantly by (2.94±0.48) nmol/mgprot, (2.82±0.36) nmol/mgprot and (2.62±0.28) nmol/mgprot and the content of SOD in the probiotics groups significantly increased to (84.60±8.50) U/mgprot, (86.28±5.52) U/mgprot and (2.62±0.28) U/mgprot. Compared with the model group, the ALT and ALP of high-dose probiotics group decreased to (49.92±15.32) U/L and (280.70±54.32) U/L, respectively; the levels of TBA in low-dose, mid-dose and high-dose probiotics groups were also significantly decreased to (67.632±18.95) μmol/L,(55.322±19.17) μmol/L and (52.92±23.00) μmol/L, respectively; the DBIL of middle- and high-dose probiotics groups were significantly decreased to (3.64±1.68) μmol/L and (2.92±0.86) μmol/L, and the IBIL were significantly decreased to (3.21±0.22) μmol/L and (3.12±0.42) μmol/L, differences were statistically significant (P<0.05). Compared to model group, levels of TBA, TBIL, DBIL and IBIL in bicyclol group were reduced to (64.49±22.41) μmol/L, (6.33±1.46) μmol/L, (3.54±1.21) μmol/L and (3.01±0.36) μmol/L, respectively. Conclusion LcS could reduce the liver injury induced by RFP combined with INH in rats.
Lactobacilluscasei; Rifampin; Isoniazid; Drug-induced liver injury; Outcome and process assessment (health care); Animal experimentation
10.3969/j.issn.1000-6621.2017.06.014
国家自然科学基金(81673160)
266021 青岛大学医学部营养研究所[王寅(研究生)、李园园(研究生)、郝海波(研究生)、梁惠、马爱国]
马爱国,Email:magfood@126.com
2017-03-03)
