CD4+ CD28- T淋巴细胞在结核性胸膜炎患者胸腔积液与外周血中的表达水平及其意义
2017-06-29甘丽英樊晓晖杨海波
甘丽英 樊晓晖 杨海波
·论著·
CD4+CD28-T淋巴细胞在结核性胸膜炎患者胸腔积液与外周血中的表达水平及其意义
甘丽英 樊晓晖 杨海波
目的 探讨结核性胸膜炎患者胸腔积液及外周血中CD4+CD28-T淋巴细胞的表达水平及其意义。 方法 收集2015年3月至2016年12月广西医科大学第一附属医院未经治疗的40例胸腔积液患者的胸腔积液及外周血标本,其中结核性胸膜炎患者20例,非结核性胸膜炎患者20例;另外选择同期广西医科大学第一附属医院体检中心健康体检人员18名作为正常对照组。40例胸腔积液患者通过胸腔穿刺采集胸腔积液,所有受试者通过真空采血法抽取外周血;用流式细胞术检测胸腔积液及外周血中CD4+CD28-T淋巴细胞百分含量。对结核性胸膜炎组、非结核性胸膜炎组胸腔积液中CD4+CD28-T淋巴细胞百分含量进行比较分析;对3组外周血中CD4+CD28-T淋巴细胞百分含量进行比较分析;同时对结核性胸膜炎组、非结核性胸膜炎组的胸腔积液和外周血的CD4+CD28-T淋巴细胞百分含量进行相关性分析。 结果 结核性胸膜炎组胸腔积液中CD4+CD28-T淋巴细胞百分含量[(14.69±4.06)%]明显高于非结核性胸膜炎组[(9.75±3.40)%],差异有统计学意义(t=4.19,P<0.01)。3组外周血CD4+CD28-T淋巴细胞百分含量差异有统计学意义(F=3.78,P=0.029);其中结核性胸膜炎组外周血中CD4+CD28-T淋巴细胞百分含量[(5.26±2.92)%]分别高于非结核性胸膜炎组[(3.76±2.07)%]和正常对照组[(3.29±1.79)%],差异均有统计学意义(t=2.04,P=0.046;t=2.61,P=0.012)。结核性胸膜炎组中,胸腔积液和外周血的CD4+CD28-T淋巴细胞百分含量[(14.69±4.06)%、(5.26±2.92)%]呈正相关(r=0.54,P=0.013);非结核性胸膜炎组胸腔积液和外周血的CD4+CD28-T淋巴细胞百分含量[(9.75±3.40)%、(3.76±2.07)%]无相关性(r=0.03,P=0.424)。 结论 CD4+CD28-T淋巴细胞百分含量的变化影响结核性胸膜炎的发生、发展,在其中可能扮演重要的免疫调节角色。
结核, 胸膜; T淋巴细胞亚群; 胸腔积液; 免疫调节
结核性胸膜炎是由结核分枝杆菌(MTB)及其代谢产物结核蛋白进入机体胸膜腔引起的炎症反应,结核性胸膜炎患者治疗不当可导致胸膜粘连与增厚,从而引发不同程度的胸痛和胸闷,甚至出现包裹性积液、对侧肺气肿、脓胸等并发症,严重者危害生命健康[1]。全球感染MTB的人数众多,但仅有约5%的感染者发病,其发病的因素相对复杂,其中最重要的是感染的MTB的菌量及其毒力大小,以及机体的抗结核免疫能力,机体的免疫系统则发挥主要作用[2-3]。
结核病患者产生免疫反应的主要效应细胞是CD4+T淋巴细胞,这一属性导致结核性胸腔积液富含CD4+T淋巴细胞。目前,结核性胸膜炎的细胞免疫学机制尚未完全明确,有研究指出体内因持续性抗原刺激导致的免疫缺陷是其发病的一项重要因素[4]。CD28是T细胞表面黏附分子,高表达于CD4+T淋巴细胞上,并称为CD4+CD28+T淋巴细胞。机体针对抗原的持续免疫导致了免疫系统的衰老和重构,初始多克隆高增殖的CD4+CD28+T淋巴细胞在抗原重复作用下,端粒缩短、下调CD28转化为记忆性,可形成寡克隆区带有限增殖的CD4+CD28-T淋巴细胞,此时的CD4+CD28-T淋巴细胞是缺失CD28的CD4+T淋巴细胞,在不同基因背景和抗原环境的相互作用下,CD4+CD28-T淋巴细胞明显增殖,并介导了组织器官的免疫损伤,引起机体内炎症反应明显增强[5]。虽然国内外对CD4+T淋巴细胞数量在结核病中的变化情况进行过诸多研究,但是对CD4+CD28-T淋巴细胞在结核性胸膜炎中产生的影响鲜有报道。因此,本研究主要以结核性胸膜炎患者T淋巴细胞为检测对象,重点研究结核性胸膜炎患者胸腔积液及外周血中CD4+CD28-T淋巴细胞的百分含量,进而分析CD4+CD28-T淋巴细胞在结核性胸膜炎患者中的变化水平及其意义。
对象和方法
一、研究对象
选择2015年3月至2016年12月期间在广西医科大学第一附属医院收治的未经抗结核治疗的结核性胸膜炎患者20例。其中,男11例,女9例,年龄14~65岁,平均年龄(41.15±14.63)岁。纳入标准:临床症状包含低热、盗汗、干咳、胸痛、咯血等,临床具有胸腔积液体征,经胸部X线摄影和超声检查证实有胸腔积液,CT诊断及病原学检查确诊,经胸腔穿刺抽液、胸腔积液检查结果为渗出液,临床抗结核药物治疗有效;所有患者近期内均未使用过糖皮质激素等免疫抑制剂,均未进行抗结核药物治疗,均无免疫相关性疾病,无脏器并发症及其他感染,排除了其他原因引起的胸膜炎。
选择同期广西医科大学第一附属医院收治的非结核性胸腔积液患者20例。其中,男12例,女8例,年龄18~69岁,平均(56.30±14.33)岁。纳入标准:排除结核病和结核性胸膜炎导致胸腔积液的患者。其中肺癌11例、乳腺癌4例、脓胸2例、淋巴癌3例,均经临床确诊。
选择同期广西医科大学第一附属医院体检中心健康体检者18名作为正常对照组。其中,男10名,女8名,年龄27~51岁,平均(39.03±10.67)岁。纳入标准:各项生化指标,与免疫相关指标及心、肝、肾功能均正常。
二、方法
1. 标本采集:所有结核性胸膜炎患者与非结核性胸膜炎患者均于入院接受正规治疗前抽取外周血2 ml及胸腔积液50 ml;正常对照组健康体检者仅抽取外周血2 ml。所有外周血均于清晨空腹抽取并用肝素抗凝。此研究通过广西医科大学伦理委员会审核,受试者均知情同意。
2. 标本检测:(1)外周血与红细胞裂解液以1︰3 的比例漩涡混匀,冰上静置15 min,450×g离心10 min弃上清,沉淀白细胞用磷酸盐缓冲液(PBS)重悬,经密度梯度离心法用淋巴细胞分离液分离提取云雾层淋巴细胞;(2)胸腔积液以离心半径15 cm,1000 r/min离心10 min后弃上清,沉淀细胞用PBS重悬,经密度梯度离心法用淋巴细胞分离液分离提取云雾层淋巴细胞;(3)外周血和胸腔积液分离提取的淋巴细胞分别转入流式管中,实验管孵育相应荧光标记的抗体[藻红蛋白标记小鼠抗人CD4抗体(PE mouse anti-human CD4)、异硫氰酸荧光素标记的小鼠抗人CD28抗体(FITC mouse anti-human CD28)],同型管孵育相应的同型对照异硫氰酸荧光素标记的小鼠IgG 1 K型抗体(FITC mouse IgG 1 K isotype control)。室温避光孵育30 min,终止孵育并应用流式细胞仪(美国BD公司)上样检测;(4)红细胞裂解液及淋巴细胞分离液均购自北京索莱宝科技有限公司;荧光标记物PE mouse anti-human CD4、FITC mouse anti-human CD28、FITC mouse IgG1 K isotype control均购自美国BD公司。选择CD4+CD28-T淋巴细胞群作为鉴定,将流式细胞仪检测后的结果用其配套CellQuest软件分析。
三、统计学分析
结 果
一、CD4+、CD28+T淋巴细胞百分含量在各组中的比较
检测结果发现,CD4+、CD28+T淋巴细胞百分含量在3组人群外周血之间差异均有统计学意义(F=9.42,P<0.01;F=21.57,P<0.01);相比于正常对照组外周血CD4+T淋巴细胞百分含量,结核性胸膜炎组和非结核性胸膜炎组均较低,差异均有统计学意义(t=4.07,P<0.01;t=3.44,P<0.01);而相比于正常对照组外周血CD28+T淋巴细胞百分含量,仅在结核性胸膜炎组中表达降低,差异有统计学意义(t=6.04,P<0.01),与非结核性胸膜炎组比较,差异无统计学意义(t=0.98,P=0.331)。对于胸腔积液CD4+T淋巴细胞百分含量,结核性胸膜炎组高于非结核性胸膜炎组,差异有统计学意义(t=5.20,P=0.035);而结核性胸膜炎组CD28+T淋巴细胞百分含量低于非结核性胸膜炎组,差异有统计学意义(t=4.31,P<0.01)。正常对照组及非结核性胸膜炎组胸腔积液及外周血的CD4+/CD28+T淋巴细胞比值<1.5,而结核性胸膜炎组胸腔积液及外周血CD4+/CD28+T淋巴细胞比值>1.5(表1)。
二、CD4+、CD28+T淋巴细胞百分含量的相关性
在此基础上,对各组CD4+与CD28+T淋巴细胞百分含量进行相关性分析,结果发现结核性胸膜炎组胸腔积液中CD4+与CD28+T淋巴细胞百分含量呈正相关(r=0.59,P=0.027),CD28+T淋巴细胞百分含量少于CD4+T淋巴细胞百分含量(t=4.18,P<0.01),而结核性胸膜炎组外周血和非结核性胸膜炎组胸腔积液及外周血中CD4+与CD28+T淋巴细胞百分含量均不相关(r=0.20,P=0.431;r=0.13,P=0.575;r=0.37,P=0.105)。
三、不同组别CD4+CD28-T淋巴细胞百分含量在胸腔积液及外周血中的比较及相关性
结核性胸膜炎组胸腔积液中CD4+CD28-T淋巴细胞百分含量[(14.69±4.06)%]明显高于非结核性胸膜炎组[(9.75±3.40)%],差异有统计学意义(t=4.19,P<0.01)。外周血CD4+CD28-T

表1 3组患者胸腔积液、外周血CD4+、CD28+ T淋巴细胞水平的比较
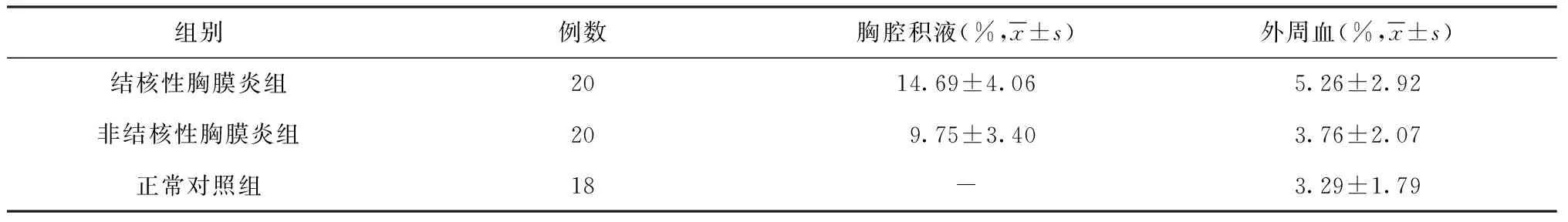
表2 胸腔积液及外周血中CD4+ CD28- T淋巴细胞百分含量在各组间的比较
注 “-”表示未进行该项检测
淋巴细胞百分含量在3组间差异有统计学意义(F=3.78,P=0.029),结核性胸膜炎组外周血中CD4+CD28-T淋巴细胞百分含量[(5.26±2.92)%]分别高于非结核性胸膜炎组[(3.76±2.07)%]和正常对照组[(3.29±1.79)%],差异均有统计学意义(t=2.04,P=0.046;t=2.61,P=0.012);但非结核性胸膜炎组和正常对照组比较,差异无统计学意义(t=0.62,P=0.536)。结核性胸膜炎组胸腔积液CD4+CD28-T淋巴细胞百分含量[(14.69±4.06)%]明显高于外周血[(5.26±2.92)%],差异有统计学意义(t=8.48,P<0.01),非结核性胸膜炎组胸腔积液CD4+CD28-T淋巴细胞百分含量[(9.75±3.40)%]也明显高于外周血[(3.76±2.07)%],差异有统计学意义(t=6.72,P=0.027),结核性胸膜炎组胸腔积液和外周血的CD4+CD28-T淋巴细胞百分含量呈正相关(r=0.54,P=0.013),非结核性胸膜炎组胸腔积液和外周血的CD4+CD28-T淋巴细胞百分含量无相关性(r=0.03,P=0.424)(表2)。
讨 论
结核性胸膜炎可诱发渗出性胸腔积液,是由于MTB及其代谢产物刺激胸膜而引起的一种迟发型超敏反应。T淋巴细胞是机体细胞免疫功能的主要效应细胞,其中包含CD8+、CD4+等T淋巴细胞亚群,并在机体中保持稳态,平衡一旦被打破,机体免疫功能降低易受病菌侵害。研究发现,白细胞介素2(IL-2)可通过调节结核性胸膜炎患者CD8+和CD4+T淋巴细胞亚群的表达水平进而纠正患者免疫功能失调[6]。MTB为兼性胞内寄生菌,因而机体抗结核特异性免疫主要以细胞免疫为主,其中CD4+T淋巴细胞是结核病患者产生免疫反应的主要效应细胞[7-8]。机体抗结核免疫中,CD4+T淋巴细胞作为辅助性T淋巴细胞亚群可促进免疫细胞增殖分化并在机体中放大免疫效应,进而增强免疫功能,对抗消灭MTB。Lazarevic等[9]研究指出CD4+T淋巴细胞的下降程度与病情的严重程度呈正相关。
CD28是一种同源二聚体糖蛋白,属于免疫球蛋白超家族成员,可表达在95%的CD4+T淋巴细胞上,并参与调控免疫应答的起始、扩大、维持和下调,尤其在免疫维持中起重要的作用;它能维持适量、有功能的T细胞存活,并保证特异性免疫应答,此外还可能涉及T细胞的成熟、分化及下调,CD28协同刺激活化T细胞信号传导途径,在保证机体体内免疫稳态的同时,对外来抗原可产生特异应答[10]。T细胞活化需要两个信号,其中第二信号(CD28/B7)由抗原呈递细胞上的B7分子与T淋巴细胞上的CD28的结合而提供;CD28是 T淋巴细胞最主要的第二信号受体,高表达于CD4+T淋巴细胞并发挥免疫效应,CD28/B7途径对于抗结核的Th1活化非常关键,缺乏CD28的T淋巴细胞活化将导致机体对MTB的免疫无反应性[11]。Bernal-Fernandez等[12]研究发现结核病患者外周血中CD4+CD28+T淋巴细胞下降明显。本研究发现结核性胸膜炎组无论胸腔积液还是外周血的CD28+T淋巴细胞百分含量均明显低于对应非结核性胸膜炎组和正常对照组,符合多克隆高增殖的CD4+CD28+T淋巴细胞在抗原重复作用下,端粒缩短、下调CD28转化为有限增殖的CD4+CD28-T淋巴细胞这一说法,CD4+/CD28+T淋巴细胞比值在结核性胸膜炎组胸腔积液和外周血均升高。且发现结核性胸膜炎组胸腔积液中CD4+T淋巴细胞与CD28+T淋巴细胞百分含量呈正相关(r=0.59,P=0.027),结核性胸膜炎组胸腔积液CD4+T淋巴细胞可随着CD28+T淋巴细胞降低而降低,CD28+T淋巴细胞百分含量降低进而减少CD4+T淋巴细胞发挥免疫效应。提示结核性胸膜炎患者T淋巴细胞稳态失衡,其免疫功能失调与胸腔积液CD4+、CD28+T淋巴细胞比例紊乱相关。
Cretney等[13]研究表明,T细胞亚群的相对比例可能与患者的免疫功能状态和病情进展密切相关,CD4+CD28-T淋巴细胞数量的增多与多种自身免疫性和慢性炎症疾病如类风湿性关节炎、自身免疫性血管炎、动脉粥样硬化、脑梗死及不稳定心绞痛等相关[14]。Xu等[15]报道Kv1.3钾离子通道阻断可降低急性冠状动脉综合征患者CD4+CD28-T淋巴细胞分泌γ-干扰素(IFN-γ)及穿孔素。其次,CD4+CD28-T淋巴细胞也可表达杀伤细胞免疫球蛋白样受体(killer immunoglobulin-like receptors,KIRs),其具有细胞毒效应,活化后可释放穿孔素进而杀伤靶细胞,如果表达升高将导致机体的免疫功能受到抑制,提示其在疾病发展中扮演了致病的角色[16]。
本研究运用流式细胞术,以结核性胸膜炎患者为研究对象,对结核性胸膜炎患者胸腔积液及外周血中CD4+CD28-T淋巴细胞百分含量进行分析,结果显示结核性胸膜炎组胸腔积液及外周血中CD4+CD28-T淋巴细胞百分含量均明显高于非结核性胸膜炎组及正常对照组,在结核性胸膜炎组胸腔积液中CD4+CD28-T淋巴细胞百分含量增加尤为明显,并且结核性胸膜炎组胸腔积液和外周血的CD4+CD28-T淋巴细胞百分含量呈正相关,说明CD4+CD28-T淋巴细胞可能参与了结核性胸膜炎的病理过程,CD4+CD28-T淋巴细胞的比例变化可影响结核性胸膜炎的发生、发展,在其中可能扮演重要的免疫调节角色。
[1] 陈建军. 胸腔内注射尿激酶治疗结核性胸膜炎疗效观察. 蚌埠医学院学报, 2009, 18(2):146-147.
[2] 陈松林, 罗军敏, 汤贤英,等. 结核性胸膜炎患者胸水和外周血Treg细胞及DC细胞亚群的检测. 中国免疫学杂志, 2013, 29(9):965-968.
[3] 朱杰华, 罗军敏, 徐林, 等. 结核性胸膜炎患者外周血和胸水γδT和Th17细胞的频率变化及其意义. 免疫学杂志, 2013, (2):142-146.
[4] Höhn H, Kortsik C, Zehbe I, et al. MHC class II tetramer guided detection ofMycobacteriumtuberculosis-specific CD4+T cells in peripheral blood from patients with pulmonary tuberculosis. Scand J Immunol,2007,65(5):467-478.
[5] Vallejo AN. Immune remodeling: lessons from repertoire alterations during chronological aging and in immune-mediated disease. Trends Mol Med, 2007,13(3):94-102.
[6] 李湘武. 白细胞介素-2辅助治疗对结核性胸膜炎患者免疫功能影响的临床观察. 结核病与肺部健康杂志, 2016, 5(2):144-147.
[7] Sakaguchi S, Sakaguchi N, Asano M, et al. Pillars article: immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor α-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases. J Immunol, 2011, 186(7): 3808-3821.
[8] 王爽,杨恩卓,王洪海,等. 新型抗结核蛋白亚单位疫苗Ag85A-γ干扰素的免疫效果评价. 微生物与感染, 2012, 7(3):164-169.
[9] Lazarevic V, Nolt D, Flynn JL. Long-term control ofMycobacteriumtuberculosisinfection is mediated by dynamic immune responses. J Immunol, 2005, 175(2):1107-1117.
[10] 郝秀丽,张逢春. CD28分子的研究进展. 北华大学学报(自然), 2004, 5(2):133-137.
[11] Popova AA, Kravchenko AV, Kozhevnikova GM, et al. The value of changes in CD8+CD28+and CD4+CD28+cells in patients with HIV infection concurrent with tuberculosis during treatment. Ter Arkh,2013, 85(11):54-57.
[12] Bernal-Fernandez G, Espinosa-Cueto P, Leyva-Meza R, et al. Decreased expression of T-cell costimulatory molecule CD28 on CD4 and CD8 T cells of mexican patients with pulmonary tuberculosis. Tuberc Res Treat, 2010, 2010: 517547.
[13] Cretney E, Xin A, Shi W, et al. The transcription factors Blimp-1 and IRF4 jointly control the differentiation and function of effector regulatory T cells. Nat Immunol,2011, 12(4):304-311.
[14] Gilani SR, Vuga LJ, Lindell KO, et al. CD28 down-regulation on circulating CD4 T-cells is associated with poor prognoses of patients with idiopathic pulmonary fibrosis. PLoS One,2010, 5(1):e8959.
[15] Xu R, Cao M, Wu X, et al. Kv1.3 channels as a potential target for immunomodulation of CD4+CD28 null T cells in patients with acute coronary syndrome. Clin Immunol,2012, 142(2): 209-217.
[16] Dumitriu IE, Araguás ET, Baboonian C, et al. CD4+CD28 null T cells in coronary artery disease: when helpers become killers. Cardiovasc Res,2009, 81(1):11-19.
(本文编辑:郭萌)
The levels and significance of CD4+CD28-T lymphocytes in pleural effusion and peripheral blood in patients with tuberculous pleurisy
GANLi-ying,FANXiao-hui,YANGHai-bo.
DepartmentofMicrobiology,SchoolofBasicMedicine,GuangxiMedicalUniversity,Nanning530022,China
s:FANXiao-hui,Email:fanxiaohui63@163.com;YANGHai-bo,Email:yanghaibo33@hotmail.com
Objective To investigate the levels and significance of CD4+CD28-T lymphocytes in the pleural effusion and peripheral blood of patients with tuberculous pleurisy. Methods Pleural effusion and peripheral blood samples were collected from 40 patients with pleural effusion, including 20 cases with tuberculous pleurisy and 20 with non-tuberculous pleurisy, in the First Affiliated Hospital of Guangxi Medical University from March 2015 to December 2016 before the onset of treatment. Peripheral blood samples were also collected from 18 healthy individuals at the medical examination center of the same hospital and served as a control group. Pleural effusions were collected by thoracentesis and peripheral blood samples by vacuum blood collection. The percentage of CD4+CD28-T lymphocytes in the pleural effusion of the tuberculous and non-tuberculous pleurisy groups, measured by flow cytometry, was compared, as was the percentage of CD4+CD28-T lymphocytes in the peripheral blood from the three groups. Correlation analysis of the percentage of CD4+CD28-T lymphocytes in the pleural effusion and peripheral blood in each group was also performed. Results The percentage of CD4+CD28-T lymphocytes in the pleural effusion was significantly higher in the tuberculous pleurisy group than in the non-tuberculous pleurisy group ((14.69±4.06) % vs. (9.75 ±3.40) %,t=4.19,P<0.01). The percentage of CD4+CD28-T lymphocytes in peripheral blood was significantly different between the three groups (F=3.78,P=0.029); the percentage of CD4+CD28-T lymphocytes in peripheral blood was higher in the tuberculous pleurisy group than in the non-tuberculous group and the healthy control group ((5.26±2.92) % vs. (3.76±2.07) %,t=2.04,P=0.046); (5.26±2.92) % vs. (3.29 ±1.79) %,t=2.61,P=0.012). The percentage of CD4+CD28-T lymphocytes in the pleural effusion was positively correlated with that in peripheral blood in the tuberculous pleurisy group ((14.69±4.06)% vs (5.26±2.92)%;r=0.54,P=0.013), but not in non-tuberculous pleurisy group ((9.75±3.40)% vs (3.76±2.07)%;r=0.03,P=0.424). Conclusion Changes in the proportion of CD4+CD28-T lymphocytes affect the development of tuberculous pleurisy, and may play an important role in the immunoregulation of tuberculous pleurisy.
Tuberculosis, pleural; T-lymphocyte subsets; Pleural effusion; Immunomodulation
10.3969/j.issn.1000-6621.2017.06.013
国家自然科学基金(81360243)
530022 南宁,广西医科大学基础医学院微生物学教研室
樊晓晖,Email:fanxiaohui63@163.com;杨海波,Email:yanghaibo33@hotmail.com
2017-03-06)
注:樊晓晖和杨海波为并列通信作者
