耐多药肺结核患者的CT表现及其与CD4细胞的关系
2017-06-29李春华吕圣秀王惠秋舒伟强杨长萍李同心杨坤严晓峰
李春华 吕圣秀 王惠秋 舒伟强 杨长萍 李同心 杨坤 严晓峰
·论著·
耐多药肺结核患者的CT表现及其与CD4细胞的关系
李春华 吕圣秀 王惠秋 舒伟强 杨长萍 李同心 杨坤 严晓峰
目的 探讨耐多药肺结核患者的CT表现及其与CD4细胞的关系,以提高对耐多药肺结核的认识。方法 回顾性分析2015年1月至2016年11月重庆市公共卫生医疗救治中心诊治的137例耐多药肺结核患者(观察组),及对抗结核药物敏感的肺结核患者130例(对照组)。根据CD4细胞<200个/μl、200~400个/μl、>400个/μl 将观察组和对照组分别分为A、B、C及A1、B1、C1各3个小组。两组患者均做胸部CT扫描及CD4细胞检测。对病变范围、形态、性质等CT表现及CD4细胞水平进行统计学分析,并分析观察组的影像表现与CD4细胞水平的关系。结果 观察组和对照组病变累及3个肺叶以上的患者分别为118例(86.1%)、69例(53.1%),全肺受累分别为84例(61.3%)、26例(20.0%),差异均有统计学意义(χ2=34.73,47.00,P值均<0.01)。在病变形态上观察组与对照组分别为:多发播散结节85例(62.0%)、39例(30.0%),纵隔淋巴结肿大101例(73.7%)、29例(22.3%),多发空洞96例(70.1%)、22例(16.9%),胸膜增厚86例(62.8%)、36例(27.7%),增殖90例(65.7%)、35例(26.9%),纤维灶75例(54.7%)、28例(21.5%),并发毁损33例(24.1%)、7例(5.4%),支气管扩张95例(69.3%)、22例(16.9%),差异均有统计学意义(χ2=27.54,62.85,76.40,33.08,40.27,31.04,18.32,74.46,P值均<0.05)。观察组空洞平均内径(30.3±4.9) mm,大于对照组的(21.3±4.2) mm(t=10.19,P<0.01)。其中观察组A、B、C小组空洞平均内径分别为(21.4±3.0) mm、(24.7±3.4) mm、(30.7±3.9) mm,差异有统计学意义(F=60.56,P<0.01)。观察组CD4细胞平均(425.6±156.5) 个/μl,低于对照组的(734.4±215.6) 个/μl(t=-13.45,P<0.01)。B小组平均(303.8±57.9)个/μl,B1小组平均(352.3±65.3)个/μl,两小组比较差异有统计学意义(t=-3.53,P<0.01)。C小组平均(603.8±188.3)个/μl,C1小组平均(852.5±231.4)个/μl,两小组比较差异有统计学意义(t=-7.18,P<0.01)。结论 观察组CD4细胞低于对照组患者,前者肺内病灶分布广泛,容易多叶段受累、多发播散,多发空洞、慢性病程及并发症表现较多,其CT表现与CD4细胞的高低有一定关系。
结核, 抗多种药物性; 体层摄影术,X线计算机; T淋巴细胞亚群; 对比研究
2010年第五次全国结核病流行病学抽样调查结果显示,估算我国每年约有10万例新发耐多药结核病(MDR-TB)患者,耐多药率为6.8%[1]。结核病的发生与预后不仅与结核分枝杆菌的数量和毒力有关,而且与宿主细胞的免疫功能有密切关系。T淋巴细胞为机体最重要的免疫细胞,尤其是CD4细胞是反映机体细胞免疫状态的重要指标[2]。影像学检查对结核病的诊断起着重要作用。耐多药结核病的影像表现虽然已有较多研究,但其影像表现与患者免疫状况,尤其是与CD4细胞水平的关系报道甚少。为提高对耐多药结核病的CT表现的认识,了解其与CD4细胞的关系,笔者收集了重庆市公共卫生医疗救治中心诊治的住院137例MDR-TB患者,对其CT表现及CD4细胞的关系进行回顾性分析。
资料和方法
一、患者来源
收集2015年1月至2016年11月重庆市公共卫生医疗救治中心诊治的住院MDR-TB患者137例,作为观察组;选取同期经罗氏比例法药物敏感性试验(简称“药敏试验”)结果对结核分枝杆菌敏感的肺结核患者130例,作为对照组。
二、纳入标准和排除标准
纳入标准:(1)观察组与对照组患者均进行痰培养并菌种鉴定为结核分枝杆菌;(2)观察组经药敏试验至少同时对异烟肼和利福平耐药,证实为MDR-TB;(3)对照组药敏试验为对抗结核药物敏感。排除标准:观察组和对照组均排除糖尿病、抗HIV阳性及使用免疫抑制剂等免疫低下患者。耐药结核病的诊断符合中国防痨协会制定的《耐药结核病化学治疗指南(2015)》[3]。
三、实验室检查
所有患者均采用改良罗氏培养基培养,药敏试验采用比例法,所做药敏试验的药物有异烟肼、利福平、乙胺丁醇、链霉素、卷曲霉素、左氧氟沙星 、对氨基水杨酸钠、力克菲蒺、阿米卡星 、利福喷丁、丙硫异烟胺。采用美国BD流式细胞仪(FACSCount)检测观察组和对照组的CD4细胞水平,其正常范围为400~1123个/μl。根据CD4细胞数量将观察组分为3个小组,A小组:CD4细胞<200个/μl;B小组:CD4细胞为200~400个/μl;C小组:CD4细胞>400个/μl;3个组患者分别为12例、62例、63例。按照观察组分小组的方法,将对照组分为A1、B1、C1 3个小组,3个小组患者分别为0例、28例、102例。
四、影像学检查
CT扫描采用Aquilion16排螺旋CT机,扫描层厚、层距均为5 mm,螺距=1。由3位高年资医生对观察组和对照组患者的CT表现进行分析,主要观察病变范围、形态及病变性质的差异。空洞壁厚≥3 mm为厚壁空洞,<3 mm为薄壁空洞;并分析观察组的CT表现及与CD4细胞水平的关系。
五、统计学分析

结 果
一、两组患者的一般情况
观察组患者男97例,女40例;年龄13~84岁,中位年龄42岁。初治患者34例,占24.8%(34/137);复治患者103例,占75.2%(103/137)。病程1个月至11年,平均(26.4±8.3)个月。
对照组患者男88例,女42例,年龄16~75岁,中位年龄39岁。初治患者88例,占67.7%(88/130);复治患者42例,占32.3%(42/130)。病程3周至3年,平均(12.2±4.6)个月。
二、两组患者CD4细胞检测情况
观察组患者CD4细胞范围在47~1239个/μl,平均(425.6±156.5)个/μl;对照组CD4细胞范围在238~1946个/μl,平均(734.4±215.6)个/μl,观察组平均CD4细胞数量低于对照组,差异有统计学意义(t=-13.45,P<0.01)。观察组CD4细胞<400个/μl者达54.0%(74/137),对照组为21.5%(28/130),两组比较差异有统计学意义(χ2=29.80,P<0.01)。B小组平均(303.8±57.9)个/μl,B1小组平均(352.3±65.3)个/μl,两小组比较差异有统计学意义(t=-3.53,P<0.01)。C小组平均(603.8±188.3)个/μl,C1小组平均(852.5±231.4)个/μl,两小组比较差异有统计学意义(t=-7.18,P<0.01)。
三、两组患者胸部病变CT表现比较
观察组病变分布更广泛,≥3叶及全部肺叶受累者均多于对照组,具体见表1;观察组空洞内径平均为(30.3±4.9) mm,对照组平均为(21.3±4.2) mm,差异有统计学意义(t=10.19,P<0.01)。增殖、钙化、纤维化、播散结节、并发毁损、支气管扩张、胸膜增厚及纵隔淋巴结肿大方面观察组的发生率高于对照组。播散结节、多发空洞及毁损、支气管扩张、胸膜增厚及纵隔淋巴结肿大患者的典型CT表现见图1~10。
四、观察组中不同CD4细胞水平的影像表现
在观察组中,随着CD4细胞的升高,增殖、纤维化、空洞及多发空洞、毁损及胸膜增厚的发生率逐渐增高,单发空洞及胸腔积液的发生率逐渐降低,具体见表2。观察组中A小组空洞内径为6~34 mm,平均为(21.4±3.0) mm;B小组为5~76 mm,平均为(24.7±3.4) mm; C小组为3~79 mm,平均为(30.7±3.9) mm。观察组中随着CD4细胞的升高,空洞内径逐渐增大,A、B、C 3个小组间空洞平均内径差异有统计学意义(F=60.56,P<0.01)。
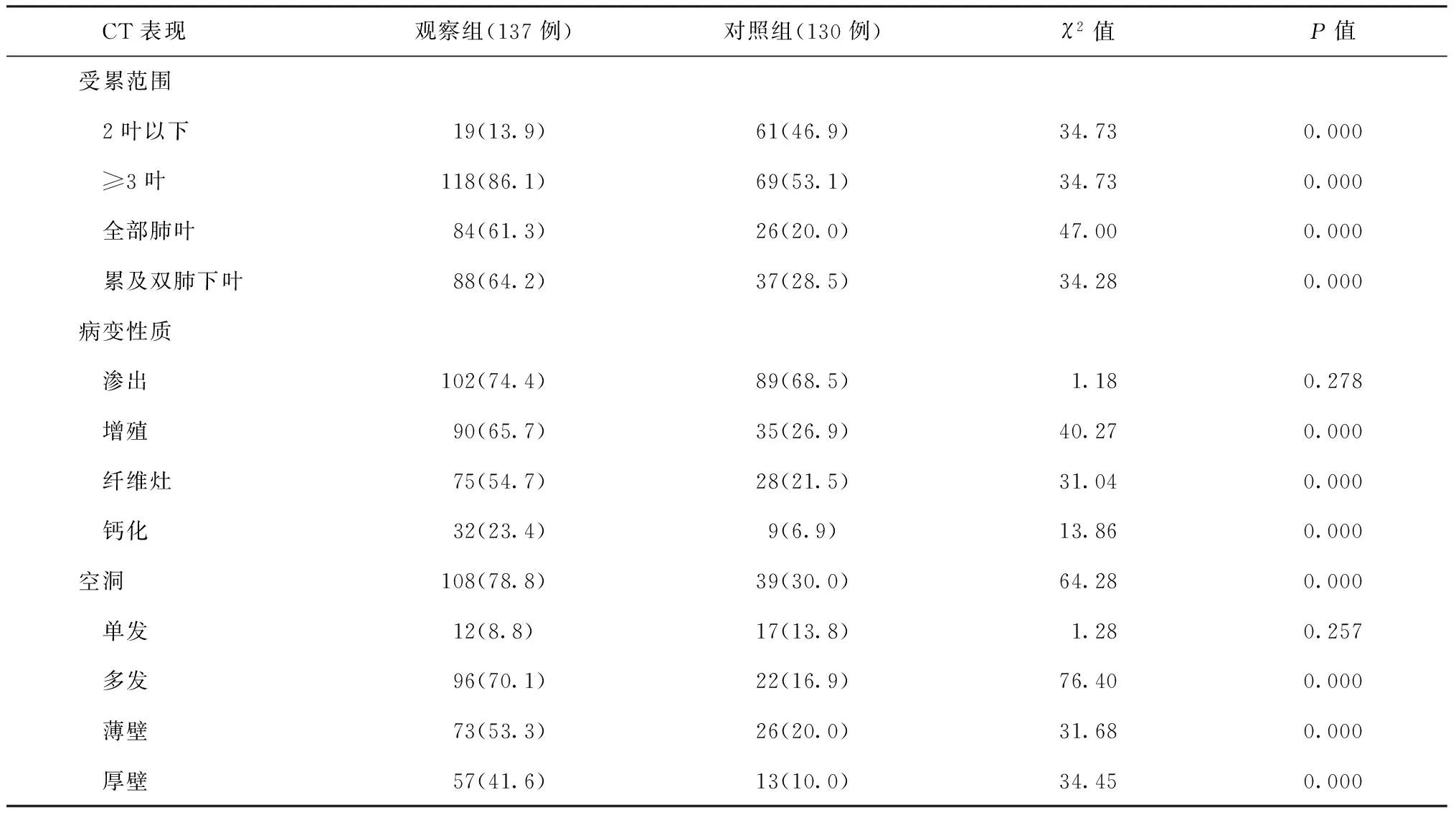
表1 各种CT表现在两组患者中的分布与比较
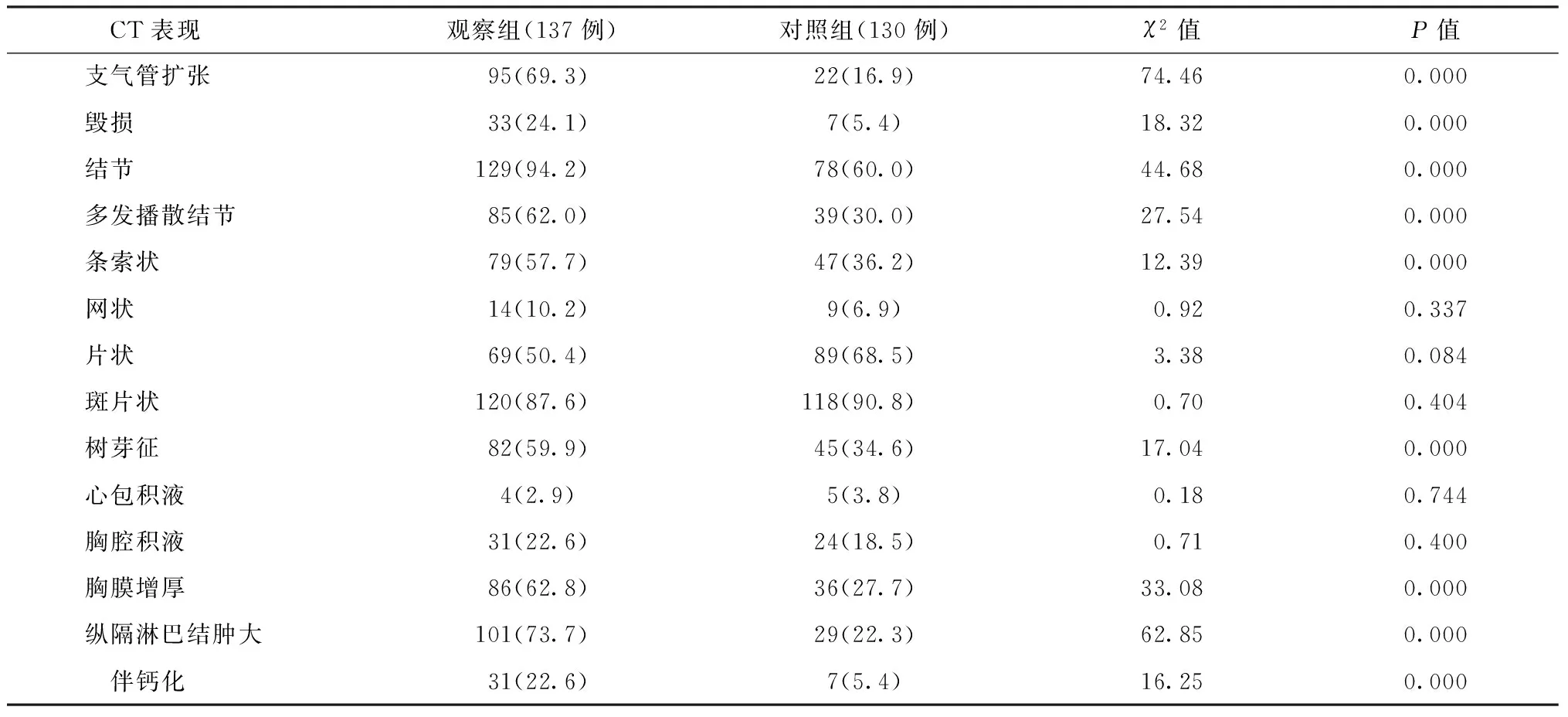
续表1
注 括号内数值为“发生率(%)”,括号外数值为“例数”
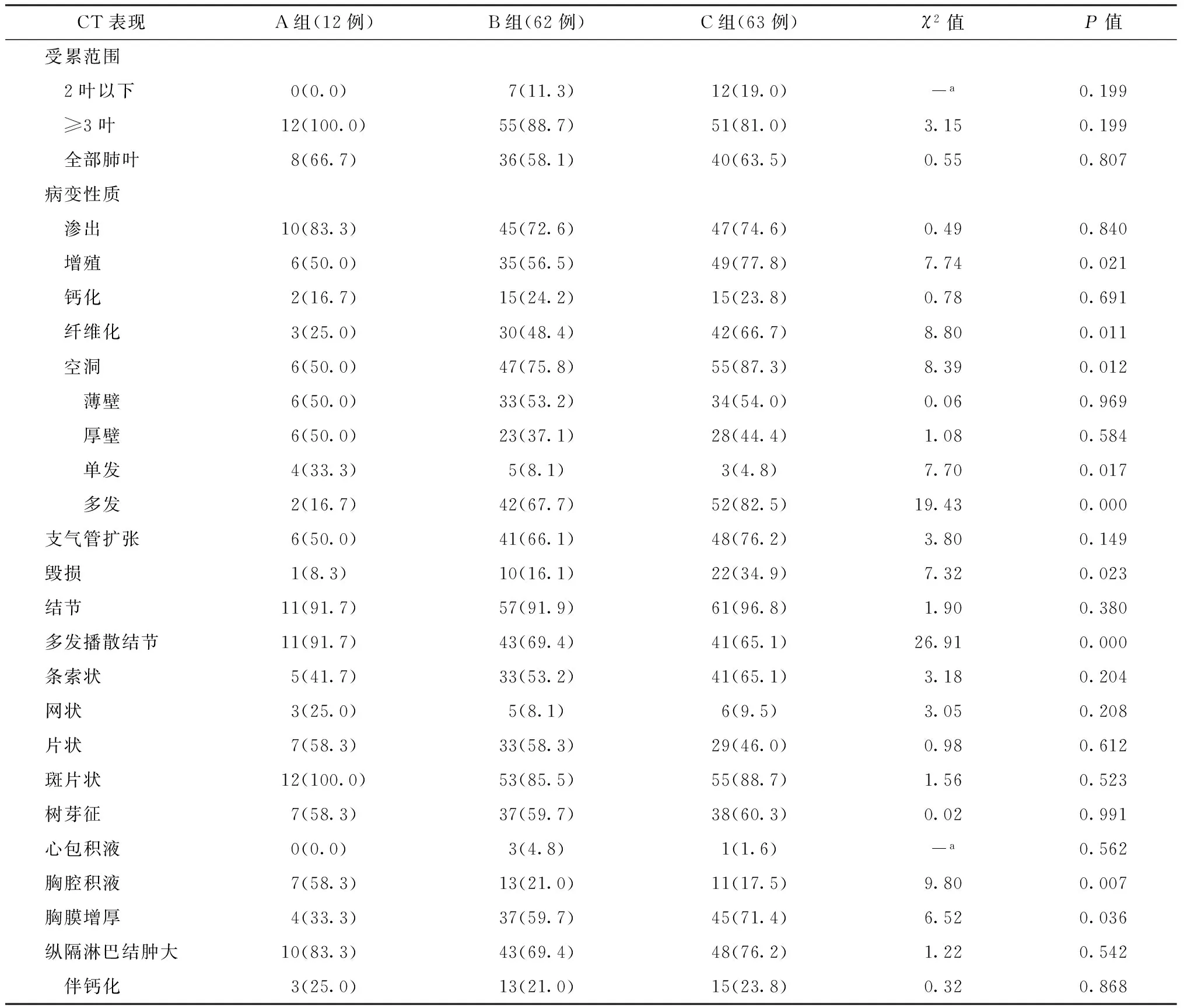
表2 不同CT表现在观察组各小组中的分布情况及比较
注a:采用Fisher确切概率法;括号内数值为“发生率(%)”,括号外数值为“例数”
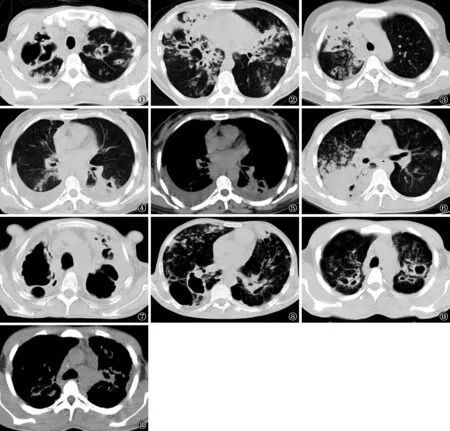
图1,2 男,38岁,CD4细胞 260个/μl。CT扫描显示双肺多发空洞及毁损腔,双肺膨胀及斑片状渗出病灶,内见支气管扩张,管壁增厚;同时显示双肺播散结节及树芽征,纵隔淋巴结肿大,双侧局部胸膜增厚粘连 图3~5 女,39岁,CD4细胞215个/μl。CT扫描显示右肺上叶小空洞及支气管扩张,左肺下叶厚壁空洞,周围卫星灶,双肺多发播散结节影,右肺下叶结节沿支气管走行呈“簇状”改变;纵隔多区淋巴结肿大,双侧胸腔积液 图6 男,21岁,CD4细胞133个/μl。CT扫描显示双肺斑片状渗出病灶及播散结节影,右肺上叶后段见树芽征,右肺下叶大片状影内见充气支气管及无壁空洞 图7,8 男,53岁,CD4细胞477个/μl。CT扫描显示双肺多发空洞、毁损腔及增殖纤维化改变,伴多发播散结节及树芽征,并可见扩张的支气管 图9,10 男,21岁,CD4细胞454个/μl。CT扫描显示双肺多发空洞及胸膜增厚粘连,并见多发小结节及树芽征,纵隔淋巴结肿大伴钙化
讨 论
研究表明,造成结核分枝杆菌耐药的主要分子机制是结核分枝杆菌染色体基因突变[4-6]。造成获得性耐药结核病产生的原因主要包括:药物短缺、药物质量差、治疗不当、患者依从性差、自行停药及治疗方案的不合理,这些是获得性耐药结核病产生的重要原因[7]。
一、MDR-TB患者的CD4细胞水平
人体对结核分枝杆菌的清除主要依赖于T细胞介导的细胞免疫[5],CD4细胞是反应患者免疫水平的重要指标。有研究报道[8-9],MDR-TB患者CD4细胞均少于非耐药结核病患者及正常健康人群。本研究显示,观察组CD4细胞平均数及各小组CD4细胞平均数均低于对照组,本研究观察组中54.0%的CD4水平都有不同程度的降低,平均(425.6±156.5)个/μl,而对照组CD4细胞平均(734.4±215.6)个/μl,表明MDR-TB患者CD4细胞明显低于对照组,与文献报道相符[9-10]。本研究观察组中A小组患者有12例、对照组中无一例CD4细胞低于200个/μl(A1组为0例),A小组患者例数明显多于A1小组。造成MDR-TB患者CD4细胞较低的原因主要与机体耐药有关,耐药结核分枝杆菌胞壁内的糖蛋白能够破坏巨噬细胞,并能直接抑制其免疫活性,使患者CD4细胞数量下降[10]。抗结核药物对患者肝脏及胃肠功能的影响,造成患者消化吸收功能降低而导致营养不良,再加上结核病本身对机体的长期“消耗”,也可导致患者免疫功能的降低,表现为CD4细胞的降低。
二、 MDR-TB患者的CT表现
MDR-TB患者的CT表现在病变范围、形态、性质上与对抗结核药物敏感的肺结核患者并没有本质区别,只是两者发生概率有所不同[11],主要表现有:(1) MDR-TB患者在病变范围上分布更广泛,多叶段发生更多见。本研究观察组病变累及≥3叶及双肺下叶同时受累的患者例数均明显高于对照组。(2)MDR-TB患者呈增殖及纤维化等慢性病程表现者较多。由于抗结核药物对耐药菌株不能短时间有效地杀灭,使得结核分枝杆菌及代谢产物对机体产生长期慢性的刺激,容易形成增殖纤维灶及胸膜增厚等慢性表现[12]。(3)MDR-TB患者多发空洞及厚壁空洞所占比率较多,观察组多发空洞者占70.1%,厚壁空洞者占41.6%,明显高于对照组。可能与耐药结核分枝杆菌对肺组织的长期持续破坏有关。观察组空洞内径大于对照组,与文献报道相符[13]。这与观察组空洞较多,部分空洞发生融合而形成毁损腔有关。(4)MDR-TB患者播散病灶及并发症多,容易出现多发的播散结节及树芽征,观察组发生率为62.0%及59.9%;有报道显示多发播散结节和树芽征及腺泡样结节在MDR-TB患者中累及范围更广泛[14]。观察组并发支气管扩张及肺毁损患者分别占69.3%、24.1%,发生率高于文献报道[15];可能与本组患者病程长、结核分枝杆菌对肺组织反复浸润、破坏有关。
三、MDR-TB患者CT表现与CD4细胞水平的关系
CD4细胞低于200个/μl者CT表现不典型,渗出及播散灶较多,增殖、纤维化、多发空洞、并发毁损及胸膜增厚患者的发生率低于CD4细胞>200个/μl 的患者,而单发空洞及胸腔积液的发生率高于CD4细胞>200个/μl的患者。在CD4细胞较低的情况下,MDR-TB患者的主要表现与原发肺结核患者的表现相似,如多发播散灶、胸腔积液、淋巴结肿大等,反映了免疫功能低下后增殖改变较少,而限制病灶扩散的能力降低后,多发播散灶发生率较高[16]。MDR-TB患者多发空洞发生率较低,单发空洞的发生率较高;随着CD4细胞的不断升高,增殖、纤维化、多发空洞、毁损及胸膜增厚等的慢性增生性病变的发生率逐渐增加,并随CD4细胞的增加,空洞的直径也逐渐增大,与文献报道相符[14]。而CD4细胞>200个/μl及400个/μl时,主要表现为继发性肺结核的CT表现,其CT表现的形式及病变发生率差异均无统计学意义,只是MDR-TB患者的病变累及范围更加广泛[17];尤其是树芽征和播散结节,观察组中A小组患者发现播散结节者占91.7%;据报道,中央小叶的多发簇状小结节,树芽征是活动性肺结核患者最普遍的表现[18]。
综上所述,MDR-TB患者的CD4细胞低于非MDR-TB肺结核患者,其CT表现在CD4细胞低下时表现为多发播散灶等类似原发肺结核患者的表现,而CD4细胞较高的情况下主要表现为继发性肺结核患者的CT表现,即表现为多性质和多形态的病变并存,以慢性病程伴多发播散灶者较多。当肺部CT表现为肺实质的广泛损伤,并多发空洞、多发播散结节、树芽征、并发毁损及支气管扩张等多种征象同时出现时,应考虑到MDR-TB感染的可能。
[1] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室.2010年全国第五次结核病流行病学抽样调查报告.中国防痨杂志,2012,34(8):485-508.
[2] 王庆枫,韩喜琴,陈玉玲,等.肺结核患者T淋巴细胞亚群的检测及临床意义.北京医学,2013,35(12):993-995.
[3] 中国防痨协会.耐药结核病化疗指南(2015).中国防痨杂志,2015,37(5):421-469.
[4] 秦欢,罗军敏.结核分枝杆菌耐药机制研究新进展.中国病原微生物学杂志,2013,8(8):759-761.
[5] 唐神结,肖和平.严重耐多药结核病的研究进展.中华结核和呼吸杂志,2009,32(5):380-383.
[6] Pillay M, Sturm AW. Evolution of the extensively drug-resistant F15/LAM4/KZN strain ofMycobacteriumtuberculosisin KwaZulu-Natal, South Africa. Clin Infect Dis, 2007, 45(11): 1409-1414.
[7] Toungoussova S, Caugant DA, Sandven P, et al. Drug resistance ofMycobacteriumtuberculosisstrainsisolated from patients with pulmonary tuberculosis in Archangels, Russia. Int J Tuberc Lung Dis, 2002, 6(5):406-414.
[8] 胡永芳,张汇征,刘家秀,等.耐多药肺结核患者血CD4细胞计数及痰菌分离鉴定和药物敏感性试验分析.中国防痨杂志,2015,37(4):360-365.
[9] 何纲,丁佩佩,甄沛林,等. 非耐药与耐多药肺结核患者外周血淋巴细胞亚群及细胞因子的变化.中国感染控制杂志,2013,12(9): 1671-1673.
[10] 喻容,周添荣,石国民,等.耐多药结核病患者细胞免疫功能的初步研究.实用预防医学,2016,23(10): 1199-1202.
[11] 李春华, 赵攀, 吕圣秀, 等. 127例耐多药肺结核CT影像学改变与临床.重庆医学,2014,43(23):3078-3080.
[12] Chung MJ,Lee KS,Koh WJ, et al. Drug-sensitive tuberculosis, multidrug-resistant tuberculosis, and non-tuberculous mycobacterial pulmonary diseasein non-AIDS adults: comparisons of thin-section CT Findings. Eur Radiol, 2006,16(9):1934-1941.
[13] 杨钧,张海青,周新华,等.肺结核空洞的CT表现及病理基础.中国医学影像技术,2007,23(12):1831-1833.
[14] Cha J, Lee HY, Lee KS, et al.Radio logical findings of extensively drug-resistant pulmonary tuberculosis in non-AIDS adults: comparisons with findings of multi drug-resistant and drug-sensitive tuberculosis.Korean J Radiol,2009,10(3):207-216.
[15] 杨钧,周新华,李曦,等.耐多药肺结核的影像特点.中华放射学杂志,2004,38(1):10-14.
[16] 朱莹.艾滋病合并药物敏感性及耐多药和广泛耐药性结核影像诊断进展.放射学实践, 2011,26(9):941-943.
[17] Migliori GB, Lange C, Girardi E, et al. Extensively drug-resistant tuberculosis is worse than multidrug-resistant tuberculosis: different methodology and settings, same results. Clin Infect Dis, 2008, 46(6):958-959.
[18] 周新华. 重视肺结核的CT征象分析.中国防痨杂志,2016,38(5):339-341.
(本文编辑:王然 李敬文)
CT manifestations of multi-drug-resistant tuberculosis and its relationship with CD4 cells
LIChun-hua,LYÜSheng-xiu,WANGHui-qiu,SHUWei-qiang,YANGChang-ping,LITong-xin,YANGKun,YANXiao-feng.
DepartmentofRadiology,ChongqingPublicHealthMedicalCenter,Chongqing400036,China
YANXiao-feng,Email: 2429918342@qq.com
Objective To investigate CT manifestations of multi-drug-resistant tuberculosis and its relationship with CD4 cells, in order to raise awareness of multi-drug-resistant tuberculosis. Methods In the retrospective analysis, 137 patients with multi-drug-resistant pulmonary tuberculosis from Chongqing Public Health Center between January 2015 and November 2016 were taken as the observation group, and 130 patients with tuberculosis sensitive to anti-tuberculosis drugs during the same period were selected as the control group. According to CD4 cells (<200/μl, 200-400/μl, >400/μl), the observation group and the control group were divided into three subgroups (A, B, C and A1, B1, C1). Patients in both groups undertook chest CT scan and CD4 cells test. Data of CT manifestations (including scope of lesions, pathological morphology, and nature) and CD4 cells was analyzed, and so was the relationship between the imaging findings and the level of CD4 cells in the observation group. Results In the observation group and the control group, there were 118 cases (86.1%) and 69 cases (53.1%) with lesions involving more than 3 lobes, respectively; and there were 84 cases (61.3%) and 26 cases (20.0%) with lesions involving the whole lung, respectively; the differences were statistically significant (χ2=34.73, 47.00, bothP<0.01). The pathological morphology changes of the observation group and the control group were as follows: multiple disseminated nodules, 85 cases (62.0%) vs. 39 cases (30.0%); mediastinal lymphadenopathy, 101 cases (73.7%) vs. 29 cases (22.3%); multiple cavities 96 cases (70.1%) vs. 22 cases (16.9%); pleural thickening, 86 cases (62.8%) vs. 36 cases (27.7%); focal proliferation, 90 cases (65.7%) vs. 35 cases (26.9%); fibrosis, 75 cases (54.7%) vs. 28 cases (21.5%); destroyed lungs, 33 cases (24.1%) vs. 7 cases (5.4%); bronchiectasis, 95 cases (69.3%) vs. 22 cases (16.9%); all the differences were statistically significant (χ2=27.54, 62.85, 76.40, 33.08, 40.27, 31.04, 18.32 and 74.46, respectively, allP<0.05). The average inner diameter of cavities in the observation group was significantly greater than that of the control group ((30.3±4.9) mm vs. (21.3±4.2) mm;t=10.19,P<0.01). The sizes of cavities in subgroups A, B, C of the observation group were (21.4±3.0) mm, (24.7±3.4) mm and (30.7±3.9) mm respectively, differences were statistically significant (F=60.56,P<0.01). Average number of CD4 cells was (425.6±156.5)/μl in the observation group, lower than that of the control group (734.4±215.6)/μl) (t=-13.45,P<0.01). Average number of CD4 cells of group A was (141.3±38.5)/μl. Difference of average numbers of CD4 cells between groups B and B1 was statistically significant ((303.8±57.9.5)/μl vs. (352.3±65.3)/μl,t=-3.53,P<0.01), and so was groups C and C1 ((603.8±188.3)/μl vs. (852.5±231.4)/μl,t=-7.18,P<0.01). Conclusion Patients with multi-drug resistant tuberculosis having lower CD4 cells than those with tuberculosis sensitive to anti-tuberculosis drugs, their lesions were widely involved and multiple dissemination; furthmore, there were more multiple cavities, chronic courses and complications. CT manifestations shows relationship with CD4 cells to a certain extent.
Tuberculosis, multidrug-resistant; Tomography, X-ray computed; T-lymphocyte subsets; Comparative study
10.3969/j.issn.1000-6621.2017.06.011
400036 重庆市公共卫生医疗救治中心放射科(李春华、吕圣秀、王惠秋、舒伟强、杨长萍),检验科(李同心、杨坤),结核科(严晓峰)
严晓峰,Email:2429918342@qq.com
2017-02-23)
