一氧化氮合酶、白细胞介素-8在不同类型胃食管反流病中的表达及意义
2017-06-28肖兰
肖 兰
四川省攀枝花学院附属医院消化内科(攀枝花617000)
一氧化氮合酶、白细胞介素-8在不同类型胃食管反流病中的表达及意义
肖 兰
四川省攀枝花学院附属医院消化内科(攀枝花617000)
目的:对比不同类型胃食管反流病(GERD)食管黏膜上一氧化氮合酶(NOS)、白细胞介素-8(IL-8)蛋白表达水平及在胃食管反流病发病中的意义。方法:反流性食管炎患者59例(RE组)、非糜烂性反流病(NERD组)患者58例及Barrett食管患者60例(BE组),评估三组患者的食管黏膜损伤、酸反流情况,同时三组均于胃镜下取病变食管黏膜,采用Western免疫组化法测定NOS及LI-8蛋白表达水平,比较三组患者损伤食管的免疫细胞学指标变化。结果:所有GERD患者食管下段黏膜组织中,两种NOS表达均出现异常,BE主要表达于化生的柱状上皮腺体胞浆,而RE、NERD主要表达于鳞状上皮的胞浆,其中 BE 组nNOS与iNOS的表达量均为1.1 β-actin;RE组nNOS的表达量为1.7 β-actin,iNOS表达量2.3 β-actin,NERD 组nNOS的表达量为1.3β-actin,iNOS表达量1.4 β-actin。三组之间NOS的mRNA表达量差异均有统计学意义(P<0.05),NOS表达量RE组>NERD组>BE组;BE、RE、NERD三组的IL-8表达水平分别为(195.06±67.59) pg/ml、(207.52±86.28) pg/ml、(202.07±81.52) pg/ml;三组IL-8 表达水平两两比较差异均有统计学意义(P<0.05)。结论:IL-8和NOS可能共同参与了食管黏膜炎症反应,在导致食管黏膜损伤过程中可能起到了协同介导作用,但其具体机制仍需进一步探讨。
胃食管反流病(Gastroesophageal reflux disease,GERD) 是胃、十二指肠内容物反流,进入食管引起反酸、烧心、胸痛、呼吸困难等临床症状,并在病理上引起胃、食管黏膜组织损伤的常见消化道疾病[1]。根据食管损伤后是否存在炎症而将GERD分为反流性食管炎(RE)和非糜烂性反流病(NERD)及Barrett食管(BE)三个类型。GERD在亚洲国家发病率为5%~17%,近年来其发病率呈逐年上升趋势[2]。NERD和RE是最常见的GERD类型,有学者认为NERD属GERD的轻型现,从NERD转变为RE是疾病由轻转重的发展过程[3]。目前GERD的病理生理机制尚不够明确,但主要认为其与胃食管连接部的抗反流屏障结构破坏或功能障碍以及食管防御功能进行性减退有关[4],而食管黏膜组织损伤和酸反流则被认为是其发病机制中的关键环节[5]。近年来研究发现一氧化氮合酶(NOS)及白细胞介素-8(IL-8)表达与GERD患者的食管黏膜组织损伤有关,但其具体机制仍不明确[6]。本课题从基因蛋白水平对比NOS及LI-8在不同类型GERD患者食管黏膜的表达差异,旨在探讨不同类型GERD的发病机制,为临床开拓新的治疗方法提供理论依据。
资料与方法
1 一般资料 选取我科于2013年9月至2015年6月收治的根据内镜下表现及病理特点确诊为RE、NERD及BE患者为研究对象。RE组59例,男41例,女18例,年龄24~71岁之间、平均(52.3±8. 7)岁,平均病程(8.31±3.73)年。NERD组58例, 男39例,女19例,年龄23~70岁、平均(51.6±9.2)岁,平均病程(7.96±3.85)年。BE组60例, 男43例,女17例,年龄22~74岁、平均(52.3±8.9)岁,平均病程(8.14±3.72)年。三组在性别、年龄、病程、症状RDQ量表评分等方面比较,差异均无统计学意义(P>0.05),具有可比性。诊断标准:本研究GERD的诊断标准参照2007年颁布的《中国胃食管反流病共识意见》关于GERD的诊断标准制定[7]。
2 检查方法 ①内镜检查:检查前5 d停用抑制胃酸分泌、质子泵抑制剂(PPI)和促进胃动力药物,检查前12 h内禁食、禁水。三组患者均采取平卧位,在Olympus EVIS-XQ260/240 型号电子胃镜协助下观察并记录患者胃内组织病理表现,根据不同分型纳入不同组别。②活检方法:BE及RE患者在接受胃镜检查同时接受病变部位组织活检,共取4块活检组织,NERD组患者则于食管远端鳞状上皮与柱状上皮交界处上2 cm取4块活检组织。所有活检组织取出后其中2块组织立即置于液氮中保存30 min后置于-80 ℃冰箱中备用,另2块组织立即用100 ml/L甲醛固定4 h后行HE染色及NOS免疫组化染色。③NOS-PCR检测:提取RNA,琼脂糖凝胶电泳鉴定,-80 ℃保存。并用Nano DropND-1000光度计测定含量和纯度,根据测定RNA含量标准化。然后合成cDNA并进一步行实时荧光PCR定量。以NCBI Gen Bank提供的人类基因序列行NOS引物设计,由北京奥科生物技术有限公司合成。反应体系为 Real time PCR Master Mix(2×) 12.5 μl,上游引物(10 μmol/L)各1 μl,cDNA 1 μl,Green DNA I dye(5×)3 μl,用DEPC水将总反应体积加到25 μl。反应条件为95 ℃,15 min;然后95 ℃,30 s;60 ℃,1 min;70 ℃,30 s共40个循环。同时用去离子水代替cDNA作为PCR反应体系的阴性对照。④ELISA 检测IL-8表达水平:采取患者肘静脉血4 ml,制备血清标本,充分分解,然后加样、稀释标本置于反应孔、加入待测样品,再加入IL-8 抗体;温育洗涤后加入亲和链酶素-HRP,混匀温育30 min;洗涤4次后每孔加入底物A、B各50 μl混匀,37 ℃温育 10 min,避免光照;取出酶标板,立即加入50 μl 终止液测定结果。
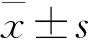
结 果
1 三组HE染色对比 见图1。BE 光镜下可见柱状上皮化生;RE 可见鳞状上皮增生、黏膜糜烂,伴炎性细胞浸润;NERD 偶见鳞状上皮增生及炎性细胞浸润。

A:BE组,B:RE组,C:NERD组
2 NOS在不同类型胃食管反流病中的表达 见图2。BE主要表达于化生的柱状上皮腺体胞浆,而RE、NERD主要表达于鳞状上皮的胞浆。其中 BE 组nNOS与iNOS的表达量均为1.1 β-actin;RE组nNOS的表达量为1.7 β-actin,iNOS表达量2.3 β-actin;NERD 组nNOS的表达量为1.3 β-actin,iNOS表达量1.4 β-actin。三组之间NOS的mRNA表达量差异均有统计学意义(P<0.05)。NOS表达量:RE组>NERD组>BE组。
3 IL-8在不同类型胃食管反流病中的表达 BE、RE、NERD 三组的IL-8表达水平分别为(195.06±67.59)pg/ml、(207.52±86.28)pg/ml、(202.07±81.52)pg/ml;三组IL-8 表达水平两两比较,差异均有统计学意义(P<0.05)。
4 NOS与血清IL-8表达量相关性分析 见图3。经Spearman相关分析,NOS与血清IL-8呈正相关(r=0.56,P<0.05)。

A:nNOS;B:iNOS
与 RE组比较,*P<0.05;与NERD组比较,#P<0.05
图2 NOS在不同类型胃食管反流病中的表达
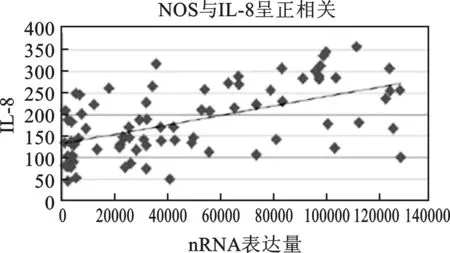
图3 NOS与IL-8相关性分析
讨 论
目前,研究已表明NO为非肾上腺素能和非胆碱能神经的主要抑制性递质,其介导的食管反应对维持食管的张力起到关键作用[8]。NO由NOS介导生成,NOS的活性可直接调节NO的生成量及生物学效应,因此可通过测定NOS活性评估食管黏膜组织细胞中NO的含量[9]。NO亦是炎性介质,iNOS在正常状态下不表达,在细胞因子等刺激下诱导性表达,并产生NO,与超氧化物反应产生过氧化亚硝酸(PXN),最后加速氧化脂类和巯基化合物,引起急慢性炎症[10]。本研究采用免疫组化方法检测了nNOS和iNOS在不同类型GERD患者食管黏膜组织中的表达,结果发现所有GERD患者食管下段黏膜组织中,两种NOS表达均出现异常,BE主要表达于化生的柱状上皮腺体胞浆,而RE、NERD主要表达于鳞状上皮的胞浆,其中 BE 组nNOS与iNOS的表达量均为1.1 β-actin;RE组nNOS的表达量为1.7 β-actin,iNOS表达量2.3β-actin,NERD 组nNOS的的表达量为1.3 β-actin,iNOS表达量1.4 β-actin。三组之间NOS的mRNA表达量有统计学差异(P<0.05),NOS表达量RE组>NERD组>BE组,提示iNOS和nNOS可能共同导致食管组织内、细胞内和细胞间NO的分布及量的改变,而此种改变正是食管平滑肌功能障碍的关键,如若病情未得到有效控制,这种改变加重的趋势者越加明显。通过查阅大量文献,我们认为上述改变与LES的功能下降关系密切,从而导致患者出现反酸、嗳气、烧心等症状,反流的存在不断刺激食管组织分泌NO,造成恶性循环,因此我们有理由相信NOS的高水平分泌时食管黏膜损伤的重要因素,它产生的NO介导的炎症反应可能与食管反流疾病的发生发展有关。
IL-8为一种强有效的中性粒细胞CXC类趋化因子,可启动和促进炎症反应。有报道[11]GERD患者食管黏膜上IL-8、蛋白的表达水平高于健康对照组,提示IL-8参与了食管黏膜的炎症损伤。本研究中BE、RE、NERD 三组的IL-8表达水平分别为(195.06±67.59) pg/ml、(207.52±86.28) pg/ml、(202.07±81.52) pg/ml;三组IL-8 表达水平两两比较差异均有统计学意义(P<0.05),而且从BE、NERD到BE,随着病情严重程度增加,其IL-8表达也升高,表明IL-8的表达是也食管黏膜炎症损伤严重程度的一个敏感指标。通过相关分析,我们发现GERD患者的NOS表达与IL-8表达呈正相关,说明IL-8和NOS可能共同参与了食管黏膜炎症反应,在导致食管黏膜损伤过程中可能起到了协同介导作用。
综上所述,本研究探索了不同类型GERD患者食管下段黏膜组织中NOS的表达变化和血清白细胞介素-8的表达变化,认为IL-8和NOS可能共同参与了食管黏膜炎症反应,在导致食管黏膜损伤过程中可能起到了协同介导作用,但其具体机制仍需进一步探讨。
[1] 陈金亮,黄 涛. 胃食管反流病辨治思路[J].陕西中医,2011,32(11):1515-1517.
[2] Jung HK,Hong SJ,Jo YJ,etal.Updated guidelines2012 for gastroesophageal reflux disease [J].Korean J Gastroenterol,2012,60(4):195-218.
[3] Fass R,Ofman JJ.Gastroesphageal reflux diease-should we adopt a new conceptual framework[J].Am J Gastroenterol,2012,97(8):1901-1909.
[4] 王启之.胃食管反流病[J].中华全科医学,2008,6(11):1209-1210.
[5] Poh CH, Gasiorowska A, Navarro-Rodriguez T,etal. Upper GI tract findings in patients with heartburn in whom proton pump inhibitor treatment failed versus those not receiving antireflux treatment[J]. Gastrointest Endosc,2010;71:28-34.
[6] 李 毅,孙 涛. 胃食管反流病发病机制研究进展[J].解放军医学院学报,2013,6:552-554.
[7] 沈 莉,康琼英,张 莉,等.芍根方对放射性食管炎大鼠食管组织中诱导型一氧化氮合酶表达和一氧化氮含量的影响[J].广东医学,2013,44(11):34-38.
[8] Baggiolini M.Chemokines and leukocyte raffic[J].Nature,1998,392(6676):565-568.
[9] 贾 涛,赵 宁,赵振平.血管活性肠肽和一氧化氮在不同类型胃食管反流病中的表达及意义[J].新乡医学院学报,2015,3(2):44-47.
[10] 袁 圆,林 中,李小玲.伴胃肠动力障碍的重症急性胰腺炎大鼠结肠黏膜下神经节一氧化氮合酶阳性神经元的变化[J].郑州大学学报:医学版,2013,48(1):47-50.
[11] 郭晓燕,王 婷,董 蕾,等. 一氧化氮合酶在胃食管反流病患者食道黏膜的表达[J] .西安交通大学学报:医学版,2015,36(3):373-377.
(收稿:2016-10-19)
Significance of NOS joint IL-8 expression in different types of gastroesophageal reflux disease
Xiao Lan.
Affiliated Hospital of Sichuan Panzhihua Medical College(Panzhihua 617000)
Objective:To compare the different types of gastroesophageal reflux disease (GERD) in the esophageal mucosa nitric oxide synthase (NOS) and interleukin -8 (IL-8) protein expression levels, explore NOS and LI-8 in different types of gastroesophageal reflux disease in significance. Methods: Gastroenterology endoscopic and pathological features of patients diagnosed with reflux esophagitis 59 cases (RE group) and diagnosed as non-erosive reflux disease (NERD group ) of 58 patients, and 60 patients with Barrett's esophagus (BE group) as the object of study, comparative assessment of the three groups of esophageal mucosa damage, acid reflux cases, while three were taken to the endoscopic esophageal lesions by western immunohistochemistry Determination of the method and its NOS LI-8 protein levels, immune cytology were compared indicators damage the esophagus. Results:All patients with GERD esophageal mucosa, both NOS expression of abnormal, BE mainly expressed in the cytoplasm of glandular metaplasia of columnar epithelium, and RE, NERD mainly expressed in the cytoplasm of squamous epithelium, in which BE group nNOS and iNOS expression were 1.1 β-actin; nNOS expression RE group was 1.7β-actin, iNOS expression 2.3β-actin, the amount of nNOS expression NERD group was 1.3β-actin, iNOS expression 1.4 β-actin. The expression of mRNA NOS among the three groups were significantly different by the statistics (allP<0.05), NOS expression of RE group> NERD group> BE Group; BE, RE, NERD IL-8 expression level of the three groups were(195.06±67.59)pg/ml,(207.52±86.28)pg/ml, (202.07±81.52)pg/ml; three groups of IL-8 expression level of any two differences were statistically significant (P<0.05). Conclusion:IL-8 and NOS esophageal mucosa may be involved in the inflammatory response, leading to esophageal mucosal injury in the process may play a synergistic role in mediating, but the exact mechanism remains to be explored.
Gastroesophageal reflux Nitric oxide synthase Interleukin-8 Causality
胃食管反流 一氧化氮合酶 白细胞介素-8 因果律
R571
A
10.3969/j.issn.1000-7377.2017.06.038
