人脐血间充质干细胞在大鼠急性肝损伤修复中的作用
2017-06-28李培杰李伟之马富权郭雯莹
李培杰, 王 佳,李伟之,马富权,郭雯莹,齐 丽,薛 挥
西安交通大学第一附属医院消化内科(西安 710061)
△通讯作者
人脐血间充质干细胞在大鼠急性肝损伤修复中的作用
李培杰, 王 佳,李伟之,马富权,郭雯莹,齐 丽,薛 挥△
西安交通大学第一附属医院消化内科(西安 710061)
目的:探讨经外周静脉途径移植人脐血间充质干细胞(hUCBMSCs)对急性肝损伤大鼠肝脏功能及组织的修复作用。方法:使用密度梯度离心法结合贴壁培养法体外培养人脐血间充质干细胞。44只雌性SD大鼠随机地分为四组,每组11只:正常组(N组)、单纯移植组(NT组)、损伤组(I组)、移植治疗组(IT组)。I组和IT组在移植前24 h腹腔注射50% CCl4溶液(3 ml/kg),N组、NT组腹腔注射等量的生理盐水。造模后24 h,使用DAPI标记第3代hUCBMSCs,NT组、IT组大鼠经外周静脉途径移植入(5~6)×106个hUCBMSCs,N组、I组大鼠注入1 ml生理盐水。在造模前、造模后24 h,移植后第3天、第7天、第14天,收集血清检测ALT和AST;移植后第3天、第7天,各组分别处死3只大鼠,第14天处死剩余大鼠,取肝脏组织行病理染色及冰冻切片,观察大鼠肝脏组织的病理学变化以及hUCBMSCs 在肝脏内的迁移定植情况。移植后第14天,取IT组和NT组的肝脏组织进行免疫组织化学染色,检测大鼠肝脏中人源性肝细胞特异性抗原(HSA)的表达。结果:造模后24 h,I组和IT组血清ALT和AST水平明显升高,与N组相比差异有统计学意义(P均<0.05)。与损伤组(I)相比,移植治疗组(IT)的肝脏病理学损伤恢复速度明显加快,移植后第14天接近于正常。无论在移植后的第3天、第7天还是第14天,IT组蓝色荧光标记的细胞数均多于NT组(P均<0.05)。在移植后的第3天,hUCBMSCs主要位于汇管区的周围,第7天和第14天主要定植于肝实质中。移植后第14天,IT组、NT组大鼠的肝组织中均可见红色荧光标记的人源性肝细胞特异性抗原(HSA),IT组的阳性细胞数(35±7.3)个明显多于NT组(7±3.4)个(t=1.377,P<0.05)。结论:肝脏受损后形成的微环境能够促使hUCBMSCs向受损肝组织中迁移、定植,并诱导其横向分化为肝样细胞来修复肝脏功能及组织。
目前肝移植仍然是治疗急慢性肝脏功能衰竭最为有效的方法,但其广泛应用受到供体肝缺乏、免疫排斥反应以及长期服用免疫抑制剂等方面的限制。近年来,随着再生医学以及干细胞技术的发展,以干细胞为基础的细胞移植治疗为广大急慢性肝功能衰竭患者带来了新曙光。间充质干细胞因其来源广泛,增值分化能力强,能够参与免疫调节,且较少涉及伦理问题,在特定条件下,可以分化为脂肪细胞、软骨细胞、骨细胞以及心肌细胞、神经细胞、肝细胞等,故大量用于实验及临床研究[1]。本实验采用人脐血间充质干细胞(hUCBMSCs)经尾静脉移植入CCl4诱导的急性肝损伤大鼠体内,观察移植后大鼠的肝脏功能及病理学变化。
材料和方法
1 材 料 DMEM/F12、DMEM/H 培养基、胎牛血清(Hyclone公司),人成纤维细胞生长因子(FGF)(美国PeproTech公司),CD34-PE、CD105-FITC单抗(美国eBioscience公司),鼠抗人HSA单克隆抗体(北京博奥森生物技术有限公司),倒置显微镜及照相系统(日本Olympus公司),流式细胞仪(美国BD公司)。健康SPF 级雌性SD大鼠44只,6~7周龄,体重190~220 g,由西安交通大学医学院动物实验中心提供。脐血标本取自我院健康产妇足月妊娠剖宫产新生儿脐带血,均取得产妇及家属知情同意。
2 实验方法 ①hUCBMSCs的分离和体外培养:无菌操作采集脐血,密度梯度离心法(人淋巴细胞分离液 1.077 g/L)分离得到脐血单个核细胞,以5×106/cm2接种于T25培养瓶中,每瓶加入含10%FBS的DMEM/F12培养基10 ml,置于37 ℃、5% CO2、饱和湿度培养箱中,5 d后首次换液,以后每3 d换液1次,当细胞融合达到80%以上时,用0.05%胰酶消化传代(1∶3)。②hUCBMSCs的鉴定:取第3代细胞(P3),采用荧光标记小鼠抗人单克隆抗体CD34-PE、CD105-FITC,流式细胞仪检测;取第2代细胞(P2),0.05%胰酶消化后离心,重悬后种植于6孔板中,阳性组用成骨诱导培养基,阴性组继续用含10% FBS的DMEM/F12培养基,每4 d换液1次,21 d后行茜素红染色。③大鼠急性肝损伤模型的制备:将44只SPF级的健康雌性SD大鼠随机地分为四组(每组11只):正常组(N组)、单纯移植组(NT组)、损伤组(I组)、移植治疗组(IT组)。I组和IT组在移植前24 h给予腹腔注射50% 的CCl4-橄榄油(3 ml/kg)诱导急性肝损伤,N组和NT组给予腹腔注射等量的生理盐水。④hUCBMSCs移植:移植前24 h,将DAPI标记第3代hUCBMSCs共培养,并计算标记阳性率。造模后24 h,NT组和IT组经外周静脉途径(尾正中静脉)移植入(5~6)×106个hUCBMSCs,N组和I组大鼠注入1 ml生理盐水。
3 观察指标及检测方法 ①在造模前以及造模后24 h,移植后的第3天、第7天、第14天,从大鼠的内眦静脉丛采血并分离血清,检测肝功指标ALT和AST;②移植后的第3 天和第7 天,各组分别处死3只大鼠,第14天处死剩余大鼠,取肝脏组织行病理染色观察肝脏组织的病理学变化;③NT组和IT组大鼠在移植后的第3天、第7天、第14天,取肝脏组织制作冰冻切片,观察hUCBMSCs 在肝脏内的迁移、定植情况;NT组和IT组大鼠在移植后第14天,取肝脏组织进行鼠抗人HSA单克隆抗体免疫组织化学染色,检测大鼠肝脏中人源性HSA的表达。
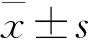
结 果
1 hUCBMSCs的分离培养鉴定 通过密度梯度离心法结合贴壁筛选法从人类脐血中分离纯化出一组形态均一的呈长梭形涡旋样生长的细胞,该组细胞高表达间充质干细胞的表面标志CD105(97.5%),低表达造血干细胞的表面标志CD34(4.3%);且经成骨诱导培养21 d后,出现钙盐沉积,并能够被茜素红染成红色(见图1、2)。
图1 P3 hUCBMSCs 的表面标记
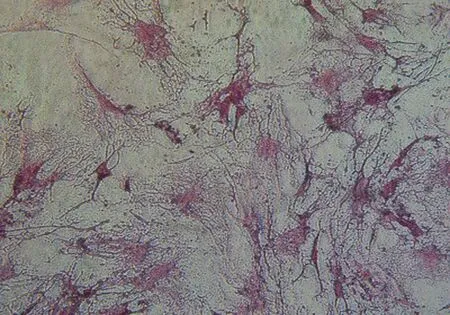
图2 成骨诱导培养21 d(×200)
2 肝功指标ALT和AST结果 见表1。在造模后24 h,I组和IT组血清中ALT和AST水平明显升高,与N组相比差异有统计学意义(P<0.05);造模后第4天,无论是否进行细胞移植,I组和IT组均基本恢复正常,与N组相比均差异无统计学意义(P>0.05)。
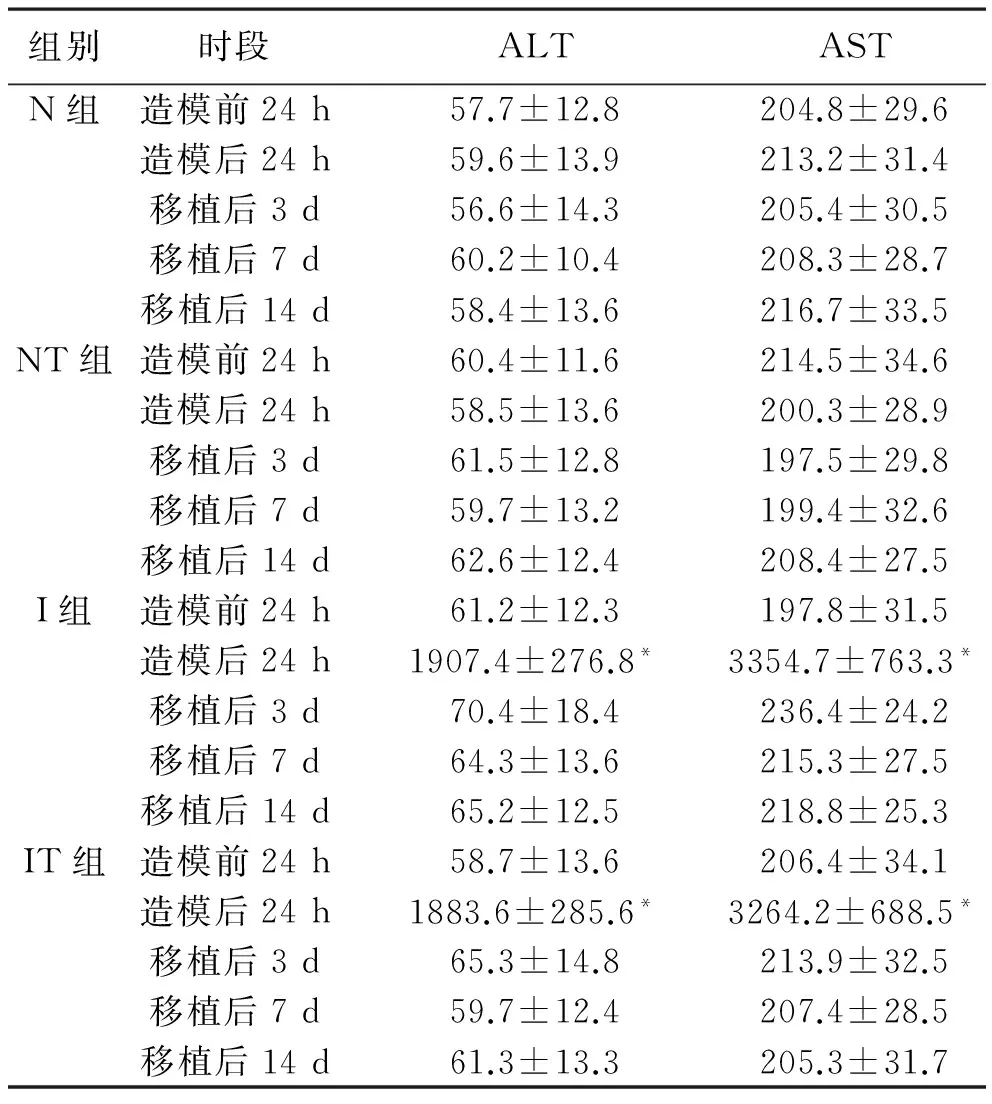
表1 各组大鼠不同时段血清ALT、AST水平(U/L)
注:与N组同时段比较,*P<0.05
3 肝组织HE染色结果 N组和NT组在移植后的第3天、第7天、第14天无明显变化,肝小叶的结构完整,细胞排列规整,以中心静脉为中心呈放射状向周边分布,无肝细胞坏死以及纤维组织的增生;I组在造模后的第4天,肝脏细胞明显肿胀,肝小叶的结构受到破坏,细胞的排列紊乱,出现大片的气球样变,在造模后的第8天、第15天受损组织恢复不明显(图3);IT组在移植后的第3天可见在中央静脉周围的肝细胞肿胀,排列紊乱,存在较大片的气球样变;在移植后第7天,肝组织的病理损伤较前有所好转,气球样变的范围较前缩小,肝细胞的损伤主要位于中央静脉的周围,肝小叶的远端细胞的排列接近于正常;在移植后的第14天,中央静脉周围的肝细胞的损伤基本消失,肝小叶的整体结构接近于正常,细胞排列较规整,仅可见散在的气球样变(图4)。
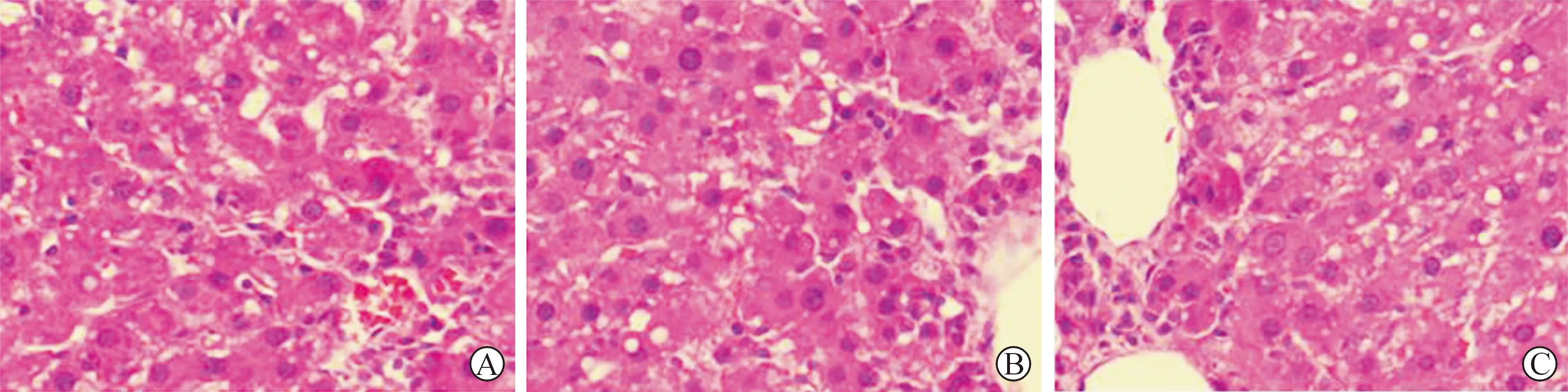
A:损伤后第4天;B:损伤后第8天;C:损伤后第15天
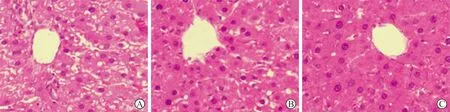
A:移植后第3天;B:移植后第7天;C:移植后第14天
4 肝组织冰冻切片结果 见图5。

A: IT组移植后第3天;B:IT组移植后第7天;C:IT组移植后第14天;D:NT组移植后第3天;E:NT组移植后第7天;F:NT组移植后第14天
移植后的第3天、第7天、第14天,在400倍镜下随机地选择5个无相互重叠的视野记录两组大鼠肝组织中的阳性细胞数,IT组蓝色荧光标记的细胞数(55±8.7、38±5.8、5±1.3)均多于NT组(10±3.7、5±2.1、1±0.4),差异均有统计学意义(P<0.05)。在移植后的第3天,hUCBMSCs主要位于汇管区的周围,部分细胞穿过血管壁间隙向肝脏实质迁移,第7天和第14天主要定植于肝实质中。
5 肝组织免疫荧光染色结果 移植后第14天,使用鼠抗人的HSA单克隆抗体对IT组和NT组的大鼠肝脏组织切片进行免疫荧光染色,两组大鼠的肝组织中均可见呈红色荧光标记的人源性肝细胞特异性抗原(HSA),在200倍镜下随机地选择5个无相互重叠的视野记录两组大鼠肝组织中的阳性细胞数,IT组的阳性细胞数(35±7.3)个,明显多于NT组(7±3.4)个,差异有统计学意义(t=1.377,P<0.05)(图6)。
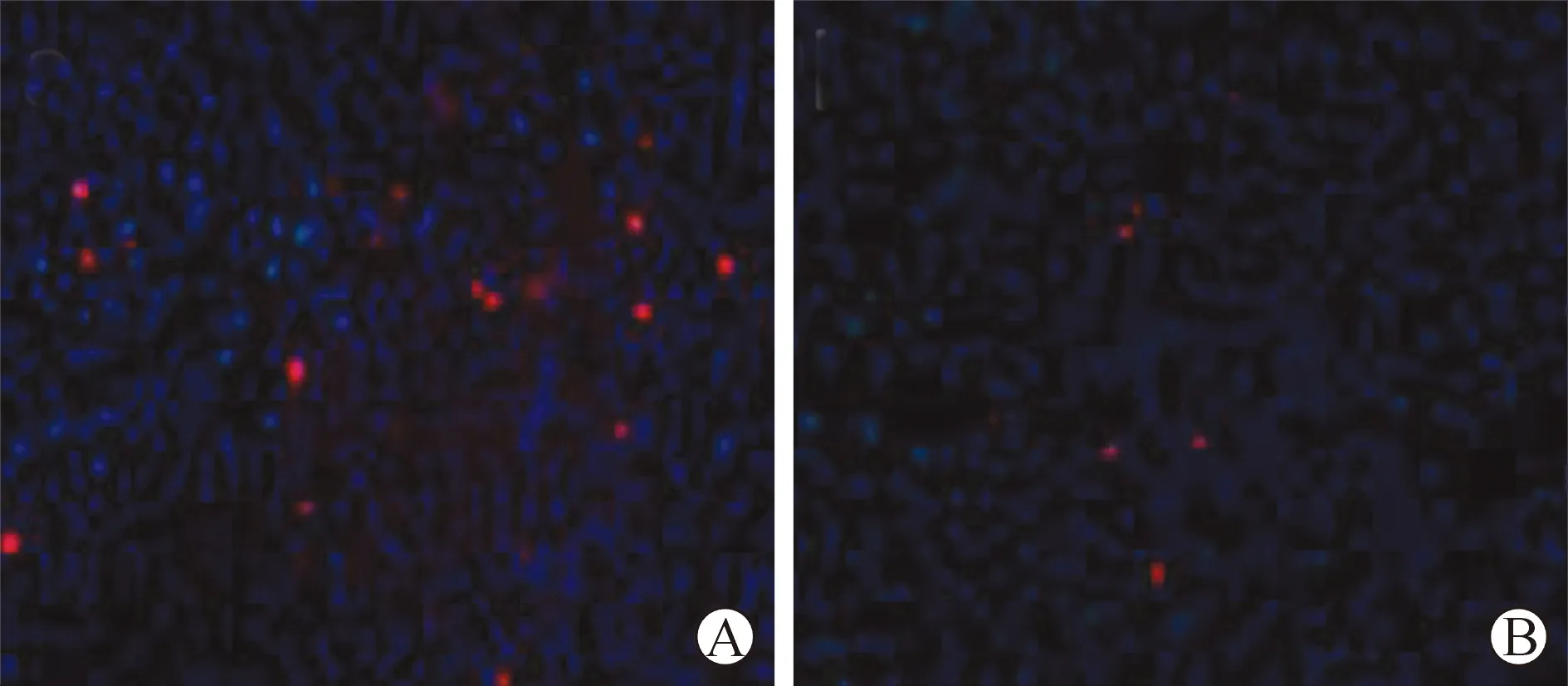
A:IT组;B:NT组
讨 论
利用脐血中各个细胞成分的密度不同,使用密度梯度离心法将脐血中的单个核细胞分离出来;再根据间充质干细胞在体外培养时具有粘附于塑料生长的特性,使用贴壁培养法将hUCBMSCs从单个核细胞中筛选出来;通过观察细胞的形态、检测表面分子标志以及多向分化能力对体外培养的第3代细胞进行鉴定,发现细胞在形态呈长梭形涡旋样排列,高表达间充质干细胞的表面标志CD105,低表达造血干细胞的表面标志CD34,并能够被诱导分化为成骨细胞,符合国际细胞治疗协会关于MSCs的认定标准[2]。
间充质干细胞具有低免疫原性,不表达MHC-Ⅱ、CD40、CD80、CD86 等表面致免疫分子,不会激活T淋巴细胞的免疫反应;还能够分泌某些细胞因子以及胞间接触,干扰抗原提呈细胞的功能,进而阻止B细胞的活化,并抑制T细胞和NK细胞介导的炎性反应[3]。有多个研究者发现在体外实验过程中,脐血来源的间充质干细胞不仅具有低免疫原性,而且具有免疫调节作用,能够抑制异种来源的免疫细胞的活性[4-5]。梁璐等[6]将DiI标记的hUCBMSCs移植到肠炎模型小鼠体内,结果发现移植后hUCBMSCs逐渐迁移至肠道,而且移植组T细胞的百分数明显低于模型组和对照组。这些研究为hUCBMSCs的异种移植的应用提供了理论以及实验上的依据。
造模后24 h,肝功指标ALT、AST明显升高(P<0.05),造模后第4 d基本恢复正常,但肝脏大体标本可见表面布满出血点,质地变韧,HE染色可见大片的气球样变,与其他研究者的结果相似[7]。ALT、AST为肝细胞损伤的急性标志物,而造模时仅给予肝脏一次打击,没有慢性的持续性损伤,因此在急性期过后转氨酶会恢复正常,但组织学的修复是个慢性过程,需要较长的时间。
IT组在移植后第3天时, DAPI标记[8]的蓝色荧光hUCBMSCs主要集中在汇管区周围,第7天和14天时则分布在肝实质中,考虑在移植的早期,hUCBMSCs主要完成迁移、定植的过程,于1周左右定植于肝实质中开始发挥修复组织的作用。NT组定植的hUCBMSCs数各个观察点均少于移IT组,考虑肝脏损伤后形成的微环境有促进hUCBMSCs归巢的作用[9]。Liu等[10]的研究指出SDF-1既是调节组织、器官修复的重要细胞因子,又是调节局部炎症反应的重要趋化因子,祖细胞、干细胞、淋巴细胞、基质细胞以及内皮细胞等多种细胞表面均表达有SDF-1的特异性受体CXCR4,认为在肝损伤时,大量分泌的SDF-1能够促进间充质干细胞向肝损伤部位迁移、归巢。在移植后第14d,NT组和IT组均能检测到红色荧光标记的人源性肝细胞特异性抗原(HSA),证实hUCBMSCs在肝脏的微环境中能够分化为人源性的肝样细胞来修复受损的肝组织,但不能排除还有其他修复机制的存在,如旁分泌机制[11],细胞融合机制[12]等。
[1] Esrefoglu M. Role of stem cells in repair of liver injury: experimental and clinical benefit of transferred stem cells on liver failure[J]. World J Gastroenterol, 2013,19(40):6757-6773.
[2] Dominici M, Le Blanc K, Mueller I,etal. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006,8(4):315-317.
[3] 邓寅业,陶艳玲.人脐血间充质干细胞体分离、培养及向脂肪细胞分化的实验研究[J].陕西医学杂志,2010,39(5):541-543.
[4] Hao L, Zhang C, Chen XH,etal. Human umbilical cord blood-derived stromal cells suppress xenogeneic immune cell response in vitro[J]. Croat Med J, 2009,50(4):351-360.
[5] Wang M, Yang Y, Yang D,etal. The immunomodulatory activity of human umbilical cord blood-derived mesenchymal stem cells in vitro[J]. Immunology, 2009,126(2):220-232.
[6] 梁 璐,陈小军,吴 昊,等. 人脐带间充质干细胞在小鼠体内的迁移变化及宿主的免疫反应[J].郑州大学学报:医学版,2010,32(1):33-36.
[7] 张孝卫,耿秀兰,黄丽华,等. 四氯化碳致大鼠、小鼠肝损伤的对比实验[J]. 基础医学与临床,2003(3):351-352.
[8] Vela DC, Silva GV, Assad JA,etal. Histopathological study of healing after allogenic mesenchymal stem cell delivery in myocardial infarction in dogs[J]. J Histochem Cytochem, 2009,57(2):167-176.
[9] Beerheide W, von Mach MA, Ringel M,etal, Downregulation of beta2-microglobulin in human cord blood somatic stem cells after transplantation into livers of SCID-mice: an escape mechanism of stem cells[J].Biochem Biophys Res Commun, 2002,294(5):1052-1063.
[10] Liu ZJ, Zhuge Y, Velazquez OC. Trafficking and differentiation of mesenchymal stem cells[J].J Cell Biochem, 2009,106(6):984-991.
[11] Gilgenkrantz H,Hortet A. New insights into liver regeneration[J].Clin Res Hepatol Gastroenterol, 2011,35(10):623-629.
[12] Wang X, Willenbring H, Akkari Y,etal. Cell fusion is the principal source of bone-marrow-derived hepatocytes[J]. Nature, 2013, 422(6934):897-901.
(收稿:2016-08-01)
肝细胞 药物性肝损伤 脐血干细胞移植 大鼠
R575.2
A
10.3969/j.issn.1000-7377.2017.06.007
