miR-145对人乳腺癌MCF-7/ADR细胞耐药逆转的作用机制研究
2017-06-28安改丽
安改丽,侯 磊,李 旭,白 俊
1.陕西省人民医院肿瘤内科(西安710068),2.西安交通大学第一附属医院肿瘤内科(西安 710061),3.陕西省肿瘤医院内一科(西安 710061)
miR-145对人乳腺癌MCF-7/ADR细胞耐药逆转的作用机制研究
安改丽1,2,侯 磊1,李 旭3,白 俊1
1.陕西省人民医院肿瘤内科(西安710068),2.西安交通大学第一附属医院肿瘤内科(西安 710061),3.陕西省肿瘤医院内一科(西安 710061)
目的:探讨miR-145对人乳腺癌阿霉素耐药细胞株MCF-7/ADR阿霉素耐药的影响及可能的作用机制。方法:采用实时定量PCR方法检测miR-145在乳腺癌细胞株MCF-7及MCF-7/ADR中的表达差异;脂质体转染法将构建好的miR-145 mimics,miR-145 inhibitor成功转染进MCF-7/ADR细胞中,MTT法检测转染后MCF-7/ADR细胞对阿霉素的敏感性,流式细胞仪检测耐药细胞对阿霉素诱导凋亡的影响,Western blot检测转染前后抗凋亡蛋白Bcl-2、多药耐药基因MDR1表达蛋白P-gp的表达差异。结果:miR-145在人乳腺癌细胞株MCF-7/ADR中表达下降;上调miR-145可以增强MCF-7/ADR细胞对阿霉素的敏感性,显著抑制MCF-7/ADR细胞增殖,并促进阿霉素诱导的细胞凋亡,同时显著抑制了耐药细胞中Bcl-2和P-gp的表达。结论:miR-145通过抑制Bcl-2和P-gp蛋白的表达来增加MCF-7/ADR细胞对阿霉素的敏感性和凋亡。
乳腺癌是女性最常见的恶性肿瘤之一,严重威胁女性的生活质量和身心健康。以阿霉素为代表的药物联合化疗是乳腺癌辅助化疗及姑息化疗的标准治疗方案,但是晚期乳腺癌患者的预后仍不容乐观,其治疗失败的原因之一就是化疗耐药的出现[1-2]。miRNA是一组由18~25个核苷酸组成的微小非编码RNA,在真核生物中具有高度保守性,它通过与靶基因的3’非翻译区互补结合,导致靶基因降解或抑制靶基因转录,从而在生物体发育、细胞分化、凋亡及肿瘤形成等多种生理及病理过程中发挥着重要的作用[3-4]。新近的多个研究均显示miRNA参与调解肿瘤化疗药物敏感性,同时有研究对乳腺癌组织和癌旁组织的基因芯片结果进行分析,发现miRNA在乳腺癌组织中表达明显低于癌旁组织,表明miR145作为抑癌基因能够抑制乳腺癌细胞的增殖、侵袭和转移[5]。本实验旨在研究miR-145对乳腺癌阿霉素耐药细胞株MCF-7/ADR耐药的影响,并探索可能的作用机制。
材料与方法
1 材 料 人乳腺癌阿霉素耐药细胞株MCF-7/ADR(南京凯基生物科技公司);阿霉素(江苏豪森药业);miR-145 mimics 和inhibitor(上海吉玛制药技术有限公司);miR-145引物(Takara公司);RPMI1640培养基(美国GIBCO公司);胎牛血清(以色列Biological Industries公司);噻唑兰(MTT)(美国Sigma公司);Annexin V-APC/7-AAD双染凋亡试剂盒(深圳晶美生物公司);二甲基亚砜(DMSO)(美国Sigma公司);逆转录试剂盒、实时定量PCR试剂盒(Takara公司),Bcl-2抗体、P-gp抗体(美国Cell Signal公司),Trizo试剂、脂质体(Lipfectamin2000)(美国Invitrogen公司)
2 实验方法 ①细胞培养:人乳腺癌细胞株MCF-7、耐药细胞株MCF-7/ADR分别用含10%胎牛血清的PRMI1640培养液,置于37 ℃、5% CO2培养箱中培养,在MCF-7/ADR细胞株的培养液中加入终浓度为1 μg/ml的阿霉素以保持其耐药性。②实时定量PCR(qRT-PCR)检测miR145的表达差异:分别收集MCF-7细胞和MCF-7/ADR细胞,用Trizol提取细胞总RNA,对其进行反转录,cDNA合成过程中采用miR-145 RT特异性颈环引物构建反转录体系,反应条件为:37 ℃,40 min,85 ℃,5 s。采用 SYBR Green 法,以cDNA为模板,利用miR-145 特异性引物进行PCR扩增。 PCR 反应条件为:95℃ 30 s,95℃ 5 s,60℃ 30 s,72℃ 10 s 共 40 个循环。miR145相对表达量采用2-ΔΔCt方法进行计算,ΔΔCt=ΔCtMCF-7/ADR-ΔCtMCF-7,ΔCt=CtmiR-145-CtU6。③细胞转染:MCF-7细胞和MCF-7/ADR细胞分别接种于6孔板。依据脂质体 Lipofectamine 2000的说明书,将100 nmol/L miR-145 mimics、inhibitor及其各自的阴性对照分别转染到MCF-7及MCF-7/ADR细胞中。④MTT法检测转染后细胞对阿霉素敏感性:上述细胞转染24 h后分别接种于96 孔板(5×103/孔,100 μl/孔)。待细胞贴壁后,分别加入终浓度为:5、10、20、40、80 μg/ml的阿霉素,100 μl/孔,每组6个复孔,将与实验组中含有最大浓度DMSO的培养液为空白对照组,不含细胞的无血清培养基为调零孔,培养48 h后每孔加入MTT溶液(浓度为5 mg/ml)10 μl,继续培养4 h后终止培养,小心吸去上清,每孔加入150 μl DMSO溶液,振荡 10 min以充分溶解结晶物,用酶标仪检测490 nm波长处各孔的OD值,所有实验均重复3次。实验结束后计算细胞生长抑制率及阿霉素的IC50值。细胞生长抑制率=(对照组吸光度-实验组吸光度)/对照组吸光度×100%,应用SPSS 软件计算阿霉素对细胞的半数抑制浓度(IC50)。⑤ Western blot检测Bcl-2和P-gp的表达差异:MCF-7细胞及MCF-7/ADR细胞分别接种于6孔板内(6×105/孔),将miR-145 mimics及其阴性对照组分别转染至MCF-7/ADR细胞中,培养72 h后提取MCF-7细胞、MCF-7/ADR细胞及转染后MCF-7/ADR细胞总蛋白,BCA法测定蛋白质浓度,10%聚丙烯酰胺凝胶电泳分离蛋白质,通过转膜、脱脂奶粉封闭,一抗(1∶1000)4 ℃孵育过夜,二抗(1∶5000)室温孵育2 h,应用ECL化学发光试剂显色,凝胶成像系统成像,Image J软件对图像进行灰度分析,以GAPDH为内参。⑥流式细胞仪检测细胞凋亡:MCF-7/ADR细胞接种于6孔板(6×105/孔),将miR-145 mimics及其阴性对照组分别转染至MCF-7/ADR细胞中,培养24 h后每孔加入阿霉素药物终浓度为10 μg/ml,常规培养48 h后终止培养,按照Annexin V-FIFC试剂盒操作方法,运用流式细胞仪进行细胞凋亡检测。
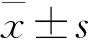
结 果
1 miR-145在MCF-7和MCF-7/ADR中的表达差异 见图1。qRT-PCR 结果显示与母代细胞株MCF-7比较,miR-145 在阿霉素耐药细胞株MCF-7/ADR中的表达量降低,平均下调倍数为 3.84(P<0.05)。
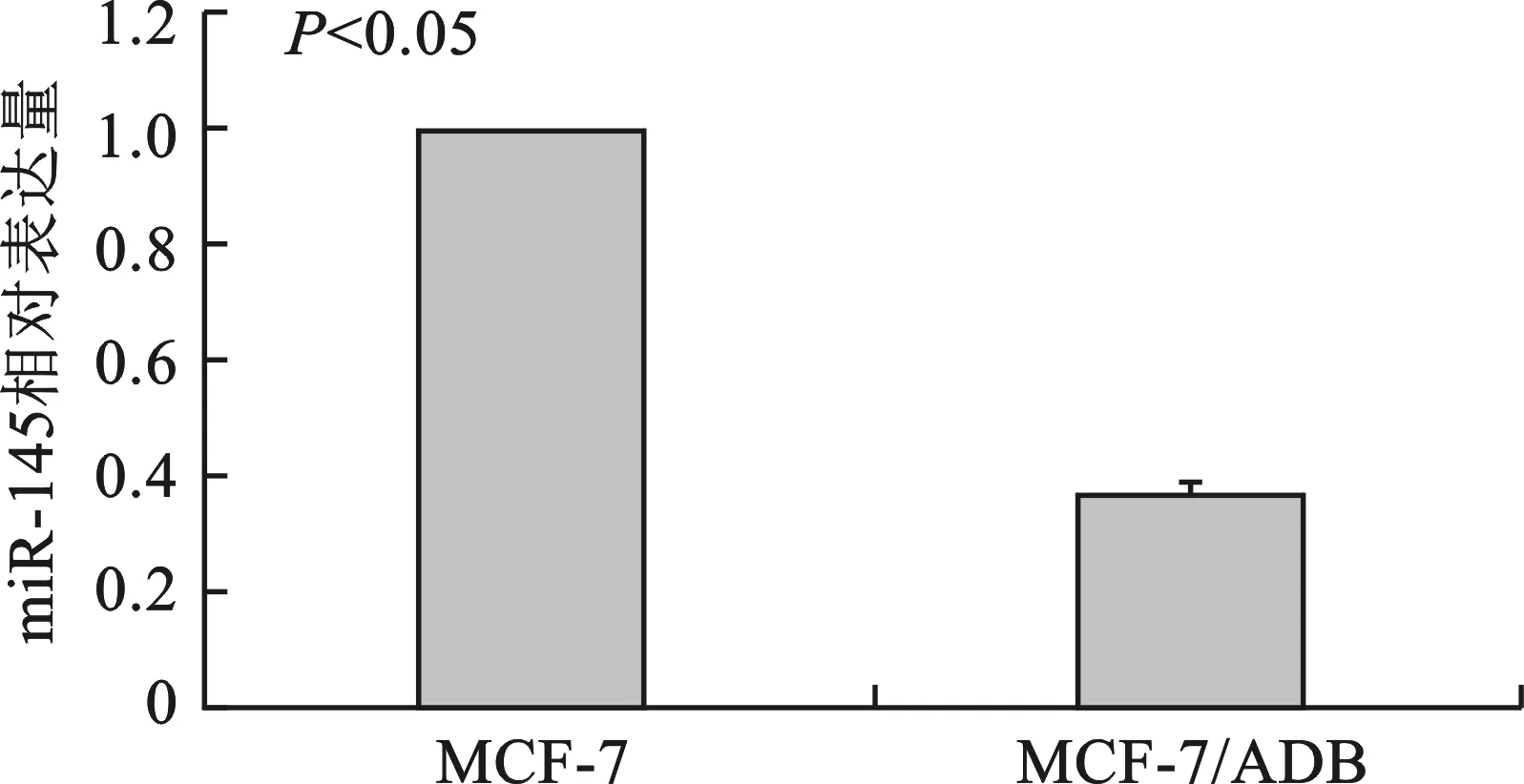
图1 miR-145在乳腺癌阿霉素耐药细胞株MCF-7/ADR中呈低表达
2 miR-145调节MCF-7及MCF-7/ADR细胞株对阿霉素的耐药性 MTT结果显示,在转染前,MCF-7/ADR细胞株对阿霉素的耐药性已得到验证(P<0.05)(图2)。与阴性对照组对比,转染miR-145 mimics明显增加了MCF-7/ADR细胞对阿霉素的药物敏感性(P<0.05)(图3)。相反,转染miR-145 inhibitor较其阴性对照组而言,显著增加了MCF-7细胞对阿霉素的耐药性(P<0.05)(图4)。

图2 MCF-7/ADR细胞对阿霉素的耐药性明显增加
3 miR-145对MCF-7/ADR细胞中Bcl-2和P-gp蛋白表达的影响 与母代细胞MCF-7比较,Bcl-2和P-gp蛋白表达量在耐药细胞MCF-7/ADR中显著增加(P<0.05)(图5)。在MCF-7/ADR细胞中转染miR-145 mimics及其阴性对照组72 h后,Western blot实验结果显示:实验组中Bcl-2及P-gp蛋白表达较对照组中显著降低(P<0.05)(图6)。
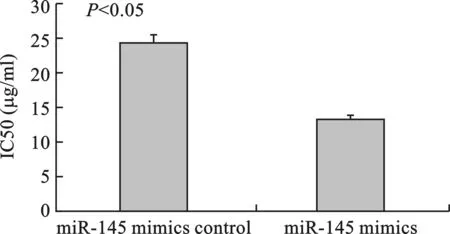
图3 转染miR-145mimics显著增加MCF-7/ADR细胞对阿霉素的敏感性
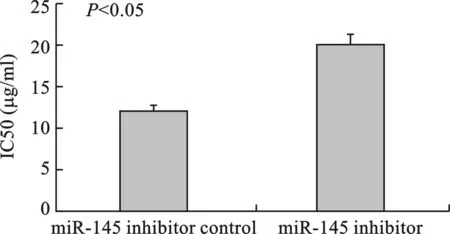
图4 转染miR-145 inhibitor显著增加MCF-7细胞对阿霉素的耐药性
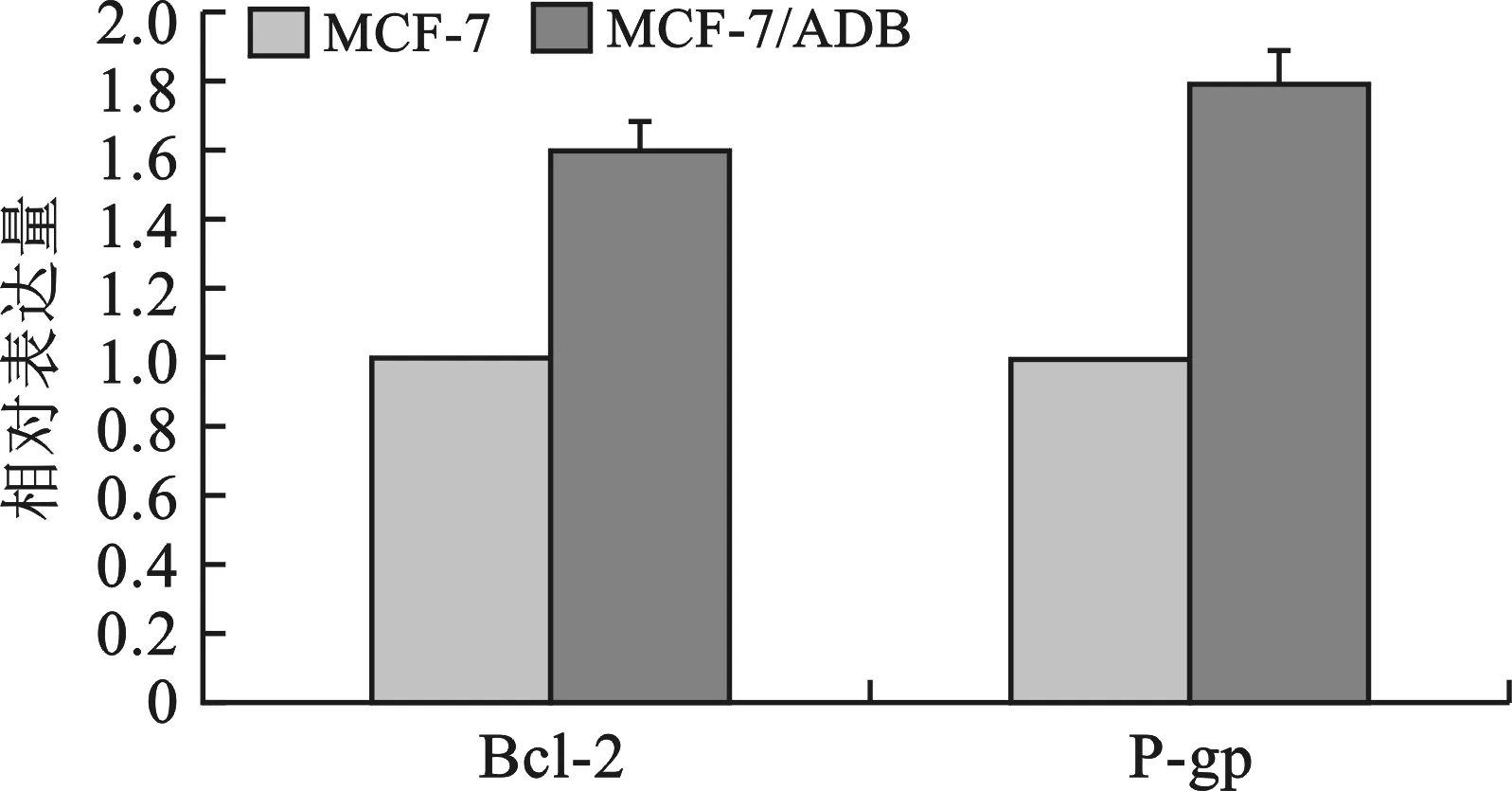
图5 Bcl-2和P-gp蛋白在MCF-7/ADR细胞中表达量较MCF-7细胞明显升高
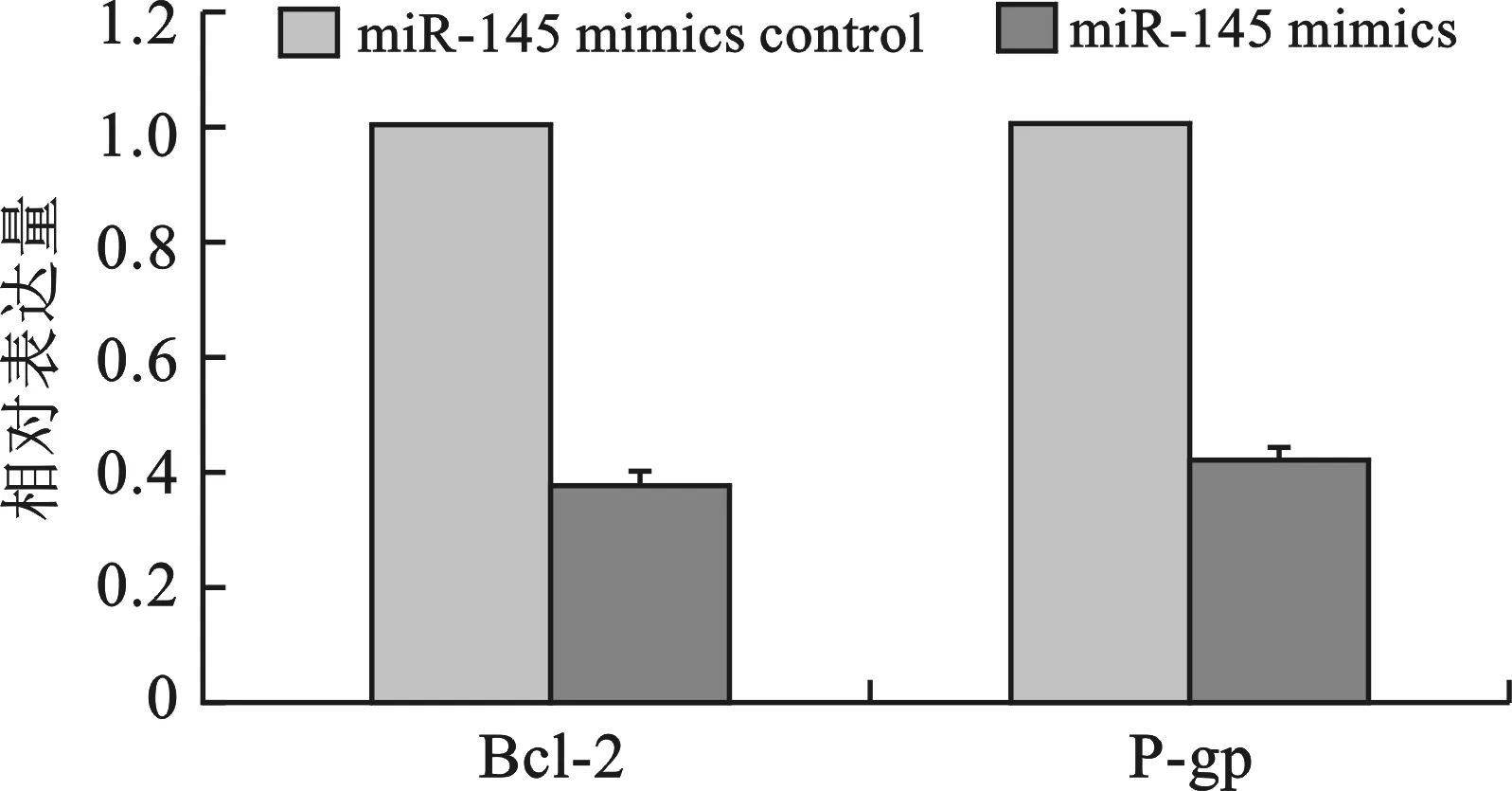
图6 Bcl-2和P-gp蛋白在转染miR-145 mimics 72 h后的MCF-7/ADR细胞中表达量较对照组明显下降
4 miR-145增强阿霉素诱导的MCF-7/ADR细胞凋亡 流式细胞仪检测结果显示,相对于阴性对照组,转染miR-145mimics的MCF-7/ADR细胞对阿霉素诱导的细胞凋亡明显增多(P<0.05)(图7)。提示miR-145明显增加了MCF-7/ADR细胞对阿霉素诱导凋亡的敏感性。
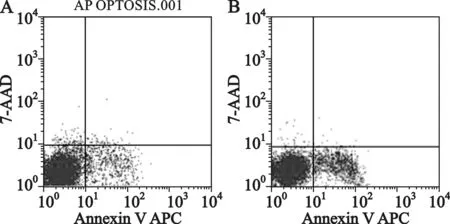
A:miR-145 mimics阴性对照组;B:miR-145 mimics组
图7 miR-145增强阿霉素诱导的MCF-7/ADR细胞凋亡
讨 论
作为非编码RNA的一种,miRNA因其在肿瘤的发生、发展中的重要作用而受到广泛的关注和重视。多项相关研究均显示出不同miRNA的表达异常与肿瘤化疗药物耐药之间存在密切相关性[6-7]。阿霉素是临床上使用广泛的一种化疗药物,应用在包括乳腺癌在内的多种实体瘤及淋巴瘤患者治疗的各个阶段,但是由于原发性及继发性耐药的发生,常常导致化疗失败。目前研究认为化疗耐药的产生机制复杂,与多种基因的表达和功能异常相关,其中包括细胞周期蛋白、凋亡调节蛋白、调节药物代谢和转运的相关分子、某些基因突变以及各种药物的靶蛋白等有关[8]。研究发现miR-145在多种肿瘤细胞中(乳腺癌、卵巢癌、肺癌、胃癌、前列腺癌、宫颈癌、结肠癌、膀胱癌、子宫内膜癌)均显示出比癌旁组织较低的表达水平,能够抑制肿瘤细胞的生长,充当抑癌基因的功能[9]。Chen等[10]发现,miR-145在非小细胞肺癌中的表达与癌旁组织相比较,其表达明显降低,在肺癌细胞系A549中,miR-145表达也明显下降,提示其作为肿瘤标志物的可能性,尤其是在肿瘤发展的较早时期。生物信息学软件分析及相关研究已经验证miR-145可调控多个靶基因:ErbB、IRS-1、IGF-IR、EGFR、STAT1、MUC-1、BCL2、CDK6等,我们的研究正是在这样的研究背景下对乳腺癌阿霉素耐药细胞株中的miR-145进行干预,发现上调miR-145后耐药细胞的凋亡率明显升高,Bcl-2显著下降,提示miR-145是通过靶向Bcl-2来实现上述功能,这与生物信息学软件预测结果相一致。
P-gp是多药耐药基因MDR1的表达产物,它具有能量依赖性“药泵”功能,通过与药物及ATP相结合,将细胞内药物泵出细胞外,有效减少细胞内的药物浓度,从而使肿瘤细胞产生耐药性。本研究中,与MCF-7细胞相比较,P-gp在MCF-7/ADR细胞中表达明显升高,差异具有统计学意义,由此可见P-gp表达增加是阿霉素耐药产生的可能机制,我们进一步比较了MCF-7/ADR细胞中转染miR-145 mimics及其阴性对照组的结果,发现P-gp在实验组中的表达显著降低,提示miR-145可能通过下调P-gp蛋白的表达来逆转阿霉素诱导的耐药。
综上所述,关于miR-145的研究目前大多数还停留在表达谱阶段,miR-145与靶基因之间的作用机制以及在多种癌细胞中下调的具体机制尚不清楚,其在肿瘤耐药中的作用还需更多深入的研究予以确认。本研究证明了miR-145在乳腺癌阿霉素耐药细胞株中呈低表达,在耐药细胞株中上调其表达可以逆转阿霉素耐药,其作用机制可能是通过调节细胞中BCL-2和P-gp的表达而产生。这与以往我们对肿瘤化疗耐药的机制认识有差别,为逆转乳腺癌阿霉素耐药治疗提供新的研究思路及潜在靶点。
[1] Chen W,Zheng R,Zhang S,etal.Annual report on status of cancer in China 2010[J].Chin J Cancer Res,2014,26(1):48-58.
[2] 徐 川,于小伟,李莎罗,等. 益气健脾汤联合化疗对乳腺癌生活质量和免疫功能的影响[J].陕西中医,2016,37(9): 1160-1161.
[3] Kala R,Peek GW, Hardy TM,etal. MicroRNAs: an emerging science in cancer epigenetics[J].J Clin Bioinforma,2013,3(1):6.
[4] Gurtan AM, Sharp PA.The role of miRNAs in regulating gene expression networks[J].J Mol Biol,2013,425(19):3582-600.
[5] 赵晓艾,胡金华,赵新汉.Hsa-miRA-145对人三阴性乳腺癌细胞侵袭和迁移的影响[J].中华临床医师杂志,2012,6(15):4276-4279.
[6] 陈双江,王 铮,姚英民,等. miRNA-106a在肝癌中的表达及其作用[J].陕西医学杂志,2014,43(2): 139-142.
[7] Zhu W, Xu H, Zhu D,etal.miR-200bc/429 cluster modulates multidrug resistance of human cancer cell lines by targeting BCL2 and XIAP[J].Cancer Chemother Pharmacol,2012 ,69(3):723-731.
[8] Ru P, Steele R, Hsueh EC,etal.Anti-miR-203 upregulates SOCS3 expression in breast cancer cells and enhance cisplatin chemosensitivity[J].Genes Cancer,2011,2(7):720-727.
[9] Yan X,Chen X,Liang H,etal.miR-143 and miR-145 synergistically regulate ERBB3 to suppress cell proliferation and invasion in breast cancer[J].Mol Cancer,2014,24(13):220.
[10] Chen ZI,Zeng H, Guo Y,etal.miRNA-145 inhibits non-small cell lung cancer cell proliferation by targeting c-Myc[J].J Exp Clin Cancer Res,2010,22(29):151.
(收稿:2016-11-17)
Mechanism of miR-145 on regulating adriamycin resistance of human breast cancer cell line MCF-7/ADR
An Gaili,Hou Lei,Li Xu,et al.
Department of Oncology,Shaanxi Provincial People’s Hospital(Xi’an 710068)
Objective:To investigate whether miR-145 could modulate the adriamycin resistance of the human breast cancer cell line MCF-7/ADR, and to explore the probable mechanism.Methods:miR-145 expression was measured by quantitative real-time PCR.Transient transfection was used in MCF-7 and MCF-7/ADR cell lines.MTT was used to detect the cell viability.Flow cytometry was used to testify the adriamycin-induced cell apoptosis. Protein expressions of BCL-2 and P-gp were measured by western blot. Results:We found that miR-145 was down-regulated while Bcl-2 and P-gp were up-regulated in MCF-7/ADR cells compared with the parental MCF-7 cells. In vitro drug sensitivity assay demonstrated that the over-expression of miR-145 sensitized MCF-7/ADR cells to adriamycin. Enforced miR-145 expression reduced the protein level of Bcl-2 and P-gp and sensitized MCF-7/ADR cells to adriamycin-induced apoptosis.Conclusion:Our study demonstrated that hsa-miR-145 can modulate adriamycin resistance in breast cancer cell line and induce cell apoptosis partly via targeting Bcl-2 and P-gp.
Breast neoplasms P-Glycoprotein Gene expression regulation,neoplastic @miR-145 @Adriamycin resistance
乳腺肿瘤 P-糖蛋白 基因表达调控,肿瘤 @miR-145 @阿霉素耐药
R737.9
A
10.3969/j.issn.1000-7377.2017.06.005
