基于MOCPs-MWCNTs的大肠杆菌电化学免疫传感器
2017-06-27徐霞红郭玉娜肖英平
杨 华 徐霞红 郭玉娜 肖英平 唐 标 王 强
(浙江省农业科学院农产品质量标准研究所, 杭州 310021)
基于MOCPs-MWCNTs的大肠杆菌电化学免疫传感器
杨 华 徐霞红 郭玉娜 肖英平 唐 标 王 强
(浙江省农业科学院农产品质量标准研究所, 杭州 310021)
食源致病菌引起的食品安全问题已成为全世界关注的焦点。设计了一种基于多壁碳纳米管(MWCNTs)-有机配位聚合物(MOCPs)高效固定抗体的大肠杆菌电化学免疫传感器。利用NaAuCl4与1,4-苯二硫醇(BDT)反应生成金属有机配位聚合物,同时在BDT的还原作用下生成大量纳米金,并包埋大量吸附在MWCNTs表面的大肠杆菌抗体,最终将抗体高效包埋在MOCPs-MWCNTs中,基于MOCPs-MWCNTs固定抗体研制修饰电极,在目标物大肠杆菌O157:H7的存在下,辣根过氧化氢酶标记的抗体(HRP-Ab)随后特异性捕获于电极表面形成典型夹心结构,通过HRP催化底物产生电化学信号从而实现大肠杆菌O157:H7的检测。MOCPs-MWCNTs特有的高比表面积高效固定了大量抗体,增加了传感器结合抗体的效率并提高了传感器的灵敏度。该传感器对大肠杆菌O157:H7的检测线性范围为67~6.7×106cfu/mL,最低检出限为40 cfu/mL。
大肠杆菌O157:H7; 金属有机配位聚合物; 多壁碳纳米管; 电化学免疫传感器
引言
细菌污染是威胁人类健康的最严峻食品安全问题之一[1-2]。在众多的食源性致病菌中,大肠杆菌O157:H7是危害最大的致病菌之一,可引起严重的食源性疾病,甚至导致死亡[3]。传统的大肠杆菌定量方法如平板计数法大多基于微生物培养技术,通常至少需要2~3 d才能获得准确结果,难以满足农产品监管需求。目前,基于聚合酶链式反应(PCR)[4]、化学发光[5]、石英晶体微天平(QCM)[6]、酶联免疫吸附检测(ELISA)[7]等技术发展了多种大肠杆菌快速检测方法,但在灵敏度、稳定性、现场监测能力上难以同时满足需求。因此,迫切需要开发新方法用于高灵敏、高特异性检测大肠杆菌O157:H7。
免疫测定法是基于抗原与抗体的高特异性识别来实现对抗原或抗体的定量分析方法,由于能避免复杂前处理过程以及具有高灵敏性和特异性响应,被认为是生物分析法和临床的一个非常强大的工具[8-9]。而电化学免疫传感器检测(EIA)凭借检测速度快、兼容性好、成本低、易小型化等优点引起广大研究者关注[10]。抗体的固定是决定电化学免疫传感器性能的关键步骤之一,研制高效固定材料,最大量将抗体修饰在电极表面是亟待解决的问题。
金属有机配位聚合物(MOCPs)是由金属离子(或金属氧簇)与有机物配体通过自组装相互连接构筑具有规则孔道或孔穴结构的框架材料[11]。MOCPs作为一种新型微孔材料,具有丰富的拓扑结构和多孔性[12-13],近年来,在气体储存[14]、化学分离[15]、传感[16]、催化[17]和药物释放与传送[17-18]等领域广泛应用。另一方面,碳纳米管(CNTs)由于独特的导电性、高比表面积及强吸附能力,是生物分子高效固定的最佳选择之一[19-20]。结合MOCPs及CNTs性能,研制高效固定抗体基质材料具有重要的价值。
本文引入高比表面积的多壁碳纳米管(MWCNTs)与MOCPs作为抗体固定基质,采用1,4-苯二硫醇(BDT)单体与NaAuCl4配位,快速配位过程中包埋大量吸附在MWCNTs上的抗体,在此基础上制备大肠杆菌O157:H7抗体修饰电极,以发展更高效灵敏的EIA方法,并研究其在牛奶实际样品中的应用。
1 原理
图1为电化学免疫传感器的构建过程,图2为构建的传感器通过HRP催化底物产生的电化学信号图。MOCPs-MWCNTs固定基质的制备过程如图1a所示。NaAuCl4与BDT反应生成金属有机配位聚合物,同时在BDT的还原作用下生成大量纳米金,并包埋大量吸附在MWCNTs表面的大肠杆菌抗体,将抗体高效包埋在MOCPs-MWCNTs中。基于免疫传感技术高灵敏、高选择性检测大肠杆菌O157:H7的新型电化学传感器实验原理如图1b所示,制备的MOCPs-MWCNTs修饰于金电极的表面,不仅能够增强电子传递效率,还能够通过嵌入方式增加捕获抗体(Ab)的固定效率与稳定性。BSA修饰到电极表面用于封闭未特异性结合位点并减少非特异性吸附。当电极在大肠杆菌O157:H7菌液中孵育后,采用HRP标记抗体(HRP-Ab)再次特异性结合电极表面的大肠杆菌,通过HRP催化检测底液中的过氧化氢(H2O2)和对苯二酚(HQ),记录催化产物对苯二醌的电化学信号从而实现对大肠杆菌的定量检测。

图2 传感器的电化学响应图Fig.2 Typical DPV responses of biosensor
2 试验
2.1 仪器及试剂
SU8010型场发射扫描电子显微镜,日立高新技术公司;FEI Tecnai G2 F20 S-TWIN型场发射透射电子显微镜,美国FEI公司;PANalyticalX’Pert PRO型X射线衍射仪,荷兰PANalytical公司;Primo R型低温冷冻离心机,美国热电公司;CHI660E型电化学工作站,上海辰华仪器有限公司;SCILOGEX MX-S型旋涡混合器,美国赛洛捷克公司。
大肠杆菌O157:H7抗体以及辣根过氧化物酶标记的大肠杆菌O157:H7抗体(HRP标记的抗体)购自上海般若生物技术有限公司。大肠杆菌O157:H7、沙门氏菌、大肠杆菌DH5α和大肠杆菌O149由北京北纳创联生物技术研究院提供。MWCNTs(长度10~20 μm, 纯度95%以上)购于南京先丰纳米材料科技有限公司。BDT、HAuCl4·3H2O和HQ购自美国Sigma公司,H2O2、磷酸氢二钠和磷酸二氢钠均为分析纯,购于上海国药集团。牛奶购自当地超市。
2.2 MOCPs与MWCNTs-MOCPs的合成
MWCNTs-MOCPs合成步骤如下:将60 μL(1 mg/mL)MWCNT与60 μL NaAuCl4(0.05 mol/L)于超声条件下加入至1 mL PBS(pH值7.0)中,搅拌2 h,然后加入600 μL 1 mg/mL BDT和4 mg大肠杆菌O157:H7捕获抗体。将混合物搅拌10 min 后形成嵌有抗体的MWCNTs-MOCPs复合材料。MOCPs的合成方法除未加入MWCNT外与MWCNTs-MOCPs合成方法一致。最后将所制备的生物复合物悬浮液离心分离,沉淀物洗涤3次,分散在200 μL水中低温保存。
2.3 传感器制备
大肠杆菌采用LB培养基(蛋白胨12 g、酵母提取物6 g和NaCl 7 g)培养24 h,将悬浮液贮存于4℃备用。大肠杆菌O157:H7的浓度通过平板计数确定。免疫传感器的构建使用典型的免疫夹心步骤。6 μL的MWCNTs-MOCPs孵育修饰于电极表面,室温下干燥2 h后用10 mmol/L的PBS清洗,然后修饰5%的BSA封闭电极,制得MWCNTs-MOCPs修饰电极。
2.4 免疫分析大肠杆菌O157:H7
所制MWCNTs-MOCPs修饰电极表面滴加10 μL不同浓度大肠杆菌O157:H7的溶液,在37℃下孵育60 min后用PBS小心洗涤。随后将10 μL的0.5 mg/mL HRP标记抗体溶液滴加在电极表面,37℃孵育60 min后经PBS小心洗涤3次,将电极浸入到检测底液中进行电化学测量。电化学测量采用传统三电极体系,Ag/AgCl为参比电极,铂电极为辅助电极,金电极(直径3 mm)为工作电极。电化学分析方法包括差分脉冲伏安法(DPV)和循环伏安法(CV)均在室温(20℃)进行。DPV扫描范围-0.2~0.2 V,底液为含3 mmol/L HQ和1.5 mmol/L H2O2的10 mmol/L PBS(pH值7.4),脉冲高度为50 mV,阶梯高度4 mV,频率15 Hz。CV扫描范围-0.2~0.6 V,扫描速率为50 mV/s,底液为含5.0 mmol/L K3[Fe(CN)6]的10 mmol/L PBS。
2.5 实际样品检测
为检验该传感器是否可应用于实际样品检测,采用牛奶进行验证实验,样品除以PBS稀释外无其他前处理步骤。均分3份,分别添加6.7×102、6.7×103、6.7×104cfu/mL的大肠杆菌,其余实验条件保持一致(如2.3、2.4节)。
3 结果与讨论
3.1 MOCPs与MWCNTs-MOCPs的表征
3.1.1 扫描电子显微镜(SEM)表征
用SEM表征MOCPs与MWCNTs-MOCPs的微观形态和结构。如图3a所示,发现了MOCPs的微观片状结构,当电极表面修饰MWCNTs-MOCPs后,可以清晰看到MWCNTs包裹在MOCPs中(图3b),这充分证明MOCPs与MWCNTs-MOCPs都已经制备完成。

图3 MOCPs与MWCNTs-MOCPs的SEM表征Fig.3 SEM images of MOCPs and MWCNTs-MOCPs
3.1.2 透射电子显微镜(TEM)表征
为进一步研究MOCPs与MWCNTs-MOCPs的微观形态,对其进行了TEM表征,其结果如图4所示。MOCPs大小分布均匀,可观察到大量纳米金在聚合物内形成(图4a)。当加入MWCNTs时,MOCPs增加了MWCNTs的管径厚度,并有大量的纳米金和生物聚合物吸附在MWCNTs表面,进一步证明了MOCPs与MWCNTs-MOCPs的成功制备。
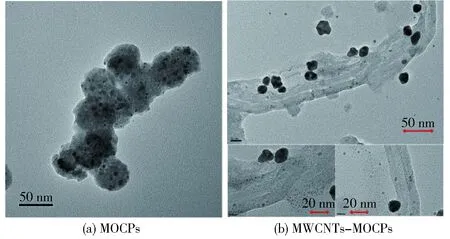
图4 MOCPs与MWCNTs-MOCPs的TEM表征Fig.4 TEM images of MOCPs and MWCNTs-MOCPs
3.1.3 X单晶衍射(XRD)表征
为研究MOCPs与MWCNTs-MOCPs的结晶情况,对其进行了XRD表征,其结果如图5所示。图中2θ表示X射线衍射角度。可以看出XRD谱图峰型较好,有结晶出现,与金的标准峰相比,MOCPs与MWCNTs-MOCPs都含有金。同时该表征也进一步证明了MOCPs与MWCNTs-MOCPs已成功合成。

图5 MOCPs与MWCNTs-MOCPs的XRD表征Fig.5 XRD patterns of MOCPs and MWCNTs-MOCPs

图6 传感器的CV 和EIS 表征Fig.6 CV and EIS of EIA sensor
3.2 电极组装的电化学表征
电极表面的层层组装是传感器构建的重要步骤,用CV表征了电极的构建过程,如图6所示。裸金电极(曲线a)出现一对标准氧化还原峰(0.26 mV和0.18 mV),分别对应了K3[Fe(CN)6]的特征氧化还原峰,当电极修饰了MWCNTs-MOCPs后,氧化还原峰出现微小的降低,可能是由于MWCNTs-MOCPs对电子传递效率的促进与抗体对电子传递速率阻碍的双重作用导致的(曲线b),随着大肠杆菌O157:H7的修饰,化学信号再次降低,这同时也证明了大肠杆菌已经修饰到电极表面(曲线c)。当HRP-Ab修饰后,可以观察到生物大分子对电子传
递速率的阻碍减小了电化学信号(曲线d)。图6b描绘了修饰电极过程中相对应的修饰电极交流阻抗(EIS)变化,图中Z′、-Z″分别表示实部和虚部。裸金电极的阻抗几乎为直线(曲线a)。而阻抗(半圆的直径)随MWCNTs-MOCPs(曲线b)、大肠杆菌(曲线c)、HRP-Ab(曲线d)逐步修饰在电极表面而增大,结果与CV一致。上述结果表明大肠杆菌电化学免疫传感器已成功制备。
3.3 大肠杆菌检测
采用该生物传感器测定一系列不同浓度的大肠杆菌O157:H7。图7a给出了对于梯度浓度大肠杆菌O157:H7的电化学响应。发现在所测菌体浓度范围内电化学响应随大肠杆菌浓度增大而提高,当菌体浓度大于6.7×106cfu/mL时,DPV响应不再随大肠杆菌浓度增高而增大。且DPV响应与大肠杆菌菌体浓度的对数存在线性关系(图7b),关系式为I=3.672lgCE. coli-4.138,线性相关系数为0.997,最低检测限为40 cfu/mL。
3.4 传感器性能

图7 传感器的标准曲线Fig.7 Calibration curves of EIA sensor
同时采用非目标细菌(如沙门氏菌、大肠杆菌DH5α和大肠杆菌O149),研究了此电化学免疫传感器的特异性。该电化学免疫传感器对大肠杆菌O157:H7的电流响应值为21.5 μA,而其他菌体的电流响应值均在2.7 μA左右,并未对检测体系产生明显的干扰作用,这表明该电化学免疫传感器对大肠杆菌O157:H7表现出极好的特异性。同时,为探讨生物传感器的重现性,5根相同修饰过程的电极分别用来测定6.7×104cfu/mL大肠杆菌O157:H7,根据检测结果计算出相对标准偏差为3.73%,表明该电化学免疫传感器具有很好的重现性。此外还探究了该传感器的稳定性,5根独立电极采用相同条件制备,于4℃储存14 d,检测最终信号约为最初信号的92%。表明该电化学免疫传感器具有很好的稳定性。
3.5 实际样品分析
为进一步考察该传感器的应用潜力,采用标准添加法,探讨了牛奶实际样品中的检测性能。将菌体浓度为6.7×102、6.7×103、6.7×104cfu/mL的大肠杆菌O157:H7添加到3个牛奶样品中,样品除了PBS缓冲液稀释没有更多的预处理。实际样品的检测结果如表1所示。该电化学免疫传感器所得的回收率范围在94.5%~103.3%之间。此外,将经典的平板计数法与该传感器的结果进行了对比,差距小于12.4%。上述实验结果表明该电化学免疫传感器在实际应用中具有很大的潜力。
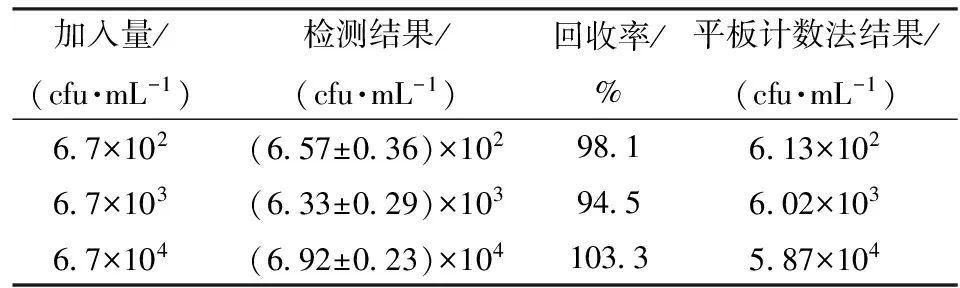
表1 实际样品分析
4 结束语
设计了一个基于MWCNTs-MOCPs高效固定抗体的大肠杆菌O157:H7电化学免疫传感器。对MOCPs及MWCNTs-MOCPs进行了SEM、TEM、XRD表征,证实了MOCPs及MWCNTs-MOCPs的成功制备。并将此MWCNTs-MOCPs材料用于抗体的固定基质成功修饰在电极表面,制备灵敏的大肠杆菌电化学传感器,MWCNTs-MOCPs不仅可以加速电极界面上的电子转移速率,还包埋了大量大肠杆菌O157:H7抗体,提高了抗体修饰效率及稳定性。同时,使用经典夹心型免疫方法,实现了67~6.7×106cfu/mL大肠杆菌的定量测定。此外,该传感器也被用于分析大肠杆菌O157:H7实际样品,检测结果与平板计数法一致。
1 SEYEDSAYAMDOST M R, CARR G, KOLTER R, et al.Roseobacticides: small molecule modulators of analgal-bacterial symbiosis[J]. Journal of the American Chemical Society, 2011, 133(45): 18343-18349.
2 张秋婷, 林素丽, 朱松明, 等. 超高压与微酸性电解水结合对鲜切果蔬的杀菌效果研究[J/OL].农业机械学报,2017, 48(3): 338-343.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20170343&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2017.03.043. ZHANG Qiuting, LIN Suli, ZHU Songming, et al. Combined effect of high pressure and slightly acidic electrolyzed water on sterilization fresh cut fruits and vegetables[J/OL]. Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(3): 338-343. (in Chinese)
3 郭建江, 张荣标,杨宁, 等. 基于磁控分离的水产致病菌微流控检测方法[J/OL].农业机械学报, 2015, 46(4): 277-281.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20150441&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2015.04.041. GUO Jianjiang, ZHANG Rongbiao, YANG Ning, et al.Aquaculture pathogens detection based on microfluidic system with magnetic isolation[J/OL].Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(4): 277-281.(in Chinese)
4 LEEH J, KIMB C, KIMK W, et al. A sensitive method to detectEscherichiacolibased on immunomagnetic separation and real-time PCR amplification of aptamers[J]. Biosensors and Bioelectronics, 2009, 24(12): 3550-3555.
5 ZHANG Y,TAN C,FEI R, et al. Sensitive chemiluminescence immunoassay forE.coliO157:H7 detection with signal dual-amplification using glucose oxidase and laccase[J]. Analytical Chemistry, 2014, 86(2): 1115-1122.
6 MA F, REHMAN A, LIU H, et al. Glycosylation of quinone-fused polythiophene for reagentless and label-free detection ofE.coli[J]. Analytical Chemistry, 2015, 87(3): 1560-1568.
7 PRIS A D, MONDELLO F J ,WROCZYNSKI R J, et al. Improved specific biodetection with ion trap mobility spectrometry (itms): a 10-min, multiplexed, immunomagnetic ELISA[J]. Analytical Chemistry, 2009, 81(24): 9948-9954.
8 杨威, 左月明,吴海云, 等. 布鲁氏菌抗体的无标记电流型免疫传感器检测[J/OL]. 农业机械学报, 2014, 45(3): 243-248.http:∥www.j-csam.org/jcsam/ch/reader/view_abstract.aspx?flag=1&file_no=20140340&journal_id=jcsam. DOI:10.6041/j.issn.1000-1298.2014.03.040. YANG Wei, ZUO Yueming, WU Haiyun, et al.Label-free amperometic immunosensor for detection of brucella antibody[J/OL]. Transactions of the Chinese Society for Agricultural Machinery,2014, 45(3): 243-248. (in Chinese)
9 SHIIGI H, KINOSHITA T, FUKUDA M, et al. Nanoantennas as biomarkers for bacterial detection[J]. Analytical Chemistry, 2015, 87(7): 4042-4046.
10 GUO Y, WANG Y, LIU S, et al.Label-free and highly sensitive electrochemical detection ofE.colibased on rolling circle amplifications coupled peroxidase-mimicking DNAzyme amplification[J]. Biosensors and Bioelectronics, 2016, 75: 315-319.
11 殷卫峰,欧植泽,高云燕, 等. 新型纳米多孔材料-金属有机配位聚合物的包结作用及其应用研究进展[J]. 材料导报, 2010, 24(5): 50-54. YIN Weifeng, OU Zhize, GAO Yunyan, et al. Research progress in the inclusion behavior and the application of metal-organic coordination polymers[J]. Materials Review, 2010, 24(5): 50-54. (in Chinese)
13 幸良淑, 杨明莉, 张新涛, 等. 金属-有机配位聚合物在催化性能上的研究进展[J]. 材料科学与工程学报, 2008, 26(3): 489-492. XING Liangshu, YANG Mingli, ZHANG Xintao, et al.Progress in catalytic metal-organic coordination polymers[J]. Journal of Materials Science & Engineering, 2008, 26(3): 489-492. (in Chinese)
14 SONG K S, KIM D, POLYCHRONOPOULOU K, et al. Synthesis of highly porous coordination polymers with open metal sites for enhanced gas uptake and separation[J]. ACS Applied Materials & Interfaces, 2016, 8(40): 26860-26867.
15 FU Y, LI P, BU L, et al. Exploiting metal-organic coordination polymers as highly efficient immobilization matrixes of enzymes for sensitive electrochemical biosensing[J].Analytical Chemistry,2011, 83(17): 6511-6517.
16 WANG C, ZHENG M, LIN W. Asymmetric catalysis with chiral porousmetal-organic frameworks: critical issues[J]. The Journal of Physical Chemistry Letters, 2011, 2(14): 1701-1709.
17 CUNHA D, YAHIAM B, HALL S, et al. Rationale of drug encapsulation and release from biocompatible porous metal-organic frameworks[J]. Chemistry of Materials,2013, 25(14): 2767-2776.
18 ZHUANG J, KUO C H, CHOU L Y, et al. Optimized metal-organic-framework nanospheres for drug delivery: evaluation of small-molecule encapsulation[J]. ACS NANO, 2014, 8(3): 2812-2819.
19 周雪,欧阳五庆,魏云鹏, 等. 碳纳米管修饰的纸传感器用于检测甲胎蛋白[J]. 分析化学, 2015, 43(10): 1589-1593. ZHOU Xue, OUYANG Wuqing, WEI Yunpeng, et al. A carbon nanotube-modified paper sensor for detection of α-fetoprotein[J]. Chinese Journal of Analytical Chemistry, 2015, 43(10): 1589-1593. (in Chinese)
20 ZHOU J, BOOKER C, LI R, et al. An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs)[J]. Journal of the American Chemical Society, 2007, 129(4): 744-745.
Electrochemical Immunosensor Assay (EIA) ofE.coliO157:H7 Based on MOCPs-MWCNTs with Highly Efficient Antibody Immobilization
YANG Hua XU Xiahong GUO Yu’na XIAO Yingping TANG Biao WANG Qiang
(InstituteofQualityandStandardforAgro-products,ZhejiangAcademyofAgriculturalSciences,Hangzhou310021,China)
Microbiological contamination caused by food-borne diseases has become a major public health problem of the world. A novel electrochemical immunosensor assay (EIA) for high sensitive and specific detection ofEscherichiacoliO157:H7 was developed. A new nanocomposites with multi-walled carbon nanotubes (MWCNTs) embedded inmetal-organic coordination polymers (MOCPs) was successfully prepared as highly efficient matrices of capturing antibody immobilization for sensitive electrochemical biosensing. In the presence of targetE.coliO157:H7, horse radish peroxidase (HRP)-labeled antibody was captured on the electrode surface to form a sandwich-type system via the specific identification. As a result,E.coliO157:H7 detection was realized by outputting a redox current from electro-reduction of hydrogen peroxide reaction catalyzed by HRP. In the assay, the combination of the unique properties of MWCNTs and MOCPs can not only accelerate electron transfer on the electrode interface, but also provide an excellent scaffold for the conjugation of capture antibody. Meanwhile, adopting the MWCNTs-MOCPs materials significantly improved the target capturing efficiency and enhanced the sensitivity of the biosensor. The results revealed that the calibration plot obtained forE.coliO157:H7 was approximately linear from 67 cfu/mL to 6.7×106cfu/mL with the limit of detection of 40 cfu/mL. In addition, the biosensor was successfully applied to quantitative assay ofE.coliO157:H7 in synthetic sample (milk). Hence, the developed electrochemical-based immunosensor might provide a useful and practical tool forE.coliO157:H7 determination and related food safety analysis and clinical diagnosis.
EscherichiacoliO157:H7; metal-organic coordination polymers; multi-walled carbon nanotubes; electrochemical immunosensor
10.6041/j.issn.1000-1298.2017.06.043
2017-04-20
2017-05-03
浙江省自然科学基金项目(LZ15C170001)
杨华(1972—),男,高级畜牧师,主要从事畜产品质量安全研究,E-mail: yanghua@mail.zaas.ac.cn
TP212.3; TB383
A
1000-1298(2017)06-0328-06
