大孔吸附树脂富集青龙衣总多酚的工艺研究
2017-06-27陈晓怡王炎赵怡程白少娟何婷常艳丽姜蕊万欣蕾邢丹折改梅
陈晓怡,王炎,赵怡程,白少娟,何婷,常艳丽,姜蕊,2,万欣蕾,邢丹,折改梅*
(1.北京中医药大学中药学院,北京 100102;2.保定市第一中心医院,河北 保定 071000)
制 剂 工 艺
大孔吸附树脂富集青龙衣总多酚的工艺研究
陈晓怡1,王炎1,赵怡程1,白少娟1,何婷1,常艳丽1,姜蕊1,2,万欣蕾1,邢丹1,折改梅1*
(1.北京中医药大学中药学院,北京 100102;2.保定市第一中心医院,河北 保定 071000)
采用大孔树脂富集青龙衣中多酚类成分。通过静态吸附及解吸附筛选出最佳树脂,在此基础上考察上样液浓度、上样pH、上样体积、上样流速、洗脱剂浓度、洗脱剂体积、洗脱流速、径高比等工艺参数。结果表明AB-8为富集青龙衣总多酚的最佳树脂,最佳工艺参数为:上样液浓度为0.070 g/mL、上样pH=4.0、上样体积为1 BV、上样流速为3 BV/h、去离子水除杂3 BV、洗脱剂浓度70% 、洗脱剂体积2 BV、洗脱流速为2 BV/h、径高比为1∶8,青龙衣总多酚的含量由0.13%提高到52.09%。AB-8树脂对青龙衣总多酚进行有效的富集。
大孔吸附树脂;青龙衣;总多酚
青龙衣始载于《开宝本草》,为我国民间常用中药,为胡桃科胡桃属植物核桃(JuglansregiaLinn.)和胡桃楸(J.mandshuricaMaxim.)的未成熟外果皮,又称为核桃青皮。其始载于《开宝本草》,具有清热解毒、祛风疗癣、止痛止痢等功效[1],临床上多用于治疗肿瘤、皮肤病、浅表性胃炎等病[2-4]。现代研究报道青龙衣富含多酚类、萘醌类、黄酮类、萜类和二芳基庚烷类成分[5-9],其中多酚类成分被认为具有抗肿瘤、抗炎、抗癌、抗氧化和抗衰老等作用[10-12],引起国内外学者的极大兴趣。课题组前期建立了总多酚含量测定方法[11],在此研究基础上,笔者采用单因素实验对大孔树脂富集青龙衣总多酚的工艺参数进行考察,确立最佳的工艺条件,为青龙衣多酚类成分活性研究奠定基础。
1 仪器、材料和试剂
SHB-III水循环真空泵(河南巩义市英峪电子仪器厂);DK-S 24电热恒温水浴锅(上海精宏实验设备有限公司);Sartorious BT25S型1/100000电子分析天平(上海精宏实验设备有限公司);AL204电子天平(梅特勒-托利多仪器(上海)有限公司);KQ-500DE型数控超声清洗器(昆山市超声仪器有限公司);UV-2000紫外分光光度计(尤尼柯上海公司)。
HPD400、Diaion、D101和AB-8型大孔吸附树脂(沧州宝恩吸附材料科技有限公司);盐酸、钨酸钠、磷酸、钼酸钠、硫酸锂、无水碳酸钠、甲醇、无水乙醇(均为分析纯,北京化工厂);水为去离子水。
没食子酸对照品(天津市光复精细化工研究所,批号为20120418,纯度99.0%);核桃青皮采自北京昌平,经本校中药鉴定系张媛副教授鉴定为胡桃科胡桃属植物核桃(JuglansregiaL.)的外果皮,将其阴干后制得青龙衣。
2 方法与结果
2.1 含量测定
本研究中采用课题组前期建立方法并已发表文章[13]。精密称取青龙衣粉末1.00 g,加入16 mL体积分数为80%的甲醇,超声提取3次,每次20 min,过滤,合并滤液,再加入50 mL 4 mol/L的盐酸,100℃水解2 h,定容至100 mL。以没食子酸为对照品,采用紫外-可见分光光度法,测定样品中总多酚的含量[13]。
2.2 洗脱液中总多酚的质量浓度及含量测定
青龙衣总多酚含量的测定:取一定浓度的样品溶液0. 2 mL,后续步骤同标准溶液测定方法,根据标准曲线求得其浓度,并计算出总多酚的质量。标准曲线的建立方法等见实验室已发表文章[13]。计算公式如下:

式中:A为洗脱液吸光度(Abs),C为洗脱液中总多酚的浓度(mg/mL),W为洗脱液中总多酚含量(%),V为洗脱液体积(mL),N为稀释倍数,M为洗脱物的质量(mg)。
2.3 大孔树脂的预处理
体积分数95%乙醇浸泡大孔树脂24 h,充分溶胀后,湿法装柱,再用体积分数95%乙醇淋洗至流出液与水混合(1∶5)不呈白色为止,然后用去离子水冲洗至流出液无醇味,沥干树脂中水分备用。

表1 四种大孔树脂的基本性能
2.4 树脂类型的筛选
精密称取预处理过的四种型号的树脂各1.00 g,分别置于4个150 mL具塞磨口三角瓶中,精密加入青龙衣供试溶液(含总多酚0.003 1 mg/mL)20 mL,密封,每10 min振摇20 s,持续2 h,按照2.1的方法显色测定吸附后各溶液中总多酚含量,计算各种类型树脂吸附量和吸附率。取上述四种吸附后的树脂,加入无水乙醇50 mL,密封,每10 min振摇20 s,持续2 h,测定各解吸液中总多酚的量,计算解吸率。
静态吸附量(mg/g树脂)=(C0-C1)V0/M1
静态吸附率(%)=(C0-C1)/C0×100
静态解吸率(%)=[C2V2/(C0-C1)V0]×100
式中:C0为初始质量浓度(mg/mL),C1为吸附后溶液中总多酚质量浓度(mg/mL),C2为解吸液中总多酚质量浓度(mg/mL),V0为供试液体积(mL),V2为解吸液体积(mL),M1为大孔吸附树脂质量(g)。结果见表2。
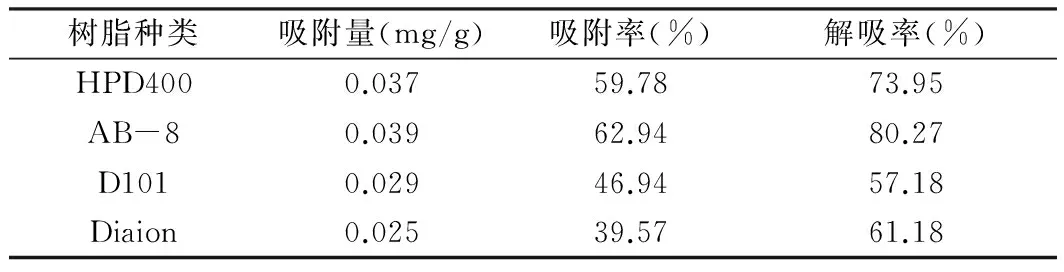
表2 4种大孔树脂静态吸附与解吸数据
由表2数据可知,综合整个静态吸附和解吸附过程,AB-8树脂吸附率和解吸率均最高。且AB-8大孔树脂具有选择性强、吸附快、解吸快、吸附容量大、易于再生等多个优点,近年来被广泛用于大工业生产多酚类等多种成分的分离与富集[14]。综合上述多种因素选用AB-8树脂为富集青龙衣总多酚的最佳树脂。
2.5 AB - 8型吸附树脂富集青龙衣总多酚的工艺参数考察
2.5.1 上样浓度的考察
配制浓度为0.10 g/mL、0.070 g/mL、0.050 g/mL、0.040 g/mL的溶液,湿法上样于40 mL的AB-8树脂柱,先用40 mL去离子水除杂,再用40 mL无水乙醇洗脱,收集洗脱液,分别蒸干得浸膏,测定洗脱液的吸光度值,计算总多酚的含量。
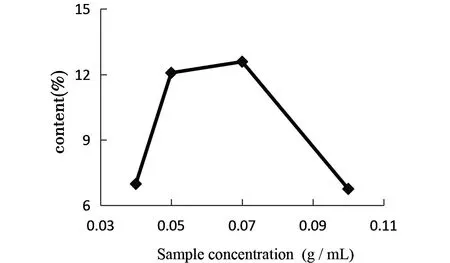
图1 上样浓度对总多酚含量的影响
由图1可知,浓度在0.040 g/mL~0.070 g/mL之间,总多酚的含量随着浓度的增加而迅速增加,在0.070 g/mL~0.10 g/mL之间,总多酚的含量随浓度的增加而急剧下降。原因可能是上样液浓度过低,多酚分子与树脂的接触机会增大,多酚分子能够迅速扩散至树脂内部。浓度过高,多酚分子的扩散受到抑制,且浓度过大易出现絮凝和沉淀,堵塞树脂,影响吸附[15]。综合考虑,选择最佳上样浓度为0.070 g/mL。
2.5.2 上样溶液pH的考察
取浓度为0.070 g/mL的上样溶液4份,分别调节pH值为2.0、3.0、4.0、5.0,湿法上样于40 mL的AB-8树脂柱,先用40 mL去离子水除杂,再用40 mL无水乙醇洗脱,收集洗脱液,分别蒸干得浸膏,测定洗脱液的吸光度值,计算总多酚的含量。
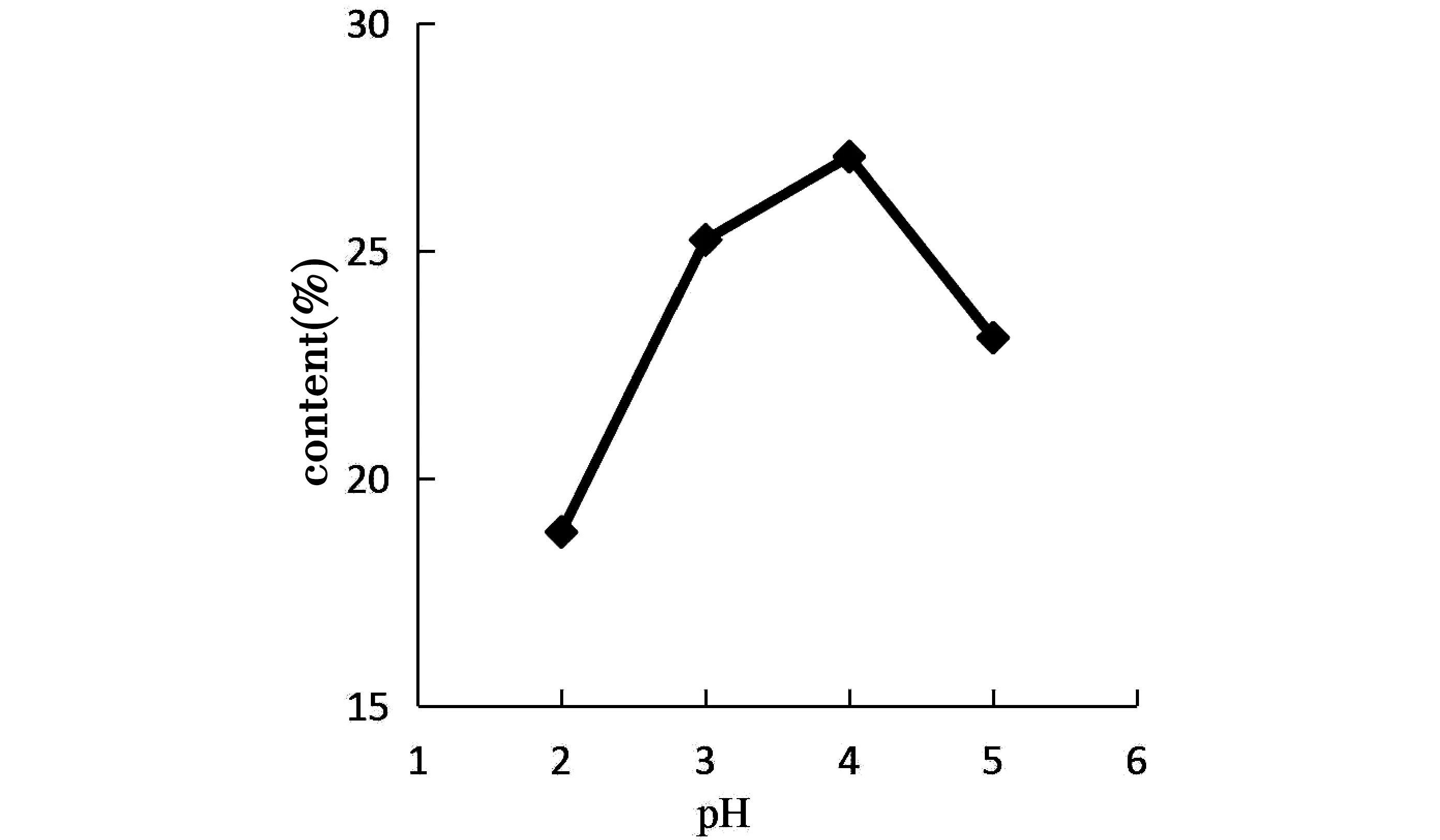
图2 pH值对总多酚含量的影响
由图2可知,随着pH的增大,总多酚的含量先升高后下降,在pH=4.0时总多酚的含量最高,pH=2.0时含量最低。原因可能是上样液pH的变化,可以改变多酚在溶液中的存在形式,影响其溶解度,从而影响多酚与大孔树脂的分子间作用力。多酚类化合物含有酚羟基,呈酸性,在微酸性条件下易被树脂吸附[16],因此,选择上样液pH=4.0为宜。
2.5.3 泄漏曲线
配制浓度为0.31 mg/mL的青龙衣溶液240 mL,调pH为4.0,湿法上样于40 mL的AB - 8树脂柱,以一个柱体积(40 mL)为单位,收集洗脱液,分别蒸干得浸膏,测定洗脱液的吸光度值,计算总多酚的质量浓度。
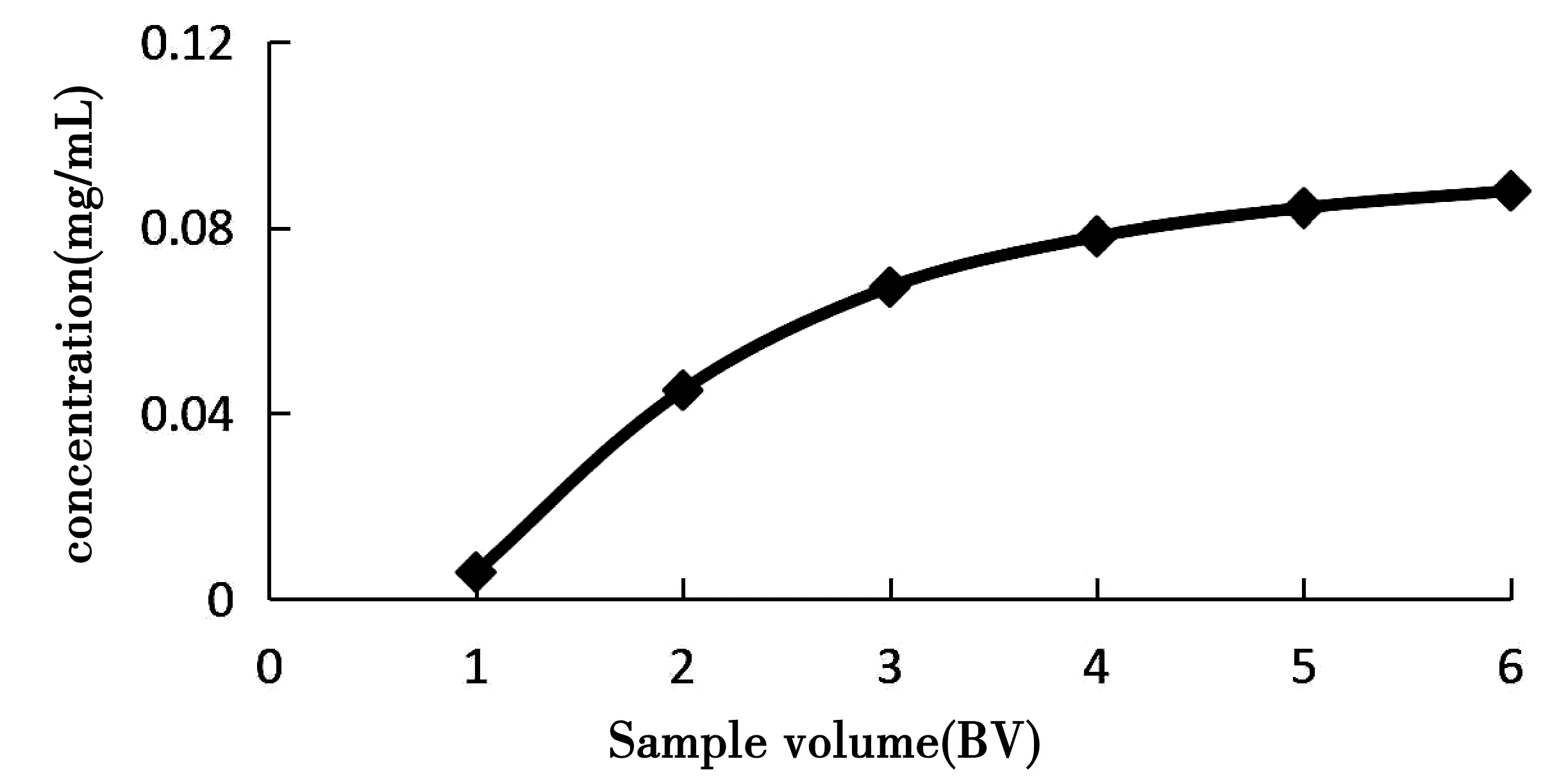
图3 上样体积对总多酚含量的影响
由图3可知,随着上样量的增加,洗脱液中青龙衣总多酚的浓度不断增大,上样2 BV时,出现明显泄漏,说明树脂已吸附饱和[17],为了避免树脂过饱和而造成死吸附,选择最佳上样量为1 BV。
2.5.4 上样流速的考察
取浓度为0.070 g/mL的青龙衣溶液,调pH为4.0,湿法上样于40 mL的AB-8树脂柱,分别控制上样流速为1 BV/h、2 BV/h、3 BV/h、4 BV/h,先用40 mL去离子水除杂,再用40 mL无水乙醇洗脱,收集洗脱液,分别蒸干得浸膏,测定洗脱液的吸光度值,计算总多酚的含量。
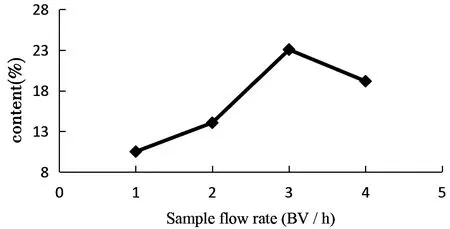
图4 上样流速对总多酚含量的影响
由图4可知,随着上样流速的增大,总多酚的含量先升高后下降,流速为3 BV/ h时总多酚的含量最高,流速为1 BV/h时含量最低。原因可能是流速慢,多酚分子虽然能与树脂内表面充分接触,使其含量增加,但会造成生产周期过长、多酚容易发生降解、聚合。流速快,多酚和树脂接触时间短,来不及吸附就发生泄漏,导致含量降低。因此,选择3 BV/h为最佳上样流速。
2.5.5 上样量与树脂体积比的考察
配制浓度为0.070 g/mL的上样溶液20 mL、40 mL、60 mL、80mL,调pH为4.0,湿法上样于40 mL的AB-8树脂柱,分别用40 mL去离子水除杂,40 mL无水乙醇洗脱,收集洗脱液,然后分别蒸干得浸膏。测定洗脱液的吸光度值,计算总多酚的含量。
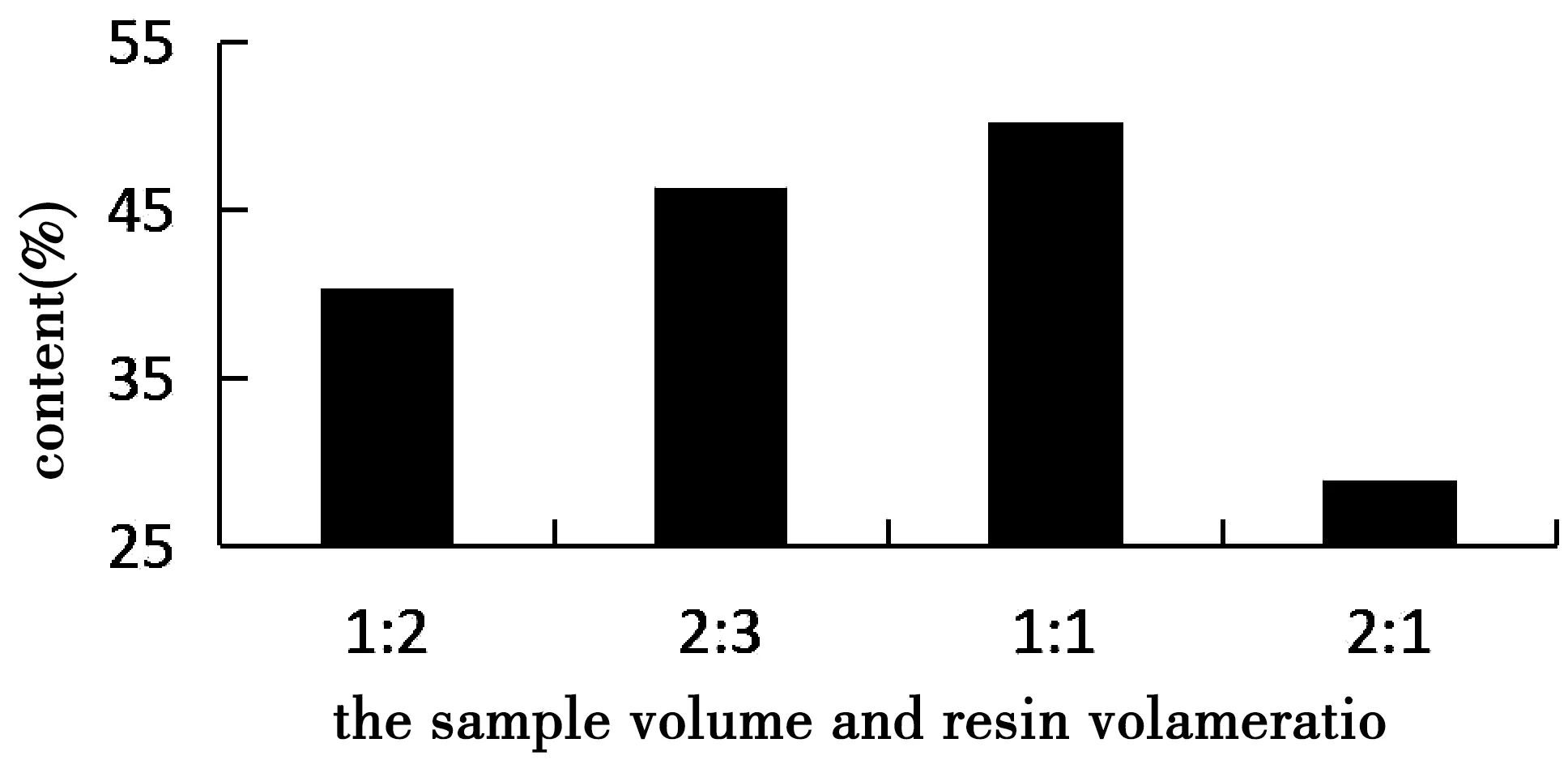
图5 上样量与树脂体积比对总多酚含量的影响
从图5可知,上样量与树脂体积的比为1∶1时,青龙衣总多酚的含量最高。故选择最佳的上样量与树脂体积比为1∶1。
2.5.6 除杂用水量的考察
取浓度为0.070 g/mL的青龙衣溶液,调pH为4.0,湿法上样于40 mL的AB-8树脂柱,控制上样流速为3 BV/h,分别用1 BV、2 BV、3 BV、4 BV去离子水除杂,再用40 mL无水乙醇洗脱,收集洗脱液,分别蒸干得浸膏,测定洗脱液的吸光度值,计算总多酚的含量。

表3 不同用量水洗脱液中总多酚的含量
由表3可知,随着水洗体积的增加,洗脱液中总多酚的含量先增加后减少,除杂用水量为3 BV时,总多酚的含量最高,故选择3 BV为最佳的水洗体积。
2.5.7 洗脱剂浓度的考察
配制浓度为0.070 g/mL的青龙衣溶液,调pH为4.0,湿法上样于40 mL AB-8树脂柱,控制上样流速为3 BV/h,用3 BV去离子水除杂后,分别用40 mL 60%、70%、80% 和90% 乙醇洗脱,收集洗脱液,然后分别蒸干得浸膏。测定洗脱液的吸光度值,计算总多酚的含量。

图6 洗脱剂浓度对总多酚含量的影响
由图6可知,随着乙醇体积分数的升高,洗脱液中总多酚的含量先上升后下降,乙醇体积分数为70% 时含量最高,90% 含量最低。因此选用70% 的乙醇为最佳洗脱浓度。
2.5.8 洗脱剂体积的考察
配制浓度为0.070 g/mL 的溶液,调pH为4.0,湿法上样于40 mL AB-8树脂柱,控制上样流速为3 BV/h,用3 BV去离子水除杂,再用70%乙醇分别洗脱1 BV、2 BV、3 BV、4 BV,收集洗脱液,然后分别蒸干得浸膏。测定洗脱液的吸光度值,计算总多酚的含量。
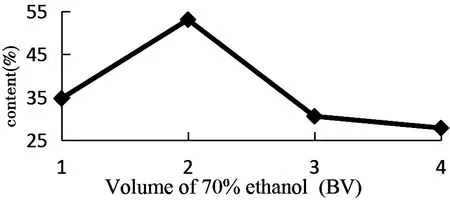
图7 洗脱剂体积对总多酚含量的影响
由图7可知,随着洗脱体积的增加,总多酚的含量先增加后减少,用2 BV 70%乙醇洗脱时,总多酚的含量最高。故选择2 BV为最佳洗脱体积。
2.5.9 洗脱流速的考察
取浓度为0.070 g/mL的青龙衣溶液,调pH为4.0,湿法上样于40 mL AB-8树脂柱,控制上样流速为3 BV/h,用3 BV去离子水除杂,再用70% 乙醇洗脱,分别控制洗脱流速为1 BV/h、2 BV/h、3 BV/h、4 BV/h,洗脱2 BV,收集洗脱液,分别蒸干得浸膏。测定洗脱液的吸光度值,计算总多酚的含量。
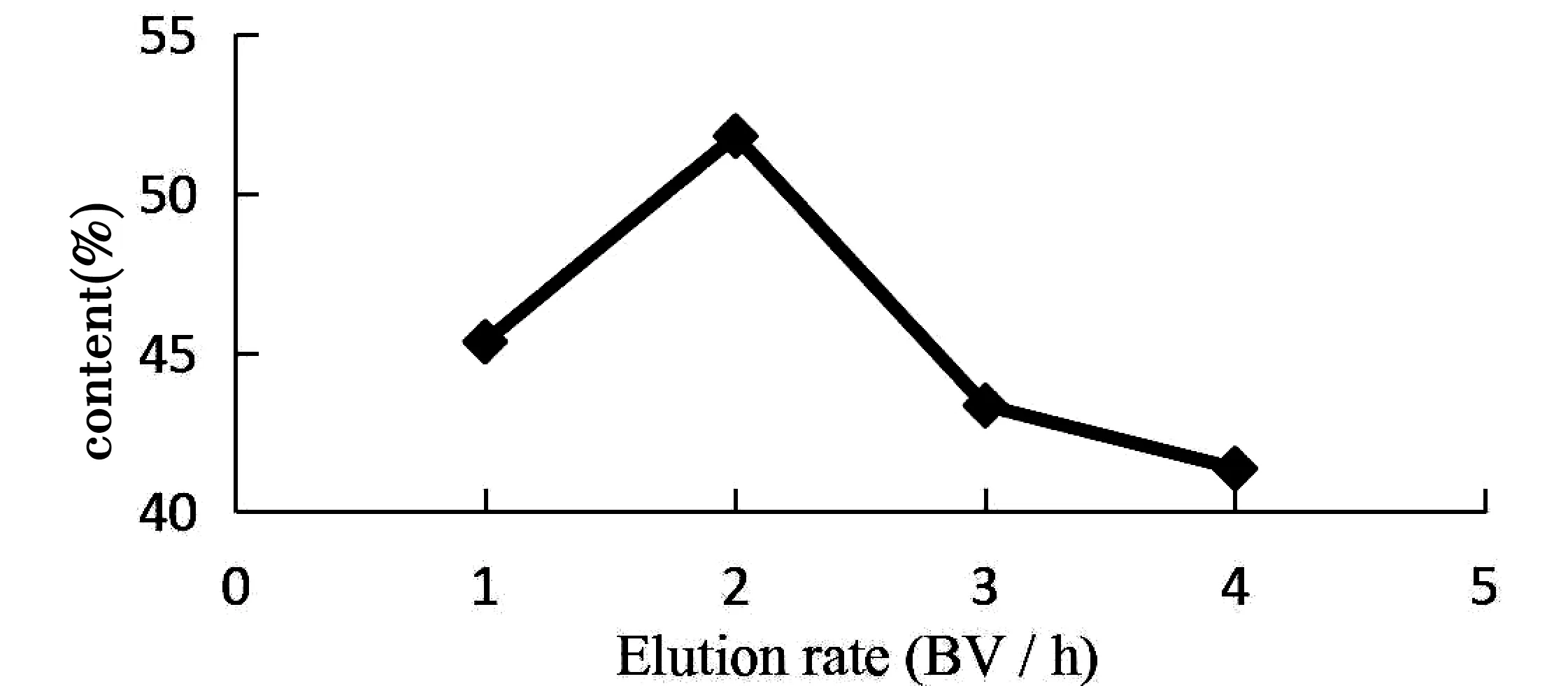
图8 洗脱流速对总多酚含量的影响
由图8可知,随着洗脱流速的增大,总多酚的含量先增加后减少,洗脱流速为2 BV/h时,总多酚含量最高,原因可能是洗脱流速过低,解吸时间长、洗脱能力小。流速过快,多酚不能充分解吸,考虑到解吸效果和工作效率,确定最佳洗脱流速为2 BV/h。
2.5.10 径高比的考察
分别装径高比为1∶4、1∶6、1∶8、1∶10的AB-8树脂柱,配制浓度为0.070 g/mL的青龙衣溶液,调pH为4.0,湿法上样于40 mL AB-8树脂柱,控制上样流速为3 BV/h,先用3 BV去离子水除杂,再用2 BV 70%乙醇以2 BV/h的速度洗脱,收集洗脱液,分别蒸干得浸膏。测定洗脱液的吸光度值,计算总多酚的含量。

图9 树脂柱径高比对总多酚含量的影响
由图9可知,树脂柱径高比在1∶8时,青龙衣总多酚的含量最高。因此,选择树脂柱最佳径高比为1∶8。
2.5.11 最优工艺验证
以考察出的最优工艺,即上样1 BV生药浓度为0.07 g/mL的青龙衣溶液,调pH为4.0,湿法上样于径高比为1∶8的AB-8树脂柱,控制上样流速为3 BV/h,用3 BV水除杂后,用2 BV的70%乙醇以2 BV/h的速度洗脱,收集洗脱液,然后分别蒸干得浸膏。测定洗脱液的吸光度值,计算总多酚的含量。经计算这3次得到总多酚的含量分别为51.94%,53.48%,50.85%。转移率分别为61.39%,62.04%,61.86%。平均含量为52.08%,平均转移率为61.78%。
3 结论与讨论
本论文与已有文献比较[18],相同之处在于均采用AB-8树脂对青龙衣总多酚进行富集。不同之处在于本研究采用与总多酚极性相近的弱极性、非极性和中极性的大孔树脂对其进行富集工艺的考察,多酚含量显著提高。研究表明AB-8型大孔吸附树脂对青龙衣总多酚具有良好的吸附性能,较大的吸附量,且易吸附、易解吸,是富集纯化青龙衣总多酚的最佳树脂。经AB-8型大孔吸附树脂富集纯化后,青龙衣总多酚的含量由0.13%增加到52.09%,最佳富集工艺为:采用径高比为1∶8的AB-8大孔吸附树脂,最大上样量为1 BV,最佳上样浓度为0.070 g/mL,最佳上样pH为4.0,最佳上样流速为3 BV/h,去离子水除杂体积为3 BV,乙醇洗脱液的浓度为70%,洗脱体积为2 BV,最佳解吸流速为2 BV/h。实验中确定的总多酚富集工艺为进一步开发青龙衣染发剂奠定基础。
[1] 江苏新医学院.中药大辞典[M].上海:上海科学技术出版社,1986.
[2] 姬艳菊,徐巍.青龙衣提取物对人肝癌细胞株抑制作用的实验研究[J].中医药学报,2014,42(5):30-34.
[3] 孙桂君,苑淑莉.青龙衣糖膏治疗浅表性胃炎疗效观察[J].中医药学报,2002,30(3):16.
[4] 李淑芳,张宁.核桃皮酊剂毒性试验研究[J].贵阳医学院学报,1997,22(4):356-358.
[5] 周媛媛,刘兆熙,孟颖,等.青龙衣中的醌类成分研究[J].中医药学报,2015,43(3):8-10.
[6] Sang-Hyun K, Kyong-Sun L, Jong-Keun S, et al. Cytotoxic compounds from the roots of Juglans mandshurica [J].Journal of Natural Products, 1998, 61(5): 643-645.
[7] 周媛媛,付蕾,金阳,等.青龙衣抗肿瘤成分的研究[J].中医药学报,2013,41(4):70-71.
[8] 李阳光,徐巍.青龙衣化学成分及抗肿瘤研究现况[J].中医药信息,2014,31(2):119-121.
[9] 周媛媛,刘兆熙,孟颖,等.青龙衣乙酸乙酯部位的化学成分研究[J].中医药信息,2015,32(3):20-22.
[10] Lili Zuo, Zhenyu Wang, Ziluan Fan, et al. Evaluation of antioxidant and antiproliferative properties of three actinidia (Actinidia kolomikta, Actinidia arguta, Actinidia chinensis) extracts in vitro[J]. International Journal of Molecular Sciences,2012,13(5):5506-5518.
[11] Ziluan Fan, Zhenyu Wang, Jiaren Liu. Cold-field fruit extracts exert different antioxidant and antiproliferative activities in vitro[J].Food Chemistry,2011,129(2):402-407.
[12] Lalit G, Praveen D, Sandeep R, et al. In vitro production of phenolic compounds and antioxidant activity in callus suspension cultures of Habenaria edgeworthii: A rare Himalayan medicinal orchid[J]. Industrial Crops and Products,2012(39):1-6.
[13] 姜蕊,张霞,邢丹,等.青龙衣水解单宁含量测定方法研究[J].西北药学杂志,2015,30(1):17-18.
[14] 徐青,陆莹莹,辛健美,等.大孔树脂吸附分离海芦笋中黄酮类化合物工艺[J].食品科学,2011,32(2):115-119.
[15] 贺金娜.苹果多酚的制备、成分鉴定及其抗氧化性研究[D].无锡:江南大学,2014.
[16] 邢佳,陆文娟,赵云霞,等.石榴叶多酚的纯化及抗氧化活性研究[J].南京师大学报(自然科学版),2015,38(3):84-89.
[17] 哈及尼沙,阿力木江·阿布力孜,阿米娜,等.榅桲总多酚的纯化工艺及PTP1B抑制作用研究[J].天然产物研究与开发,2015,27:1448-1452.
[18] 李琼,陈凯,陈燕勤,等.大孔吸附树脂分离纯化核桃青皮总多酚[J].食品与机械,2015,31(1):175-180.
Technic-process Study of Enriching Total Polyphenols fromJuglansRegiaL.
CHEN Xiao-yi1, WANG Yan1, ZHAO Yi-cheng1, BAI Shao-juan1,HE Ting1,CHANG Yan-li1, JIANG Rui1,2, WAN Xin-lei1, XING Dan1, SHE Gai-mei1
(1.BeijingUniversityofChineseMedicine,Beijing100102,China;2.TheFirstCentralHospitalofBaoding,Baoding071000,China)
The total polyphenols fromJuglansregiaL. was enriched with macroporous resin. The optimal macroporous resin was selected after the static adsorption and desorption tests, with which to optimize the separation process of total polyphenols from J. regia. The parameters of concentration, pH value, bed volume and flow velocity from the sample liquid, as well as the parameters of concentration, bed volume, flow velocity and the ratio of diameter to height(D/H) from the eluant were observed with the optimal macroporous resin. The results showed that the AB-8 macroporous resin had good qualities of adsorption and desorption. The preferred condition for the procedure was as follows: the concentration of sample liquid was 0.070 g/mL, pH=4.0, the bed volume=1 BV, the flow rate of adsorption=3 BV/h, the volume of water to remove impurities was 3 BV; 70% ethanol was taken as the eluant, bed volume=2 BV, t he flow rate of desorption=2 BV/h and D/H=1∶8. Under this condition, the content of total polyphenols had been increased from 0.13% to 52.09%. The AB-8 macroporous resin could be effectively applied to purify the total polyphenols from J. regia.
Macroporous resin;JuglansregiaL.; Total polyphenols
2016-06-17
2016-12-18
北京中医药大学创新创业项目(201510026048);北京中医药大学自主选题中青年教师资助项目(2013-JYBZZ-JS-137);榆林现代特色农业新技术研究与集成示范(2015CXY-13)
陈晓怡(1992-),女,硕士研究生,专业:中药化学。
*通讯作者:折改梅(1976-),女,研究员,博士研究生导师,研究方向:中(民族)药药效成分和新药创制研究。
R284.2
A
1002-2392(2017)03-0095-04
